仿刺参精酶解工艺的优化及酶解液的抗氧化活性
2022-05-25孙小飞罗国瑞李英美张禹茜宫慧慧朱文慧励建荣李学鹏
孙小飞,罗国瑞,李英美,张禹茜,宫慧慧,朱文慧,励建荣,李学鹏*
(1 渤海大学食品科学与工程学院 辽宁 锦州 121013 2 江苏海洋大学 江苏省海洋生物资源与环境重点实验室 江苏 连云港 222000 3 达莲食品(锦州)有限公司 辽宁 锦州 121200)
仿刺参(Apostichopus japonicus)是一种主要分布于中国、俄罗斯、韩国和日本沿海的海参,是重要的海洋食品和药物资源[1]。仿刺参中生物活性物质的提取和利用一直备受关注,研究主要集中在仿刺参的体壁活性物质方面[2-7]。性腺和肠道组织属于仿刺参的内脏,作为仿刺参加工过程中的副产物常常被丢弃,没有得到有效利用,从而导致资源浪费和环境污染[8]。研究表明,仿刺参性腺不仅富含多糖,而且蛋白质、脂肪酸和其它活性成分含量丰富,其中的蛋白质更是优质多肽的来源[9-11]。现代生物代谢研究表明,蛋白质是通过消化酶作用以多肽的形式被人体吸收[12-13]。与蛋白质相比,多肽更容易被人体吸收利用,并在人体代谢方面表现出更重要的生物活性,如抗衰老和抗氧化活性等[14-15]。
人体正常生理代谢过程中会产生少量的活性氧,包括羟基自由基(·OH)、超氧自由基(·O2-)和过氧化氢(H2O2)等,这些活性氧在人体中总是处于产生与消失的动态平衡中[16-19]。研究表明,适量的活性氧对人体是有益的,通过控制氧自由基的产生,可以消除炎症,增强免疫力以及抑制肿瘤。过量的活性氧则会破坏细胞结构,扰乱人体正常的生理代谢活动,从而造成机体损伤,导致各种疾病产生[20]。
目前,对于仿刺参的研究主要集中在体壁的组成成分及功能活性方面,而关于仿刺参性腺的研究很少[21-22]。仿刺参性腺包括卵子和精子,在收集过程中两者极易混合在一起,对于仿刺参卵现有少量的研究成果,主要涉及其营养成分组成[23-25],而关于仿刺参精的活性研究暂未见报道。本研究中,仿刺参精被单独收集,用木瓜蛋白酶水解,在单因素实验基础上,采用响应面法确定最佳水解条件。采用Pall Minimate 超滤系统对酶解液进行处理,收集不同分子质量范围的多肽。据报道,不同分子质量的多肽通常表现出显著差异的抗氧化活性[26-28]。·O2-是所有氧自由基中的第一个自由基,可经一系列反应生成其它氧自由基,具有很强的氧化能力。·OH 是化学性质最活泼的活性氧物种,几乎与生物体内所有物质反应,在活性氧中,它的危害最大。本研究测试了收集的3 种多肽对·O2-和·OH 的清除能力,以此考察它们的抗氧化活性。
1 材料和方法
1.1 材料和试剂
仿刺参精,采集于山东烟台,采集时大部分仿刺参处于性腺成熟期。将仿刺参解剖后,收集仿刺参精并均质,在-20 ℃下储存备用。
木瓜蛋白酶(酶活性:100 万U/g),中国南宁庞博生物工程有限公司;牛血清白蛋白,中国上海蓝基科技发展有限公司;超氧自由基、羟基自由基检测试剂盒,南京建成生物工程研究所;其它化学品和试剂均为分析纯级。
1.2 试验方法
1.2.1 仿刺参精的酶解 仿刺参精清洗干净,沥干水分后经胶体磨研磨匀浆,准确称取仿刺参精匀浆液10 g,加入一定量的木瓜蛋白酶,混合均匀,在恒温水浴锅中进行酶解,酶解完成后立即取出,将酶解液置于100 ℃水浴锅中灭酶10 min。
1.2.2 水解度的测定 根据三氯乙酸(TCA)方法测定水解度[29]。取1 mL 酶解液加入1 mL 的10 g/100 mL 的TCA,混合振荡,静止10 min 后,10 000 r/min 离心10 min,取上清液以双缩脲法测定可溶性蛋白含量,用凯氏定氮法测总蛋白含量[30]。按照式(1)计算水解度(DH):

式中,ρ1——反应后酶解液中可溶性蛋白含量(mg/mL);ρ2——反应前仿刺参精中可溶性蛋白含量 (mg/mL);ρ0——仿刺参精中总蛋白含量(mg/mL)。
1.2.3 单因素研究 为了考察酶解温度、加酶量和酶解时间3 个因素对水解度的影响,首先进行单因素实验。制定酶解的基本条件为:酶解温度65 ℃,加酶量([E/S])3%,时间5 h。固定其中2 个条件,改变另外1 个条件,分别考察不同的影响因素,各因素取值范围如下:酶解温度分别为50,60,65,70,80 ℃,加酶量分别为1%,2%,3%,4%,5%,时间分别为3,4,5,6,7 h。
1.2.4 响应面法优化水解条件[31-32]在单因素实验的基础上,以水解度为衡量指标,选取酶解温度、加酶量和时间3 个因素,设计3 因素3 水平的响应面试验,选用木瓜蛋白酶,进行酶解条件优化。根据单因素实验结果,采用Box-Behnken 设计试验,分析3 个因素对水解度的影响,试验次数为17 次,其中析因部分试验次数12 次,中心点重复试验次数为5 次。
1.2.5 梯级肽的制备 将仿刺参精酶解液加蒸馏水稀释2 倍,10 000 r/min 离心10 min,取上清液,先用普通滤纸过滤,再依次用0.45 μm 和0.22 μm 的微孔滤膜过滤。然后采用Pall Minimate 超滤系统,将过滤后的仿刺参精酶解液加到超滤杯中,安装合适的切向流膜包,控制压力在20~30 psig 进行超滤,分别收集滤出液和截留液。选择截留分子质量为10 ku 的膜包超滤,超滤开始后,当超滤杯中酶解液剩余1/5 时,收集过滤液,并将超滤杯中补充蒸馏水至初始体积,再次超滤,重复3次后停止超滤,收集每次过滤液(分子质量<10 ku 的多肽) 和截留液 (分子质量>10 ku 的蛋白质)。再分别选用截留分子质量为5 ku 和1 ku 的切向流膜包,最终制备出3 种不同分子质量的多肽,将收集到的3 种多肽溶液真空冷冻干燥处理。
1.2.6 抗氧化活性测定
1.2.6.1 清除·O2-能力测定 模拟机体中黄嘌呤与黄嘌呤氧化酶反应系统产生·O2-,加入电子传递物质及Griess 显色剂,使反应体系呈紫红色,用分光光度计测其在波长550 nm 处的吸光度,计算出多肽对·O2-的抑制能力。在反应系统中,每升样品在37 ℃下反应40 min 所抑制的·O2-相当于1 mg的维生素C 所抑制的·O2-变化值为一个活力单位。按式(2)计算:

1.2.6.2 清除·OH 能力测定 利用Fenton 反应产生·OH,该反应是最常见的产生·OH 的化学反应,H2O2的量和该反应产生的·OH 量成正比,当给予电子受体后,用Griess 试剂显色,形成红色物质,其呈色与·OH 的量成正比。按照试剂盒说明依次加样,于分光光度计波长550 nm 处测定各管吸光度值。每毫升样品在37 ℃下反应1 min,使反应体系中H2O2浓度降低1 mmol/L 为1 个抑制·OH 能力单位。按式(3)计算:


1.2.7 统计方法 每组试验均重复3 次,使用Design Expert 8.0 软件进行方差分析(ANOVA)并求解回归方程,P<0.05 差异性显著。
2 结果与分析
2.1 单因素对仿刺参精酶解的影响
由图1a 可知,随着温度升高,仿刺参精的水解度呈上升趋势,在70 ℃时水解度达到最高;继续升高温度,水解度开始下降。木瓜蛋白酶在70℃时有很高的活力,同时高温激活了仿刺参精中某些自溶酶,促进了仿刺参精蛋白的降解,从而使70 ℃时仿刺参精的水解度达到最高。如果继续升高温度会增加加热成本,也会对木瓜蛋白酶造成一定程度的变性影响,因此将木瓜蛋白酶最佳温度控制在70 ℃左右。
酶与底物的比例对水解度也有显著影响。如图1b 所示,当加酶量由1%增加到4%时,水解度随着加酶量的增加而升高,当加酶量增加到5%时,水解度变化不大。此时底物已经接近饱和,再增大加酶量难以使水解度有明显的提高,且增大加酶量会使生产成本增加,因此木瓜蛋白酶最佳加酶量控制在4%左右。
由图1c 可知,反应4 h 时水解度最高,随着时间的延长,水解度呈下降趋势。这可能是由于开始时酶与底物充分反应,使水解度升高,随着时间的延长,可能会出现过度酶解现象,多肽分解为氨基酸从而导致水解度下降,因此,最佳酶解时间控制在4 h 左右。
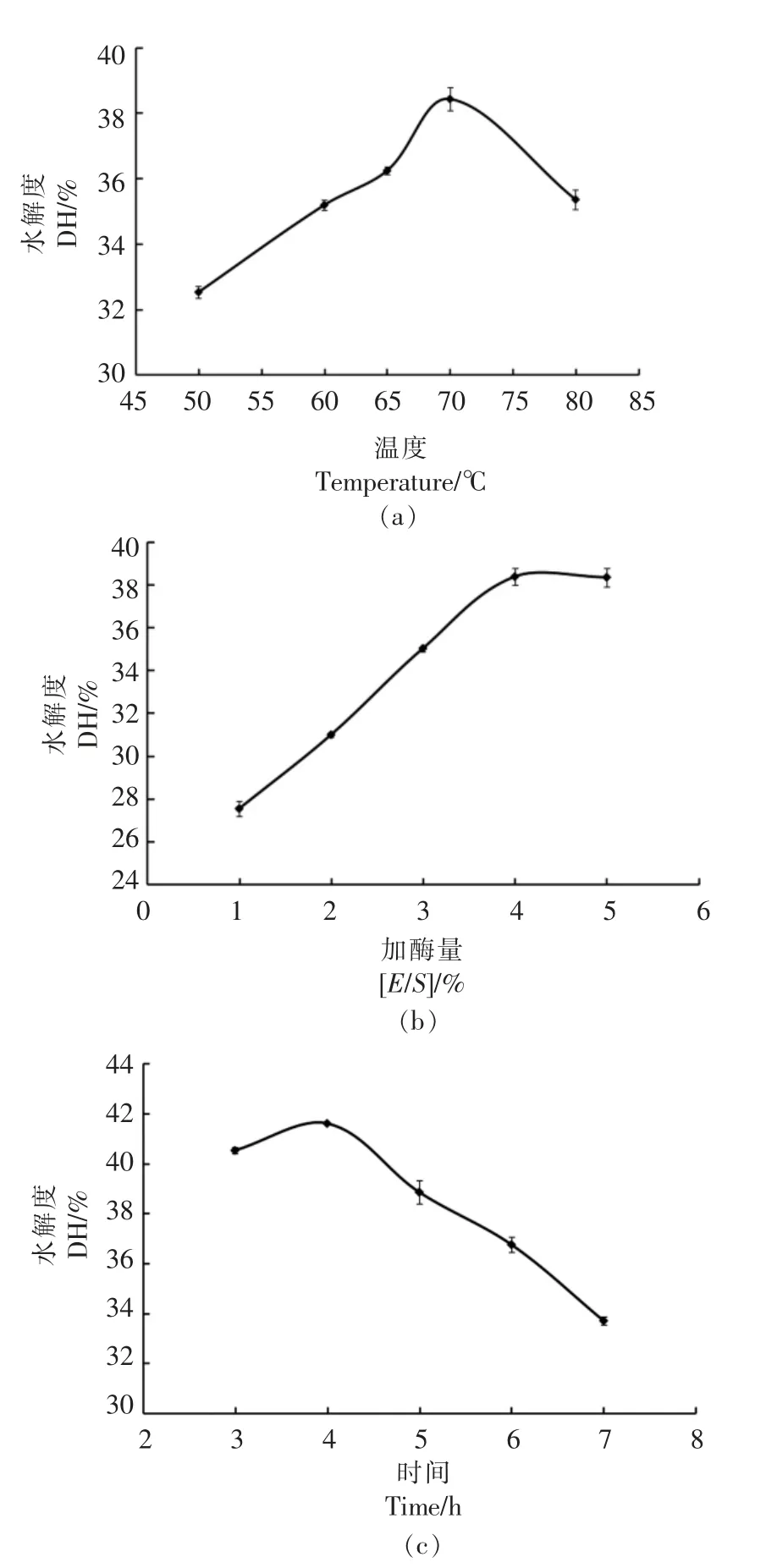
图1 温度(a)、加酶量(b)和时间(c)对水解度的影响Fig.1 Effects of temperature (a),[E/S](b),and time on DH (c)
根据上述单因素实验的结果,暂定如下参数条件:用木瓜蛋白酶水解仿刺参精时,适宜的酶解温度为70 ℃,加酶量4%,反应时间4 h。
2.2 回归模型建立及响应面分析
基于单因素实验结果,考察酶解温度(X1)、加酶量(X2)和时间(X3)3 个变量对水解度的影响,计算二阶多项式方程的系数。响应面试验设计及结果见表1。水解度对应的回归方程为:

利用Design Expert 软件对表1的试验结果进行二次多元回归拟合,并进行方差分析,结果如表2所示。回归方程中各变量对响应值影响的显著性,由F 检验来判定,概率P 值越小,则相应变量的显著程度越高,P<0.05 表示变量项显著,P>0.1 则代表变量项不显著。由表2可知,本试验所选二次项模型F 值为43.89,具有高度显著性(P<0.0001)。在所有变量中,X2、X3、X1X2、X12、X22和X32对应的P 值均小于0.05,说明其对试验结果影响显著。F 值为0.31 表明失拟项的影响不显著。复相关系数R2为0.9826,表明水解度的变化有98.26%来源于所选变量,并且0.9257 的预测相关系数与校正相关系数0.9602 值相吻合,因此,回归方程可以很好地描述各变量与响应值之间的真实关系,可以用该回归方程确定最佳水解条件。此外,信噪比大于4 时所建立的模型可信,本试验的信噪比为19.768 远大于4,进一步说明该试验模型可靠,可以很好地反应水解度与温度、加酶量和时间之间的关系。在所选取的因素水平范围内,各变量对试验结果的影响作用依次为:加酶量>时间>温度。

表1 响应面试验设计及结果Table 1 Box-Behnken design and results

表2 响应面试验方差分析Table 2 ANOVA for DH response surface quadratic model
通过固定1 个变量值,考察另外2 个变量对水解度的影响来绘制响应面图,温度、加酶量和时间对水解度的影响结果如图2所示。随着变量的改变,水解度首先呈上升的趋势,当到达最高点后开始下降。温度和加酶量同时改变引起的水解度下降,可归因于随着温度的升高,对酶活性产生抑制作用,以及加酶量增大后,酶与底物浓度逐渐达到饱和。加酶量和时间改变导致的水解度下降,可能是由于随着时间的延长,酶变性从而使活性降低[33]。据文献报道,响应面底部呈现椭圆形的等高线,表明该变量交互作用显著[34],试验结果表明,温度和加酶量的交互作用最强。该响应面图在预测水解度和两个组合变量之间的显著交互作用方面显示出极高的准确性,结果与回归模型一致。
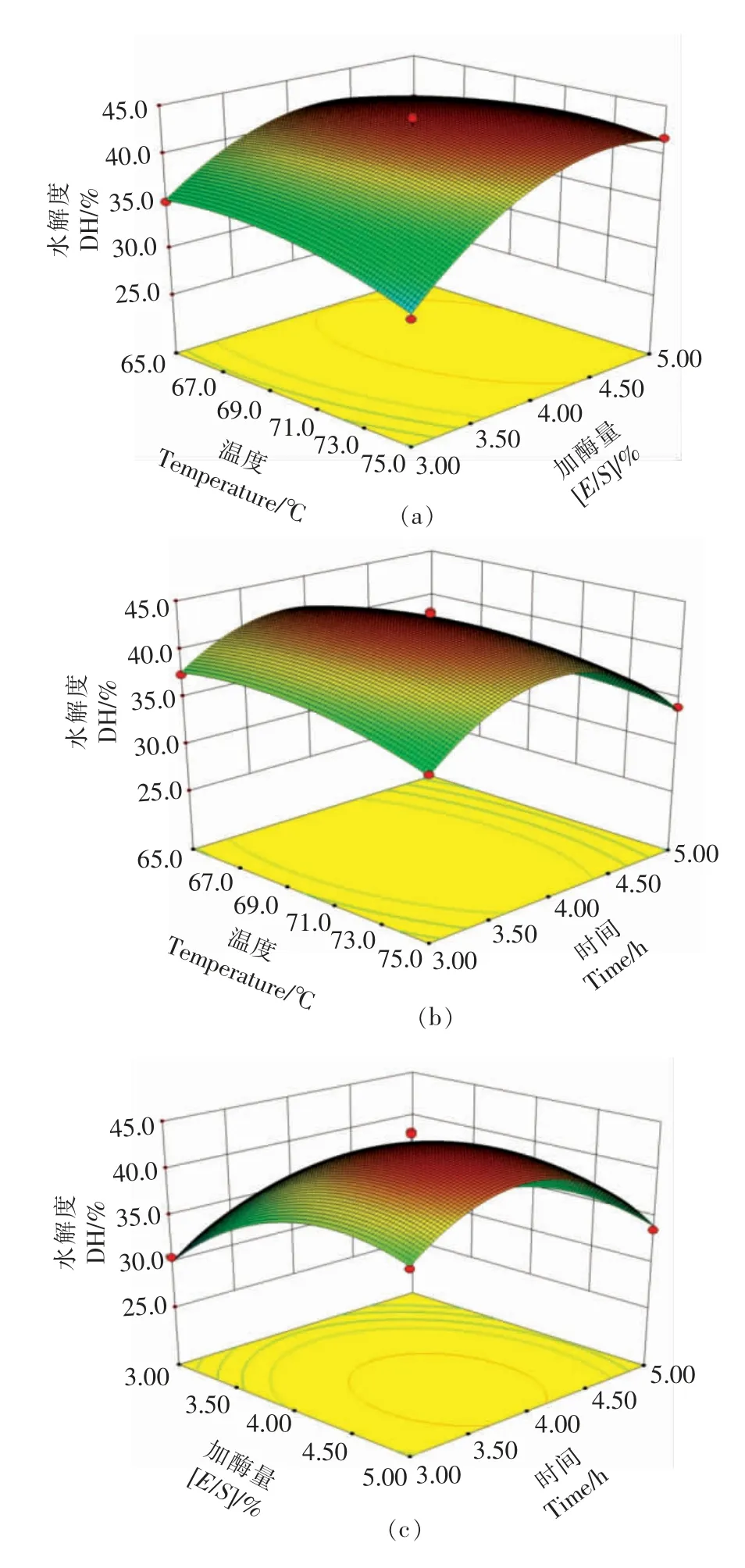
图2 温度与加酶量(a)、温度与时间(b)、加酶量与时间(c)交互作用对水解度的影响Fig.2 Interaction effects of temperature and [E/S](a),temperature and time (b),and [E/S]and time (c) on DH
根据分析结果,得到最佳水解条件为:温度为70.10 ℃、加酶量4.43%、反应时间3.88 h 时,预测的最高水解度为43.75%。考虑到实际操作的便利性,将最佳水解条件修正为:温度70 ℃、加酶量4%、时间4 h,在此条件下,得到的水解度为43.18%。与预测值相比,相对误差仅为1.30%。这表明所建立的回归方程能够很好地反映温度、加酶量和时间对仿刺参精水解度的影响,通过该优化模型可以有效地改善水解度。
2.3 梯级肽的分布
使用Pall Minimate 超滤系统,最终得到分子质量范围分别为1 ku,1~5 ku 和5~10 ku 的3 种仿刺参精多肽,分别命名为P1、P2 和P3。
2.4 清除·O2-和·OH 能力
在模拟生理条件下(pH 7.4,37 ℃),测试了仿刺参精多肽对·O2-和·OH 的清除能力。如图3a 所示,仿刺参精多肽清除·O2-的能力在试验浓度范围内具有较强的浓度依赖性,随着浓度的升高其清除·O2-能力不断增强。3 种多肽对·O2-的清除能力表现出比较显著的差异,分子质量越低的肽段,清除·O2-的能力越强,强度依次为P1>P2>P3。
如图3b 所示,不同分子质量的仿刺参精多肽对·OH 的清除能力差异较大。在低浓度范围内,3种多肽清除·OH 的能力与其分子质量密切相关。质量浓度为2.5~5 mg/mL 时,分子质量<1 ku 的多肽P1 的活性远低于P2 和P3。P1 对·OH 的清除能力具有很强的浓度依赖性,随着质量浓度的增加,P1 的活性迅速增强,分别在约12 mg/mL 和10 mg/mL 时超过P2 和P3。而P2 和P3 在试验质量浓度范围内均保持较高的活性,随着质量浓度的增加,P2 的活性变化不大,P3 的活性略有下降。研究结果表明,P1、P2 和P3 均具有较好的清除·OH 的能力,表明它们具有较好的抗氧化活性。

图3 仿刺参精多肽清除·O2-(a)和·OH(b)能力Fig.3 Scavenging effects of peptides from Aj sperm against ·O2- (a) and ·OH (b)
3 结论
综上所述,酶解温度、加酶量和时间对仿刺参精的水解程度有显著的影响。通过单因素实验和响应面法,确定的最佳水解条件为温度70 ℃,加酶量4.4%,水解时间4 h。从酶解液中分离得到的3 种不同分子质量范围的多肽,对·O2-和·OH 均表现出比较好的清除能力。其中,分子量1 ku 的多肽P1 抗氧化活性最好。本研究可为仿刺参副产物的高值化提供一定的参考依据。
