超声制备抗性淀粉及其对香肠品质和血糖生成指数的影响
2022-05-25胡方洋陈金玉张坤生许时慧耿亚鑫
胡方洋,陈金玉,张坤生,许时慧,耿亚鑫
(天津市食品生物技术重点实验室 天津商业大学生物技术与食品科学学院 天津 300134)
抗性淀粉(Resistant starch,RS),又称抗酶解淀粉、难消化淀粉,是指那些不能被健康人体小肠所吸收,在结肠中能被大肠菌群发酵或部分发酵的淀粉及其降解物的总称[1]。一些RS 存在于天然食物如香蕉、土豆、谷物和豆类中,而大部分是通过商业方式生产或改性后应用到食品中。RS 具有很多独特的生理功能,如控制血糖指数,降低血清和肝脏中的甘油三酯与胆固醇含量,预防肠道疾病等[2-4]。根据RS 来源与抗消化性的不同,可将抗性淀粉分为RS1、RS2、RS3、RS4 和RS5 五大类[5],其中RS3 为老化淀粉,又称回生淀粉,主要是由糊化后的淀粉经冷却回生后形成,与其它种类的RS相比,其保持了淀粉的基本官能团且具有较高的安全性,成为抗性淀粉工业主要生产类型。近年来,许多高新技术,如超声波、微波等被应用于RS3 的制备[6]。超声波引发的机械力学效应和空穴效应能加速溶剂与溶质分子之间的摩擦,切断聚合物分子连接键形成较短的分子链[7],有利于通过氢键作用形成双螺旋结构,提高RS 的得率,且超声处理因操作简单而逐渐被用来制备RS。问燕梅[8]研究发现适宜的超声处理可明显提高RS 的得率。抗性淀粉的得率还与直链、支链淀粉所占比例有关。然而,超声处理在制备RS 阶段过程中所发挥的作用及其对不同来源原淀粉制备RS 的影响有待进一步研究。本试验选取直链淀粉含量较高的禾谷类玉米淀粉、薯类马铃薯淀粉和豆类豌豆淀粉为原料,比较糊化-回生、糊化-超声-回生、超声-糊化-回生3 种制备工艺对RS 含量与性质的影响,筛选最优的RS 制备原料与方法。
RS 在食品工业中可作为添加剂添加至面包、饼干、饮料等食品中,在不影响其风味的同时可改善产品品质,提高营养价值[9]。Mehrdad 等[10]研究发现,在香肠中添加适量的淀粉可降低香肠脂肪含量与热量,增强香肠的保水性。然而,将RS 添加到肉制品中鲜有研究报道。考虑到RS 对肉糜制品持水性的改善[11]及其具有控制餐后血糖上升[12]的优势,本试验将通过超声法制备的RS 添加至香肠中,通过测定香肠的质构、估计血糖生成指数(e-GI)等指标,考察RS 对肉制品品质的影响。本文旨在为RS 的制备工艺及其在肉制品中的应用提供新思路,为研究开发低GI 值的肉制品提供理论依据。
1 材料与方法
1.1 材料与试剂
玉米淀粉(Maize starch,MS),梁山菱花生物科技有限公司;马铃薯淀粉(Potato starch,POS),北京古松经贸有限公司;豌豆淀粉 (Pea starch,PS),新乡良润全谷物食品有限公司;鸡胸肉,天津市西青区华润万家超市;耐高温α-淀粉酶(BR),北京Biotopped 科技有限公司;葡萄糖淀粉酶(BR),北京Solarbio 科技有限公司;95%乙醇、甘油,天津市风船化学试剂科技有限公司;焦磷酸盐,河南三化生物科技有限公司;葡萄糖,天津市化学试剂一厂;氯化钠,天津渤化化学试剂有限公司;葡萄糖试剂盒,上海荣盛生物药业有限公司;人工唾液、人工胃液、人工肠液,飞净生物科技有限公司;其余试剂均为分析纯级。
1.2 仪器与设备
HH·SY21-Ni 电热恒温水浴锅,北京市长风仪器有限公司;CE-9600 便携式超声仪,东莞市洁康超声波设备有限公司;LT-DBX120F 精密可编程热风循环烘箱,立德泰勀(上海)科学仪器有限公司;800Y 多功能粉碎机,铂欧五金厂;GB6003-88 标准100 目筛,浙江上虞市华康化验仪器厂;FA1104A 电子天平,上海精天电子仪器有限公司;ME2002/02 电子天平,梅特勒-托利多仪器(上海)有限公司;H1850R 台式高速冷冻离心机,湘仪离心机仪器有限公司;HJ-3 数显恒温磁力搅拌器,巩义市予华仪器有限责任公司;BC-117F C 海尔冷藏冰箱,青岛海尔股份有限公司;2102486-TMA快速粘度分析仪,澳大利亚NEWPORT SCIENTIFIC 仪器公司;RISE-2008 激光粒度分析仪,济南润芝科技有限公司;Q20 差示扫描量热仪,美国TA 仪器有限公司;SU506 手动U 型打卡机,衡水鸿昊企业有限责任公司;CM-21 斩拌机、EC-12灌肠机,西班牙Carnicos 设备有限公司;SIM-124制冰机,台湾三洋电机有限公司;CA-HM 食品热量分析仪,日本JWP 公司;SMSTA TA.XT plus 物性测定仪,英国Stable Micro Systems 公司;Heracles Ⅱ全自动快速电子气味分析仪、AstreeⅡ电子舌味觉指纹分析仪、VA400 复杂非均质视觉分析仪,法国Alpha MOS 公司。
1.3 方法
1.3.1 抗性淀粉的制备 加蒸馏水调节淀粉质量浓度为400 g/L,25 ℃放置30 min。
糊化-回生法 (Gelatinization-retrogradation,GR):将样品置于95 ℃水浴处理30 min,冷却至25 ℃后置于4 ℃冰箱老化24 h,取出25 ℃放置1 h 后105 ℃条件下干燥恒重,粉碎,过筛,即得糊化-回生法抗性淀粉(GRS)。
糊化-超声-回生法 (Gelatinization-ultrasound-retrogradation,GUR):样品在95 ℃条件下水浴处理30 min,冷却后40 ℃下超声处理(70 W)30 min,冷却至25 ℃后置于4 ℃冰箱老化24 h,取出25 ℃放置1 h,105 ℃条件下干燥恒重,粉碎,过筛,即得糊化-超声-回生法抗性淀粉(GURS)。
超声-糊化-回生法 (Ultrasound-gelatinization-retrogradation,UGR):样品在40 ℃条件下超声处理(70 W)30 min 后,转至95 ℃水浴处理30 min,冷却至25 ℃后,放入4 ℃冰箱老化24 h,取出25 ℃放置1 h,105 ℃条件下干燥恒重,粉碎,过筛,即得超声-糊化-回生法抗性淀粉(UGRS)。
1.3.2 抗性淀粉性质的测定
1.3.2.1 含量的测定 参照俞东宁[13]的方法测定RS 含量。取适量样品以pH 6.0 的柠檬酸-柠檬酸钠缓冲溶液稀释后,加入过量的耐高温α-淀粉酶(500 U/g),90 ℃水浴30 min 后,沸水浴灭酶,取出冷却至60 ℃,用柠檬酸调pH 值至4.5 后加入过量葡萄糖淀粉酶(5 000 U/g),60 ℃水浴30 min后,离心(10 000 r/min,10 min),用95%乙醇反复洗涤离心(10 000 r/min,10 min)3 次,取沉淀物干燥。按式(1)计算RS 含量:
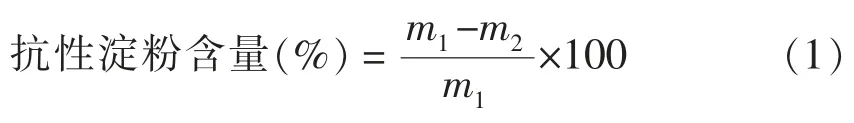
式中,m1——样品质量,g;m2——处理烘干后样品质量,g。
1.3.2.2 颗粒形态的测定 普通光学显微镜:淀粉样品加水调制成淀粉乳,取一滴样品置于载玻片上,盖上盖玻片,轻按压紧,以10×的物镜和10×的目镜(放大倍数100×)观察。
偏光显微镜:淀粉样品用甘油稀释,取一滴样品置于载玻片上,盖上盖玻片,轻按压紧(尽量不要有空隙),置于偏光显微镜载物台上,以物镜10×、目镜10×观察拍摄照片(放大倍数100×)。
1.3.2.3 粒径的测定 取2~3 mg 样品于激光粒度分析仪样品室中。测试参数如下:1 500 r/min,25 ℃,颗粒折射率1.50,颗粒吸收率0.01,分散体系为蒸馏水(折射率为1.330)。
1.3.2.4 糊化性质的测定 根据《小麦、黑麦及其粉类和淀粉糊化特性测定 快速粘度仪法》(GB/T 24853-2010)[14]测定淀粉样品的糊化特性。先量取(25.0±0.1)mL 蒸馏水于干净样品筒中,再准确称取(3.00±0.01)g 抗性淀粉样品移入样品筒,快速搅动至完全分散后,立即置于快速粘度分析仪测定。测定程序如下:起始转速960 r/min 维持10 s后一直保持160 r/min,起始温度为50 ℃保持1 min,之后3.7 min 内以恒定温度速率升至95 ℃,保持2.5 min 后,在3.8 min 内以恒定温度降至50℃,保持2 min。平行3 次测定。
1.3.2.5 热力学性质的测定 称淀粉样品3~5 mg,以1∶1 的比例添加蒸馏水于坩埚中,加盖密封,置于差示扫描量热仪(DSC)中测定。测定条件:起始温度60 ℃,以10 ℃/min 速率升温至200℃后,以20 ℃/min 速率降温至60 ℃。每个样平行测3 次。
1.3.3 香肠的制备 将鲜肉从冰箱中取出于4 ℃解冻12 h 后,切成2~3 cm 小块,4 ℃下以食盐腌制1.5 h 后,加入辅料斩拌3 min (斩拌温度≤12℃),将斩拌好的肉糜放入灌肠机灌肠后将香肠放入蒸锅,蒸煮45 min 后,冷水迅速冷却至室温,分别置于4 ℃和25 ℃贮藏备用。
1.3.4 香肠性质的测定
1.3.4.1 营养成分分析 将香肠粉碎后置于热量分析仪分析盘中,选择折射模式,选定香肠测定程序,分析产品营养成分。
1.3.4.2 估计血糖生成指数的测定 参照崔亚楠[15]的方法。准确称取含500 mg 可利用碳水化合物的样品于试管中,以样品∶蒸馏水=1∶1 的质量比加入蒸馏水混匀后加入1 mL 人工唾液,15~20 s 后加入5 mL 人工胃液,37 ℃振荡水浴30 min 后,用5 mL 0.02 mol/L NaOH 中和,随后加入25 mL 0.2 mol/L 醋酸钠缓冲溶液,加入5 mL 包含胰蛋白酶(6 μg/g)的人工肠液,继续在37 ℃水浴锅中温育,于0,10,30,60,90,120,180 min 分别取4 mL 沸水浴灭酶。用葡萄糖试剂盒测定其葡萄糖含量。以标准葡萄糖为参考物。参照Goni 等[16]的方法计算样品的eGI。

式中,Gt——t 时刻样品中葡萄糖含量(mmol/L);G0——样品中葡萄糖总含量(mmol/L)。
1.3.4.3 质构的测定 将样品切成长×宽×高约为4 cm×2.5 cm×2 cm 的块状,切面平整,置于物性分析仪测定其质构特性,选取探头P50,测试前速度1 mm/s,测试速度1 mm/s,测试后速度1 mm/s,压缩比50%,触发类型为自动,触发力5 g。每个样品平行测4 次。
1.3.4.4 气味的测定 称取5 g 样品切成2 mm 左右小方块置于小瓶中,在快速自动气味分析仪上分析,试验参数:60 ℃下孵化10 min,进样量500 μL,注射速度125 μL/s。平行测3 次。
1.3.4.5 滋味的测定 称取5 g 香肠样品切碎与100 mL 蒸馏水混合,均质机下均质3 min 后,用4层纱布过滤,取滤液倒入电子舌专用小杯中,于味觉分析仪上检测分析,采集参数:搅拌速率1 r/s,采集时间120 s,采集周期1 s,采集延迟0 s,每个样品平行3 次。
1.3.4.6 颜色的测定 取香肠较中间部分,切片于视觉分析仪上分析香肠切面颜色,平行4 次。
1.4 数据处理
利用Excel 2010、WPS 2018 以及Origin 8.5进行数处理及绘图,通过SPSS 16.0 进行显著性差异分析。
2 结果与分析
2.1 RS 性质测定结果
2.1.1 RS 含量分析 图1为淀粉的RS 含量。由图1可知,处理后的RS 含量较原淀粉均升高,不同淀粉处理后的RS 含量不同,同种淀粉不同处理方法其RS 含量也不同,然而不论何种方式处理,豌豆淀粉的RS 含量均最高。这可能与直链、支链淀粉含量有关,3 种原淀粉的直链淀粉含量排序为豌豆淀粉(35%)>玉米淀粉(28%)>马铃薯淀粉(21%)[17]。与支链淀粉相比,较短的直链淀粉在糊化后相对更易聚集形成结晶,在适宜范围内随着直链淀粉含量的增大,RS 含量升高[12]。由图1还可知,GUR、UGR 的RS 含量均高于GR,超声处理顺序不同,RS 含量不同。GUR 处理的RS 含量较UGR 处理高的原因可能是经糊化后的淀粉颗粒崩解使淀粉分子链溶出,超声后形成较短的C-C链,更有利于直链淀粉聚集到晶核上形成回生抗性淀粉(RS3)[18]。
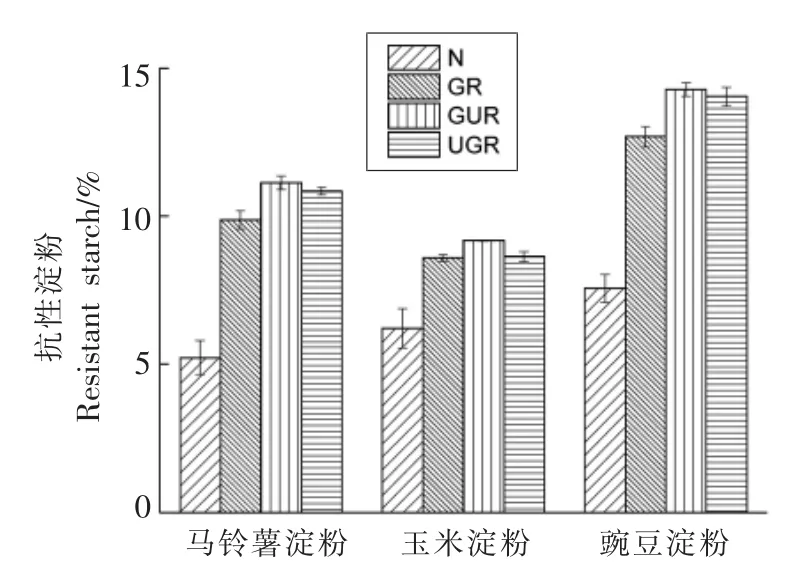
图1 不同处理方式下的RS 含量Fig.1 RS content under different treatment methods
2.1.2 颗粒形态 图2为处理前、后的淀粉颗粒形态图,其中图2(a、b、c)为普通光学显微镜观察图片,图2(d、e、f)为偏光显微镜观察图片。由图2(a、b、c)可知,原淀粉的淀粉颗粒形态完整,处理后淀粉颗粒完整性均被破坏,表面有裂纹。在图2(d、e、f)中可明显观察到原淀粉的偏光十字现象,然而经GR、GUR、UGR 处理后的淀粉偏光十字均消失。这是因为处理后的淀粉颗粒内部分子链的径向有序排列的晶体结构被破坏,导致淀粉颗粒偏光十字消失[19]。GR 处理过程中的热能促进了淀粉双螺旋链的流动性,使淀粉分子的有序性降低,从而导致双折射强度下降,偏光十字消失[20]。而在GUR 与UGR 处理过程中除发生淀粉糊化颗粒崩解外,超声波的机械力学效应与空穴效应等作用损害了原淀粉的内部径向排列结构,淀粉颗粒晶体结构被破坏,从而导致偏光十字消失[21]。

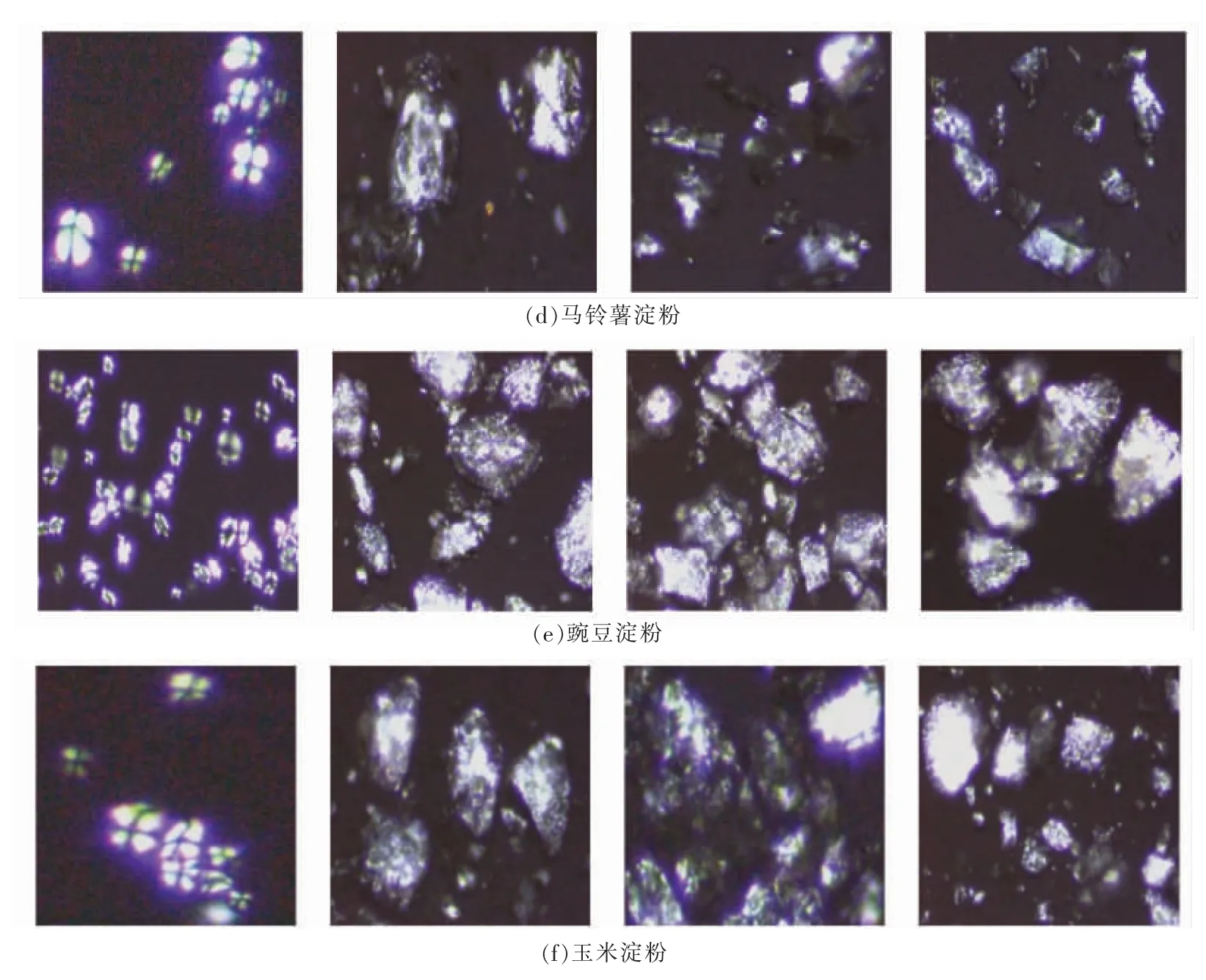
图2 不同处理方式下的淀粉颗粒形态图(×100)Fig.2 The morphology of starch granules under different treatment methods (×100)
2.1.3 粒径 由图3和表1可知,豌豆、马铃薯和玉米淀粉经GR、GUR、UGR 处理后粒径增大,粒径范围变宽。多数马铃薯、豌豆、玉米淀粉颗粒粒径在50 μm 左右,而处理后的大部分淀粉颗粒在180 μm 左右。由此说明,原淀粉经处理后,淀粉颗粒发生膨化或聚集成了更大的颗粒。这与周一鸣等[22]和俞东宁[13]的结果相似。
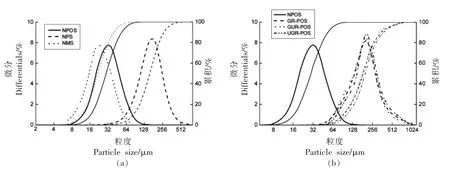
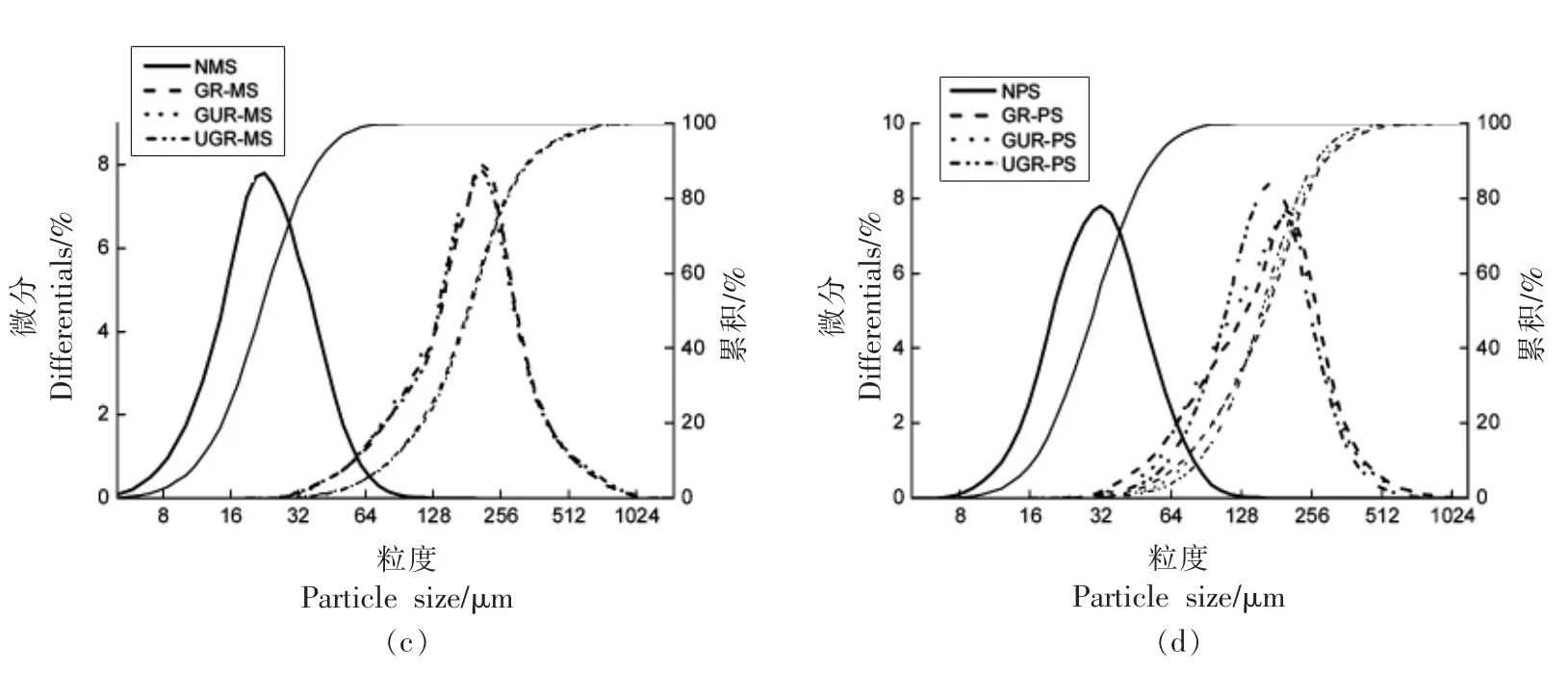
图3 不同处理方式下的淀粉粒度分布图Fig.3 Starch grain size distribution under different treatment methods
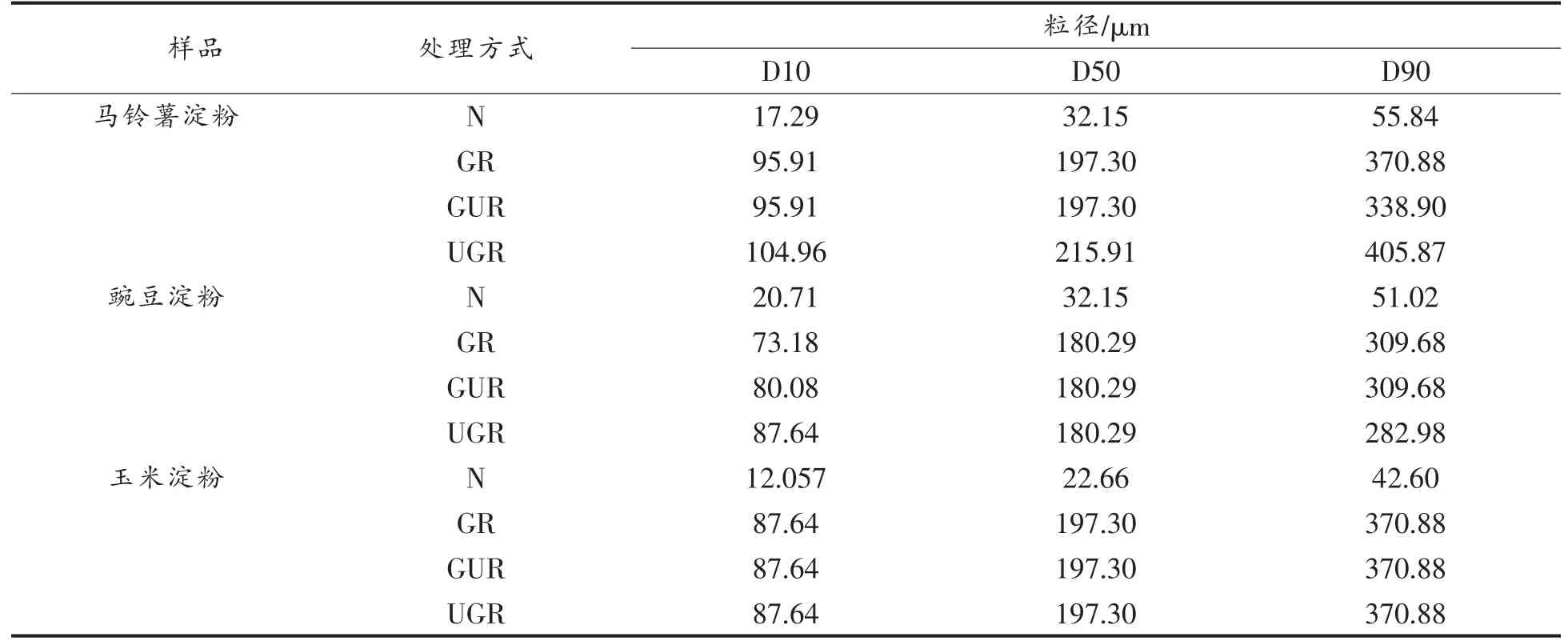
表1 不同处理方式下的淀粉粒径分布Table 1 Starch particle size distribution under different treatment methods
2.1.4 糊化性质 图4为不同处理方式下的淀粉RVA 曲线图。由图可知,玉米、豌豆及马铃薯原淀粉的RVA 曲线变化趋势相同 (图4a),经GR、GUR、UGR 处理后RVA 曲线发生改变(图4b、4c、4d)。不同淀粉的RVA 特征参数存在极大差异的原因是原料淀粉的来源不同。Gelencsér 等[23]发现不同来源的淀粉RVA 曲线与参数差异显著。处理前、后的玉米、豌豆及马铃薯淀粉的RVA 参数如表2所示,与原淀粉相比GR、GUR、UGR 处理后的淀粉峰值黏度、崩解值、最终黏度、回生值均降低。这与尹婧[24]的结果相似。这是因为原淀粉经处理后淀粉颗粒被破坏而重新缔合形成更紧密的结构[25],热稳定性变化,也不易回生。也有可能是在标准RVA 程序里,温度达不到处理后淀粉的糊化温度,致使淀粉未完全糊化甚至不糊化,故检测不出淀粉成糊温度,以及测出的峰值黏度、崩解值、最终黏度等均低于原淀粉。对于玉米淀粉,其成糊温度依次为GURS>UGRS>GRS>NS,马铃薯淀粉依次为GURS>UGRS>NS>GRS,而豌豆淀粉不论经过GR、GUR、UGR 中的哪种方式处理均未在95℃内未检测到其成糊温度。说明处理后的淀粉热稳定性增强,淀粉糊化需要更多的热量。此外,处理后的豌豆淀粉崩解值均低于40 cp,说明处理后的豌豆淀粉热稳定性好。
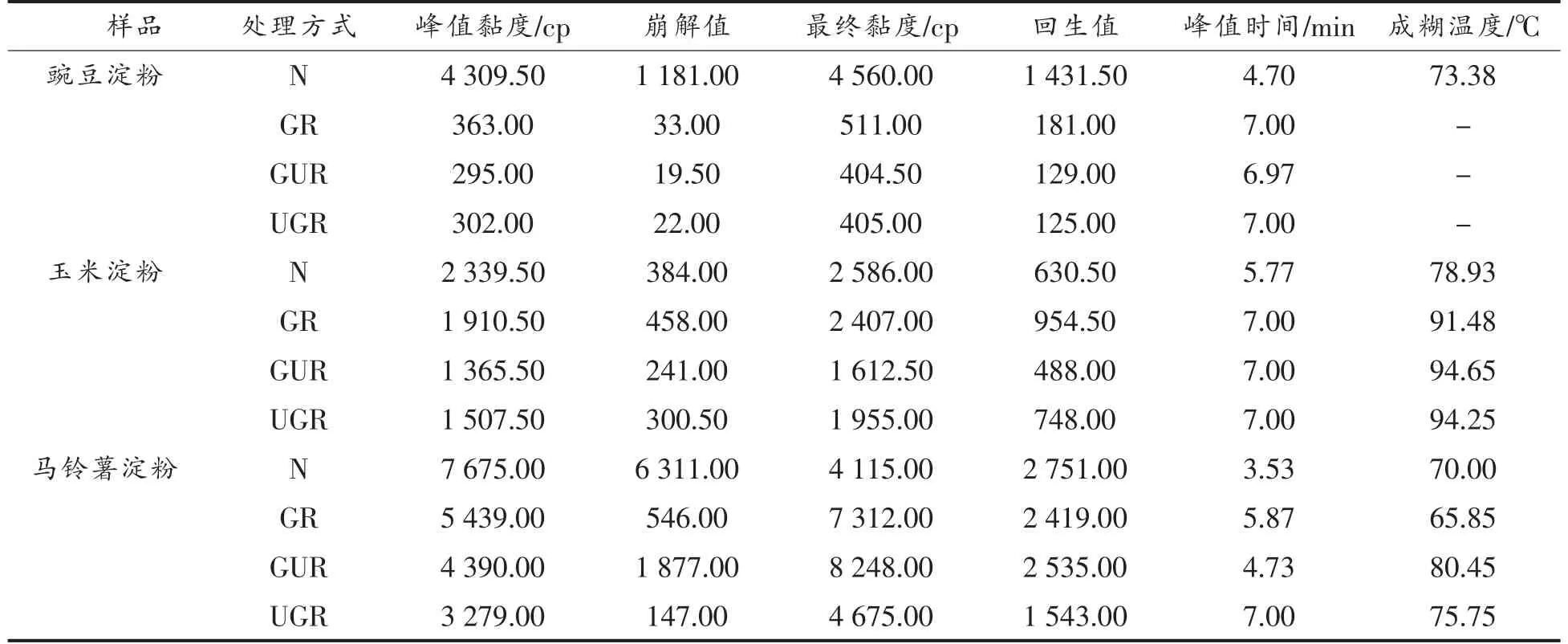
表2 不同处理方式下的淀粉糊化主要参数Table 2 The main parameters of starch gelatinization under different treatment methods
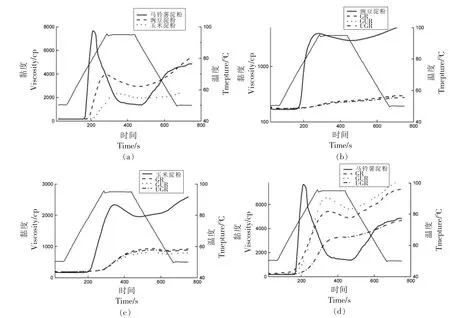
图4 不同处理方式下的淀粉黏度变化Fig.4 Starch viscosity changes under different treatment methods
2.1.5 热力学性质分析 玉米、豌豆与淀粉马铃薯处理前、后的DSC 曲线和热特性参数分别见图5和表3。从图5可知,处理前、后的3 种淀粉均出现一个向下的吸热峰,不同来源淀粉与处理方式之间的峰值温度不同,然而均有NS>GRS>UGRS>GRUS 的出峰顺序。与RVA 中的成糊温度结果类似。这可能与RS 淀粉含量有关。淀粉经处理后主要通过回生作用制得RS,GUR 处理可得到较多的短直链淀粉分子,利于通过氢键作用重新形成有序的晶体结构而得到更多的RS,破坏其结构需要更多的热量和更高的温度[7]。
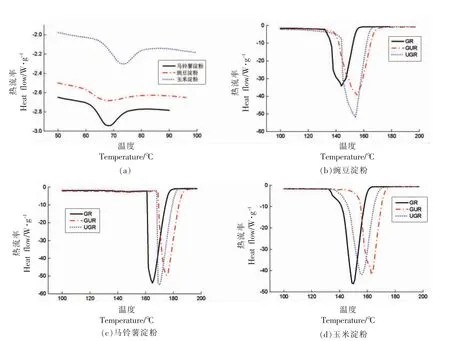
图5 不同处理方式下的淀粉DSC 图Fig.5 The DSC diagram of starch under different treatment methods
由表3可知,经GR、GUR、UGR 处理后的淀粉TO、TP、TC较原淀粉均明显增大。这是因为处理后的淀粉晶体结构更加有序,形成稳定性更好的淀粉结构[25-26]。而ΔH 从原来的4.58~8.98 J/g 跃升至2 775.40~4 464.70 J/g,进一步说明了GR、GUR、UGR 处理后形成的淀粉颗粒晶体稳定性高于原淀粉。峰高指数PHI 表示DSC 图谱的吸热或放热峰的相对形状,与ΔH 成正比,与Tr成反比关系[27]。从表3可知,处理后的淀粉的PHI 较原淀粉升高了百倍以上,除马铃薯淀粉外GUR 处理的PHI 最高。表明GUR 处理可形成更加紧密稳定的结构,淀粉分子分布更集中。
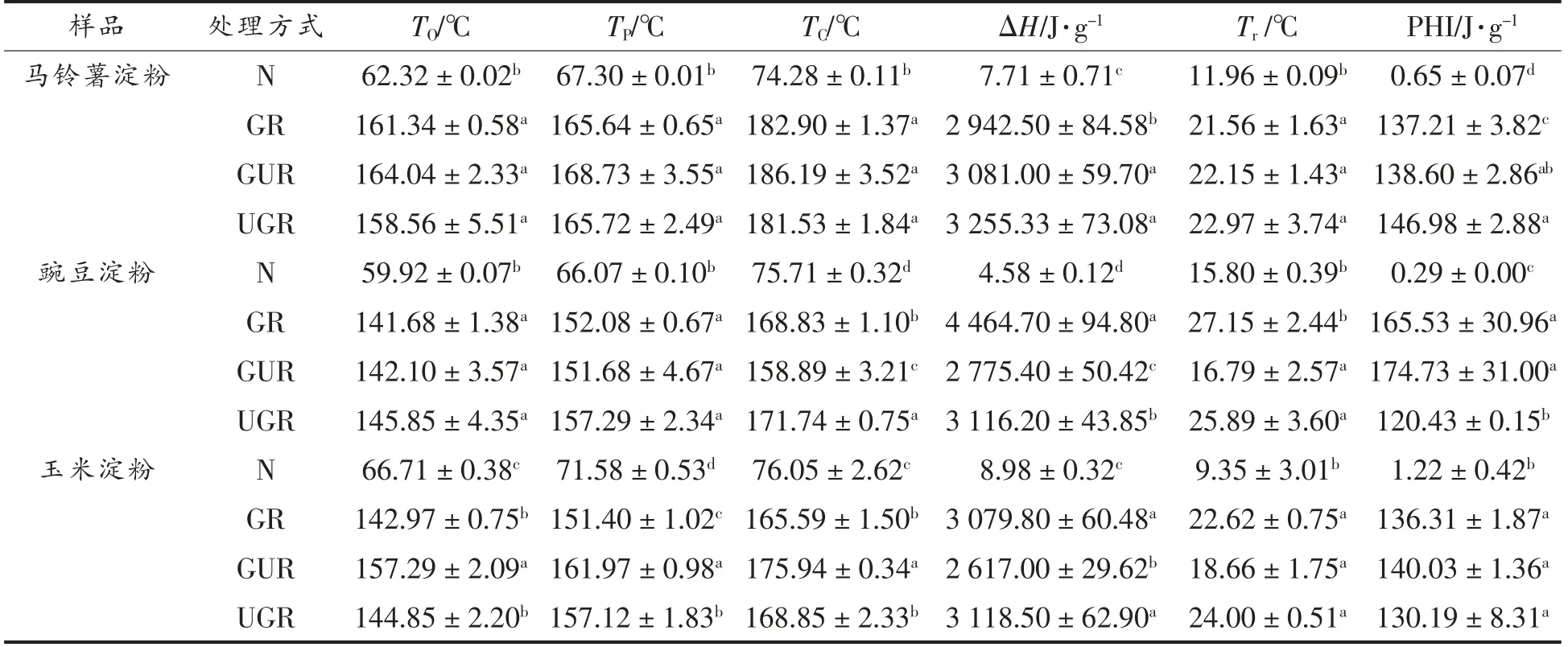
表3 不同处理方式下的淀粉DSC 数据表Table 3 The DSC data table of starch under different treatment methods
2.2 RS 在中式香肠中的应用
2.2.1 营养成分分析 研究发现经GUR 处理后的豌豆淀粉具有较好的理化性质。故以4%的添加量分别将豌豆原淀粉与抗性淀粉(经GUR 处理)添加至鲜肉中制备香肠,并对产品品质进行测定。表4为香肠的营养成分表,由表4可知,PS 与PRS 香肠营养成分无明显差别(P>0.05),表明RS在营养成分上可替代普通淀粉,添加RS 不会导致香肠营养成分发生改变。

表4 香肠营养成分表Table 4 Nutrition facts of sausages
2.2.2 血糖生成指数分析 血糖生产指数(Glycemic index,GI)是用来衡量食物中碳水化合物对血糖浓度影响的指标,反映某种食物能够引起人体血糖升高量的能力。根据测试食物对餐后2 h 的血糖反应可将食物分为高GI 食物 (GI≥75)、中GI 食物(GI 为55~75)与低GI 食物(GI≤55)[28]。长期食用高GI 食物可导致慢性胰岛素血症,引发癌症等[29]。肉制品作为人类营养物质主要来源之一,长期食用易导致高血糖、高血脂等一系列慢性疾病。故低GI 肉制品的开发具有重要意义。
图6为香肠的体外消化淀粉水解率。由图6可知,随着体外消化时间的延长,淀粉发生水解,水解作用增强,而总有PRS 低于PS 的结果。表明RS 具有抗消化作用。可将RS 添加至食品中调节糖脂代谢,控制体重等[30-31]。
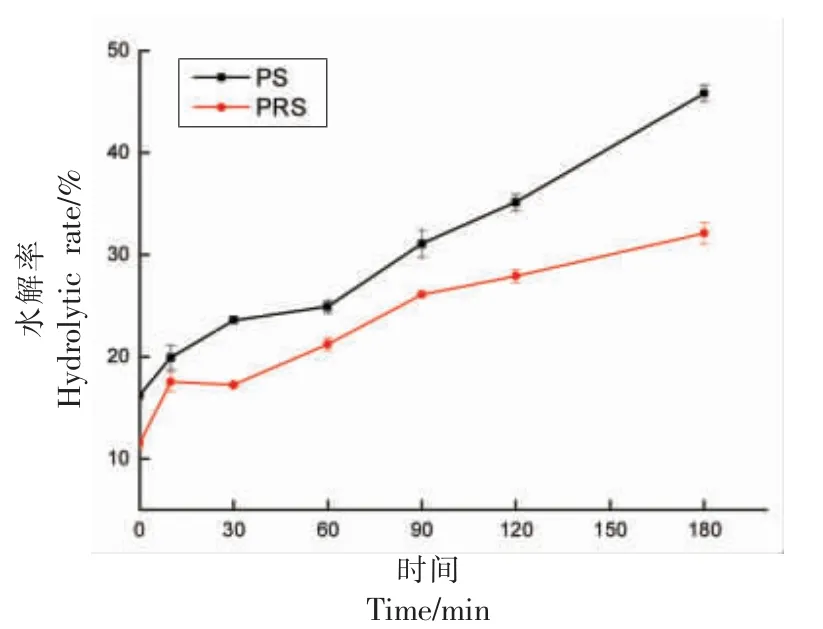
图6 香肠的体外消化曲线Fig.6 In vitro digestion curve of sausages
图7为香肠的体外估计血糖生成指数。由图7可知,随着体外消化时间的延长,香肠的eGI 逐渐升高,然而总有PRS 小于PS 的结果,且差异显著(P<0.05)。在180 min 处,PS 香肠的eGI 为64.86,而PRS 香肠的eGI 仅为55.04,明显低于PS 香肠。与普通淀粉相比添加RS 使香肠血糖值降低了15.14%。表明将普通淀粉替换为RS 对香肠具有显著的降糖作用。这与肖兵[32]的玉米RS3 可明显降低小鼠血糖值的结果类似。Wang 等[33]也得出莲子RS3 可有效降低糖尿病小鼠的血糖水平。将RS添加至肉制品中降低产品的血糖生成指数,对于开发营养健康的低GI 肉制品具有重要意义。

图7 香肠的估计血糖生成指数Fig.7 The estimated glycemic index of sausages
2.2.3 质构分析 从表5可知,PS 香肠与PRS 香肠的质构参数无明显差异(P>0.05)。图8为PRS香肠在不同温度下贮藏7 d 的质构变化图。由图可知,无论是4 ℃还是25 ℃贮藏,7 d 后的硬度、弹性和咀嚼度均大于0 d,弹性则变化不大。表明RS 不仅能降低香肠的血糖水平,还能保证产品质构。
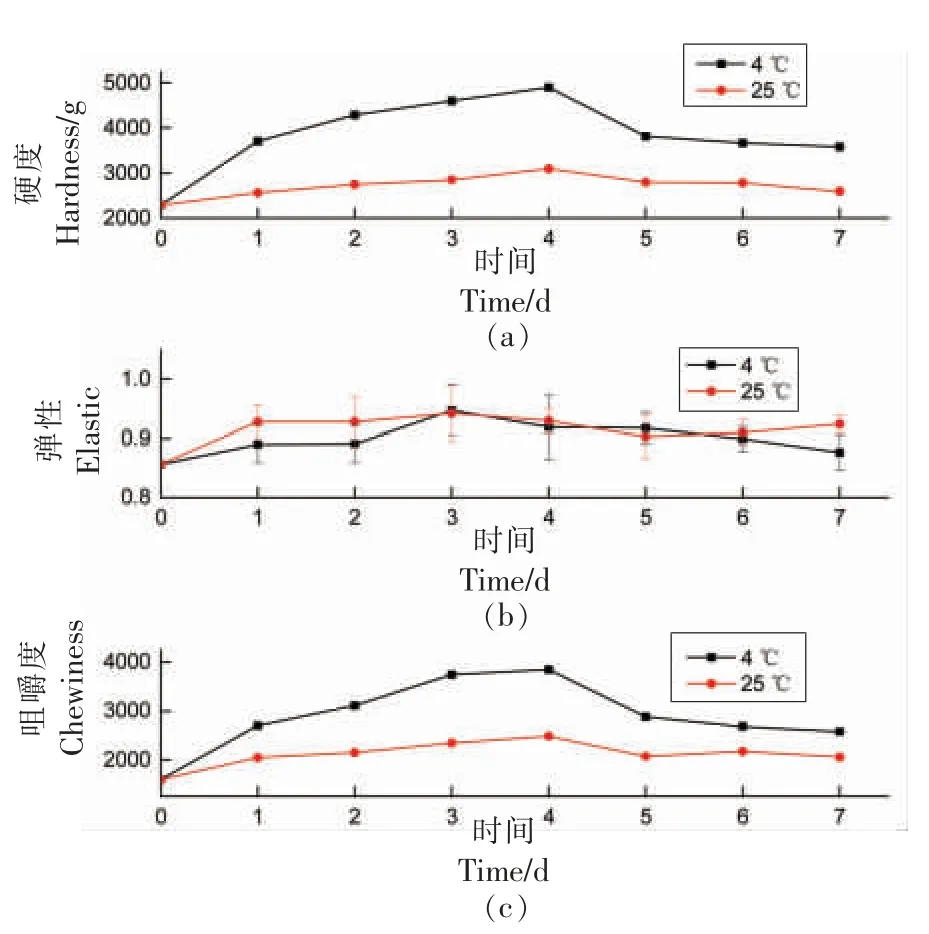
图8 不同贮藏温度下香肠质构变化Fig.8 Changes of texture of sausages under different storage temperatures

表5 香肠质构Table 5 The texture of sausages
2.2.4 气味分析 主成分分析(Principal component analysis,PCA) 是指将传感器响应值的特征向量进行数据转换和降维后,以散点图的形式分布在PCA 图谱中[34]。当主成分贡献率超过70%~85%时,则PCA 方法可行[35]。图9为PS 香肠与PRS 香肠的PCA 图。从图9可知,主成分1 的贡献率为83.369%,主成分2 的贡献率为11.817%,总贡献率95.186%>85%。识别指数为-0.1,表明PS 香肠与PRS 香肠的气味相似或相近,RS 可维持香肠原有风味,从侧面反映在产品中添加RS 不会产生影响产品风味的物质。

图9 香肠气味变化的主成分分析Fig.9 Principal component analysis of sausages odor changes
图10为不同温度下贮藏7 d 的香肠气味变化PCA 图。图中主成分1 将贮藏于4 ℃和25 ℃1~5 d 的样品与贮藏于25 ℃6~7 d 样品的区别开。表明PRS 香肠在4 ℃贮存7 d 与25 ℃贮存5 d 后仍保有原味道,RS 保证了香肠的品质。

图10 不同贮藏温度下香肠气味变化的主成分分析Fig.10 Principal component analysis of sausages odor changes under different storage temperatures
2.2.5 滋味分析 图11为PS 香肠和PRS 香肠的滋味PCA 图。由图11可知,PS 香肠与PRS 香肠在味觉上也无明显差异。图12为PRS 香肠在不同温度下贮藏1~7 d 的滋味PCA 图。从图中可以看出,4 ℃与25 ℃贮藏的香肠滋味在7 d 内差异不大,RS 可很好的维持香肠滋味。
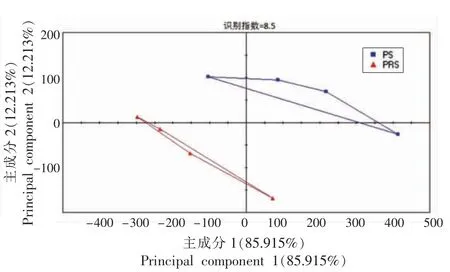
图11 香肠的味觉主成分分析Fig.11 Analysis of taste principal component of sausage
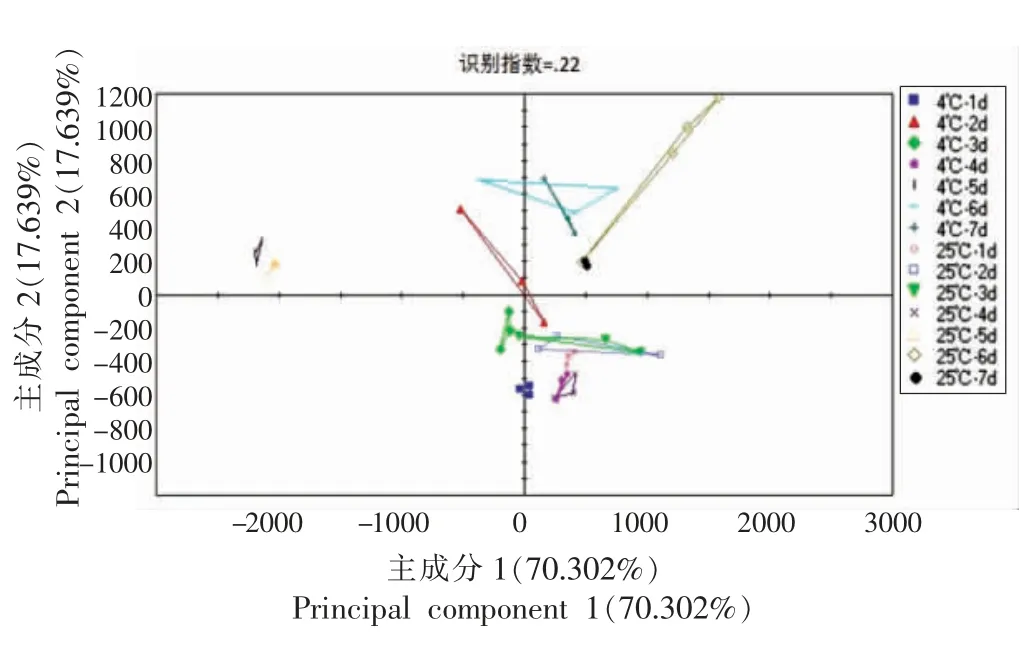
图12 不同贮藏温度下香肠滋味变化的主成分分析Fig.12 Principal component analysis of sausage taste changes under different storage temperatures
2.2.6 颜色分析 对于肉制品来说,颜色的变化直接影响产品品质,进而影响消费者的购买欲。图13、14 分别为香肠颜色变化PCA 与分布图。从图13可知,PCA 识别指数为78,表明PRS 与PS 香肠存在颜色差。从图14中可知其主要颜色差异为3515(温和的粉红色)与3531(褐色的粉红色)。PRS 香肠在3515 处具有较高响应值,表明RS 可更好的保持鲜肉原有的粉红色。
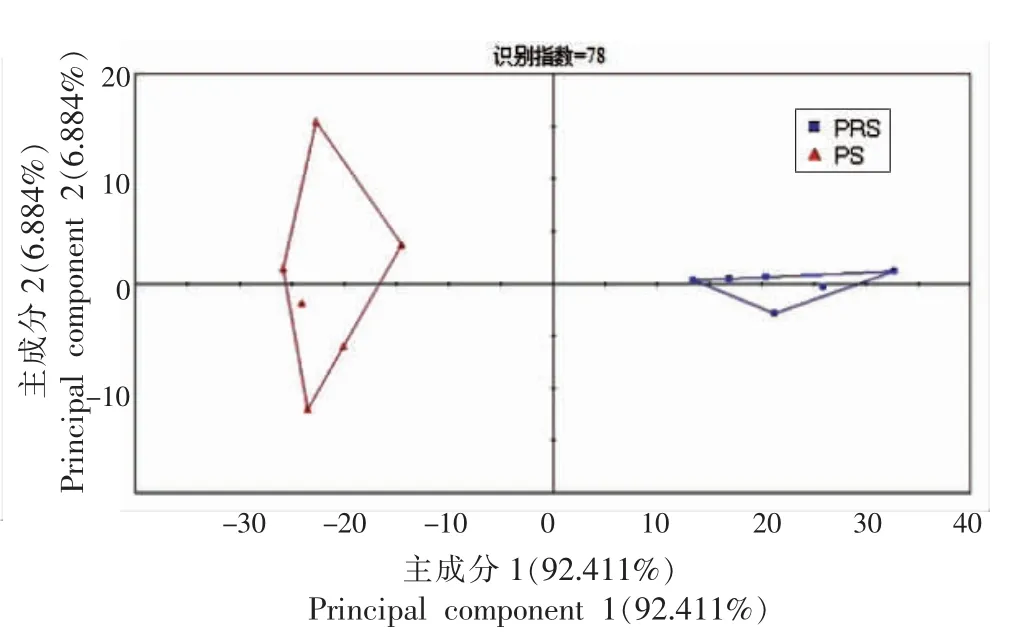
图13 香肠颜色变化的主成分分析Fig.13 Principal component analysis of sausages color changes
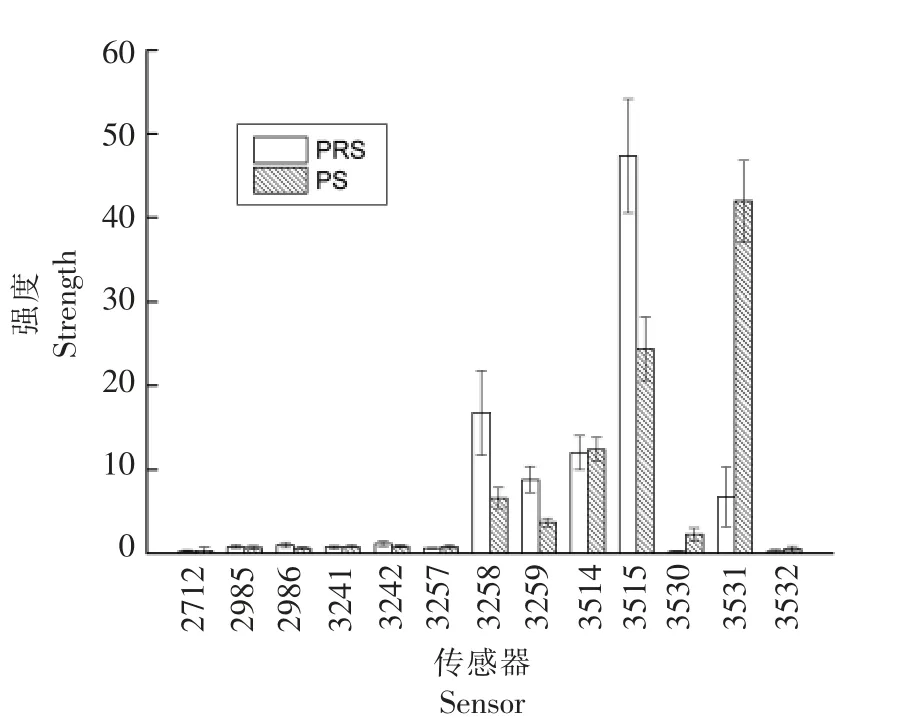
图14 香肠颜色分布图Fig.14 The color distribution of sausage
图15是以3515、3531 为主要传感器来反映香肠在不同贮藏条件下的颜色变化PCA 图。由图可知,主成分1 和主成分2 将PCA 图谱分为4 个区域,不同区域之间表明存在一定的差异性。PRS香肠的颜色在4 ℃与25 ℃下分别可维持4 d 与3 d 不发生变化。

图15 不同贮藏温度下香肠颜色变化的主成分分析Fig.15 Principal component analysis of sausage color changes under different storage temperatures
3 结论
本试验以马铃薯淀粉、玉米淀粉以及豌豆淀粉为原料,比较GR、GUR、UGR 处理后的抗性淀粉的相关性质。结果表明:淀粉经处理后可得到粒径大、糊化温度升高、热稳定性增强的抗性淀粉,且豌豆淀粉经GUR 处理后,RS 含量最高,热稳定性最好。将豌豆抗性淀粉(经GUR 处理)添加至香肠中,发现制备的PRS 香肠具有更低的eGI 值,为55.04,与添加原淀粉PS 香肠相比,其血糖值降低了15.14%;且香肠的营养成分、质构以及风味等均没有发生明显改变。此外,香肠在4 ℃贮藏7 d后,PRS 香肠的气味与滋味无明显变化,25 ℃贮藏5 d 香肠的气味也无明显变化。RS 可很好地维持香肠品质,在不改变营养成分与品质的前提下降低了香肠的eGI。试验结果可为RS 在肉制品中的应用,以及开发营养健康的低GI 食物提供理论依据。
