文冠果种子不同发育期内源激素的动态变化
2022-05-25王鹏侠阮成江
王鹏侠,阮成江,杜 维,赵 振
(1.甘肃省渭源县林业和草原服务中心,甘肃 渭源 748200;2.大连民族大学 资源植物研究所,辽宁 大连 116600;3.吴忠市协贵厚种植专业合作社,宁夏 吴忠 751100)
文冠果(XanthocerassorbifoliumBunge)是中国北方特有的木本油料树种,广泛分布于辽宁、内蒙、宁夏、甘肃和新疆等地[1]。文冠果具有耐旱、耐盐碱、耐寒和适应沙地等抗逆特性,可以在土壤贫瘠和气候干旱的地区种植[2]。文冠果种子含油率可达35%以上、种仁含油率可达67%以上,油脂中含有丰富的不饱和脂肪酸,如油酸、亚油酸和神经酸等[3]。
植物种子发育受内源激素的严格调控,如生长素和赤霉素可促进种子膨大、脱落酸可促进糖酸形成等[4,5]。但生长素(IAA)、细胞分裂素(CTK)、赤霉素(GA3)和脱落酸(ABA)在文冠果种子发育过程的动态变化仍不清楚。本文以不同发育期文冠果种仁为实验材料,经固相萃取提取纯化内源激素,利用液质联用法(LC-MS)分析不同发育期文冠果种仁内源激素的动态变化及其对种子发育的影响,旨在为理解内源激素对文冠果种子发育的调控规律提供科学参考。
1 材料与方法
1.1 材 料
文冠果不同发育期种子分别于2019年采收自宁夏回族自治区吴忠市国家农业科技示范园区文冠果基地。选取花后50天(50 days after flowering DAF 前期)、65天(65 DAF中期)、80天(80 DAF 末期)和95天(95 DAF成熟期)4个发育期,采收时选取发育良好的果实,取出种子混合后用锡纸包裹液氮速冻,干冰运输回实验室以后,保存于-80 ℃冰箱中、备用。
1.2 种子含油率测定
选取50、65、80和95 DAF 4个发育期种子,剥种皮后对种仁进行形态观察并拍照。
采用氯仿甲醇法测定文冠果种仁含油率[6]。将烘干的文冠果种仁研磨,精确称取0.3 g研磨后的种仁并转移至1.5 ml离心管中,加入含有60%氯仿的甲醇溶液,剧烈震荡1 min后于4 ℃冰箱中静置过夜。过夜静置后10 000g离心5 min,上清液转移至新离心管中,加入300 μL 1% KCl溶液震荡5 min,震荡后10 000g离心5 min,弃上清液,将下层氯仿相转移至重量已知的离心管中。风干或真空浓缩氯仿相,称重后与空管差值即为种仁的含油量。每个样品做3次重复。
1.3 内源激素提取纯化与检测方法建立
采用甲醇法结合固相萃取提取和纯化种仁内源激素[7]。将样品从低温冰箱取出,液氮研磨后称重(1~2 g)转移至10 mL离心管中,加入5 mL 体积比为75%甲醇、5%甲酸水溶液过夜提取。10 000g离心20 min, 加入2 mL提取液清洗沉淀2次,合并离心后的提取液,离心浓缩至溶液体积为3 mL,浓缩后用1 mol·L-1甲酸溶液定容至10 mL。MCX固相萃取柱对提取液进行纯化:用2 mL甲醇纯化,2 mL 1%甲酸溶液平衡,进样后先用2 mL甲醇洗脱得到IAA、ABA和GA3,用3 mL氨化甲醇(含有0.35 mol·L-1氨水、60%甲醇的水溶液)洗脱得到CTK。合并洗脱液,用甲醇定容至10 mL。上样前样品经过0.22 μm滤膜过滤,由于植物内源激素易见光分解,提取时应用棕色容器避光操作。
采用液质联用法对纯化后的内源激素进行测定[7],液相条件为:A为1%甲酸溶液,B为甲醇溶液。洗脱程序:0~5 min 10% B,5~20 min 10%~90% B,20~25 min 90% B, 25.1~35 min 10% B。色谱柱为C18柱(150 mm×4.6 mm),流速为1 mL·min-1,柱温40 ℃。质谱采用ESI离子源,离子化电压为+5500 V,TEM:550℃,MRM模式下优化IAA、GA3、ABA和CTK的检测条件以增加离子信号强度,提高检出限。4种植物内源激素采用外标法定量,样品测定峰面积与标准曲线对比,计算对应激素的浓度。
2 结果与分析
2.1 文冠果种子发育过程形态学观察
宁夏吴忠文冠果花期为5月上中旬,随后进入种子发育期。6月下旬至8月初为种子发育到成熟期图1。50 DAF时,种皮白色、种仁绿色,种子硬度较低,含水量较高;65 DAF,种皮由白色变为黄棕色,种仁变大的同时叶绿素逐渐降解,种子含水量不断下降,硬度有所提高;80 DAF,种皮逐渐脱水木质化,颜色由黄棕色变为棕色,种仁体积进一步增大,颜色逐渐变浅;95 DAF果实成熟时,种子颜色变为黑色,硬度较高,种仁叶绿素完全降解,颜色变为白色。

(注:左至右时期分别为:50、65、80和95 DAF)
2.2 文冠果不同发育期种子含油率变化
文冠果种子含油率随发育进程迅速升高,文冠果不同发育期种子含油率变化如图2。50 DAF种子含油率仅为7.13%,50~65 DAF为种子油脂快速合成积累期,含油率由7.31%快速升高到31.47%,增长率为341%。65 DAF后种子油脂合成积累速率减慢,到95 DAF上升到41.1%。由此可见,50~65 DAF为文冠果种子油脂合成积累的关键时期,种子发育中后期的油脂积累对总油脂含量贡献相对较小。
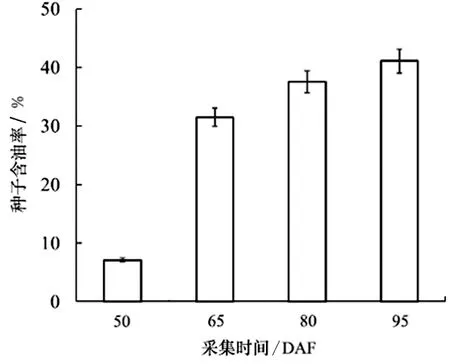
图2 文冠果不同发育期种子含油率变化
2.3 内源激素提取纯化与检测方法建立
对质谱参数进行优化,结果见表1。IAA和CTK为正离子扫描模式,定量子离子荷质比(m/z)分别为130.2和136.3。ABA和GA3为负离子扫描模式,定量子离子分别为153.1和239.2。调整每种内源激素的碰撞能量和去簇电压以得到最高响应值,内源激素GA3在负离子模式下母离子345.1只能产生1种对应的子离子。对浓度范围10~500 ng·mL-1的标准品溶液进行测定,得到4种内源激素标准品峰面积和对应浓度呈现良好线性关系,标准曲线相关系数(R2)均大于0.99,符合外标法定量要求。

表1 4种内源激素MRM参数和标准曲线方程
4种内源激素50 ng·mL-1的LC-MS/MS图如图3。内源激素根据非极性由弱至强,出峰时间依次为CTK 4.5 min、ABA 13.8 min、GA318.1 min和IAA 24.1 min。无杂峰且峰型对称,无明显前沿和拖尾现象。由于试验采用质谱多反应监测模式(MRM)进行信号采集,避免了单独使用高效液相色谱法时植物细胞内色素、黄酮和多酚等非极性生物活性物质对目标出峰产生的干扰。

图3 4种内源激素LC-MS/MS图
2.4 文冠果种子发育过程内源激素变化
文冠果种子发育过程中,不同种类内源激素含量变化规律存在明显差异,动态变化如图4。IAA含量在种子发育前中期保持稳定(0.90 nmol·L-1),发育末期略有下降(0.63 nmol·L-1),但种子成熟时IAA含量急剧上升,是发育前中期的1.78倍,达到1.6 nmol·L-1。说明种子发育后期IAA含量升高可能利于促进种子脱水成熟及休眠,与Liu的研究结果一致[8]。
GA3含量随文冠果种子发育进程呈下降趋势,50、65 DAF浓度分别为0.19 nmol·L-1和0.13 nmol·L-1,发育末期和成熟期稳定在0.038 nmol·L-1和0.026 nmol·L-1。GA3与植物细胞代谢速率相关[9],GA3含量降低反映出文冠果种子发育过程细胞代谢逐渐减缓,直至成熟时降至较低水平。成熟后随着脱水的进行,种子逐渐进入休眠,代谢速率降至最低。这与GA3作为细胞代谢强度的指标反映着植物细胞活性[10]的结果相一致。
在不同发育期文冠果种子中,ABA浓度最高时较其他三种激素最高浓度高8~50倍左右如图4。在不同发育期种子中,ABA浓度随种子发育进程而呈明显下降趋势。种子发育前期(30 DAF),ABA浓度高达10.79 nmol·L-1,中后期逐渐降低,成熟期降至最低点(0.78 nmol·L-1)。ABA在调控种子发育成熟和产物合成积累等方面起到重要的调控作用,高浓度的ABA可以促进碳水化合物和脂类的合成与积累[11]。文冠果种子含油率在发育前中期增速较快可能与ABA浓度较高相关,前中期高水平的ABA对应文冠果种子油脂的快速合成积累。

a) IAA b)GA3
CTK在文冠果种子发育前中期维持较高水平(0.38 nmol·L-1、0.51 nmol·L-1),但后期和成熟期逐渐降至较低水平(0.13 nmol·L-1、0.02 nmol·L-1)。前中期高水平的CTK可促进文冠果种仁细胞分裂,使种仁体积在前中期有较快幅度的增大,这与CTK可促进细胞分裂、分化[12]的结果相一致。
3 结 语
文冠果种子含油率随发育进程逐渐升高,前中期是种子油脂形成的关键时期。不同发育期文冠果种子不同内源激素动态变化的差异明显,IAA在果实成熟时含量最高,可促进种子脱水成熟;GA3随果实发育过程含量逐渐降低,与种子细胞活性一致;ABA浓度与含油率增长速率成正相关,高浓度ABA有助于文冠果种子油脂的快速积累;种子发育前期CTK含量较高,可促进文冠果种仁体积的增大。
植物种子发育的激素调控网络十分复杂,内源激素、转录因子以及相关信号分子一起控制这一复杂过程。文冠果种子内源激素动态变化的研究有助于从激素水平揭示文冠果种子生长发育的调控机制,也可为制定提高种子含油量的调控措施提供科学参考。
