东北人工红松针叶林和天然次生阔叶混交林林下土壤氮初级转化速率特征
2022-05-24吴昌福苏孝纯
郎 漫,吴昌福,苏孝纯,李 平*
(1. 南京信息工程大学,江苏省农业气象重点实验室,江苏 南京 210044;2. 南京信息工程大学应用气象学院,江苏 南京 210044)
氮素是植物生长发育所必需的大量营养元素。研究表明,土壤氮素有效性是森林生产力的主要限制因子之一[1-2]。土壤中氮的有效性受控于决定其数量和形态的有机氮矿化速率、无机氮固定速率和硝化反硝化速率的大小[3]。近年来,随着大气环境污染研究的推进,大气氮沉降及其对森林生态系统的影响日益受到关注,森林土壤氮转化过程及其机理也成为当前生态环境领域的研究热点。
森林类型不同,输入到土壤中的林木凋落物和根系分泌物的种类、数量、分解速率等具有显著差异[4],进而导致森林土壤理化性质[5]以及微生物数量、活性和群体结构显著不同[6-7]。与阔叶林相比,针叶林凋落物中所含的营养物质较少,而木质素和纤维素等难降解物质较多,分解速率较慢,使得土壤有机碳总量和易分解有效碳数量相对较低[8],土壤C/N 较高[9]。此外,针叶林凋落物分解过程中产生的有机酸和根系分泌的有机酸通常也会导致土壤pH 显著低于阔叶林土壤[9]。这些性质上的差异可能会对微生物参与的土壤氮素转化过程产生显著影响,进而影响土壤中氮的有效性。目前,关于不同森林类型土壤净氮转化速率的研究较多[1,10-11],而针对森林土壤氮初级转化速率的研究只有零星报道[12]。研究发现,森林土壤中铵态氮和硝态氮的周转速率很快,有机质矿化产生的无机氮很快被微生物固定为有机氮,常规研究测定的土壤净氮矿化速率或净硝化速率为负值或者很低的情况实际上并不意味着森林土壤的氮矿化和硝化能力很低[13]。自然条件下,土壤净氮转化速率是控制氮转化的各个初级转化速率的综合结果[14],不能表征土壤氮实际转化速率的大小。因此,研究土壤氮初级转化速率可以从过程水平上深入认识控制森林土壤中无机氮形态和含量的各个氮转化过程的初始速率[15],对于了解森林生态系统生产力、氮素循环,评价森林土壤中氮素的可利用性以及森林经营管理具有重要意义。
针叶林和阔叶林是我国寒温带地区的两种主要林型,前期已有较多关于寒温带森林土壤净氮转化速率的研究[1,11,16],但尚未有从土壤氮初级转化速率角度开展的研究报道。此外,受进入土壤的林木凋落物数量、分解速率及林木根系活力差异的影响,不同深度土壤的理化性质和生物学性质存在差异,进而可能导致土壤氮初级转化速率的不同。因此,本研究以我国东北寒温带的人工红松针叶林(简称针叶林,下同)和天然次生阔叶混交林(简称阔叶林,下同)不同深度的表层土壤为研究对象,采用室内培养试验,通过15N 同位素成对标记技术和FLUAZ 数值优化模型研究土壤氮初级矿化速率、铵态氮固定速率、硝态氮固定速率、初级硝化速率特征对林型和土壤深度的响应,旨在揭示该地区森林土壤氮素转化特征,了解森林土壤氮供应能力及氮有效性,为森林生态系统的合理经营管理提供科学依据。
1 材料与方法
1.1 供试土壤
供试针叶林和阔叶林土壤采自黑龙江省北安市赵光镇,该地区位于47°35′~48°33′ N、126°16′~127°53′ E 之间,海拔300~350 m,属寒温带大陆性季风气候,土壤类型为暗沃冷凉淋溶土,成土母质以花岗岩、砂页岩的风化残积物为主,有黏化层和暗沃表层[17-18]。北安市年平均降水量553 mm,年平均气温2 ℃。人工红松针叶林优势树种为红松(Pinus koraiensisSieb. et Zucc.),其他树种为云杉(Picea asperataMast.)和冷杉(Abies nephrolepisMaxim.),平均树龄超过50 a,树木间距约2 m。天然次生阔叶混交林主要树种包括桦树(Betula platyphyllaSuk.)、杨树(Populus BonatiiLevt.)、糠椴(Tilia mandshuricaRmpr.et Maxim.)、榆树(Ulmus pumilaLinn.)和蒙古栎(Quercus mongolicaFisch. ex Ledeb.),平均树龄超过50 a。灌木有毛榛子(Corylus mandshuricaMaxim.)、暴马丁香(Syringa reticulate( Blume) H. Hara var.amurensis(Rupr.) J. S. Pringle)、东北鼠李(Rhamnus schneideriLevl.)、 金 银 忍 冬(Lonicera maackii(Rupr.) Maxim.)、东北溲疏(Deutzia parvifloraBunge var.amurensisRegel)等。
于2020 年10 月8 日取样,每种林型土壤设置3 个空间重复采样区域,空间重复间隔300 m左右,每个空间重复采样区域再设置5 个采样点(1 m × 1 m),采样点间隔20 m 左右,每个采样点去除表层枯枝落叶后用直径为5 cm 的环刀分别采集0~10、10~20 cm 土壤,将每个土层的10 个样品混匀后作为此土层的一个空间重复样品[11,19]。此混合样品过2 mm 筛后一部分新鲜土样置于4 ℃冰箱中储存用于培养试验,其余土样风干后用于土壤理化性质分析,2 种林型土壤的基本理化性质见表1。

表1 供试土壤的基本理化性质(平均值±标准差)Table 1 Physico-chemical properties of the studied soils (mean ± SD)
1.2 培养试验
本研究采用15N 同位素成对标记室内培养试验,每个土壤设置2 个15N 标记处理:一个处理添加15NH4NO3,一个处理添加NH415NO3,每个处理3 次重复。称取30 g(干基)新鲜土壤至250 mL三角瓶中,用移液管向三角瓶中均匀加入2 mL15N 标记的15NH4NO3或NH415NO3溶液(标记丰度为5% atom),使添加的铵态氮浓度达到20 mg·kg−1,同时将土壤水分含量调至最大持水量的60%。将三角瓶用锡箔封口,并在锡箔上扎4~5 个洞以利于通气,然后置于25 ℃恒温培养箱中培养7 d,培养期间每隔1 d 通过称质量法补充蒸发损失的水分。分别在培养后的0、1、3、5、7 d破坏性取样,向三角瓶中加入75 mL 2 mol·L−1的KCl 溶液,250 rpm 下振荡提取1 h 后过滤,将滤液收集于100 mL 塑料瓶中用于分析无机氮浓度及其15N 丰度。过滤后的土壤用去离子水淋洗3 次以去除残留的KCl,然后将土壤于60 ℃下烘干,球磨仪磨碎后用于分析土壤有机氮浓度及其15N 丰度。
1.3 测定项目与方法
土壤pH 用电位法测定(液土比为2.5:1);土壤有机碳和全氮用CN 元素分析仪(vario MACRO cube, Germany)测定;土壤砂粒、粉粒、黏粒含量用比重计法测定;土壤铵态氮、硝态氮含量用MgO-定氮合金蒸馏法测定[20];土壤用水浸提后利用有机碳氮分析仪测定水溶性有机碳和水溶性有机氮含量[21];土壤最大持水量参照Fierer 和Schimel的方法测定[22];土壤无机氮和有机氮的15N 丰度采用同位素质谱仪(Thermo Fisher MAT 253, USA)测定。
1.4 数据处理与统计分析
土壤氮初级转化速率采用FLUAZ 模型拟合得出[23]。将每一次取样获得的标记铵态氮库和硝态氮库的铵态氮、硝态氮、有机氮浓度及其15N 丰度分别输入到模型中,通过数值优化拟合出土壤氮初级矿化速率(gm)、初级硝化速率(gn)、初级固定速率(gi)、铵态氮固定速率(ia)、硝态氮固定速率(in)。FLUAZ 模型以最小平均加权误差(MWE, mean weighed error)为标准拟合数据,相对于最小平方和而言更加标准化,能够更加准确反映速率之间的变异,估算的土壤氮转化速率与实测值之间具有很好的一致性,而且运用简便、迅速。该模型可以拟合出不同培养时间段的氮初级转化速率,能够反映土壤氮转化的动态变化趋势,本文通过加权平均法计算出了整个培养期间的平均氮初级转化速率。文中数据均为3 次重复的平均值,采用Origin 软件做图,采用SPSS 软件进行不同处理间的差异显著性检验。
2 结果与分析
2.1 土壤中无机氮含量的动态变化
2 种林型土壤中无机氮含量的动态变化见图1。针叶林0~10 cm 土壤铵态氮含量在0~1 d 略有增加,之后没有显著变化;而10~20 cm 土壤铵态氮含量在整个培养期间基本保持不变。阔叶林0~10 cm 土壤铵态氮含量随着培养时间的增加显著增加,10~20 cm 土壤铵态氮含量增加较缓(图1A)。说明阔叶林土壤有机氮矿化作用较强,有机氮转化为铵态氮的速率高于针叶林土壤。2 种林型不同深度土壤中硝态氮含量在培养期间的动态变化很小(图1B),说明土壤硝化速率较低。无论是针叶林还是阔叶林,各个取样时间0~10 cm 土壤无机氮含量均显著大于10~20 cm土壤(p<0.05)。无论0~10 cm 还是10~20 cm 土壤,阔叶林土壤铵态氮含量都显著高于针叶林土壤(p<0.05) (图1A),而阔叶林土壤硝态氮含量则显著低于针叶林土壤(p<0.05) (图1B)。
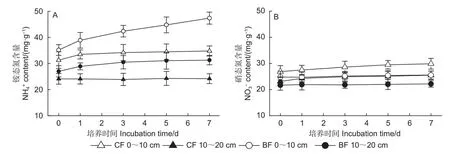
图1 针叶林(CF)和阔叶林(BF)不同深度土壤中无机氮含量的动态变化Fig. 1 Dynamic changes of inorganic N contents in coniferous (CF) and broad-leaved (BF)forest soils at different soil depths
2.2 土壤中无机氮15N 丰度的动态变化
2 种林型土壤中无机氮15N 丰度的动态变化见图2。在15NH4NO3标记的土壤样品中,针叶林和阔叶林土壤中NH4+库的15N 丰度随培养时间的增加有不同程度的下降,阔叶林土壤的15N 丰度下降速率相对较快,说明有机氮矿化产生了自然丰度的铵态氮稀释了标记的NH4+库,阔叶林土壤的有机氮矿化速率比针叶林土壤更快。随着土壤深度的增加,2 种林型土壤NH4+库的15N 丰度下降幅度均变缓(图2A)。在15NH4NO3标记的土壤样品中,NO3−库的15N 丰度在整个培养期间没有显著变化(图2B)。在NH415NO3标记的土壤样品中,无论哪种林型和土壤深度,培养期间各处理NH4+库的15N 丰度均无明显变化(图2C),说明土壤中不存在标记的NO3−异化还原为NH4+或已同化的15NO3−再矿化。培养期间各处理土壤中NO3−库的15N 丰度随着培养时间的延长逐渐下降,说明土壤中发生了硝化作用产生了自然丰度的NO3−稀释了标记丰度的NO3−库。同一深度下,针叶林土壤的下降幅度相对较大;随着土壤深度增加,2 种林型土壤NO3−库的15N 丰度下降幅度都有所降低(图2D)。
2.3 土壤氮初级转化速率
林型和土壤深度对土壤氮初级转化速率具有显著影响,二者的交互作用也显著影响除初级硝化速率之外的其余各个氮初级转化速率(图3)。无论是0~10 cm 还是10~20 cm 土壤,氮初级矿化速率、初级固定速率、铵态氮固定速率和硝态氮固定速率都表现为阔叶林土壤显著高于针叶林土壤,而初级硝化速率则是针叶林土壤显著高于阔叶林土壤(p<0.05)。无论是针叶林还是阔叶林,随着土壤深度的增加,各个氮初级转化速率都显著下降(p<0.05)。针叶林0~10 cm 和10~20 cm 土壤初级硝化速率与铵态氮固定速率比值(gn/ia)分别为1.56 和1.92,显著高于阔叶林相同土层(0.27、0.15)(p<0.05)。

注:图中不同小写字母表示各处理间差异显著(p<0.05)。Notes: Different lowercase letters indicate significant difference among the four treatments (p<0.05).
相关分析表明:土壤氮初级矿化速率、初级固定速率、铵态氮和硝态氮固定速率都与土壤pH、SOC、TN、SOCw、SONw和NH4+-N 含量呈显著正相关,初级矿化速率、初级固定速率和铵态氮固定速率都与C/N 呈显著负相关(表2)。初级硝化速率与NO3−-N 和砂粒含量呈显著正相关,与土壤pH、WHC、粉粒和黏粒含量呈显著负相关(表2)。
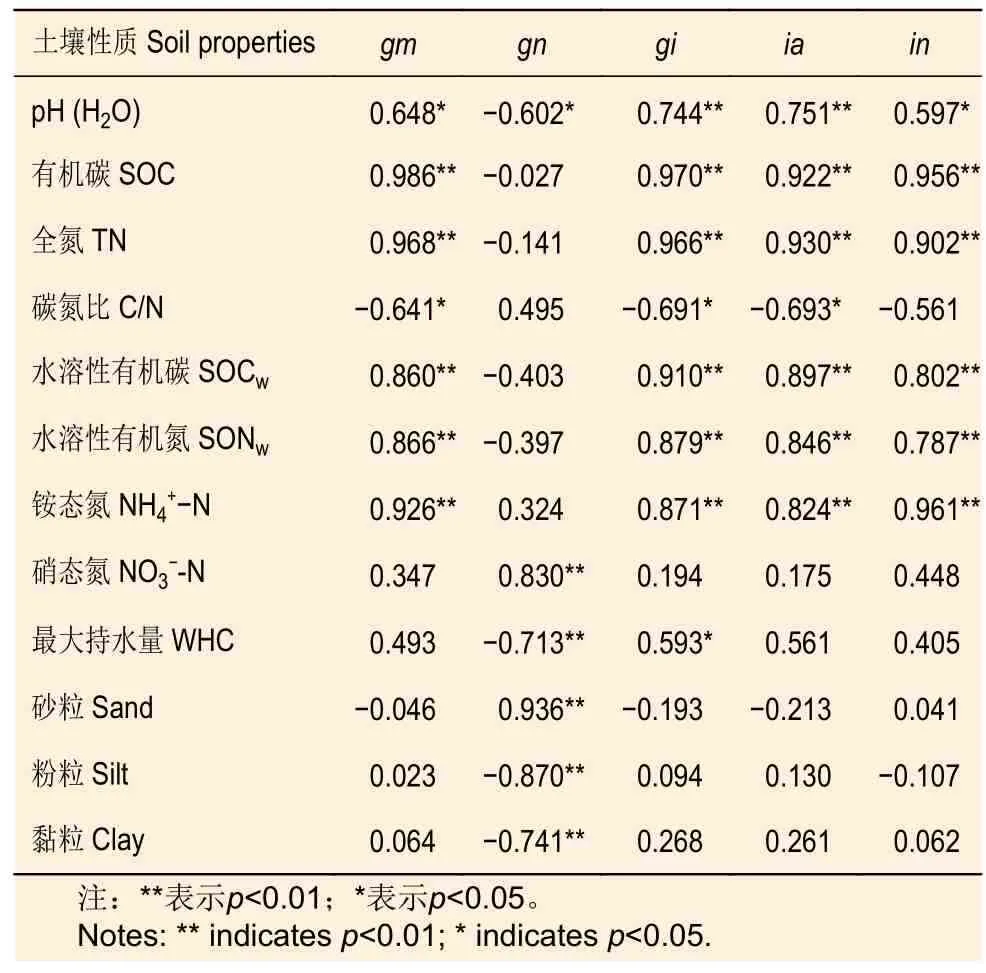
表2 土壤氮初级转化速率与土壤理化性质的相关关系Table 2 The correlations between soil gross N transformation rates and soil physico-chemical properties
3 讨论
本研究中供试林地土壤的氮初级矿化速率为0.53~3.22 mg·kg−1·d−1,这与Cheng等[24]报道的中国南方亚热带森林土壤( 0.56~5.02 mg·kg−1·d−1)和Burton 等[25]报道的澳大利亚亚热带森林土壤(0.62~1.78 mg·kg−1·d−1)的氮初级矿化速率相当,但是低于智利南方[26](14.7 mg·kg−1·d−1)和巴西东部[27](5.0~13.9 mg·kg−1·d−1)的森林土壤氮初级矿化速率,这可能与林木类型、树龄、气候、土壤微生物种类及数量等因素差异有关,其中,林型是一个重要影响因素。本研究结果表明,阔叶林土壤的氮初级矿化速率显著高于针叶林土壤(图3),可能与不同林型所处生存环境的温、湿度以及林木凋落物的种类和数量差异会影响土壤中参与氮素转化的微生物群体种类、数量与活性有关[12,28]。土壤有机碳是微生物生存的基质和来源,通常土壤有机碳含量越高,微生物活性越强,氮矿化能力越高[29]。本研究也发现,2 种林型土壤氮初级矿化速率与土壤有机碳和水溶性有机碳含量均呈显著正相关(表2)。一方面,针叶林凋落物中的营养物质较少,而且其难降解化合物种类(木质素、纤维素、单宁等)和数量较多,分解速率缓慢,输入土壤的有机物数量和质量都显著低于阔叶林[8],导致针叶林土壤氮初级矿化速率较低。另一方面,针叶林凋落物在分解过程中会产生大量有机酸类化合物,致使土壤pH 显著低于阔叶林土壤[30],进而降低氮转化相关土壤微生物种类和数量,导致针叶林土壤氮初级矿化速率低于阔叶林土壤。Cheng等[24]和Zhang 等[3]基于亚热带森林土壤的研究结果也表明,阔叶林土壤氮初级矿化能力显著高于针叶林土壤。此外,土壤C/N 也是影响土壤氮初级矿化速率的一个重要因素,土壤C/N 越高,有机物的降解程度越低,氮初级矿化速率越低[31]。相关分析结果也显示,2 种林型土壤C/N 与氮初级矿化速率呈显著负相关(表2),这与Zhu 等[32]和Zhao等[33]基于亚热带森林土壤的研究结果一致,表明C/N可能是影响森林生态系统中土壤可利用有效氮数量的关键因素。随着土壤深度的增加,输入土壤的有机物数量减少,土壤微生物数量和活性都会降低,因此,氮初级矿化速率相应显著降低。
林型对土壤铵态氮固定速率的影响与氮初级矿化速率相同,表现为阔叶林土壤显著高于针叶林土壤。有研究报道,阔叶林土壤铵态氮固定速率是针叶林土壤的4~5 倍[2-3],这与本研究结果相似。研究指出,参与氮素固定过程的微生物只能利用简单易分解有效碳[34]。因此,本研究中阔叶林土壤较高的水溶性有机碳含量可能是导致其铵态氮固定速率显著高于针叶林土壤的主要原因,具体机制还需进行更深入研究。一般认为,当土壤中同时存在铵态氮和硝态氮时,微生物主要利用铵态氮[35],而且即便很低浓度的铵态氮也可以抑制微生物对硝态氮的固定[36]。然而,本研究中,0~10 cm 土壤硝态氮固定速率为0.10~0.21 mg N·kg−1·d−1,说明即便铵态氮的浓度相对较高,硝态氮的固定仍可占一定比例,这与前人研究结果一致[3,37]。2 种林型10~20 cm 土壤铵态氮和硝态氮固定速率均显著低于0~10 cm 土壤,10~20 cm 土壤硝态氮的固定速率可以忽略不计,这可能与土壤中有效碳数量的显著降低有关,硝态氮的固定需要消耗较多的能量[35],当可利用有效碳数量减少,土壤无机氮的固定速率也相应降低。
研究指出,pH 是影响硝化作用的重要因素[38],土壤初级硝化速率与土壤pH 呈显著正相关[39]。本研究中针叶林土壤虽然具有较低的pH,但其初级硝化速率显著高于阔叶林土壤(图3),这可能与土壤中发生了异养硝化作用有关[25,40]。真菌主导的异养硝化普遍存在于自然生态系统中,尤其是pH 较低的酸性针叶林土壤中,土壤中NO3−的产生主要是由有机氮直接氧化所致[41]。无论是室内培养试验还是原位15N 标记试验结果都表明,针叶林和阔叶林土壤的自养硝化速率相近,但针叶林土壤较高的异养硝化速率导致其总初级硝化速率显著高于阔叶林土壤[2-3]。然而,本研究采用FLUAZ 模型拟合的初级硝化速率结果不能区分自氧硝化速率和异养硝化速率,因此,后续可以考虑使用马尔可夫链蒙特卡罗(MCMC)模型开展进一步深入研究。2 个林型土壤的初级硝化速率都随着土壤深度增加而显著降低,尤其是阔叶林10~20 cm 土壤的初级硝化速率可以忽略不计,说明此土层中参与硝化过程的微生物活性显著低于0~10 cm 土壤[42]。
在没有种植作物的实验室培养条件下,酸性土壤中铵态氮主要有两个去向:一是在硝化微生物的作用下发生硝化作用转化为硝态氮,二是被土壤微生物固定为有机氮。因此,土壤初级硝化速率与铵态氮固定速率的比值(gn/ia)可以用来表征土壤中铵态氮的主要去向,并可用来衡量土壤硝态氮的淋溶风险[34,43]。本研究中,针叶林0~10 cm 和10~20 cm 土壤的gn/ia值均显著高于阔叶林相同深度土壤,且针叶林0~10 cm 土壤硝态氮固定速率显著低于阔叶林土壤。由此可见,针叶林土壤中硝态氮的产生能力强于阔叶林土壤,而无机氮的固持能力却相对较弱,导致土壤中硝态氮的淋溶风险更高。Staelens 等[2]的原位试验研究结果也表明,针叶林土壤总的自养硝化和异养硝化速率显著高于阔叶林土壤,而硝态氮固定能力却可以忽略不计,导致针叶林土壤硝态氮含量很高,具有较高的硝态氮淋溶风险和氮饱和特征。
4 结论
林型对土壤氮初级转化速率具有重要影响,天然次生阔叶混交林土壤的氮初级矿化速率、铵态氮固定速率、硝态氮固定速率均显著大于人工红松针叶林土壤,但初级硝化速率则显著小于人工红松针叶林土壤。随着土壤深度的增加,人工红松针叶林土壤和天然次生阔叶混交林土壤的氮初级转化速率都显著降低。人工红松针叶林土壤的硝态氮产生能力较强,且无机氮固定能力较弱,导致其硝态氮淋溶风险大于天然次生阔叶混交林土壤。
