全身免疫炎症指数对非小细胞肺癌免疫检查点抑制剂疗效的预测价值
2022-05-24刘剑李敏菁
刘剑 李敏菁
佛山市第一人民医院呼吸与危重症医学科(广东佛山 528000)
肺癌是全球癌症相关死亡的主要原因[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常见的亚型[2]。NSCLC 起病隐匿,大约1∕3的NSCLC 患者初诊时已为局部晚期或已发生远处转移[3]。近年来,免疫检查点抑制剂如程序性死亡因子1(programmed death-1,PD-1)及其配体程序性死亡因子配体1(programmed deathligand1,PD-L1)单抗等,在临床治疗局部晚期和转移性NSCLC 中获得较好的疗效[4]。但临床上,部分患者对免疫治疗不敏感或治疗一段时间后发生药物抵抗[5-6]。因此,寻找能够有效预测免疫治疗疗效的肿瘤标志物逐渐成为临床研究的热点[7]。炎症是肿瘤微环境的重要特征,中性粒细胞、淋巴细胞、血小板及单核细胞等外周血参数可反映机体免疫状态,对肿瘤患者的预后具有重要的预测价值[8]。全身免疫炎症指数(systemic immune-inflammation index,SII)定义为中性粒细胞与淋巴细胞比率和血小板计数的乘积,是反映NSCLC 患者肿瘤进展的简单且无创的治疗前预后评估指标。研究表明,系统炎症指数如SII、中性粒细胞与淋巴细胞比值等,有助于反映NSCLC 患者治疗前全身炎症状态的指标,对患者免疫治疗的预后进行预测[9-10]。本研究通过比较接受免疫治疗的不同SII 水平NSCLC 患者的临床预后,分析SII 的临床预后预测价值。
1 资料与方法
1.1 一般资料 以我院2019年1-12月期间我院诊治的88 例NSCLC 患者作为研究对象。纳入标准:(1)NSCLC 诊断符合2016年版《中国晚期原发性肺癌诊治专家共识》[11];(2)初诊肿瘤分期为Ⅲb期、Ⅳ期NSCLC 患者和肺癌根治术后因肿瘤复发或转移的Ⅲb 期、Ⅳ期NSCLC 患者;(3)一般状态良好,东部肿瘤合作组(ECOG)评分0 ~1 分;(4)心肺肝肾功能正常。排除标准:(1)既往有免疫治疗病史;(2)合并脑转移,病情不稳定;(3)合并系统性红斑狼疮、类风湿性关节炎等自身免疫性疾病;(4)神经障碍性疾病,不能配合治疗及随访;(5)一线化疗治疗失败。最终入组病例88 例,见图1。
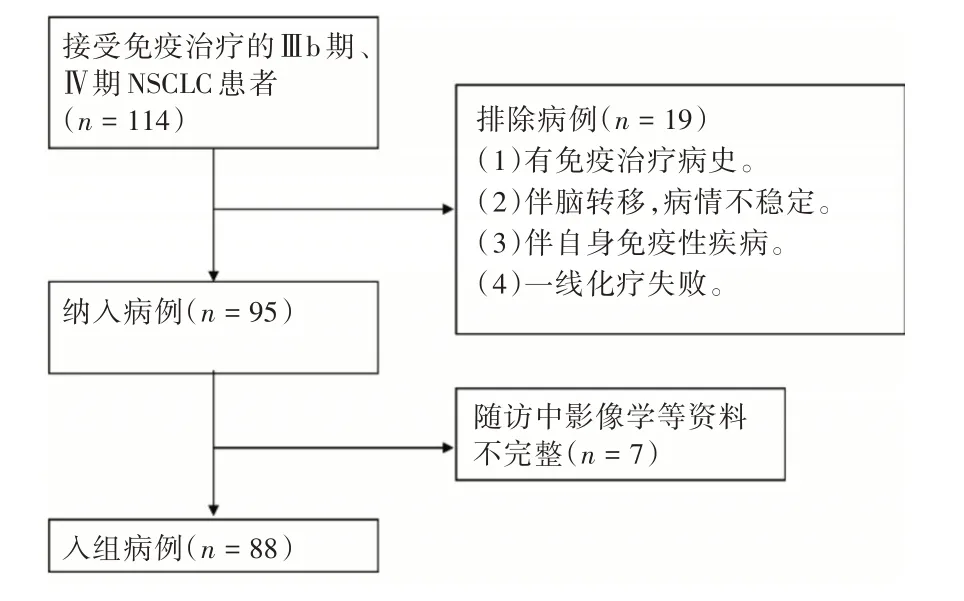
图1 入组流程图Fig.1 Flow chart of joining the group
1.2 检测及SII计算方法 取所有研究对象治疗前1 周以内空腹8 h 外周静脉血进行血常规检测,根据外周血中性粒细胞(neutrophil,N)计数、血小板(platelet,P)计数和淋巴细胞(lymphocyte,L)计数,计算公式SII=(N×P)∕L。
1.3 治疗方法 NSCLC 患者接受多西他赛联合信迪利单抗治疗,Ⅲb 期患者同时接受胸部放疗治疗,放射野包括原发灶、转移淋巴结及区域引流淋巴结,2.0 Gy∕次,1 次∕d,总照射剂量60 ~70 Gy∕6 ~8 周。多西他赛药物应用剂量为75 mg∕m2,3 周∕次;信迪利单抗治疗剂量为200 mg,3 周∕次,直至患者出现不耐受或疾病进展。
1.4 观察指标 (1)所有患者在第9周根据实体瘤疗效评价标准[12],对患者进行疗效评估。免疫治疗的临床疗效分完全缓解(complete relief,CR)、部分缓解(partial relief,PR)、疾病稳定(stable disease,SD)、疾病进展(progress disease,PD)。CR 和PR,计算客观反应率(objective response rate,ORR),计算公式:ORR=(CR+PR)∕(CR+PR+SD+PD)×100%;疾病控制率(disease control rate,DCR)=(CR+PR+SD)∕(CR+PR+SD+PD)×100%。(2)随访:自患者确诊之日起开始进行随访,并在治疗后给予持续定期随访,每3 个月随访1 次,电话方式进行随访,随访3年,随访内容为患者生存情况,随访截止至2021年12月。
1.5 统计学方法 采用SPSS 19.0统计软件进行统计分析。计量资料进行正态性检验,符合正态分布的计量资料以()表示,两组间比较采用t检验;不符合正态分布的计量资料以中位数(四分位间距)表示,组间比较采用Mann-WhitneyU秩合检验。计数资料用例(%)表示,组间比较采用χ2检验。应用时间依赖受试者工作曲线分析SII 对NSCLC 患者生存预后的预测价值,并以约登指数最大时作为SII 的最佳截断点。Kaplan-Meier 生存分析不同SII对NSCLC 患者生存预后的影响。单因素及多因素Cox 回归分析影响NSCLC 患者生存预后的独立危险因素。P<0.05 为差异有统计学意义。
2 结果
2.1 一般临床参数及SII的最佳截断值确立 本研究入组患者中,男51例,女37例,年龄37~74岁,平均(57.5±6.2)岁;有吸烟史46 例,无吸烟史42 例;腺癌58 例,鳞癌30 例;Ⅲb 期37 例,Ⅳ期51 例;ECOG评分0分49例,1分39例;BMI指数≤25 kg∕m2为52 例,BMI 指数>25 kg∕m2为36 例。根据时间依赖受试者工作曲线分析SII 对NSCLC 患者生存状态(1:死亡,0:生存,t:生存时间)的预测价值,结果曲线下的面积为0.762(95%CI:0.711 ~0.812),最佳截断值为423,见图2。根据SII 的最佳截断值423,将NSCLC 患者分为低SII 组(<423,n = 43)和高SII 组(≥423,n=45)。

图2 ROC 曲线分析SII 对NSCLC 患者生存预后预测的最佳截断值Fig.2 The best cut-off value of SII for predicting survival prognosis of NSCLC patients by ROC curve analysis
2.2 SII 与NSCLC 患者临床病理特征的关系 高SII组和低SII组SII水平与肿瘤分期差异有统计学意义(均P <0.05),而性别、年龄、KPS 评分、吸烟史、体质量指数及高血压、糖尿病和冠心病各基础疾病差异无统计学意义(均P >0.05)。见表1。
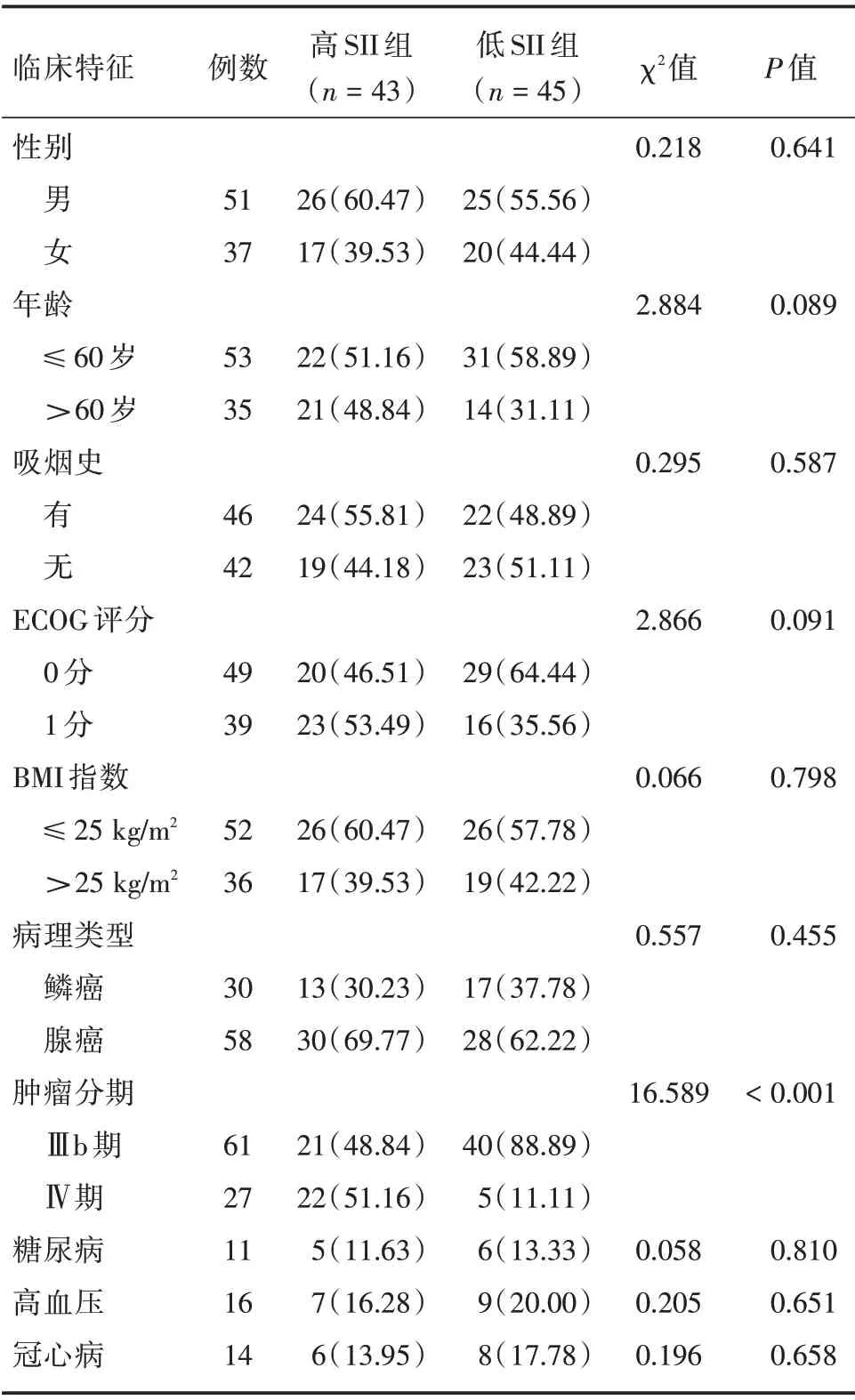
表1 SII 水平与NSCLC 患者临床病理特征的关系Tab.1 The relationship between SII level and clinicopathological characteristics of NSCLC patients例(%)
2.3 两组NSCLC 患者免疫治疗疗效比较 高SII组CR 0例,PR 1例,SD 9例,PD 33例,OCR为2.33%(1∕43),DCR 为23.26%(10∕43);低SII 组中,CR 0 例,PR 2 例,SD 22 例,PD 21 例,OCR 为4.44%(2∕45),DCR 为53.33%(24∕45)。高SII 组DCR 明显低于低SII 组(χ2= 8.390,P = 0.004),两组OCR差异无统计学意义(χ2=0.002,P=0.584)。
2.4 SII 与NSCLC 患者生存预后的关系 随访过程中无失访,随访期间死亡57例,3年总体生存率为35.23%(31∕88)。高SII 组死亡35 例,3年总体生存率为18.60%(8∕43),中位总体生存时间为16.25(9.20,19.36)个月;低SII 组死亡22 例,3年总体生存率为51.11%(23∕45),中位总体生存时间为22.23(14.57 ± 26.92)个月。相比于低SII 组,高SII组3年总体生存率显著较差(Log-rank χ2= 6.721,P <0.001),中位总体生存时间较短(U = 4.886,P <0.001)。见图3。
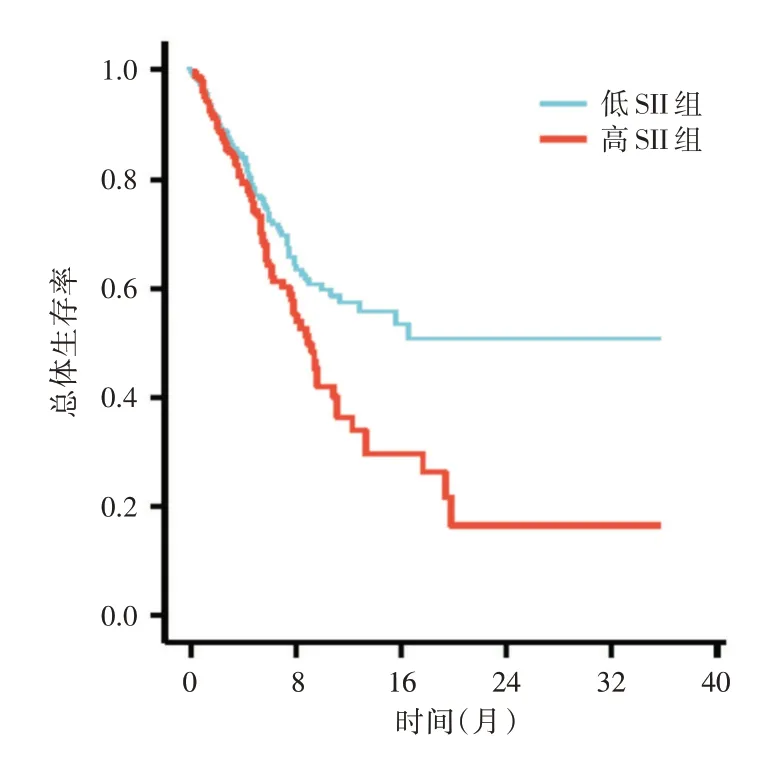
图3 Kaplan-Meier 生存分析SII 与NSCLC 患者生存预后的影响Fig.3 The effect of SII on survival prognosis of NSCLC patients by Kaplan-Meier survival analysis
2.5 影响NSCLC 患者生存预后的单因素及多因素Cox 回归分析 单因素Cox 回归分析结果,肿瘤分期和SII 是影响NSCLC 患者生存预后的因素。多因素Cox 回归分析结果肿瘤分期Ⅳ期、SII 高表达是影响NSCLC 患者生存预后的独立危险因素。见表2、3。
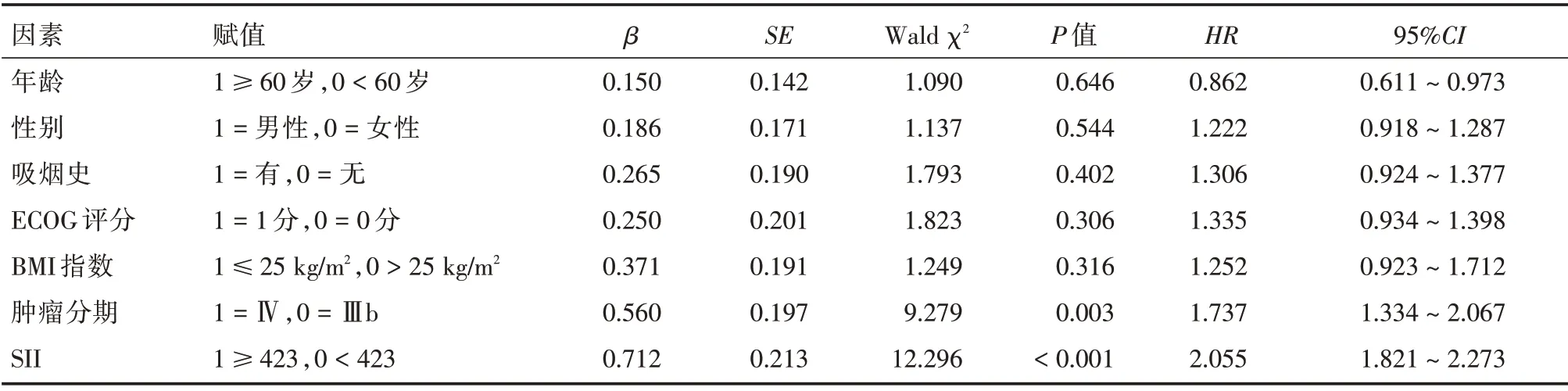
表2 影响NSCLC 患者预后的单因素Cox 比例风险回归模型Tab.2 Factors affecting the prognosis of NSCLC patients by Univariate Cox proportional hazards regression model
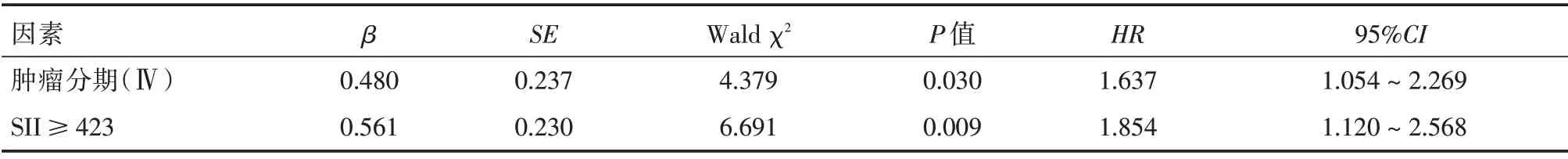
表3 影响NSCLC 患者预后的多因素Cox 比例风险回归模型Tab.3 Factors affecting the prognosis of NSCLC patients by Multivariate Cox proportional hazards regression model
3 讨论
近年来随着肿瘤免疫学研究的深入,免疫检查点抑制剂,如阻断PD-1∕PD-L1 的单克隆抗体及纳伍单抗、信迪利单抗等在NSCLC 的临床治疗中,获得良好的疗效[13]。但临床中发现,仍有部分患者存在治疗不敏感的现象[14]。因此,筛选免疫治疗敏感的患者群体,对于提高免疫治疗的疗效至关重要。肿瘤组织PD1∕PD-L1 表达及肿瘤突变负荷均可用于预测免疫治疗疗效,但由于肿瘤晚期患者取样困难及测序成本较高,限制其临床应用。外周血血常规是临床常规检查,广泛应用于临床。近年来研究表明,基于外周血血常规的免疫炎症指标能够对肿瘤患者的临床预后进行预测,有助于反映肿瘤免疫治疗的临床疗效[15]。
SII 评分内容包括外周血淋巴细胞、中性粒细胞及血小板计数,能够较为全面地反映机体免疫状态和炎症反应状态。近年来发现,SII 评分能够有效评估肿瘤患者术后的生存预后,是新的预后评估的指标[16-17]。因此,SII 可能是新的反映NSCLC 免疫治疗疗效的生物标志物。目前临床上尚无公认的NSCLC 患者SII 的最佳临界值标准,本研究应用时间依赖的ROC 曲线计算的SII 最佳临界值423,并对NSCLC 患者进行分组。以往研究亦利用ROC 曲线计算SII 的最佳截断值,并发现SII 能够有效预测患者的临床预后。但不同研究计算的最佳临界值不同,可能是不同研究纳入标准不一,年龄、机体营养状态等因素对研究的结果造成一定的影响,值得深入研究。本研究发现,SII评分与NSCLC 患者肿瘤分期有关,高SII 评分组患者中肿瘤分期Ⅳ期的比例较高,提示外周血SII水平可能有助于反映NSCLC 的肿瘤进展情况。淋巴细胞在肿瘤杀伤过程中发挥重要的功能。研究表明,肿瘤患者外周血中性粒细胞数∕淋巴细胞比值能够反映机体的免疫功能状态,比值降低时机体淋巴细胞通过启动细胞毒性杀伤功能,介导肿瘤的免疫抑制作用[18]。此外,外周血淋巴细胞水平降低,不仅导致其本身的肿瘤杀伤功能下降,其分泌的细胞因子如γ-干扰素等免疫激活因子水平降低,其抗肿瘤免疫能力降低,机体处于免疫抑制状态,进而导致肿瘤患者的不良生存预后[19]。此外,中性粒细胞通过表达细胞间黏附分子-1,增强肿瘤细胞在毛细血管中停滞,并分泌血管内皮生长因子,促进肿瘤血管新生,导致肿瘤患者的不良生存预后[20]。血小板活化后能够释放大量促炎性细胞因子,细胞因子能够促进肿瘤的血管新生,并能够促进肿瘤细胞发生上皮间质转化,促进肿瘤细胞的侵袭和迁移能力[21]。本研究进一步分析发现,外周血高SII 水平的NSCLC 患者接受免疫治疗的疾病控制率较低,并且是患者不良生存预后的独立危险因素。提示检测免疫治疗前外周血SII 水平有助于对NSCLC 患者的近期和远期预后进行预测,是新的预后判断的外周血标志物。既往有研究亦证实,接受PD-1 单抗治疗的NSCLC 患者中,治疗前中性粒细胞∕淋巴细胞比值等外周血指标不仅能够预测免疫治疗不良反应的发生,还能评估患者的临床预后结局,是患者不良预后的独立因素[22]。目前国内SII对接受PD-1∕PD-L1 免疫治疗的NSCLC 患者疗效预测的研究报道较少,本研究初步证实了SII 对NSCLC 患者免疫治疗疗效的预测作用,SII 有望成为一种简单、经济用于NSCLC 免疫治疗预后预测的肿瘤标志物,指导临床治疗及预后评估。
综上所述,SII 与NSCLC 患者的肿瘤分期有关。免疫治疗前高SII 水平提示接受免疫治疗的NSCLC 患者较差的疾病控制率及较差的生存预后。但本研究尚存在一定的局限,一方面是由于样本例数有限,未进行亚组分析,研究可能存在一定的偏倚,有待今后扩大样本量,并进行分层分析,进一步验证本研究的结论。另一方面,免疫治疗过程中SII 的动态变化可能更有助于判断免疫治疗的疗效,有待今后设计前瞻性临床实验进一步研究。
