巨大腹膜后肿瘤的术前评估和手术策略*
2022-05-24李洪明冯晓创林佳鑫刁德昌
李洪明,冯晓创,林佳鑫,刁德昌
广东省中医院胃肠肿瘤中心/结直肠外科 广东广州 510120
腹膜后肿瘤(retroperitoneal tumors,RPT)是指原发于腹膜后间隙的肿瘤,主要来源于脂肪、肌肉、神经、淋巴结、血管或淋巴管等腹膜后软组织,但不包括来源于腹膜后脏器如肾脏、肾上腺、胰腺等脏器结构的肿瘤以及转移瘤。腹膜后间隙范围广泛,上至膈肌,下至盆腔,前壁为后壁层腹膜,后壁为腹横筋膜,两侧达腹前外侧壁。RPT常侵犯腹膜后脏器和盆腔脏器(膀胱、子宫、卵巢、前列腺等),侵袭性RPT还可能累及腹主动脉、下腔静脉和输尿管等。RPT临床上较少见,其可分为良性、恶性及交界性肿瘤,以恶性肿瘤较为多见,占70%~80%[1-2]。良性RPT多见于年轻患者,最常见的类型为神经源性肿瘤(约占30%)和畸胎瘤(约占15%),而恶性RPT多见于年长患者,且发病率随着年龄的增长而增加[3]。
临床上将来源于上皮组织的腹膜后恶性肿瘤归类为癌症,来源于间叶组织的腹膜后恶性肿瘤归类为肉瘤。大部分腹膜后恶性肿瘤属于腹膜后肉瘤(retroperitoneal sarcoma,RPS)[1-3]。RPS病理组织学类型种类繁多,目前已经鉴定出70余种病理组织学类型,其中最常见的为脂肪肉瘤、平滑肌肉瘤、未分化多形性肉瘤以及孤立性纤维瘤等[4]。在美国和欧洲,RPS占所有软组织肉瘤的15%~25%[5]。
外科手术是RPT的主要治疗方法,首次手术的质量是决定患者能否达到潜在根治的关键因素。若首次手术能完成切缘阴性的en-bloc切除,则成为此类患者达到潜在根治的最佳时机[6]。由于肿瘤部位特殊、异质性高、病理组织学类型复杂,RPT的外科手术难度大,术后复发率高。尤其是巨大RPT(指肿瘤直径>10 cm,约20%的RPT在初诊时肿瘤直径>10 cm)[7-8],因为肿瘤累及范围大,大多需要联合脏器切除。因此,巨大RPT的外科手术治疗是外科医师面临的一项重大挑战,而有效的术前评估,完善的手术策略及精细的手术技巧对于手术治疗的成功十分重要。本文就巨大RPT的术前评估及手术策略进行述评。
1 术前评估
充分的术前评估有助于制定精准的、个体化的手术策略,降低手术相关并发症发生率,提高手术安全性。巨大RPT的术前评估内容主要包括术前影像学检查评估,术前脏器功能评估,术前营养支持治疗,血制品的准备,术前血管造影及术中球囊阻断,术前穿刺活检等。
1.1 术前影像学检查评估
影像学检查是巨大RPT术前评估的一项重要内容,包括CT、MRI和PET-CT等[9-12]。其中CT是RPT术前评估最常用的影像学检查手段,可以清晰地显示肿瘤的密度、大小、部位及肿瘤与周围脏器的毗邻关系(见图1)。血管成像技术能够直观地显示肿瘤的血供来源及肿瘤与周围大血管的关系。MRI对软组织具有较高的分辨率,除了能提供上述信息外,还能提供肿瘤周围血管及神经的受累情况等信息。此外,MRI还适用于不愿意或不适于接受放射线检查、碘类对比剂过敏以及肾功能不全的患者(心脏起搏器、人工瓣膜置换术后或者体内含其他金属植入物等患者除外)。PET-CT是正电子发射断层(positron emission tomography,PET)和X线计算机断层(computer tomography,CT)组合而成的多模式成像系统,可用于全身肿瘤诊断、疗效评价、复发和转移监测等方面。目前在临床上,PET-CT亦用于巨大RPT的术前评估,但其在区分脂肪肉瘤与良性RPT方面有一定难度。有研究报道,腹膜后良性肿瘤和肉瘤的最大标准摄取值(SUVmax)值差别很大,PET-CT可以根据RPT所含脂肪成分的分类、肿瘤的大小及改变脂肪或非脂肪成分的SUVmax截断值(cut-off值)来区分良、恶性RPT[9]。此外,PET-CT还可评估全身肿瘤负荷、定位富活性肿瘤组织的活检穿刺等。近年来,随着数字医学技术的发展,CT三维重建、3D打印等三维可视化技术在临床得到广泛应用(见图2)。其能直观立体并精确地显示肿瘤、血管、腹腔脏器及毗邻关系,可以为术前诊断、手术方案个体化规划、手术切除范围术前规划、重要血管切除与否的预判及手术入路选择提供决策依据[13-14],同时还便于术前与患者及其家属的病情沟通。

图1 巨大RPS的CT检查图像(图片来源于作者科室病例)
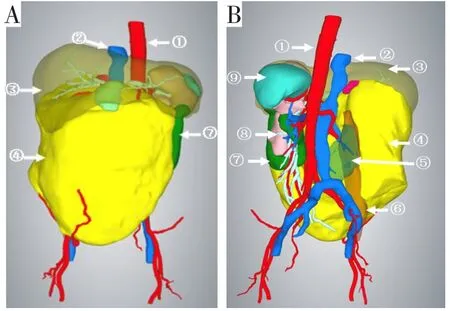
图2 一例巨大RPS的CT三维重建可视化模型(图片来源于作者科室病例)
1.2 术前脏器功能评估
巨大RPT通常会挤压患者的心、肺等脏器,术前全面评估心、肺等脏器功能,有助于保障患者围手术期安全性。对于不能排除异位嗜铬细胞瘤的患者,还需要测定血液和尿液中去甲肾上腺素(NE)、肾上腺素(E)、多巴胺(DA)及其中间代谢产物甲氧基肾上腺素(MN)、甲氧基去甲肾上腺素(NMN)和终末代谢产物香草扁桃酸(VMA)的浓度。当巨大RPT侵犯一侧肾脏可能需要手术联合切除时,术前必需评估对侧肾脏功能,一般应用同位素肾图或增强CT进行评估。当肿瘤瘤体巨大,无法准确判断肿瘤与输尿管的关系时,术前可行输尿管逆行插管,便于术中判断输尿管位置及走行,避免损伤输尿管。
1.3 术前营养支持治疗及血制品的准备
巨大RPT患者,由于瘤体巨大,局部压迫症状明显,进食量减少和/或肿瘤消耗而伴有营养不良和贫血。文献报道46%的RPS患者就诊时伴有营养不良[15]。因此,术前需积极行以肠内营养支持为主的营养支持治疗。如果患者手术时仍伴有营养不良,术后出现并发症的风险明显增高(P=0.04)[15]。联合切除四个或者更多的脏器时,患者术后的营养状况更差,因此文献建议术后也要注意营养支持治疗[15]。中重度贫血的患者术前应予以输血来纠正贫血。预估术中出血风险较大时,术前应充分备血(包括红细胞悬液、血浆、血小板及凝血因子等)。
1.4 术前血管造影及术中球囊阻断
对于动脉血供丰富、与周围脏器的解剖关系复杂的巨大RPT,手术前可选择性栓塞肿瘤的供血动脉,以降低手术难度和减少术中出血量。需要注意的是,应尽量缩短血管栓塞术与肿瘤手术的间隔时间,以减少血管再通的机会或侧支循环的可能形成,并降低因间隔时间过长而继发的炎性反应而增加手术难度和风险。对于无法栓塞或者不适于栓塞肿瘤供血血管、瘤体巨大或位于盆腔的肿瘤,预估盆腔手术视野显露比较困难的、预判术中骶前出血可能性较大的患者,术前可行低位腹主动脉球囊置入,术中根据情况行腹主动脉球囊阻断术。部分RPT术中可能需行血管切除及重建,故术前应备好血管外科手术器材、口径合适的人造血管等。
1.5 术前穿刺活检
明确肿瘤病理组织学类型是包括手术治疗在内的综合治疗的基础。多项指南或专家共识推荐对于诊断不明的RPT在治疗前行穿刺活检以帮助诊断和分级,穿刺活检对于鉴别诊断、治疗方案的选择具有重要的指导意义[16-18]。因此,对于肿瘤无法切除、肿瘤性质无法确定、需要进行术前治疗的患者进行术前活检是有意义的。有研究报道认为CT引导下经腹膜后穿刺活检方法是比超声引导活检更有价值的方法[19]。欧洲医学肿瘤学协会(ESMO)—欧洲罕见成人实体癌网络参考临床实践指南和美国国家综合癌症网络(NCCN)临床实践指南均建议通过细针抽吸穿刺活检(fine-needle aspiration cytology,FNAC)方法进行活检[16-18]。而跨大西洋腹膜后肉瘤工作组(TARPSWG)则认为FNAC提供的诊断信息较少,还可能导致治疗延误,应该避免使用[16-18]。另有指南建议采用使用同轴铠装活体组织检查针(coaxial sheathed biopsy needle)穿刺活检[16-18],使用芯针收集4~6个活检厚度≥16-G的肿瘤组织[16-18]。根据既往的报道,经穿刺活检引起针道种植的发生率为0.37%~2%[20-21]。肿瘤扩散的风险与穿刺途径有关,经后入路穿刺活检的扩散风险比经腹入路低[20]。此外,有研究表明经穿刺活检引起的针道种植对总体生存率(OS)没有影响[22]。
2 手术治疗
在过去十年中,RPT的治疗已经从单纯手术切除的“一刀切”模式转向更具组织学针对性的治疗模式。
2.1 腹膜后良性肿瘤的手术治疗
如果术前可以使用穿刺活检和/或影像学检查判断RPT的性质,则无临床症状的良性RPT一般不需要治疗。良性RPT随着时间的推移而增长,肿瘤生长速度为每年10.5%(9.4%~11.6%),手术指征为有症状或肿瘤体积迅速增大[23-24]。
2.2 腹膜后恶性肿瘤的手术治疗
手术切除仍然是治疗腹膜后恶性肿瘤的基石,也是潜在治愈的唯一机会[6]。随着对软组织肉瘤认识的不断深入和肿瘤治疗模式的不断优化,外科治疗的理念、形式和模式也有了很大改变。如前所述,大部分腹膜后恶性肿瘤为RPS,因此本文中关于腹膜后恶性肿瘤的手术治疗内容重点阐述RPS的手术治疗。最近使用美国国家癌症数据库(NCDB)的数据进行的研究表明,在经验丰富的大型医疗机构进行诊治的RPS患者的预后可以得到改善[25-26]。有文献建议RPS的诊治应在经验丰富、团队健全、多学科综合治疗协作组(MDT)模式成熟的大型医疗机构进行[25-26]。
(1)肿瘤阴性切缘状态的判定标准:20世纪90年代,欧洲和北美的肉瘤外科医师一致认为,达到肉眼完整切除的手术范围已经足够[27]。肿瘤切缘状态是影响RPS患者长期无病生存的重要因素[28-29]。相较于其他实体肿瘤手术切缘的评价,由于腹膜后缺乏筋膜平面以及腹膜后病变毗邻关键结构,临床实践中很难准确评估大部分RPS的切缘状态,获得阴性切缘具有挑战性。一项对2 084例软组织肉瘤患者进行分析的研究中,45%的RPS患者的显微切缘为阳性,而四肢软组织肉瘤的这一比例仅为19%(P<0.005)[30]。手术范围多依靠术者的手术理念和术前及术中的经验来判断及确定,所以,目前大部分研究将RPS的彻底切除(R0+R1)定义为“术者术中判定达到肉眼无肿瘤病灶残留”[31]。Nathan等[32]的研究纳入了1998—2005年的1 365例RPS患者进行分析,发现R0/R1切除的患者术后5年生存率为47%,术后10年生存率为27%。Giuliano等[33]报道2002—2012年的2 920例R0/R1切除的RPS患者的术后5年生存率为58.4%,术后10年生存率为45.3%。
(2)外科切除理念的变更:完整肿瘤切除是指术中沿肿瘤假包膜锐性分离,不破坏肿瘤组织,整块切除肿瘤病灶,术者判定彻底切除了肉眼可见肿瘤(R0+R1切除),术后病理学检查证实切缘为阴性。腹膜后巨大肉瘤常侵犯多个周围脏器,初次手术时往往需要联合脏器切除。联合脏器切除会增加术后并发症的发生风险,同时切除三个或三个以上脏器会增加死亡率[2]。然而,有文献报道联合切除多个脏器导致的并发症并不影响RPS的OS[34]。联合切除时因切除的脏器不同,发生并发症的风险也有所不同。Judge等[35]回顾性分析了美国外科医师学会国家外科质量改进计划(The American College of SurgeonsNationalSurgicalQuality ImprovementProgram,ACS NSQIP)的数据,以探索RPS多脏器切除术相关的术后30天内并发症发生率和死亡率,研究中纳入了564例患者,其中233例(41%)患者接受了联合脏器切除,最常见的受累脏器为肠道(19%)、肾脏(15%)和血管(3%),当联合切除胰腺(2%)和肝脏(1%)时,并发症发生风险较高。而当联合切除肠道和肾脏时,并发症发生风险较低[36]。在另一项纳入1 007例接受联合脏器切除的RPS患者的研究报道中,联合脏器切除中结直肠切除占57.2%,肾脏切除占54.8%,腰大肌(部分/全部)切除占27.1%,脾脏切除占16.0%,髂静脉和/或下腔静脉切除占10.9%,并发症发生风险较高的联合切除脏器包括胰体胰尾(11.2%),肝脏(2.3%),十二指肠/胰头(0.9%),十二指肠或十二指肠空肠交界处(0.3%)[37]。笔者研究团队目前的手术策略是“保留人体核心脏器的前提下实施联合脏器切除,对肿瘤进行en-bloc切除”。
如前所述,尽管手术治疗强调了联合脏器切除,RPS仍很难保证足够的解剖切缘来达到阴性显微切缘,而R2切除治疗RPS的疗效较差[32-33]。
有文献报道,R2切除的患者预后较无法切除的患者预后仅有轻微改善[30]。21世纪初,欧洲的两个肉瘤诊治中心凭借其治疗四肢软组织肉瘤患者的经验,开始探索进一步扩大手术切除范围在RPS治疗中的应用[38-39]。2009年意大利和法国的学者首次提出扩大切除或间隔室切除的概念[38-39]。这项新概念的基本要点是类似于对躯干/四肢软组织肉瘤采用的手术理念和方法:整块切除毗邻的、未受影响的脏器和结构,以最大程度地提高阴性显微切缘的可能。这也就是对RPS所在的同侧肾脏和结肠的同期切除持更积极的态度,积极扩大切除肿瘤周围的粘连结构(即使它们没有被肿瘤明显浸润),通常联合切除的脏器/结构包括肾脏、结肠、胰腺、脾脏、腰大肌和/或膈肌,以及从膈肌到肿瘤一侧髂血管的所有同侧腹膜后脂肪组织,注意避免术中肿瘤破裂和分块切除,以尽量避免肿瘤切缘阳性[37-39](见图3)。Gronchi等[38]研究发现接受了扩大切除的152例患者的5年局部复发率为29%,而接受标准切除(只切除手术时肿瘤直接侵犯的受累脏器)的136例患者的5年局部复发率为48%;随后更新的5年随访数据显示只有G1和G2的肉瘤患者的OS有所改善[40]。Bonvalot等[39]报道接受扩大切除的120例患者局部复发率比接受标准切除的65例患者减少3.3倍。因此,目前的外科治疗理念为对于所有潜在根治性切除的RPS,提倡将肿瘤连同邻近受侵犯脏器的en-bloc切除和/或血管重建,目的是实现肉眼完整切除,尽量降低显微切缘阳性的风险。
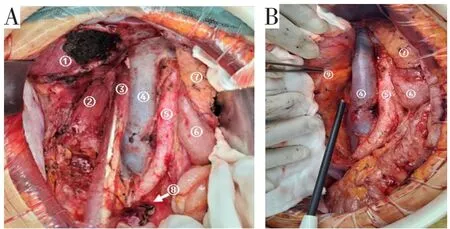
图3 巨大RPS的间隔室切除(图片来源于作者科室病例)
随着对腹膜后软组织肿瘤的组织学和生物学行为认识的深入,研究发现脂肪肉瘤倾向于局部复发(local recurrence,LR),而平滑肌肉瘤往往有远处转移(distant metastasis,DM)风险[37,41-42]。文献报道在2004—2014年间,同样是手术时不伴有远处转移的腹膜后恶性肿瘤,平滑肌肉瘤的5年肿瘤特异性死亡率比脂肪肉瘤低(20%vs.37.8%;P<0.001)。此外,高级别脂肪肉瘤的死亡率低于低级别脂肪肉瘤(13.7%vs.40.1%;P<0.001)[43]。这提示外科医师应该根据肿瘤组织学亚型来调整手术切除的范围。事实上,脂肪肉瘤的高分化成分与腹膜后的正常脂肪几乎无法通过影像学检查区分。多中心腹膜后肉瘤协作工作组(Multi-institutional Collaborative RPS Working Group)对1 007例RPS患者的术后复发模式进行了总结[37],研究发现高分化脂肪肉瘤(well-differentiated liposarcoma,WDLPS)患者的复发部位几乎集中在局部,8年局部复发率超过30%;从生存曲线上看,局部复发曲线并没有随着时间的推移而出现平台期。高分化脂肪肉瘤的预后取决于局部复发的风险,因此手术时需要更大范围的切除,根治性切除术后的8年总生存率超过80%。去分化脂肪肉瘤(dedifferentiated liposarcoma,DDLPS) 分为 G2 DDLPS 和G3 DDLPS,两者复发模式有所不同。G2 DDLPS局部复发风险较高,但远处转移风险较小(5年DM率<10%),而G3 DDLPS具有较高的局部复发率(5年LR率为10%)和远处转移风险(5年DM率为40%)。平滑肌肉瘤的特点是远处转移风险高(5年DM率约50%),但5年局部复发的风险相对低(5年LR率约10%),而且,平滑肌肉瘤的远处转移风险在5年后趋于平稳。因此对于平滑肌肉瘤而言,即使在术中联合脏器切除,生存率和复发风险也无法得到明显改善,提示可以适当缩小手术范围(相对于间隔室切除而言)[44-45],平滑肌肉瘤需要多模式的综合治疗,包括放射治疗和化疗。
(3)手术经验总结:伴随着近年来外科治疗理念的更新,笔者团队逐渐优化了本中心巨大RPS的手术操作流程,现将经验总结如下。
①手术切口选择:合适的手术切口才能充分暴露术野。应根据肿瘤部位、大小及肿瘤与其周围脏器的关系来综合考虑腹部切口位置,切口要足够长,才能实现充分的暴露。对于巨大RPS根据需要可选用“T”形或者“十”字形切口。
②注重解剖层次:RPS大多具有完整的肿瘤假包膜,仔细判断肿瘤的假包膜及其与周围脏器的关系后,按照扩大切除或者间隔室切除的理念,沿着肿瘤假包膜进行锐性分离,充分切除与肿瘤粘连的周围组织。对于肿瘤侵犯肠管的情况,评估肿瘤可以切除后,应先离断受侵犯肠管,以充分显露肿瘤与周围组织之间的间隙。锐性操作应首先沿着易于显露的疏松组织间隙进行,按照先易后难的原则,从肿瘤的四周或者多方位逐步推进,小心仔细地剥离,直至肿瘤的基底部。分离操作时要以“面”推进,不要盲目“单点深入”,“单点深入”有因手术视野暴露不理想而损伤大血管及周围脏器的风险。
③特殊情况的处理:对于囊性病变,可先行减压,吸尽囊内容物,瘤体缩小后再完整切除肿瘤囊壁。对于累及腹腔重要大血管如下腔静脉、腹主动脉或髂血管的肿瘤,操作时应打开血管鞘裸化血管。应仔细结扎大血管周围的粗大淋巴管,避免术后淋巴漏的风险。若肿瘤侵犯血管,无法分离时,可行血管部分切除术,重建根据需要选择直接吻合或者人工血管重建。若肿瘤侵犯膈肌范围较大,直接修补膈肌困难时,应予以植入防粘连补片或者生物补片进行修补。对于粘连严重,瘤体及创面广泛渗血的情况,笔者研究团队的策略是先用纱布填塞压迫暂时性止血,暂停此部位的分离操作,转到其他部位进行肿瘤分离,迅速移除肿瘤,得到良好的手术视野后,再行电凝或者缝扎等止血操作。盆腔的巨大肿瘤术野显露极度困难,可使用结扎术“小步”分离操作,一般止血效果良好。若损伤骶前静脉丛,往往出血难以控制,或者对于创面广泛渗血的情况,一方面避免盲目钳夹止血导致更严重的大出血,另一方面也要避免长时间的、无效的、反复缝扎止血等,避免导致弥散性血管内凝血(DIC)的风险。若术中发生出血,果断使用纱布填塞止血,术后72小时内再逐渐拔除。无水酒精的使用:有观点认为使用无水酒精浸泡瘤床可以降低肿瘤局部复发率,并且安全可行[46]。笔者研究团队目前在完成间隔室切除RPS后,常规用无水酒精浸泡瘤床15秒,然后用大量温盐水冲洗腹腔。
综上所述,巨大RPT,特别是巨大RPS,发病率低、异质性高、病理组织学类型复杂、治疗难度大、术后复发率高,手术治疗应在经验丰富的MDT团队的合作下完成。手术治疗RPS时应按照“间隔室切除”的理念联合切除一些邻近脏器来达到en-bloc切除,同时争取阴性显微切缘,以预防局部复发和提高生存率。目前手术联合放化疗、靶向治疗和免疫治疗的一些临床试验正在进行中,希望未来能有高级别的循证医学证据来进一步优化RPS的治疗策略以及改善患者预后。
利益冲突声明全体作者均声明不存在与本文相关的利益冲突。
