肾透明细胞癌的CT 特征与其侵袭性的相关性研究
2022-05-24陈炜越陈春妙舒恩芬纪建松
高 杨,陈炜越,陈春妙,施 倩,舒恩芬,纪建松
(1.浙江省丽水市中心医院ⓐ 放射科,ⓑ 病理科,浙江 丽水 323000;2.浙江省影像诊断与介入微创研究重点实验室,浙江 丽水 323000)
肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是肾脏最常见的恶性肿瘤[1]。ccRCC 病理Fuhrman 核分级能直接反映肿瘤的侵袭转移潜能。有研究显示,Fuhrman 高分级的ccRCC 提示预后不良[2],而Fuhrman 核分级低级别部分肿瘤则具有潜在侵袭性的生物学行为,但此类研究有一定局限性。Lane 等[3]将具有潜在侵袭性的肾细胞癌定义为Fuhrman 分级Ⅲ~Ⅳ级或存在血管、肾周脂肪、集合系统侵犯、转移等。目前肾穿刺活检是ccRCC 术前病理分级的金标准和常用诊断技术,但其无法反映整个肿瘤的生物学行为,且为有创操作,其引起的并发症一直是临床棘手的问题[4]。CT 作为肾癌术前诊断及术后随访的首选检查方法,在ccRCC 的定位、定性及分期评估中具有一定优势,因此,本研究通过非侵入性的方法获得可靠的ccRCC 术前评估信息,结合ccRCC 的微观侵袭性表现,探讨CT 征象对其侵袭性生物学行为的预测价值,以指导临床。
1 资料与方法
1.1 一般资料 回顾性分析2010 年1—12 月丽水市中心医院经手术病理证实的ccRCC 患者87 例,其中男57 例,女30 例;年龄31~77 岁,平均(62.2±5.8)岁。根据病理是否具有侵袭性(Fuhrman 分级Ⅲ~Ⅳ级、侵犯肾门结构、集合系统、肾周脂肪/肾周筋膜、脉管或癌栓形成、区域淋巴结转移等),分为侵袭组25 例和无侵袭组62 例。本研究经医院伦理委员会批准。
1.2 纳入及排除标准
1.2.1 纳入标准 ①均行外科手术且病理诊断及分级明确;②术前2 周内均行常规腹部CT 平扫和皮质期、髓质期、排泄期增强扫描,部分图像行VR;③术前未行其他治疗。
1.2.2 排除标准 ①合并肝脏等远处转移;②临床和/或影像资料不全。
1.3 仪器与方法 2 组均行CT 平扫及3 期增强扫描。采用Philips 128 排/256 层CT 扫描仪。扫描范围从膈顶至肾下极水平。扫描参数:120 kV,150 mAs,探测器准直128×0.625 mm,球管旋转时间0.75 s,螺距0.914。增强扫描使用高压注射器注入对比剂碘海醇(碘浓度350 mg/mL)80 mL,流率2.5~3.0 mL/s,之后以相同流率注射20 mL 生理盐水,分别于注入对比剂后30、90、180 s 行皮质期、髓质期、排泄期扫描。
1.4 图像分析 由2 名放射科腹部亚专业高年资医师通过PACS 对CT 图像进行分析,意见不一致时,经协商得出结论。定性评估包括病灶的生长方式,形态,边界,假包膜情况,肾包膜突破情况,密度,有无坏死/囊变、钙化、出血,以及瘤内血管情况。定量评估包括病灶最大径、病灶实性区域平扫及3 期增强扫描CT 值,并计算3 期强化程度(强化密度与平扫密度差值);手动测量3 次,取平均值。
1.5 统计学分析 采用SPSS 26.0 软件进行数据分析。采用Kolmogorov Smirnov 检验计量资料是否符合正态分布,正态分布资料以表示,行独立样本t 检验。非正态分布的数据以M(QL,QU)表示,行Mann-Whitney U 检验。计数资料以频数表示,行χ2检验。采用ROC 曲线评价肿瘤CT 强化特征对ccRCC 侵袭性行为的预测效能,并计算AUC、阈值、95%CI、敏感度和特异度。以P<0.05 为差异有统计学意义。
2 结果
2.1 2 组一般资料比较(表1)侵袭组25 例中,Ⅱ级3 例,其中2 例见脉管癌栓,1 例伴左肾门淋巴结转移;Ⅲ级19 例,其中1 例见脉管癌栓,1 例累及肾周脂肪,2 例累及肾盂、肾盏;Ⅳ级3 例,其中1 例合并脉管癌栓。非侵袭组62 例中,Ⅰ级16 例,Ⅱ级46 例。2 组年龄差异有统计学意义(P<0.05),性别、肿瘤最大径和左右肾发病情况差异均无统计学意义(均P>0.05)。
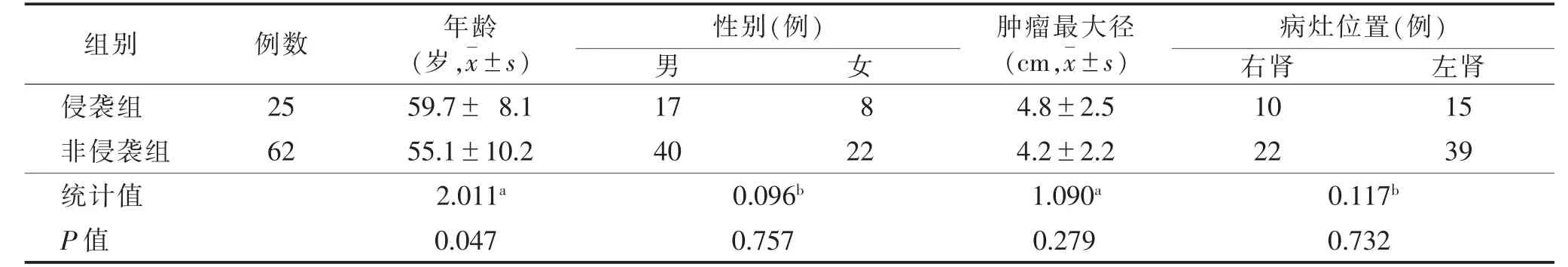
表1 2 组基本资料比较
2.2 2 组CT 特征比较(表2)2 组肿瘤形态、边界、假包膜、肾包膜突破及瘤内血管情况比较差异均有统计学意义(均P<0.05),肿瘤生长方式、密度均匀与否、有无出血、坏死/囊变及钙化情况差异均无统计学意义(均P>0.05)(图1~3)。
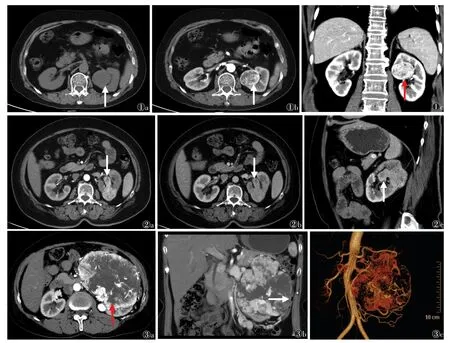
图1 女,67 岁,左肾透明细胞癌Fuhrman Ⅱ级图1a CT 平扫示左肾类圆形肿块,边界清,部分突向肾实质外(箭)图1b CT 增强扫描皮质期示病灶明显不均匀强化,可见完整的假包膜强化(箭)图1c 增强扫描髓质期冠状位示病灶突向集合系统,周围间隙存在(箭)图2 女,64 岁,左肾透明细胞癌Fuhrman Ⅲ级图2a~2c 分别为CT 增强扫描皮质期、髓质期及髓质期矢状位图像,可见病灶强化明显,累及集合系统(箭)图3 女,60 岁,左肾透明细胞癌Fuhrman Ⅳ级 图3a CT 增强扫描皮质期病灶明显不均匀性强化,病灶内见多发粗大血管影及无强化的坏死区(箭)图3b 增强扫描皮质期冠状位示病灶不均匀强化,包膜不连续,与邻近肠管紧贴(箭)图3c 肾动脉VR 示左肾肿瘤区见多发粗大供血动脉
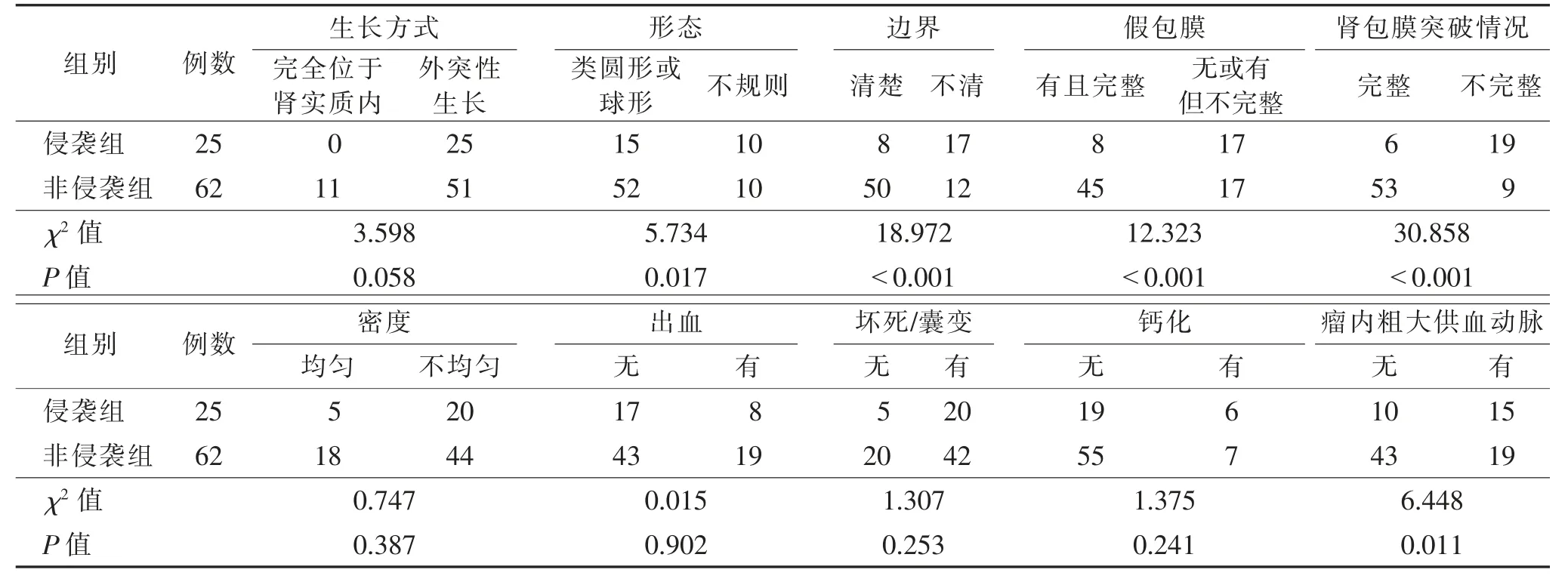
表2 2 组CT 特征比较 例
2.3 2 组肿瘤CT 平扫密度及强化程度比较(表3)2 组肿瘤实性成分平扫密度、皮质期强化程度差异均有统计学意义(均P<0.05);肿瘤实性成分皮质期、髓质期、排泄期密度,以及髓质期、排泄期强化程度差异均无统计学意义(均P>0.05)。
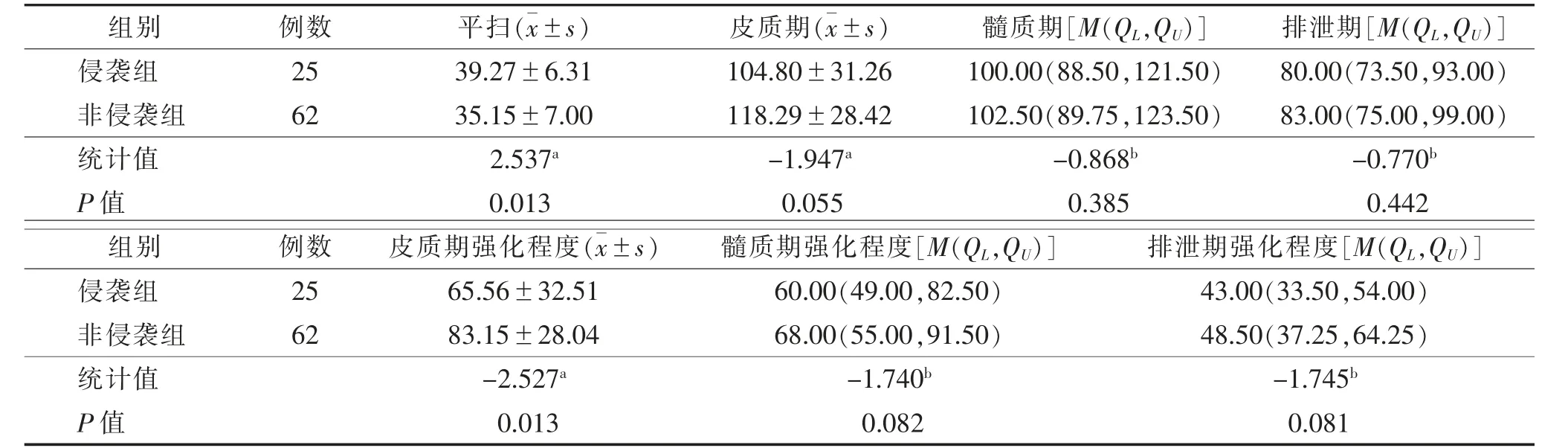
表3 2 组CT 平扫密度及强化程度比较 HU
肿瘤皮质期密度、髓质期密度、排泄期密度、皮质期强化程度、髓质期强化程度、排泄期强化程度预测ccRCC 侵袭性行为的ROC 曲线的AUC(95%CI)分别为0.629(0.494~0.765)(P=0.060)、0.560(0.423~0.696)(P=0.386)、0.553(0.424~0.682)(P=0.442)、0.659(0.526~0.793)(P=0.021)、0.620(0.487~0.752)(P=0.082)、0.620(0.493~0.747)(P=0.081)。其中,仅皮质期强化程度对侵袭性具有鉴别价值,最佳临界值60.5 HU,敏感度80.65%,特异度52.00%(图4)。
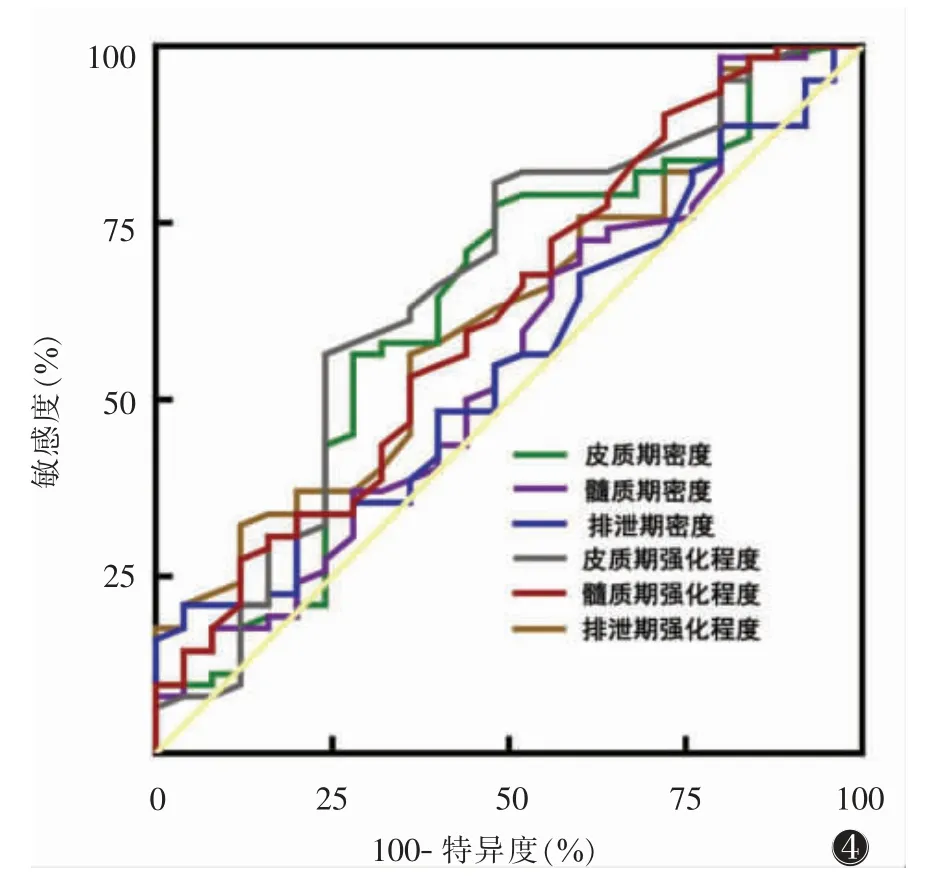
图4 皮质期密度、髓质期密度、排泄期密度、皮质期强化程度、髓质期强化程度、排泄期强化程度预测ccRCC 侵袭性的ROC 曲线。AUC分别为0.629、0.560、0.553、0.659、0.620、0.620
3 讨论
手术切除是早期肾癌的首选治疗方案,但不同分期ccRCC 的治疗方式差异较大,其局部复发和转移风险是目前临床治疗方案选择的重要依据[5]。以往研究指出,手术治疗的ccRCC 中10%~30%具有潜在侵袭性[6],而本研究侵袭组患者占28.7%(25/87),与既往文献报道一致。朱冶华[7]研究表明,高龄是构成ccRCC 高Fuhrman 分级的独立因素;李琼等[8]研究表明,ccRCC 低级别组和高级别组间年龄、肿瘤最大径差异有统计学意义;也有研究表明,肿瘤大小在预测肿瘤生物学行为方面的能力有限[9]。本研究发现侵袭组与非侵袭组年龄差异有统计学意义,与既往研究一致,但2 组性别、肿瘤最大径和发病位置差异均无统计学意义。
侵袭性ccRCC 具有更高的恶性潜能,肿瘤的快速生长使其呈不规则形态,易侵犯局部组织,使其边界不清,而均匀生长或生长相对较慢的非侵袭性ccRCC 其边缘常较光滑。张钰等[10]研究表明,ccRCC低、高级别组间形态与边界差异均有统计学意义。Wei 等[11]研究发现,ccRCC 低、高级别组形态差异有统计学意义。Coy 等[12]研究发现,ccRCC 低、高级别组边界差异有统计学意义。李琼等[8]研究发现,ccRCC低、高级别组的假包膜、形态与边界、瘤内血管等差异均有统计学意义。本研究2 组肿瘤形态、边界、假包膜、肾包膜突破及瘤内血管情况差异均有统计学意义,与既往研究一致。假包膜是肿瘤缓慢生长过程中炎性反应导致的纤维增生或受压肾实质形成,CT表现为病灶周围边界清楚的强化环,其相对封闭的局部微环境,可限制肿瘤的生长和扩散。同时假包膜的存在给外科保留肾单位手术提供了非常重要的肿瘤边界标志,在术中能更好地引导外科医师获得阴性肿瘤切缘,改善患者预后[13]。在临床工作中,假包膜及肾包膜的完整性可作为区分肿瘤T1/2期和T3a期(肿瘤是否存在肾周脂肪或肾窦脂肪浸润)的影像学标志。本研究侵袭组假包膜、肾包膜完整比例[32.0%(8/25)、24.0%(6/25)]明显低于非侵袭组[72.6%(45/62)、85.5%(53/62)],差异均有统计学意义,由此可见,肿瘤假包膜及肾包膜完整情况可作为判断其侵袭性行为的重要依据。此外,肿瘤微血管生成、供血动脉增加是其生长的必要条件,也是脉管癌栓形成的高危因素,可能与肿瘤的生物学行为及预后相关。而本研究侵袭组肿瘤内粗大供血动脉比例[60.0%(15/25)]明显高于非侵袭组[30.6%(19/62)],差异有统计学意义,说明瘤内血管情况可进一步预测其侵袭性行为。
李琼等[8]研究表明,ccRCC 低、高级别组在瘤内出血、囊实性方面差异均有统计学意义。而张钰等[10]研究发现,ccRCC 低、高级别组肿瘤在生长方式、出血、囊实性、坏死方面差异均无统计学意义。本研究2 组肿瘤在生长方式、密度均匀与否、有无出血、坏死/囊变及钙化方面差异均无统计学意义(均P>0.05)。笔者推测原因可能是选择的样本量偏小,致使结果出现偏差。
既往多数研究提示,ccRCC 高级别组CT 增强扫描皮质期强化程度低于低级别组[7,11,14]。本研究侵袭组肿瘤实性成分平扫密度值高于非侵袭组,且皮质期强化程度低于非侵袭组,差异均有统计学意义,与既往研究结果一致。笔者推测可能与肿瘤生长的多因素作用相关,侵袭组较非侵袭组肿瘤异质性更高,肿瘤内部的微血管形成、微出血等可导致其平扫密度增高,而肿瘤生长过快所致的微坏死及相对血供不足可影响皮质期强化程度,且这些微观改变很难用肉眼直接辨认。近年来,影像组学作为一种新兴的研究方法,通过从不同模态的影像中提取高通量的影像特征,在一定程度上实现了肿瘤异质性的评估,舒恩芬等[15]通过CT 影像组学定量生物标志物的研究表明,ccRCC 级别越高,异质性越高,肿块更易发生出血、坏死。本研究ROC 曲线预测结果显示,皮质期强化程度能较好地判断ccRCC 的侵袭性生物学行为,亦可作为临床工作的潜在应用手段。
本研究在既往较多单纯研究ccRCC 核分级的基础上,加入微观侵袭性的分组概念,在Fuhrman 分级的低级别组(Ⅱ级)中发现有因脉管癌栓、肾周脂肪侵犯、肾门淋巴结转移而影响预后的侵袭性患者,说明该分组方法可能具有更好的预测准确性;更加系统、全面地对ccRCC 的CT 形态学特征、密度特征及3 期增强扫描的强化特点进行验证。本研究的局限性:①为回顾性分析,且样本量相对不足,可能使结果产生一定偏倚;②CT 在观察肿瘤的假包膜、微血管、微出血等方面不如MRI 组织分辨力高,在今后的研究中需结合MRI 图像进行观察。
综上所述,形态不规则、边界不清、假包膜和/或肾包膜不完整、粗大的瘤内血管,以及更高的CT 平扫密度值与相对的皮质期低强化程度多提示ccRCC具有更高的侵袭性行为,有助于更好地指导临床决策及改善患者预后。
