纤维素/壳聚糖复合微球的制备及对铜(Ⅱ)的吸附性能研究
2022-05-23孙林静毕韶丹韩兴威
孙林静,毕韶丹,韩兴威
(沈阳理工大学环境与化学工程学院,辽宁沈阳 110159)
电镀废水污染问题已经成为当近世界上最严重的环境污染问题之一[1]。电镀废水的水质成分复杂,不易控制,其中含有铬、镉、铜、锌、镍等许多重金属离子[2]。铜在电镀行业中使用较为广泛,电镀会产生大量的含铜废水,浓度高达几十甚至于几百mg·L-1的含铜废水进入环境水体[3]。水体中的铜还会抑制大自然水体的自净作用。铜是人体所需的微量元素,但是摄入过量的铜会引起严重的中毒反应,例如:呕吐、腹泻等。目前,常见的含铜废水处理方法有化学沉淀法、离子交换法、反渗透、氧化还原、活性炭吸附等[4-5],但这些方法在一定程度上均存在成本高或容易造成二次污染等问题。因此寻找成本低、环保、可循环使用的吸附剂成为人们研究的热点。
壳聚糖(CS)上存在大量的羟基、氨基等活性基团,可与大量的重金属离子进行螯合作用从而吸附金属离子。壳聚糖产量丰富、无毒、易生物降解,但壳聚糖存在酸性条件下易降解,机械性能低的缺点[6]。将Fe3O4等磁性离子引入可以使吸附剂从废水中分离出来并回收利用[7-8]。纤维素是世界上最丰富的可再生资源,具有很高的比表面积和孔隙率[9],其中常见的纤维素衍生物有甲基纤维素和羧甲基纤维素等,羧甲基纤维素(CMC)是一种天然的高分子衍生物,分子链中存在的羧基和羟基是较好的亲水官能团,可以通过与金属离子形成的配位作用进行结合,来富集和回收废水中的重金属[10]。壳聚糖和羧甲基纤维素可以通过阴阳离子的聚电解质复合作用形成不溶于水的共混材料[11],而且可提高壳聚糖的机械性能,增强其在酸性溶液中的稳定性。
本研究通过反相悬浮交联法制备了纤维素/壳聚糖复合微球(简称复合微球),研究了不同因素对吸附的影响,并对复合微球进行了表征。
1 材料与方法
1.1 实验材料和仪器
材料:壳聚糖购自浙江金壳药业股份有限公司;羧甲基纤维素钠购自国药集团化学试剂有限公司;戊二醛,Span80,氢氧化钠,冰乙酸,无水乙醇,环己烷等试剂均为分析纯。
仪器:UV5800紫外可见分光光度计(上海元析仪器有限公司);SHZ-Z数显恒温水浴振荡器(金坛市三和仪器有限公司);NicoletiS50傅里叶变换红外光谱仪(美国尼高力(Nicolet)仪器公司);X-650型扫描电子显微镜(北京第二光学仪器厂);WFX-220系列原子吸收分光光度计(北京北分瑞利分析仪器集团有限公司)。
1.2 纤维素/壳聚糖复合微球的制备方法
将适量的硫酸铜、壳聚糖和纤维素溶解在2%的乙酸中,用磁力搅拌器搅拌至完全溶解。将适量的Fe3O4加入到上述溶液中,用超声波分散均匀,得到磁性壳聚糖复合物。将3 mL的司班80和50 mL的环己烷加入到三口烧瓶中,在500 r/min的转速下搅拌10 min,加入16 mL的磁性壳聚糖复合物,在500 r/min的条件下继续搅拌10 min。加入5%的戊二醛溶液450 r/min下继续反应一定时间。反应结束后,将反应溶液过滤,所得微球用无水乙醇洗涤3次,0.5 mol/L的盐酸洗涤多次,直至上清液中检测不出铜(Ⅱ)为止,用0.1 mol/L的氢氧化钠固化,最后用蒸馏水洗涤至中性,35℃烘干备用。
1.3 复合微球对铜离子的吸附方法
称取一定质量的铜离子印迹壳聚糖复合微球加入到50 mL的200 mg/L的铜(Ⅱ)溶液中,恒温震荡一定时间,震荡后取上清液在497.6 nm波长下测定铜(Ⅱ)质量浓度,按照下式计算吸附量:
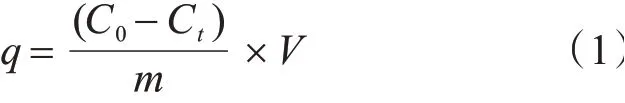
式中:q为铜离子印迹复合微球对铜(Ⅱ)的吸附量,mg/g;C0和Ct分别为初始和吸附一定时间后溶液中Cu2+的浓度,mg/L;V为铜(Ⅱ)溶液体积,mL;m为铜离子印迹复合微球质量,g。
1.4 扫描电镜表征
将干燥的复合微球用导电胶固定在SEM样品座上,然后在其表面喷金,用扫描电镜观测样品的形貌,加速电压为20 kV。
1.5 红外光谱表征
将干燥的壳聚糖、羧甲基纤维素和复合微球研成粉末,采用KBr压片法用傅里叶变换红外光谱仪进行分析。
1.6 吸附选择性测试
分别配置200 mg/L等浓度的Cu2+/Zn2+、Cu2+/Ni2+二元体系的混合溶液,调节pH为5.24。准确称取0.05 g的印迹和非印迹的复合微球分别加入到50 mL上述溶液中,在25℃下振荡吸附2 h,取上清液测定浓度,按照式(2)~(4)计算分配系数Kd、选择性系数K和相对选择性系数Kr。

式中:Kd(目标离子)为目标离子即Cu2+的分配系数,L/g;Kd(共存离子)为共存离子的分配系数,L/g;K(印迹微球)为印迹微球对Cu2+的选择性系数;K(非印迹微球)为非印迹微球对Cu2+的选择性系数。
2 结果与分析
2.1 甲基纤维素和羧甲基纤维素复合剂对吸附的影响比较
按照1.2方法,分别以甲基纤维素和羧甲基纤维素为复合剂制备复合微球,在其他条件相同的情况下,两种纤维素的添加量分别取0.05、0.10、0.15和0.20 g制备壳聚糖复合微球,然后按1.3方法,复合微球投加量为0.05 g时进行吸附实验,计算出吸附量,结果如图1所示。
由图1可以看出来,随着复合剂添加质量的增加,两种复合微球对铜(Ⅱ)的吸附量均逐渐增加。对于添加量相同的复合微球,羧甲基纤维素复合微球对铜(Ⅱ)的吸附量均高于甲基纤维素的,说明羧甲基纤维素引入的官能团和结构更有利于吸附,更适合与壳聚糖复合制取吸附剂,因此后续的实验中选用羧甲基纤维素与壳聚糖进行复合。

图1 两种复合剂对吸附的影响比较Fig.1 Comparison of the effects of two compounds on adsorption
2.2 壳聚糖与羧甲基纤维素质量比对吸附的影响
按照2.1的方法制备复合微球,在戊二醛用量0.6 mL,交联温度35℃,交联时间80 min,仅改变壳聚糖与羧甲基纤维素的质量比(6∶1、8∶1、9∶1、10∶1和12∶1),制备复合微球并测定吸附量,结果见图2。
从图2可以看出,随着壳聚糖与羧甲基纤维素质量比的增加,复合微球对铜(Ⅱ)的吸附先快速上升后开始下降,即适当增加壳聚糖与羧甲基纤维素的比例,有利于复合微球对铜(Ⅱ)的吸附。当壳聚糖与羧甲基纤维素质量比为9∶1时,吸附量最大,因此选择9∶1为壳聚糖与羧甲基纤维素最佳质量比。
2.3 戊二醛用量对吸附的影响
在上述实验优化条件的基础上,固定其他实验条件不变(壳聚糖与羧甲基纤维素质量比为9∶1,交联温度35℃,交联时间80 min),仅改变戊二醛用量分别为0.5、0.6、0.7、0.8和0.9 mL,所得复合微球对铜(Ⅱ)的吸附结果如图3。

图3 戊二醛用量对铜(Ⅱ)吸附量的影响Fig.3 Effect of glutaraldehyde dosage on copper(II)adsorption
以戊二醛作为反应的交联剂,通过反应使壳聚糖上的-NH2与醛基反应形成Schiff碱型结构[12],在CS与CMC之间相互键合形成网状结构,从而降低壳聚糖本身的酸溶性[13]。由图3可见,随着戊二醛用量的增加,复合微球对铜(Ⅱ)吸附量先缓慢增加后开始大幅度下降,0.7 mL时吸附量达到最大。这是因为戊二醛用量较少时交联反应不充分,对复合微球吸附铜(Ⅱ)有一定的抑制作用;而当戊二醛用量较多时,戊二醛与氨基进行反应,使吸附位点减少,也会抑制复合微球对铜(Ⅱ)的吸附。因此选择0.7 mL为戊二醛的添加量。
2.4 交联温度对吸附的影响
在上述实验优化条件的基础上,固定其他实验条件不变(壳聚糖与羧甲基纤维素质量比为9∶1,戊二醛用量为0.7 mL,交联时间80 min),仅改变交联温度分别为25、35、45和55℃,所得复合微球的吸附结果见图4。

图4 交联温度对铜(Ⅱ)吸附量的影响Fig.4 Effect of crosslinking temperature on copper(II)adsorption
由图4可见,当交联温度由25℃上升至35℃,吸附量随之升高,在35℃达到最高,然后随温度升高吸附量呈下降趋势。这可能由于温度升高,分子的活性增强,分子的不规则热运动加剧,分子间碰撞的几率变大,CS、CMC与戊二醛的交联程度也增高,反应物中大量的活性基团被交联剂占用而不能参加吸附反应,使吸附能力有所下降,因此选择35℃为交联反应温度。
2.5 交联时间对吸附的影响
在上述实验优化条件的基础上,固定其他实验条件不变(壳聚糖与羧甲基纤维素质量比为9∶1,戊二醛用量为0.7 mL,交联温度为35℃),仅改变交联时间分别为40、60、80、100和120 min,制备复合微球并测定吸附量,结果如图5所示。

图5 交联时间对铜(Ⅱ)吸附量的影响Fig.5 Effect of crosslinking time on copper(II)adsorption
从图5可以看出,随着交联时间的延长,复合微球对铜(Ⅱ)吸附量是先升高后降低,交联时间较长或者较短时,复合微球对铜(Ⅱ)吸附量较低,这是因为交联时间较短使得交联反应不充分,交联程度不够,而若交联的时间过长,则会消耗较多反应物上的-NH2和-OH,导致复合微球对铜(Ⅱ)吸附量下降。因此优选交联时间为80 min。此时,复合微球对铜(Ⅱ)吸附量最大,其吸附量为121.3 mg/g。
2.6 溶液p H对吸附的影响
取0.05 g的吸附剂分别置于50 mL pH不同的初始质量浓度为200 mg/L的铜(Ⅱ)溶液中,25℃下振荡吸附2 h,按照2.2方法测定吸附量,其结果如图6所示。
从图6中可以看出,复合微球对Cu2+的吸附量随着溶液的pH值的升高而增大。当pH值较低时,复合微球的吸附量较低,吸附效果较差,这是因为当溶液中氢离子浓度较大时,复合微球上的-NH2被质子化,与H+反应后形成的NH3+,阻碍了铜(Ⅱ)的吸附,从而使复合微球的吸附量较低。随着pH值的升高,吸附量增加,这是因为溶液中H+浓度随着pH的升高而逐渐减小,氨基质子化程度降低,使复合微球上吸附铜(Ⅱ)的位点增加,吸附量增大。pH值不仅影响着吸附材料对Cu2+的吸附量,同时也影响着Cu2+在水溶液中的存在形态,当溶液pH升至5.67,铜离子水解产生沉淀,而200 mg/L的原溶液pH值为5.23,因此选择原溶液pH条件下进行吸附。

图6 溶液p H对铜(Ⅱ)吸附量的影响Fig.6 Effect of solution pH on copper(II)adsorption
2.7 性能表征
2.7.1扫描电镜
按照方法1.4对最佳制备条件下(壳聚糖与羧甲基纤维素复合微球质量比为9∶1,戊二醛用量为0.7 mL,交联温度为35℃,交联时间为80 min)获得的复合微球进行扫描电镜表征,结果如图7所示。
由图7(a)可见,复合微球的平均粒径为60μm左右,粒径分布均匀,微球的球形形状良好,较为规则,由图7(b)可见,复合微球表面凹凸不平,表面呈交织的网状结构,有较深的沟壑和孔隙,这表明复合微球有较大的孔隙率,有利于吸附的进行。

图7 复合微球的SEM图Fig.7 SEM image of composite microspheres
2.7.2红外光谱
按照1.5方法分别对CS,CMC和复合微球进行红外光谱测试,结果如图8所示。
图8中(a)曲线为CMC的红外谱图,其中1425 cm-1和1629 cm-1为中心的特征峰分别是-COO-的非对称伸缩振动峰和C-O的伸缩振动峰。图8中(b)曲线为CS的红外光谱图,分别在3445 cm-1(N-H和O-H的伸缩振动)、2919 cm-1、2850 cm-1(C-H的伸缩振动)、1653 cm-1(酰胺带的对称边角振动)、1677 cm-1(酰胺带的对称边角振动)和1420 cm-1(N-H的变形振动)处出现了吸收峰。曲线(c)上,CMC中的1629 cm-1与壳聚糖上酰胺Ⅰ和酰胺Ⅱ的特征峰发生了重合,在1660 cm-1处出现新峰,羧基上的C=O峰与N-H弯曲振动峰在1425 cm-1处重合,说明了微球中CMC的存在。图8(c)在586 cm-1处出现了一个较强的吸收峰,这属于Fe-O键的伸缩振动,曲线(c)上有CMC、CS和Fe3O4的特征峰,表明复合微球中含有CMC、CS和Fe3O4成分。

图8 CMC(a)、CS(b)和复合微球(c)的红外光谱图Fig.8 FTIR spectra of CMC(a),CS(b)and composite microspheres(c)
2.8 不同吸附剂吸附量比较
按照2.1的制备方法,不加羧甲基纤维素制备了壳聚糖微球(简称CTS),按照2.2的方法分别测定CTS与复合微球对铜离子的吸附,结果见表1。
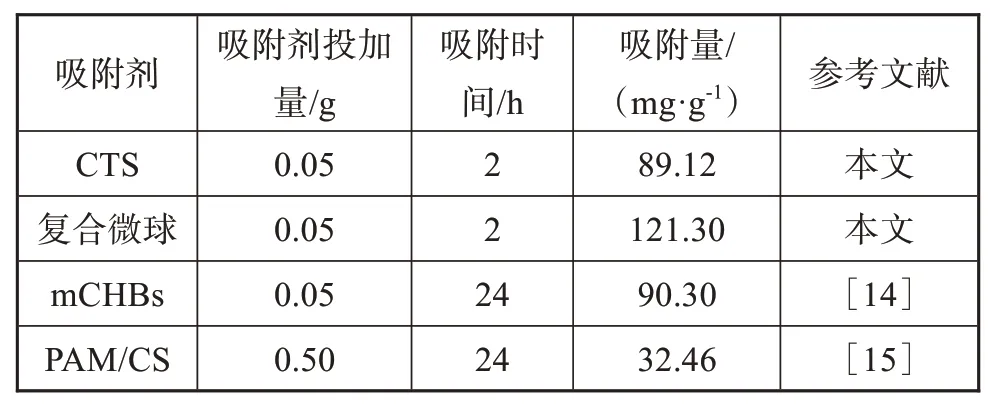
表1 不同吸附剂对铜离子的吸附结果比较Tab.1 Comparison of adsorption of copper ions about different adsorbents
由表1可知,本文合成的羧甲基纤维素/壳聚糖复合微球对铜(Ⅱ)的吸附量明显增大,比CTS的吸附量提高了36.1%,表明羧甲基纤维素的引入可大大提高吸附剂的吸附能力。这主要是羧甲基纤维素上有丰富的羧基阴离子和羟基,作为吸附位点,对铜离子有较强的配位作用,有利于吸附。与文献[14]、[15]的吸附剂mCHBs(苹果酸改性壳聚糖水凝胶微球)和PAM/CS(聚丙烯酰胺/壳聚糖吸附剂)相比,本文所制复合微球的吸附速率快,吸附时间为2 h时对Cu2+的吸附量明显高于文献中两种吸附剂在吸附时间为24 h下的数值,这表明羧甲基纤维素与壳聚糖复合,所得吸附剂的吸附效率和吸附性能都有很大提高。
2.9 吸附选择性
表2为印迹复合微球和非印迹复合微球对二元混合溶液的选择性吸附参数。由表2可知,在二元组分溶液中印迹复合微球对铜离子的吸附量要高于非印迹的复合微球,这是因为印迹后在复合微球表面形成了许多能专一识别Cu2+的空穴结构。在二元体系中,共存的金属离子会占据复合微球上的活性吸附位点,使复合微球对Cu2+的吸附量降低。印迹复合微球对Cu2+/Ni2+、Cu2+/Zn2+的选择性吸附系数均高于非印迹复合微球,表现出对Cu2+有较高的选择性吸附能力。
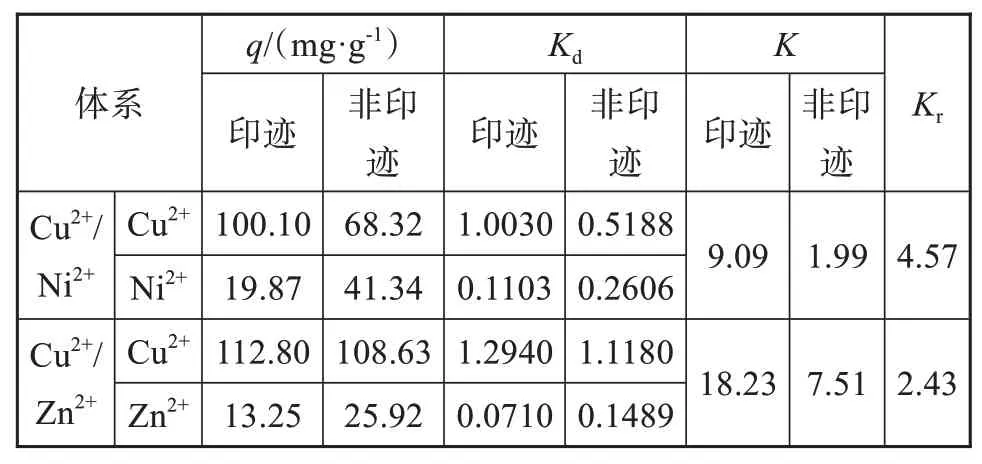
表2 印迹复合微球和非印迹复合微球对二元混合溶液的选择性吸附参数Tab.2 Selective adsorption parameters for binary mixed solutions for imprinting composite microspheres and non-imprinting composite microspheres
3 结论
与壳聚糖微球相比,纤维素/壳聚糖复合微球对铜(Ⅱ)有更好的吸附性能。实验结果表明,选用羧甲基纤维素与壳聚糖复合比选用甲基纤维素与壳聚糖复合效果更好,吸附量更大,当壳聚糖与羧甲基纤维素质量比为9∶1,戊二醛用量0.7 mL,交联温度35℃,交联时间80 min,在原溶液pH时,复合微球对铜(Ⅱ)的吸附量可达121.3 mg/g。扫描电镜表明复合微球平均粒径约为60μm,其表面有较深的沟壑和孔隙,有利于吸附。红外光谱表明,复合微球中复合有羧甲基纤维素和壳聚糖,复合微球对铜(Ⅱ)有较更好的吸附性能。
