宫颈组织人乳头状瘤病毒E6/E7 mRNA ATG-12 Tie-1表达情况及与鳞状上皮内病变病理分级的相关性
2022-05-21周新欢杨弋弋李中钦任红娟
周新欢 邹 科 杨弋弋 李中钦 任红娟 冯 磊
WHO 2014年推荐的女性生殖器官肿瘤分类将鳞状上皮内病变(squamous intraepithelial lesion, SIL)分为低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion, LSIL)、高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion, HSIL)2种,前者包括CIN Ⅰ级,后者则包括CIN Ⅱ级、CIN Ⅲ级,即宫颈癌前病变[1]。提高HSIL筛查率,积极防治HSIL是降低宫颈癌病死率的关键。但CIN分级需多点活检,作为SIL的常规检查方式存在局限性,可重复性差。当前研究[2-3]致力于寻找与SIL病理分级有关生物标志物,以期通过生物标志物辅助SIL分级,但在生物标志物的选择上尚未达成共识。人乳头状瘤病毒(human papillomavirus, HPV)是宫颈癌致病因素之一,Zappacosta等[4]证实,HPV E6/E7mRNA阳性标本中CINⅡ级患者占89.2%,而在宫颈鳞癌(squamous cell carci-noma, SCC)中HPV E6/E7mRNA阳性率可达100%。自噬相关蛋白-12(autophagy-related protein 12, ATG-12)是ATG-12基因编码的蛋白,与自噬相关蛋白-5(autophagy-related protein 5, ATG-5)形成复合物参与自噬过程。有研究[5]证实,ATG12参与乳腺癌HER-2靶向治疗耐药的发生。酪氨酸激酶受体1(tyrosine kinase receptors-1,Tie-1)是络氨酸激酶受体类型之一,主要参与调节血管生成、稳定微血管、血管重塑及衰退等过程,在多种实体肿瘤中均存在高表达现象[6]。现阶段ATG-12、Tie-1与SIL病理分级的关系尚未完全阐明,其在HSIL临床筛查上的价值有待探究。鉴于此,本研究在分析宫颈组织HPV E6/E7mRNA表达情况与SIL病理分级的关系基础上,探究ATG12、Tie-1与SIL病理分级的关系,以期为HSIL的临床筛查提供参考。
1 资料与方法
1.1 一般资料 回顾性分析2017年1月至2020年12月在南阳市中心医院行保存宫颈活检组织或手术切除宫颈组织228例的患者资料。纳入标准:①既往未接受过宫颈病变相关治疗者;②高危型HPV阳性者;③临床资料、病理切片、组织蜡块齐全。排除标准:①宫颈组织采集前接受过局部抗病毒治疗者;②合并宫颈癌以外的恶性肿瘤者;③合并HPV以外的急慢性病毒或细菌感染者;④合并严重肝肾功能衰竭、器质性病变者;⑤子宫颈表面有明显外生性溃疡性病灶者。最终入选228例,年龄18~70岁,平均(40.11±8.87)岁。参照2014年WHO女性下生殖道肿瘤分类标准[1]分为:慢性炎症34例、LSIL 20例、HSIL 55例、宫颈鳞状上皮癌(cervical sqamous cell carcinoma,CSCC)119例,分别纳入慢性宫颈炎组、LSIL组、HSIL组、CSCC组。各组患者一般资料比较,差异无统计学意义(P>0.05)。见表1。
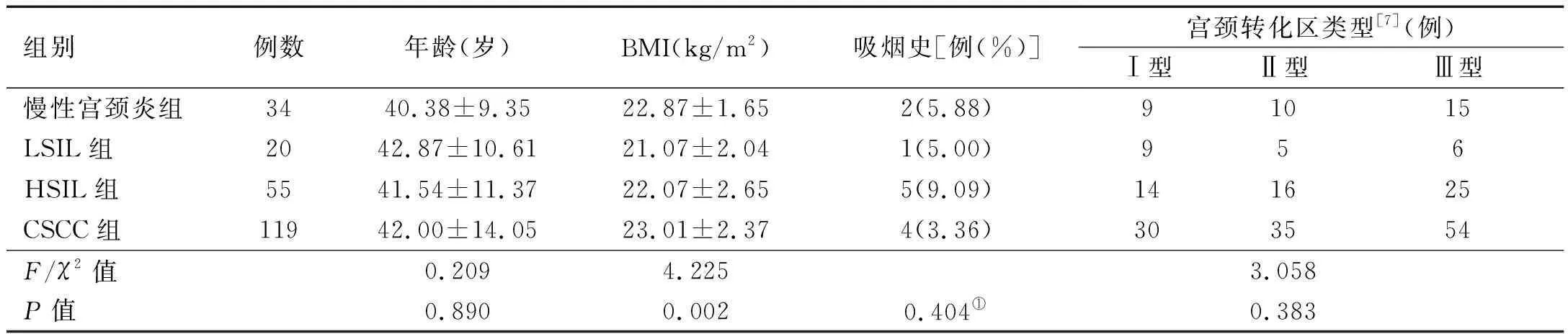
表1 各组患者一般资料比较
1.2 方法
1.2.1 宫颈组织HPV E6/E7 mRNA表达情况检测 应用bDNA法检测HPV 16型、HPV 18型、HPV 31型、HPV 33型、HPV 35型、HPV 39型、HPV 45型、HPV 51型、HPV 52型、HPV 56型、HPV 58型、HPV 59型、HPV 66型、HPV 68型等14种高危型HPV,参考试剂盒说明书依次裂解细胞、杂交捕获mRNA、信号放大、底物发光反应,应用Quanti-VirusTM冷光仪检测光子数,计算机自动转换获得HPV E6/E7 mRNA拷贝数,自动判定结果,拷贝数>0则提示HPV E6/E7 mRNA阳性。
1.2.2 ATG-12、Tie-1表达情况检测 采用免疫组化链霉菌抗生物素蛋白-过氧化物酶连接(immunohistochemical streptravidin-biotin peroxidase, SP)法检测宫颈组织ATG-12、Tie-1表达情况;取连续切片的宫颈组织蜡块,二甲苯脱蜡、梯度乙醇水花、100℃抗原修复后,用3%过氧化氢中和过氧化酶,加anti-ATG-12抗体(1∶1 000稀释)孵育3~4 h,以磷酸盐缓冲液(phosphate buffer solution, PBS)为阴性对照;滴加PV-6000二抗工作液孵育20~30 min,3,3’-二氨基联苯胺(diaminobenzidine,DAB)显色5~10 min,苏木素染核1 min,盐酸乙醇蓝化,梯度酒精脱水后中性树胶封片。Tie-1表达情况判断参照ATG-12。SP染色结果由2位高年资病理科医师采用双盲法阅片,每张切片随机取3个视野在高倍镜下(×400)观察。ATG-12存在于细胞浆及胞膜,均呈棕黄色颗粒,棕黄色染色则为阳性、不着色则为阴性[8]。
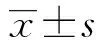
2 结果
2.1 宫颈组织中HPV E6/E7 mRNA表达水平比较 慢性宫颈炎组、LSIL组、HSIL组、CSCC组HPV E6/E7 mRNA阳性率比较差异有统计学意义(H=47.768,P<0.001);HSIL组、CSCC组HPV E6/E7 mRNA阳性率高于慢性宫颈炎组(Hc=9.210、43.550,P<0.017)、LSIL组(Hc=3.664、32.455,P<0.017),CSCC组HPV E6/E7 mRNA阳性率高于HSIL组(Hc=12.116,P<0.017)。见表2。
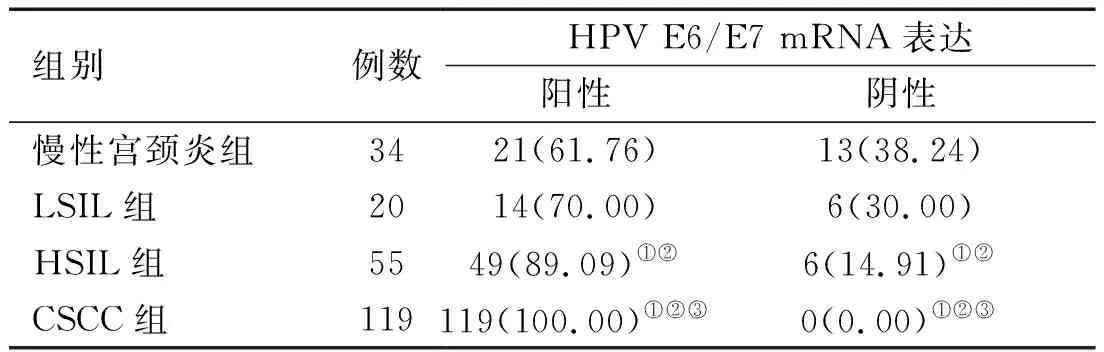
表2 各组宫颈组织中HPV E6/E7 mRNA表达水平比较[例(%)]
2.2 各组宫颈组织中ATG-12表达水平比较 慢性宫颈炎组、LSIL组、HSIL组、CSCC组ATG-12阳性率比较,差异有统计学意义(H=73.856,P<0.001);HSIL组、CSCC组ATG-12阳性率低于慢性宫颈炎组(Hc=14.352、49.833,P均<0.017),HSIL组、CSCC组ATG-12阳性率低于LSIL组(Hc=8.552、33.461,P<0.017),CSCC组ATG-12阳性率低于HSIL组(Hc=13.225,P<0.017)。见表3。
表3 各组宫颈组织中ATG-12表达比较[例(%)]
2.3 宫颈组织中Tie-1表达水平比较 慢性宫颈炎组、LSIL组、HSIL组、CSCC组Tie-1阳性率比较差异有统计学意义(χ2=80.975,P<0.01);HSIL组、CSCC组Tie-1阳性率低于慢性宫颈炎组(Hc=15.227、84.364,P均<0.017),HSIL组、CSCC组Tie-1阳性率低于LSIL组(Hc=8.012、80.355,P<0.017),CSCC组Tie-1阳性率低于HSIL组(Hc=24.363,P<0.017)。见表4。
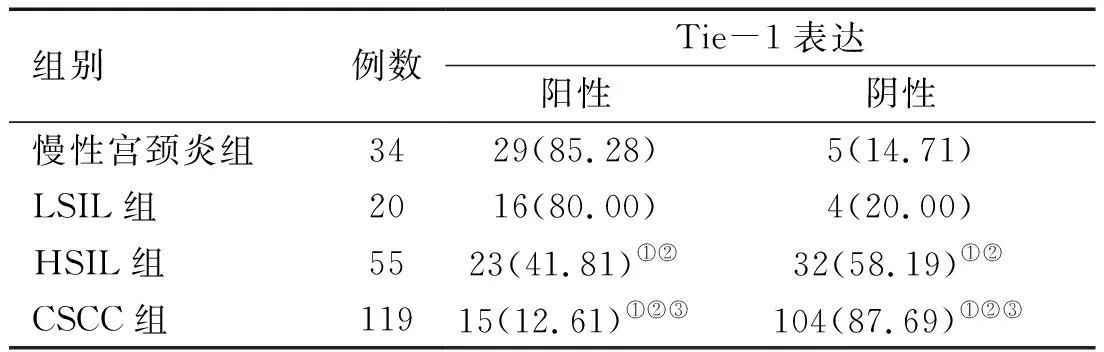
表4 各组宫颈组织中Tie-1表达情况比较[例(%)]
2.4 宫颈组织中HPV E6/E7 mRNA、ATG-12、Tie-1表达对HSIL+的筛查价值 以HSIL+为状态变量,分别以HPV E6/E7 mRNA、ATG-12、Tie-1、联合筛查标准为检验变量绘制ROC曲线,结果显示,单一HPV E6/E7 mRNA、ATG-12、Tie-1筛查HSIL+时,HPV-E6/E7mRNA的AUC值最小,筛查灵敏度为96.55%,特异度为35.49%;ATG-12阴性、Tie-1阴性筛查HSIL+的AUC值高于HPV E6/E7 mRNA阳性(Z=2.650、2.578,P=0.008、0.009),但ATG-12阴性、Tie-1阴性筛查HSIL+的AUC值差异无统计学意义(Z=0.121、P=0.903);联合(HPV-E6/E7mRNA阳性基础上,ATG-12阴性或Tie-1阴性)筛查HSIL+的AUC值上升至0.856,灵敏度、特异度分别为89.66%、81.48%,高于HPV E6/E7 mRNA阳性、ATG-12阴性、Tie-1阴性筛查的AUC值(Z=4.348、3.011、2.842,P均<0.001)。见表5、图1。

表5 宫颈组织中HPV E6/E7 mRNA、ATG-12、Tie-1表达对HSIL+的筛查价值
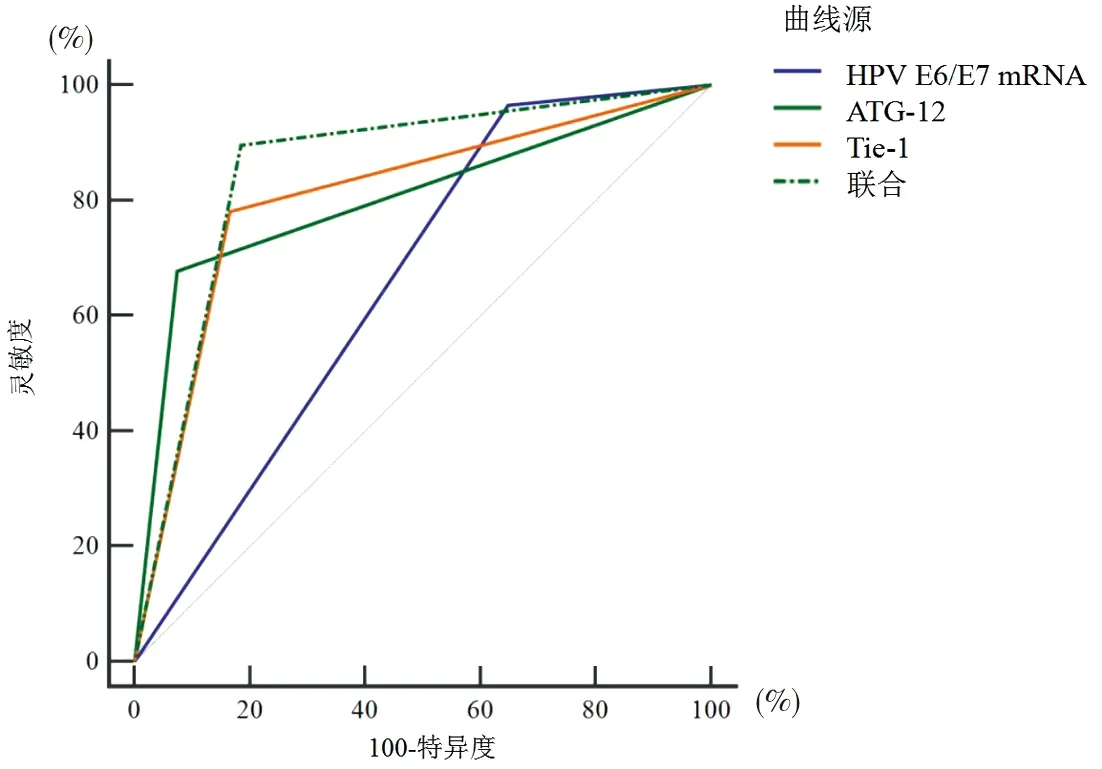
图1 宫颈组织中HPV E6/E7 mRNA、ATG-12、Tie-1表达筛查HSIL+的ROC曲线
3 讨论
高危型HPV持续感染与宫颈癌的发生密切相关,70%的宫颈癌与HPV 16型、HPV 18型感染有关。通常情况下,一种或多种高危HPV持续感染、或慢性感染导致的宫颈癌早期病变并无特异性临床表现[9]。研究[10]证实,高级别的CIN临床标本中均可见E6、E7蛋白过表达,作为病毒癌基因蛋白,E6蛋白可结合并灭活肿瘤抑制因子P53,从而调控细胞生长周期;而E7蛋白不仅可调控细胞生长周期,导致细胞生命周期延长、细胞结构改变,还能结合并降解抑制蛋白pRb,引起DNA合成障碍、细胞代谢改变,破坏基因组稳定性,最终导致细胞无限分裂而癌变。本研究显示,慢性宫颈炎组、LSIL组中HPV E6/E7 mRNA阳性率分别高达61.76%、70.00%,且HSIL组、CSCC组HPV E6/E7 mRNA阳性率高于慢性宫颈炎组,HSIL组、CSCC组HPV E6/E7 mRNA阳性率高于LSIL组,CSCC组HPV E6/E7 mRNA阳性率高于HSIL组。这与李晓林等[11]的报道结论相符,均提示HPV E6/E7 mRNA阳性率可随SIL病理分级增加而上升。另Bruno等[12]的研究显示,93例HPV E6/E7 mRNA检测阳性妇女经为期3年的随访,22例确诊为CIN Ⅱ+,而在HPV E6/E7 mRNA检测阴性患者中,仅2例被检出CIN Ⅱ+,由此认为HPV E6/E7 mRNA阳性的女性具更高的宫颈病变恶性进展风险,HPV E6/E7 mRNA阳性可作为宫颈病变筛查的可靠指标。本研究以HPV E6/E7 mRNA阳性筛查HSIL+的敏感度虽高达96.55%,高于Pruski等[13]报道86.1%,但HPV E6/E7 mRNA阳性筛查HSIL+的特异度不足50%,提示单一HPV E6/E7 mRNA阳性筛查HSIL+存在较高的假阳性风险。
自噬与脑缺血、恶性肿瘤疾病存在密切关联,往期关于宫颈病变与自噬的关系研究多集中于自噬相关蛋白Beclin 1,认为自噬下调了CSCC进展,指出自噬与宫颈病变恶性进展存在密切关联[14-15]。ATG-12也是自噬相关的分子标志物之一,杜晓薇等[16]的研究证实ATG-12参与脑缺血脑组织的自噬方式调节,Tan等[17]首次证实miR - 378可能通过靶向ATG-12促进宫颈癌的转移而发挥致癌基因作用。本研究比较各组ATG-12表达情况,结果显示HSIL组、CSCC组ATG-12阳性率低于慢性宫颈炎组,HSIL组、CSCC组ATG-12阳性率显著低于LSIL组,CSCC组ATG-12阳性率显著低于HSIL组。由此可见,宫颈组织ATG-12阳性表达率随SIL病理分级增加而呈一定上升趋势。这与谭冬梅[18]的报道结论相似,提示ATG-12表达缺失可能与宫颈病变分级有关。ROC曲线也证实,ATG-12阴性筛查HSIL+的AUC达0.780,具良好的筛查效能。Tie-1则是酪氨酸受体家族成员之一,既可表达于内皮细胞,也可表达于上皮来源的肿瘤细胞。秦君君等[19]报道,肿瘤直径<2 cm、ⅠB2~ⅡA2期、合并淋巴结脉管间质浸润的CSCC患者宫颈组织中Tie-1阳性表达率显著更低,并具更短的3年累积生存时间及3年累积无瘤生存时间。本研究则显示,Tie-1在慢性宫颈炎、LSIL、HSIL、CSCC患者中表现出与ATG-12相似的趋势,HSIL组、CSCC组Tie-1阳性率显著低于慢性宫颈炎组;HSIL组、CSCC组Tie-1阳性率低于LSIL组,CSCC组Tie-1阳性率低于HSIL组。ROC曲线分析也显示Tie-1筛查HSIL+的AUC与ATG-12接近,筛查的敏感度、特异度分别为78.16%、83.33%,与ATG-12在筛查灵敏度上有一定欠缺,存在高漏诊风险,影响筛查效能。
基于本研究,考虑单一HPV E6/E7 mRNA、ATG-12或Tie-1筛查HSIL+的优劣,本研究进一步联合HPV E6/E7 mRNA、ATG-12或Tie-1筛查HSIL+,结果显示在HPV E6/E7 mRNA阳性基础上,以ATG-12或Tie-1任意一项阴性为联合筛查表现,筛查效能上升并高于任意单一检验指标筛查,敏感度、特异度分别为89.66%、81.48%。但本研究为回顾性分析,为满足研究需求,研究对象仅纳入留存有宫颈组织标本的患者,可能导致样本对象的代表性欠缺,另LSIL组样本不足30例,均可能导致研究结论具有一定偏倚,拟在下阶段研究中收集更具代表性的大样本量患者资料,补充及完善本研究结论,为宫颈病变恶性进展防治提供更严谨的参考依据。
综上所述,宫颈组织HPVE6/E7mRNA阳性表达随SIL病理分级增加而增加,ATG12、Tie-1阳性表达率则随病理分级增加而降低,三者均可作为筛查HSIL+的可靠检验指标,但在ATG12、Tie-1阳性基础上,联合ATG12阴性或Tie-1阴性为筛查条件可进一步提升筛查效能,值得临床重视。
