清肝化瘀颗粒对H22 肝癌腹水瘤小鼠的治疗作用
2022-05-21索菲娅朱晓燃杨振寰姚树坤
索菲娅,朱晓燃,杨振寰,姚树坤
(1.北京中医药大学研究生院,北京 100029;2.中日友好医院消化科,北京 100029)
目前原发性肝癌是我国发病率第4 位的恶性肿瘤,死亡率第2 位的肿瘤,严重威胁我国人民的生命和健康[1]。肝癌腹水是晚期肝癌最常见的并发症之一,可引起腹胀、腹痛、乏力、纳差、呼吸困难、活动受限、循环障碍以及多器官功能衰竭等,严重影响患者生活质量,且目前临床治疗棘手,预后极差,临床尚无明确治疗方案[2-4]。研究表明中医药治疗能够改善上述症状,提高机体的抵抗力,提高生活质量,有效控制腹水的进一步增长,延长患者生存期[1,5]。因此研究中医药对恶性腹水的治疗意义重大[6,7]。清肝化瘀方是姚树坤教授结合三十余年临床经验拟成,前期研究结果证实清肝化瘀方可显著提高原发性肝癌患者免疫功能,提高生存质量,延长生存期,具有极高的开发研发价值,因而在此基础上开发了“清肝化瘀颗粒”以便用于新药研发与临床推广[8-10]。本研究对清肝化瘀颗粒治疗H22 肝癌腹水瘤小鼠进行疗效评价及基本机制探讨,为新药研发提供药效学依据,也为其对原发性肝癌伴恶性腹水患者的治疗提供基础实验支持。
1 材料与试剂
1.1 主要实验材料
小鼠肝癌细胞H22,购自中国医学科学院基础医学研究所;雄性ICR 小鼠,4 周龄,体重20 g 左右,由北京华阜康生物科技有限公司提供,许可证号SCXK(京)2019-0008,饲养于中日友好医院SPF 级动物实验室。实验符合动物实验伦理规定,伦理编号:190114。
1.2 药材与试剂
氟尿嘧啶注射液,购于天津金耀药业有限公司,批号1504261;0.9%生理盐水注射液,购于北京双鹤药业股份有限公司,批号1003182;肝复乐胶囊,购于湖南九典制药股份有限公司,批号Z20050817;清肝化瘀颗粒干膏粉(批号:20170731)由中日友好医院药学部提供。“干膏粉”指的是本供试品提取物,每克提取物相当于4.472 g 生药。
1.3 小鼠H22 肝癌腹水瘤模型建立
1.3.1 H22 肝癌细胞准备 水浴37 ℃将细胞快速复苏,加入PBS、离心去除冻存液,加入生理盐水重悬,将细胞配制成浓度为1×107cells/mL 的细胞悬液。
1.3.2 小鼠H22 肝癌细胞腹腔内传代 取4 周龄SPF 级雄性ICR 小鼠3 只,于右下腹腔注射0.2 mL已备细胞悬液,置于SPF 级动物室饲养,每日观察小鼠生长情况及腹部变化,1 周后抽取腹水,于超净工作台中进行细胞计数,调整细胞浓度为2×107cells/mL。再以同样方法进行小鼠腹腔内细胞传代,连续传代2 次。第3 次传代后取适量腹水计数,检测细胞存活率98% 以上,调整细胞浓度到2×107cells/mL。
1.4 小鼠H22 肝癌腹水瘤模型建立
取4 周龄SPF 级雄 性ICR 小鼠120 只,体重20 g左右。无菌操作于小鼠右下腹腔内注射0.2 mL 制备好的细胞悬液,建立小鼠H22 肝癌腹水瘤模型,接种完成后观察小鼠状态,于SPF 级动物实验室条件下饲养。
1.5 分组及给药
接种24 h 后将120 只小鼠随机分为模型组、清肝化瘀颗粒低、中、高剂量组及肝复乐组、氟尿嘧啶组,每组20 只。模型组给予无菌水每日灌胃一次,清肝化瘀颗粒低剂量组(0.67 g/kg)、清肝化瘀颗粒中剂量组(1.34 g/kg)、清肝化瘀颗粒高剂量组(2.68 g/kg)、肝复乐组(1.35 g/kg),以上各组每日灌胃一次,及氟尿嘧啶组(50 mg/kg)每7 天腹腔注射1 次,以上各组给药10 d 停药。
1.6 观测指标
1.6.1 小鼠一般情况及体重腹围监测 监测各组小鼠的一般情况,包括外观、活动情况和精神状态等,每3 天测量小鼠的体重及腹围。
1.6.2 小鼠腹水量、腹水抑制率及腹膜渗透性 用药结束24 h,每组随机选择8 只小鼠,于尾静脉注射浓度为5%的伊文蓝溶液0.2 mL,2 h 后处死,抽取腹水,量取腹水体积,并计算腹水抑制率。腹水离心取上清,酶标仪测定吸光度(OD 值)(波长540 nm),计算腹膜渗透性。腹水抑制率=(1-治疗组平均腹水量/模型组平均腹水量)×100%;腹水渗透性:采用伊文蓝的吸光度OD 值测定腹膜血管的渗透性。
1.6.3 小鼠腹膜组织病理染色 取上述抽取过腹水的小鼠,剥去腹部表皮,剪下左侧中下腹1 cm×1 cm 腹膜一块,生理盐水冲洗后将样本放入包埋盒防止样本卷皱,将样本连同包埋盒置于福尔马林溶液中固定,后续进行病理H-E 染色切片观察。
1.6.4 生存期观察 记录每组剩余12 只小鼠的自然存活天数,统计平均生存天数、中位生存期,绘制生存曲线图,计算生命延长率。生命延长率=[(治疗组平均生存天数-模型组平均生存天数)/模型组平均生存天数]×100%。
1.7 腹膜组织Western bolt 检测
依据上述药效学评价,确定清肝化瘀颗粒最佳用药剂量组。取该组及模型组小鼠腹膜应用Western bolt 法检测VEGFA、VEGFR2 表达量。腹膜组织进行裂解、蛋白定量、变性、电泳、转膜、封闭,4 ℃条件下VEGFA 抗体(ab1316,abcam)及VEGFR2抗体(9698S,CST)孵育过夜,后孵育对应二抗,显像。条带灰度值采用ImageJ v1.53c 软件进行分析,灰度值与内参条带进行对比,得出相对表达量。
1.8 统计学处理
应用SPSS 20.0 统计软件对所得到的所有数据资料进行统计学分析,计量资料均以均值±标准差(±s)表示,若方差齐,采用单因素方差分析整体比较,两两比较采用Dunnet't检验,若方差不齐时采用非参数检验进行整体比较,两两比较采用Kruskal-Wallis 检验。
2 结果
2.1 小鼠的一般状况观察
所有小鼠接种H22 细胞后,均有毛发变暗黄、成簇、打结,活动速度减少减慢,眼睛深凹,腹部膨隆等表现。与模型组比较,各用药组小鼠以上表现出现稍晚,尤以氟尿嘧啶组、清肝化瘀颗粒中、高剂量组出现最迟。
2.2 小鼠的体重监测
与模型组相比,各用药组小鼠体重增长缓慢,其中氟尿嘧啶组和清肝化瘀中、高剂量组体重增长趋势明显缓慢(P<0.05~0.01),清肝化瘀低剂量组及肝复乐组小鼠体重与模型组相比差异无统计学意义(P>0.05)。见表1。
表1 各组小鼠体重(g,n=12,±s)Tab 1 Body weight of mice in each group(g,n=12,±s)

表1 各组小鼠体重(g,n=12,±s)Tab 1 Body weight of mice in each group(g,n=12,±s)
注:同一时间,与模型组比较,*P<0.05,**P<0.01。
组别模型组清肝化瘀低剂量组清肝化瘀中剂量组清肝化瘀高剂量组肝复乐组氟尿嘧啶组15 d 41.17±1.83 39.90±1.87 37.77±1.31*38.68±2.52*39.15±0.38 34.75±4.22**5.471 0.01 FP 0 d 21.11±0.69 20.98±0.77 21.40±0.96 21.45±0.96 21.20±1.07 21.75±0.76 1.444 0.237 3 d 26.60±1.10 26.39±1.13 26.18±1.04 26.05±1.22 25.88±0.73 25.73±1.05 1.169 0.347 6 d 30.90±2.17 30.73±1.57 29.53±1.63 30.68±1.28 30.87±0.49 27.63±0.95**21.360 0.01 9 d 35.00±2.97 34.27±2.94 31.03±1.90*31.63±2.01 34.48±1.88 28.49±1.85**14.493 0.01 12 d 37.00±2.18 37.95±3.22 34.68±0.96*35.56±2.27*37.52±1.20 32.66±1.98**31.490 0.01
2.3 小鼠的腹围监测
与模型组相比,各用药组小鼠腹围增长较慢,其中氟尿嘧啶组和清肝化瘀中剂量组的腹围于第6天开始差异有统计学意义(P<0.05~0.01),清肝化瘀高剂量组于第12 天开始差异有统计学意义(P<0.05),而清肝化瘀低剂量组及肝复乐组小鼠腹围差异无统计学意义(P>0.05)。见表2。
表2 各组小鼠腹围(cm,n=12,±s)Tab 2 Abdominal circumference of mice in each group(cm,n=12,±s)

表2 各组小鼠腹围(cm,n=12,±s)Tab 2 Abdominal circumference of mice in each group(cm,n=12,±s)
注:同一时间,与模型组比较,*P<0.05,**P<0.01。
组别模型组清肝化瘀低剂量组清肝化瘀中剂量组清肝化瘀高剂量组肝复乐组氟尿嘧啶组15 d 12.58±0.73 11.80±0.58 11.09±0.53*11.73±0.16*11.88±0.25 10.37±0.45**18.881 0.01 FP 0 d 8.00±0.16 8.03±0.10 8.06±0.09 8.03±0.15 7.98±0.19 7.99±0.17 0.454 0.809 3 d 8.18±0.14 8.12±0.12 8.19±0.14 8.18±0.15 8.22±0.10 8.14±0.08 1.008 0.420 6 d 9.07±0.26 8.84±0.34 8.74±0.22*8.94±0.26 8.91±0.19 8.13±0.12**37.392 0.01 9 d 10.01±0.20 9.73±0.31 9.09±0.29*9.58±0.22 9.46±0.53 8.55±0.18**49.077 0.01 12 d 11.49±0.63 11.21±0.57 10.63±0.80*10.77±0.58*11.07±0.39 9.68±0.49**28.913 0.01
2.4 小鼠腹水量、腹水抑制率及腹膜渗透性
与模型组相比,氟尿嘧啶组、清肝化瘀中剂量和高剂量组小鼠腹水量明显减少,差异有统计学意义(P<0.05),腹水抑制率分别为48.78%、25.67%、19.28%,清肝化瘀低剂量组、肝复乐组小鼠的腹水量差异无统计学意义(P>0.05)。与模型组结果相比,清肝化瘀中、高剂量组、氟尿嘧啶组小鼠腹水上清OD 值明显降低(P<0.05),以上结果显示清肝化瘀颗粒中、高剂量治疗可以抑制H22 腹水瘤小鼠的腹水增长,并降低腹膜渗透性。见表3。
表3 各组小鼠腹水量、腹水抑制率及腹水上清OD 值(n=8,±s)Tab 3 Amount and inhibition rate of ascites and OD value of ascites supernatant of mice in each group(n=8,±s)

表3 各组小鼠腹水量、腹水抑制率及腹水上清OD 值(n=8,±s)Tab 3 Amount and inhibition rate of ascites and OD value of ascites supernatant of mice in each group(n=8,±s)
注:与模型组比较,*P<0.05,**P<0.01。
腹水上清OD 值1.92±0.15 1.98±0.22 1.68±0.30*1.73±0.38*1.91±0.17 1.29±0.50*15.182 0.01组别模型组清肝化瘀低剂量组清肝化瘀中剂量组清肝化瘀高剂量组肝复乐组氟尿嘧啶组腹水抑制率(%)-18.00 25.67 19.28 15.23 48.78 FP腹水量(mL)9.39±0.99 7.70±1.44 6.98±0.68*7.58±0.68*7.96±0.93 4.81±1.43**17.739 0.01
2.5 小鼠腹膜组织病理H-E 染色结果
结果显示模型组腹膜组织细胞排列松散,呈破絮样改变,出现新生血管,伴大量的中性粒细胞浸润,大量细胞变性坏死。清肝化瘀低剂量组腹膜组织细胞排列松散,出现新生血管,伴大量的中性粒细胞浸润,部分细胞变性坏死。清肝化瘀中剂量组组织细胞结构稳定,轻度水肿,中性粒细胞数量较少。清肝化瘀高剂量组组织细胞结构稳定,轻度水肿,中性粒细胞数量较多。肝复乐组组织细胞结构排列松散,明显水肿,中性粒细胞数量明显增多,腹膜厚度明显增加。氟尿嘧啶组细胞形态结构正常,排列整齐,仅出现轻微的水肿。以上结果表明氟尿嘧啶组小鼠腹膜结构最完整、水肿较轻微,未观察到新生的血管,考虑化疗药物直接接触癌性腹水,作用效果最佳;与模型组相比,清肝化瘀中、高剂量组小鼠腹膜结构较完整、水肿较轻、血管新生较少,优于肝复乐组和清肝化瘀低剂量组。见图1。
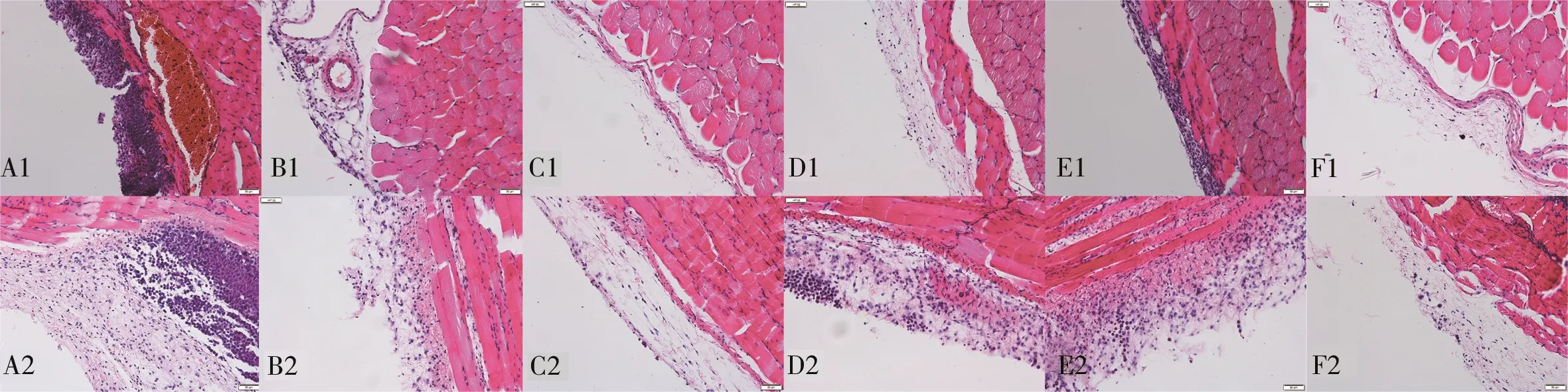
图1 各组小鼠腹膜组织病理H-E 染色结果(×200)Fig 1 H-E staining results of peritoneal tissues in mice of each group(×200)
2.6 小鼠生存情况
与模型组相比,清肝化瘀颗粒中剂量组和氟尿嘧啶组的平均生存天数明显延长,差异具有统计学意义(P<0.05~0.01)。模型组和清肝化瘀低、中、高剂量组小鼠的中位生存期分别为14、16、18、16天。与模型组比较,清肝化瘀各剂量组的生存期均有延长,其中清肝化瘀中剂量组中位生存期差异有统计学意义(P<0.05)。见表4、图2。
表4 各组小鼠生存情况(n=12,±s)Tab 4 Survival of mice in each group(n=12,±s)

表4 各组小鼠生存情况(n=12,±s)Tab 4 Survival of mice in each group(n=12,±s)
注:与模型组比较,*P<0.05,**P<0.01。
组别模型组清肝化瘀低剂量组清肝化瘀中剂量组清肝化瘀高剂量组肝复乐组氟尿嘧啶组生命延长率(%)-16.7 25.7 15.3 18.1 66.7中位生存期(d)14.5 16.5 18.5*16.0 16.5 26.0**FP平均生存天数(d)14.4±2.7 16.8±3.0 18.1±4.0*16.6±2.7 17.0±3.7 24.0±4.6**25.674 P<0.01
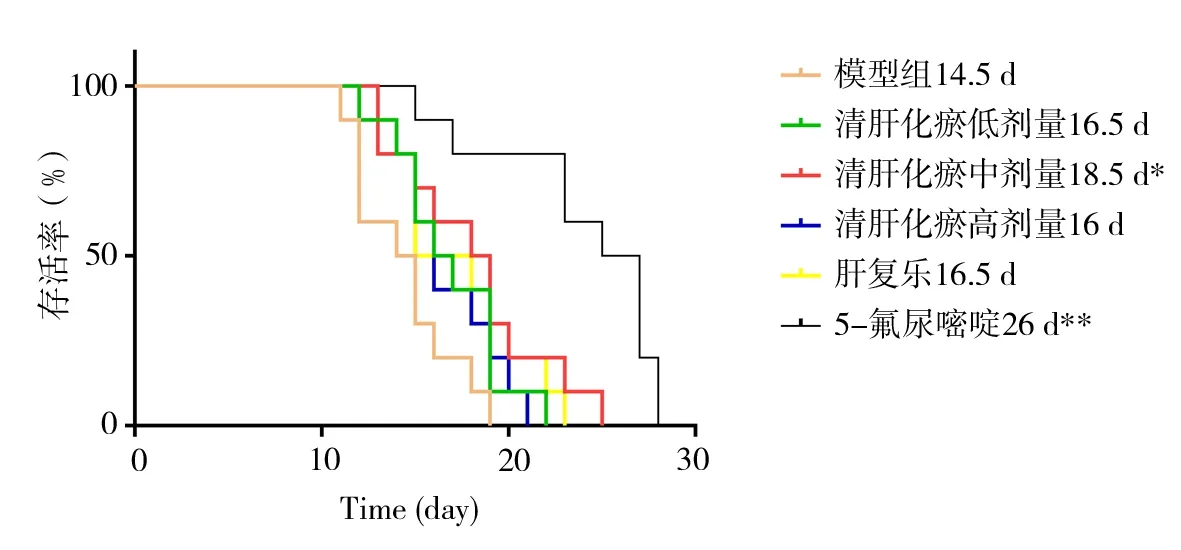
图2 各组小鼠生存曲线Fig 2 Survival curve of the mice
2.7 Western blot 检测
清肝化瘀中剂量组小鼠腹膜的VEGFA 及VEGFR2 表达量显著低于模型组,差异均具有统计学意义(P<0.05,P<0.01)。见图3。
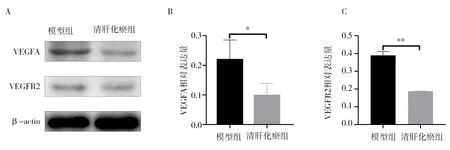
图3 模型组与清肝化瘀中剂量组VEGFA、VEGFR2 表达量Fig 3 Expression of VEGFA and VEGFR2 in the model group and the middle-dose Qinggan Huayu group
3 讨论
腹水是原发性肝癌晚期常见的并发症之一,原发性肝癌腹水具有反复性、难治性,一直以来都是肝癌临床治疗的难题[11]。目前肝癌腹水的治疗缺少循证医学证据的支持,主要包括多种姑息措施,然而治疗效果并不理想,且存在禁忌证多、副作用大、风险性高等问题[12,13]。肝癌腹水的形成机制复杂,尚未完全明确,除肝功能异常导致白蛋白减低及门静脉高压导致组织液漏出外,肿瘤侵袭导致的腹膜血管渗透性增加及腹膜新生血管的增多被认为是腹水形成的主要原因之一,因此降低腹膜微血管渗透性和抑制腹膜血管新生也被认为是减少恶性腹水的重要策略[14]。有研究者已尝试将靶向药物如抗VEGF 抗体贝伐珠单抗、重组人血管内皮抑制素等药物应用于恶性腹水的治疗,可以获得较好近期疗效,但长期疗效不确切,且药物价格高昂,患者生存期难以显著延长,有效的治疗方法仍需进一步研究[15-18]。
原发性肝癌腹水属中医学“鼓胀”范畴,《素问》记载:“诸胀腹大,……,诸病有声,鼓之如鼓,……水液浑浊,皆属于热”,将鼓胀认识为热症。姚树坤教授认为肝癌腹水患者临床可见两胁疼痛、呼出臭秽,抽出的腹水黄浊质重、腹表皮温升高,舌红苔黄腻,脉弦滑数,局部辨证属热症,整体辨证为湿热瘀毒炽盛伴有气血亏虚,其主要病机在于癌毒侵犯隧道,隧道不通、郁生湿热,湿热毒瘀停结日久则阻滞气血的运行和津液的输布,使三焦决渎失调、水液停聚腹中、使腹部胀大。病至晚期,患者正虚邪盛,气血阴阳俱损,而患者平素饮酒或进食高热量食物补品,更加重了湿热毒瘀停结。《素问》云:“湿热相搏则怫郁痞膈,小便不利而水肿也”,“瘀血不去,其水乃成”,说明了湿热、瘀血阻闭气机为水气病的关键病机,姚树坤教授以此为基础,提出了“祛湿热瘀血以利肝癌腹水”的治法,即破除痹阻之湿热毒瘀实邪,宣通三焦水道、辅助气血运行、改善津液输布,达到祛湿逐瘀不伤阳、调气利水不伤阴的效果。因此总结得出清肝化瘀方,适用于治疗原发性肝癌中晚期、终末期,失去化疗机会,或合并多种并发症如伴肝功能异常、伴恶性腹水的患者,在前期的临床实践中取得了良好效果。清肝化瘀颗粒组方以黄芩、苦参为君,清热燥湿,泻火解毒;以白术、莪术、半枝莲、蛇舌草为臣,活血破瘀,消积利水,抗癌毒;以三棱为佐,破血行气,消积止痛;以甘草为使,调和诸药;全方药味精妙,功专力强,共奏清热祛湿,破瘀利水,散结抗癌之功。
从现代药理研究的角度来看清肝化瘀颗粒的组成,黄芩主要成分之一的黄芩素可通过破坏肿瘤血管发育,抑制血管生成[19],另一种主要成分黄芩苷可降低VEGF 的表达和活性,抑制肿瘤血管生成,抑制肿瘤生长和转移[20]。苦参的主要成分苦参碱可通过抑制血管内皮细胞增殖、下调血管内皮生成因子和MMP-9 蛋白表达来抑制肿瘤血管生成[21]。有研究表明莪术主要单体成分莪术醇可以抑制VEGF 蛋白表达,进而抑制肿瘤血管生成[22],莪术油能显著抑制肝癌细胞生长增殖[23]。半枝莲不同提取物或不同化学成分均具有一定的抗肿瘤活性,可通过降低血小板-内皮细胞黏附分子(CD31)的密度,降低VEGF 含量,抑制肿瘤血管的生成[24,25]。因此笔者推测清肝化瘀颗粒的作用可能与抑制腹膜血管渗透性的增加及腹膜新生血管生成相关,并通过腹膜病理学检查及腹水上清OD 值检测进行验证,及进行VEGFA、VEGFR2 表达量检测初步机制探索。
VEGF 已被证实是腹水肿瘤中腹水形成、血管生成的重要介质,并且靶向VEGF 的治疗可以抑制腹 水 产 生[26]。VEGFR2 是VEGF 的 主 要 受 体,是VEGF 介导的血管生成最重要的转导因子[27]。靶向VEGF/VEGFR 信号通路的治疗可以抑制腹水生成。本研究检测H22 肝癌腹水瘤小鼠腹膜组织VEGFA、VEGFR2 的蛋白表达量,结果显示清肝化瘀颗粒组的表达量显著低于模型组,提示清肝化瘀颗粒的作用机制可能与抑制VEGF/VEGFR 信号通路相关。
肝复乐胶囊是治疗以肝瘀脾虚为主证的原发性肝癌的中成药,强调祛邪兼扶正,组方功效全面[28]。清肝化瘀颗粒以祛湿热毒瘀以利水之法,其药味少而精,功专效强而直达病所,急则治其标,避免过早补益闭门留寇,二者处方思路有所差别。在本研究中,两种药物分别作用于H22 肝癌腹水瘤小鼠模型,结果显示清肝化瘀颗粒抗腹水生成作用较肝复乐更强,可更显著地减少腹水生成、延长小鼠生存期。
本研究选取H22 肝癌腹水瘤小鼠模型,将H22肝癌细胞种植于小鼠腹腔内,能恰当地模拟原发性肝癌腹水的形成。结果证实,清肝化瘀颗粒对于H22 肝癌腹水瘤小鼠具有抑制腹水生成、延长生存时间的作用,且最佳治疗剂量为1.34 g/kg,其腹水抑制率为25.67%,疗效确切;通过对腹膜组织病理学及腹水上清OD 值的检测,提示清肝化瘀颗粒可能是通过抑制腹膜新生血管的增加和腹膜血管渗透性的升高,发挥治疗恶性腹水的作用,其作用机制可能与抑制VEGF/VEGFR 通路相关。
作者贡献度说明:
索菲娅负责共同完成实验、样本检测、论文书写、数据分析;朱晓燃、杨振寰负责共同完成实验及文章核对等审校工作;姚树坤负责实验指导、整体把握。
