浙江省不同地区野生鼠茅遗传多样性研究
2022-05-20刘本同王丽玲王衍彬黄旭波秦玉川
刘本同,王丽玲,王衍彬,黄旭波,秦玉川
(浙江省林业科学研究院,浙江 杭州 310023)
鼠茅Vulpia myuros为越年生禾本科Poaceae 鼠茅属Vulpia植物,每年9 月萌发,翌年6 月死亡,留下的种子可于当年9 月萌发。目前,鼠茅主要用于果园抑草[1]和绿肥种植[2-3],主要分布在江苏、浙江、广西等地,具有较高的经济价值。前期研究表明,不同产地的鼠茅在生理特性方面存在差异,特别是耐寒、耐旱性方面存在差异。近年来,对于鼠茅的研究也多集中在种植、生理特性等方面[4-7],关于用分子标记技术研究鼠茅遗传多样性及遗传结构的报道几乎没有。与其他分子标记技术相比,简单序列重复区间扩增多态性分子标记(Inter-simple sequence repeat,ISSR)是显性标记,具有稳定性好、多态性高、简便及易操作等优点,被视为理想的遗传标记方法[8-10]。目前,ISSR 已在多种动植物的遗传多样性、亲缘关系分析、种质资源鉴定、基因定位和遗传图谱构建等研究方面得到应用[11-14]。本研究应用ISSR 分子标记法分析来源于浙江省内及市售日本种的鼠茅遗传多样性水平及亲缘关系,以期对鼠茅资源的保护和开发等方面提供科学依据。
1 材料与方法
1.1 实验材料
2020 年4—5 月,采集浙江省各市的鼠茅的地上部分,将采摘的鼠茅存放于装有干燥硅胶的密封袋中备用。日本种质购于种子市场,为日本鼠茅品种‘雪印’。共26 个样品,样品采集信息见表1。
1.2 试剂
TIANamp Genomic DNA Kit,天根生物科技(北京)有限公司;TS-GelRed 核酸染料(10 000×水溶液),北京擎科新业生物技术有限公司;Regular Agarose,西班牙Biowest 公司;50×TAE Tris-乙酸电泳缓冲液,福州Phygene 生物科技有限公司。
1.3 供试仪器
DK-S26 电热恒温水浴锅,上海森信实验仪器有限公司;FRESCO 21 微量冷冻离心机、NanoDrop2000 超微量分光光度计,美国Thermo scientific 公司;Life ECO 扩增仪,杭州博日科技有限公司;DYY-12C 型电泳仪,北京六一生物科技有限公司;Bio-Rad 凝胶成像系统,美国伯乐公司。
1.4 引物序列
供试引物所采用的ISSR 扩增引物信息见表2,共15 条引物。供试引物委托北京擎科新业生物技术有限公司合成。

表2 最优ISSR 引物序列Table 2 The optimal ISSR primer sequence
1.5 DNA 的提取及检测
取待提取鼠茅叶片,用无菌水清洗数遍,用滤纸吸干水分,加研磨珠在研磨机上彻底磨碎。基因组DNA 的提取参照天根TIANamp Genomic DNA Kit 试剂盒操作说明书。利用NanoDrop 2 000 超微量分光光度计对样品基因组DNA 进行核酸纯度及浓度的检测,于-20℃冰箱储藏备用。
1.6 PCR 引物的筛选、ISSR-PCR 扩增及检测
参考加拿大哥伦比亚大学(UBC)公布的100 条ISSR 引物序列,随机选取2 个鼠茅样品模板DNA,采用最优ISSR-PCR 体系中的扩增条件,从ISSR 引物中筛选出15 条反应体系较稳定、扩增条带较清晰且多态性较多的引物,最优引物序列见表2。PCR 反应体系为20 μL,含有DNA 样品1 μL(40 mg·L-1)、引物1 μL,2×TSINGKE Master Mix 10 μL,加ddH2O 至体积20 μL。反应程序:94℃预变性5 min,95℃变性1 min,52~ 57℃退火1 min,72℃总延伸5 min,共35 个循环,4℃保存。PCR 扩增反应在LifeECO 基因扩增仪(杭州博日)上进行。PCR产物在质量分数为1.5%的琼脂糖凝胶上进行电泳,TS-GelRed 核酸染料染色,1×TAE 电泳缓冲液中电泳40 min,电压为130V。Marker 为2 000 bp。电泳后,在Bio-Rad 凝胶成像仪上拍照并保存DNA 检测结果。
1.7 数据分析
根据样品的ISSR 扩增谱带信息,按照邹喻萍等[15]制定的标准,以扩增条带有计为“1”,无计为“0”。用Image Lab 软件对图谱上的条带进行人工标记,并导出为0-1 矩阵的数据。用NTSYS 2.10 软件对来源于不同地区的鼠茅进行个体间的非加权成对算术平均法(UPGMA)聚类分析,使用软件中的SimQual 程序计算样品间的Dice 遗传相似系数,用SAHN 程序进行UPGMA 聚类分析,通过Tree plot 模块生成聚类图。
2 结果与分析
2.1 I SSR-PCR 扩增结果
用筛选出的15 条引物对采集的25 个样品和1 个日本种质进行扩增,共扩增出87 条条带,在多态性条带中其有效条带数为83 条,有效条带数占总条带数的95.40%。15 条引物扩增出的条带数量均为2~ 12 条,其中,引物848 扩增出的条带数量最多,为12 条;PCR 扩增结果见表3。引物835 对鼠茅的PCR 扩增结果见图1。
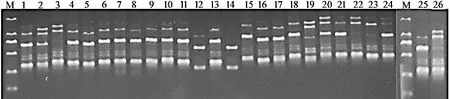
图1 引物835 对鼠茅的PCR 扩增结果Figure1 PCR amplification of primer 835 on V.myuros
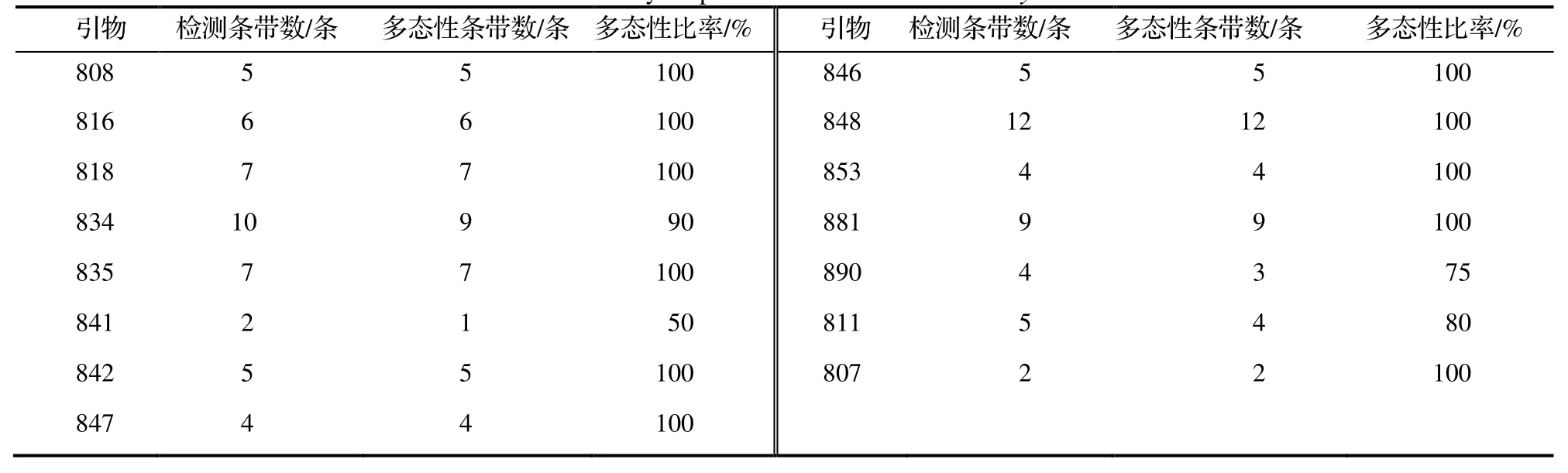
表3 鼠茅ISSR 标记的多态性Table 3 Polymorphism of ISSR markers in V.myuros
2.2 遗传相似性分析
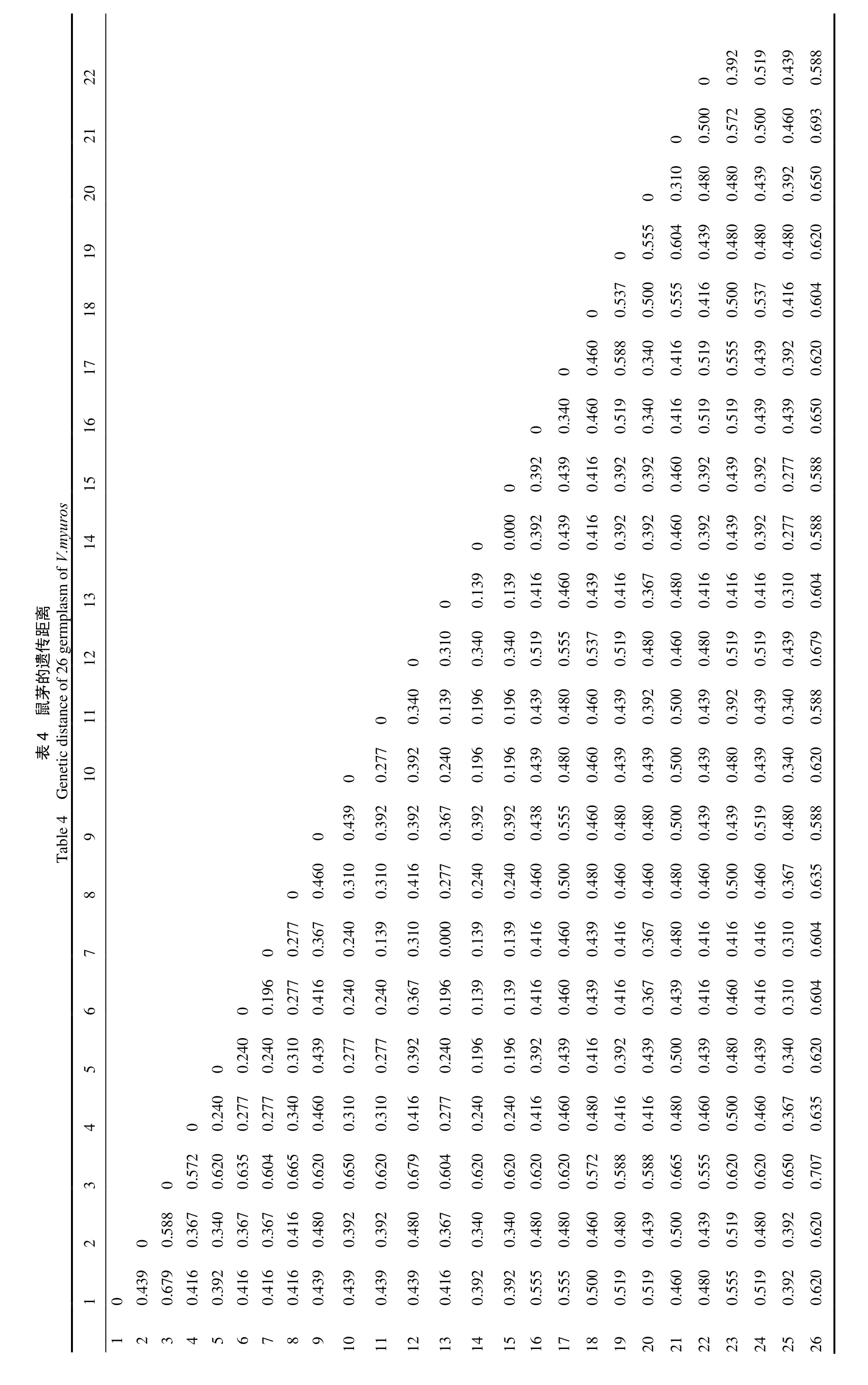
将15 条引物扩增出的条带作为原始矩阵,利用NTSYS-pc 软件计算26 份鼠茅种质间的Dice 遗传距离,结果见表4。由表4 可知,26 份种质之间的遗传距离均介于0~ 0.707,平均为0.457。其中,浙江省内种质间遗传距离最大的为1 号和3 号、3 号和12 号,其遗传距离均为0.679,表明两者间的亲缘关系最远;遗传距离最小的为7 号和13 号,其遗传距离为0,说明这两者亲缘关系非常近,可能来源于同一祖先。此外,日本种质26号与浙江种质的鼠茅遗传距离都较远,其中与3 号的遗传距离最大,为0.707,与24 号和25 号的遗传距离最近,均为0.555。这表明浙江的这25 份鼠茅种质为浙江特有种质,均非人工播种的日本种质。26 份试样间的遗传距离详见表4。
2.3 聚类结果分析
使用Ntsys 2.1 软件对26 个鼠茅样品基于遗传相似性系数进行UPGMA 聚类,聚类结果见图2。由图2 聚类结果显示,在遗传相似系数0.63 处划分,26 个样品可聚为2 类,其中,来自丽水的3 号种质单独为一类,其余25 个种质为一类;在遗传相似系数0.78 处,可将第一类的25 份样品进一步细分为两类,其中,日本种质26 号单独为一类,其余24 份样品聚为一类;相同产地的鼠茅聚类关系都较近,如12 号、13 号、14 号来自台州的鼠茅种质均在同一个分叉上,4 号和5 号来自丽水的鼠茅种质也聚集较近,也有少数同一产地的鼠茅种质没有聚在一类,如来自杭州的23 号、24 号种质聚类较远,说明两者的亲缘关系较远。结合产地聚类和个体聚类结果可知,除3 号种质外,浙江省内鼠茅的亲缘关系都较近,且相互交叉。这与遗传距离分析结果一致,鼠茅不同种源的基因交流程度较高,遗传分化较小。
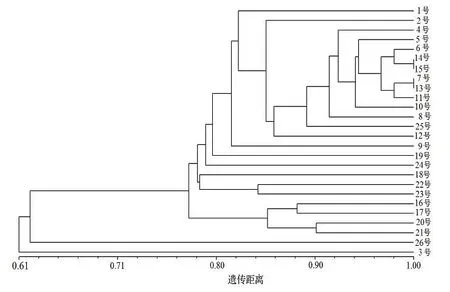
图2 26 份种质的UPGMA 遗传聚类图Figure 2 Dendrogram constructed for 26 germplasms based on UPGMA
3 讨论
本研究利用ISSR 分子标记方法对浙江省内25 份不同地理来源的鼠茅和1 份从市场采购的日本种质进行遗传多样性分析。由遗传多样性分析结果可知,鼠茅具有丰富的遗传多样性。遗传距离是用来比较群体或个体间亲缘关系远近的度量参数,距离越小,说明亲缘关系近,遗传背景的一致性越强,由遗传距离进行亲缘关系分析,26 份鼠茅种质之间遗传距离为0~ 0.707,其遗传距离总体来说比较小,表明浙江省内鼠茅个体间的亲缘关系较近;进一步的聚类结果分析可知,来自衢州的7 号种质和来自台州的13 号种质,以及来自台州的14 号种质和
来自宁波的15 号种质的亲缘关系较近,表明这些地区鼠茅种质的亲缘关系较近,遗传背景较为一致。同时,从聚类关系图也可看出,同一个地区的鼠茅并未聚集在一起,如来自宁波的15~ 19 号种质,分布在聚类图的各分叉上,这可能与鼠茅的繁殖方式相关,并与基因的交流程度有关。此外,来自丽水的3 号种质在聚类图上单独聚为一类,这说明该鼠茅种质的遗传上与其他种质有较大差异,在后续的育种等方面值得关注。
ISSR 分子标记技术能够揭示鼠茅不同种质间的遗传差异及亲缘关系,虽然目前对鼠茅种质间的遗传多样性的研究较少,但在其他物种中得到了很好运用。如:李曼等[16]采用ISSR 分子标记对39 个不同产地的牛膝Achyranthes bidentata种质进行聚类分析,将其分为2 大类群6 个亚群,这说明牛膝具有丰富的遗传多样性;李勇慧等[17]采用ISSR 分子标记法对洛阳地区35 个牡丹Paeonia suffruticosa品种进行了遗传多样性分析,结果表明,35 个牡丹品种的遗传多样性丰富,可分为5 大类,为合理利用牡丹种质资源提供分子水平的研究基础。蒋明等[18]对8个居群共125份日本荚蒾Viburnum japonicum样品进行了ISSR遗传多样性分析,聚类分析结果表明,同一地理来源的日本荚蒾大多聚为一类,呈一定的地域分布规律,日本荚蒾遗传多样性水平高,但主要存在于居群间,岛屿之间的地理隔离可能是遗传分化的主要原因。因此,本文通过ISSR 分子标记方法对鼠茅亲缘关系鉴定,结合不同鼠茅的生理生化特征,可为鼠茅规范化种植及资源保护开发等提供科学依据。
4 结论
本研究对浙江地区及市售日本种质共26 份鼠茅样品进行ISSR 遗传多样性分析。用筛选出的15 条引物对26 份种质进行扩增,共扩增出87 条条带,其中有效条带数为83 条,占总条带数的95.40%;15 条引物扩增出的条带数量均为2~ 15 条,其中,引物848 扩增出的条带数量最多,为12 条。26 份种质之间的遗传距离均介于0~ 0.707,平均为0.457,其中,浙江省内种质间遗传距离最大的为1 号和3 号、3 号和12 号,其遗传距离均为0.679,表明两者间的亲缘关系最远,遗传距离最小的为7 号和13 号,其遗传距离为0;此外,日本种质26 号与浙江种质的鼠茅遗传距离都较远,其中与3 号的遗传距离最大,为0.707。UPGMA 聚类结果表明,在遗传相似系数0.63 处划分,26 个样品共聚为2 类,其中,来自丽水的3 号种质单独为一类,其余25 个种质为一类;在遗传相似系数0.78 处,可将上述第一类的25 份样品进一步细分为两类,其中日本种质26 号单独为一类,其余24 份样品聚为一类。同一地理来源的鼠茅大多聚为一类,呈现一定的地域分布规律,但也不仅仅局限于地域聚类,不同地域遗传相似度较高,鼠茅遗传分化程度也不高。以上研究结果,可以为鼠茅的异地种植、资源保护提供理论依据。
