代谢流分析技术及其在肿瘤代谢中的应用进展
2022-05-20牛宇佳徐同冉林树海
牛宇佳,徐同冉,林树海
(厦门大学生命科学学院,细胞应激生物学国家重点实验室,福建 厦门 361102)
在20世纪20—60年代,生物化学领域呈现突飞猛进的发展,科学家们鉴定了人类和其他物种的绝大多数代谢网络中营养物质利用和能量产生的过程[1].进入21世纪后,又迎来代谢复兴的新时期.研究人员借助各类新技术、新仪器,如色谱质谱联用技术,实现了高通量代谢物的定性、定量分析,可表征细胞、组织和体液在某一特定条件下的病理与生理变化,因此代谢组的变化可以看成是生化反应的指示剂;然而,这只解决了问题的一半,代谢组学反映的是静态代谢物的丰度,而单独某一种代谢物增加的原因既可能是合成途径的活跃,也可能是消耗途径的抑制,因此了解代谢物相关途径活性的变化同样重要[2].为了更好地定性与定量研究代谢物的代谢命运,代谢流分析技术伴随稳定同位素示踪和质谱技术的发展而产生.研究人员引入稳定同位素来示踪代谢物,依据代谢物分子的同位素分布模式推断出相关代谢反应的通量[3],以实现从静态与动态角度均能剖析细胞代谢的变化.机体代谢处于动态平衡时,代谢物的产生量与消耗量应相等[2];一旦打破这种稳态(即代谢异常),则常会导致代谢疾病的发生[3].为了精准地研究疾病特别是肿瘤发生发展过程中的代谢物动态变化,代谢流技术得以广泛应用.依据已有报道,代谢流分析技术在识别新的代谢途径、鉴定代谢物的代谢命运、发现新的代谢物,以及鉴定疾病诊断的生物标志物等方面取得了重要进展[4].
1 稳定同位素示踪剂的选择
为量化细胞内的代谢流通量,最重要且有效的方法之一是使用稳定同位素示踪剂[5].稳定同位素示踪剂是将某些特定原子替换成稳定同位素标记的代谢物,常用的稳定同位素标记有13C、2H、15N等.细胞的生命活动基本单元是碳骨架,细胞中最重要的碳源是葡萄糖,其他的代谢物如谷氨酰胺、棕榈酸、乙酸、乳酸等也可作为细胞的碳源[6],它们也参与重要的代谢反应如糖酵解、三羧酸循环、磷酸戊糖途径等.本文从细胞代谢中若干重要代谢通路的角度阐述代谢流分析技术的流程及其在肿瘤代谢中的应用价值.
1.1 以[U-13C6]-葡萄糖为示踪剂区分进入三羧酸循环的代谢途径
经典生物化学中,葡萄糖通过糖酵解通路转化为丙酮酸,丙酮酸有两种方式进入三羧酸循环[7-8]:一种途径是通过丙酮酸脱氢酶(PDH),即丙酮酸转化为乙酰辅酶A,乙酰辅酶A结合草酰乙酸生成柠檬酸;另一种途径是通过丙酮酸羧化酶(PC)产生草酰乙酸[9](图1).为了区分这两条代谢途径,可以使用[U-13C6]-葡萄糖作为示踪剂.为了简化研究策略,仅考虑一轮三羧酸循环历程:对于第一种途径,来自葡萄糖的丙酮酸经PDH产生的柠檬酸标记应为[M+2],即含有2个13C 标记;对于第二种途径,来自葡萄糖的丙酮酸经PC产生的草酸乙酸标记应为[M+3],进而柠檬酸标记也含有3个13C标记.由此可以计算出柠檬酸同位素异型体[M+2]/[M+3]的比例,即为通过PDH与通过PC的通量分流比例,三羧酸循环中其他代谢物也可反映相同信息.因此,比较丙酮酸进入三羧酸循环的两种不同方式的代谢通量,使用13C标记的葡萄糖或其他糖酵解过程中的代谢物(如丙酮酸)均可以实现研究目的.值得一提的是,若只为考察PC活性,可使用[1-13C]-丙酮酸作为示踪剂,即通过PC转化得到的柠檬酸含有1个13C,而通过PDH转化得到的柠檬酸不含13C.

图1 [U-13C6]-葡萄糖作为示踪剂短时间内通过PDH和PC进入三羧酸循环
1.2 以[1,2-13C2]-葡萄糖为示踪剂鉴别氧化型和非氧化型磷酸戊糖途径
磷酸戊糖途径含有氧化型和非氧化型两条支路.在氧化型磷酸戊糖途径中[10-11],葡萄糖转化为葡萄糖-6-磷酸后,经历氧化和脱羧成为5-磷酸核酮糖,再经非氧化型磷酸戊糖途径回到糖酵解过程中的果糖-6-磷酸.由于葡萄糖-6-磷酸经历氧化脱羧过程,其碳骨架上第一个被标记的13C原子被脱去成为CO2释放,所以重新进入糖酵解的果糖-6-磷酸只有1个标记的13C 原子;而未进入磷酸戊糖途径的葡萄糖-6-磷酸有2个标记的13C原子,下游代谢物也是如此标记模式.可以使用糖酵解下游代谢产物(如丙酮酸或乳酸等)计算其同位素异型体[M+1]与[M+2]的标记比例,该比值即为葡萄糖经磷酸戊糖途径和仅经糖酵解而不经磷酸戊糖途径的代谢通量分流比例(图2).

图2 [1,2-13C2]-葡萄糖为示踪剂鉴别氧化型和非氧化型磷酸戊糖途径
1.3 以[2,3,3-2H]-丝氨酸为示踪剂鉴别线粒体和胞浆中的一碳代谢
由叶酸辅酶介导的一碳代谢支持多种生理活动的正常进行,包括核苷酸合成、氨基酸代谢、表观遗传调节和氧化还原稳态的维持[12].近年来,越来越多的研究报道了线粒体中一碳代谢的生物学重要性,于是引入L-[2,3,3-2H]-丝氨酸作为稳定同位素示踪剂,以阐明一碳单元在细胞中的代谢模式.
首先,丝氨酸羟甲基转移酶(SHMT)利用四氢叶酸(THF)转化丝氨酸为甘氨酸,并产生5,10-亚甲基四氢叶酸(5,10-meTHF),且该反应可逆.SHMT1和SHMT2分别在胞浆和线粒体中分解丝氨酸,其流动方向取决于每个区室中一碳单元的供需情况[13].在这两个区室中都编码可以实现5,10-meTHF到甲酸的转化代谢酶且该反应可逆,在胞浆中为亚甲基四氢叶酸脱氢酶1(MTHFD1),在线粒体中为双功能脱氢酶/环化水解酶(MTHFD2/2L)[14].另外,以5,10-meTHF为底物,胸苷合成酶(TYMS)可将一个甲基单位转移至单磷酸脱氧尿苷(dUMP)上,以合成三磷酸脱氧胸苷(dTMP),该过程发生在胞浆中.
通过追踪[2,3,3-2H3]-丝氨酸中的2H插入一碳代谢的终产物(如胸苷),可以确定丝氨酸的区室化代谢[15].丝氨酸若在线粒体中代谢会造成3位碳的1个质子在氧化成甲酸盐的过程中丢失(如图3中蓝色点所示).此外,[2,2-2H2]-甘氨酸在线粒体中代谢时2位碳的1个质子氧化成甲酸盐丢失(如图3中绿色点所示).此时丢失的甲酸盐在胞浆叶酸代谢池中发生还原反应,产生同位素异型体[M+1]的dTMP;而在胞浆中,被SHMT1分解的丝氨酸则把2个质子转移至5,10-meTHF上,产生[M+2]的dTMP.通过分析dTMP的同位素异型体[M+1]/[M+2]即可知丝氨酸在线粒体与胞浆中的代谢分流比例.

NAD(P)+.氧化型辅酶Ⅱ(或Ⅰ);NAD(P)H.还原型辅酶Ⅱ(或Ⅰ);GLDC.甘氨酸脱羧酶.
1.4 2H标记示踪NADH或NADPH
NADH和NADPH是细胞中重要的能量和还原物质.传统的NADH和NADPH检测使用试剂盒,仅能观察细胞中NADH或NADPH的变化趋势.尽管遗传荧光标记可以实现亚细胞定位,但依然无法知晓NADH或NADPH的具体生化反应历程.为此,有必要使用2H标记的稳定同位素示踪技术来准确地追踪NADH或NADPH的产生.这些代谢物的降解速度比其他碳水化合物要快得多,特别是NADPH极易被氧化,故代谢物提取与检测需要特别注意方法的选择及优化[16].磷酸戊糖途径中葡萄糖-6-磷酸脱氢酶(G6PD)和6-磷酸葡萄糖酸脱氢酶(6PGD),其他酶如异柠檬酸脱氢酶(IDH)、苹果酸激酶、乙醛脱氢酶和MTHFD也可催化产生NADPH[17-18],故可引入[3-2H]-葡萄糖或[1-2H]-葡萄糖来标记NADP2H[19];另外,葡萄糖的4位碳上标记2H,则可以通过 3-磷酸甘油醛脱氢酶(GAPDH)的作用来标记NAD2H(图4).由此可见,同一代谢物同一元素不同的标记位置所能示踪的代谢通路不同,故需根据所要回答的科学问题和生物化学反应原理选择合适的稳定同位素标记示踪剂.

LDH.乳酸脱氢酶.
2 代谢途径通量实现的基本流程
2.1 天然同位素的校正
当引入稳定同位素后,依据机体的生物化学反应,代谢物也会产生相应的同位素分布模式.同位素的产生有两个来源:一方面是掺入带有同位素标记的营养物质;另一方面也可能是由天然的同位素丰度所致.生物分子中最常见的天然同位素是13C,天然丰度为1.07%[20].其他同位素原子比较少见,但还是会有重大影响.15N天然丰度为0.368%,2H天然丰度为0.011 5%,17O天然丰度为0.038%,18O天然丰度为0.205%,29Si天然丰度为4.683%,30Si天然丰度为3.087%[21-23].以细胞中主要的能量载体三磷酸腺苷(ATP,C10H16N5O13P3)为例,13C的天然丰度占[M+1]峰值的大部分,而18O是[M+2]峰的最大干扰因素.由于天然同位素的存在,依据二项式分布定理,原本标记水平较低的组分在数据上显示水平较高,所以此时应对质谱检测到的同位素标记分布质量分数解卷积,以求取准确的同位素标记分数,这一过程称作同位素丰度校正.
目前已经出现一系列校正软件,以IsoCor软件[24]为典型代表,其主要优势在于可校正各种元素种类,原理如下:
ICcor=CM-1·ICmeas,
(1)
其中,ICcor表示校正后的实际同位素分布信息,CM-1表示校正矩阵,ICmeas表示经质谱检测得到的原始同位素分布信息.
相比于IsoCor软件,AccuCor软件[25]所得结果则更加准确.考虑到质谱的分辨率(即区分两个质量相近离子的能力),如对于丝氨酸(C3H7NO3)中的13C或15N均是[M+1],若是低分辨率则无法区分,若是高分辨率则两个峰得以分开.
Δm≥1.66×fwhm,
(2)
其中,Δm表示峰质心的质荷比差值,fwhm表示半峰全宽.式(2)考虑了质谱分辨率,使IsoCor软件在校正高分辨率质谱所得数据误差较大的问题得到明显改善.
关于同时校正双同位素(如C和N)标记的软件也逐渐出现[26].校正天然同位素丰度的软件日趋理想化将有助于获取真实标记信息.
2.2 代谢通量分析(MFA)的相关算法
当引入稳定同位素示踪后,分析目的是准确映射出示踪剂参与代谢通路的活性变化[23,27].MFA已是一项发展成熟的定量研究代谢的重要技术[28],使用稳定同位素标记的示踪信息可计算出通量,即细胞的代谢反应速率.
如图5(a)所示,当引入稳定同位素标记A后,B的生成通量是fin,消耗通量是fout,若此时达到代谢物稳态,则满足
fin=fout=fB.
(3)
若处于代谢物稳态而同位素标记非稳态时,如图5(b)所示,当B的未标记形式逐渐被标记形式所取代,可得B的未标记形式随时间变化的函数
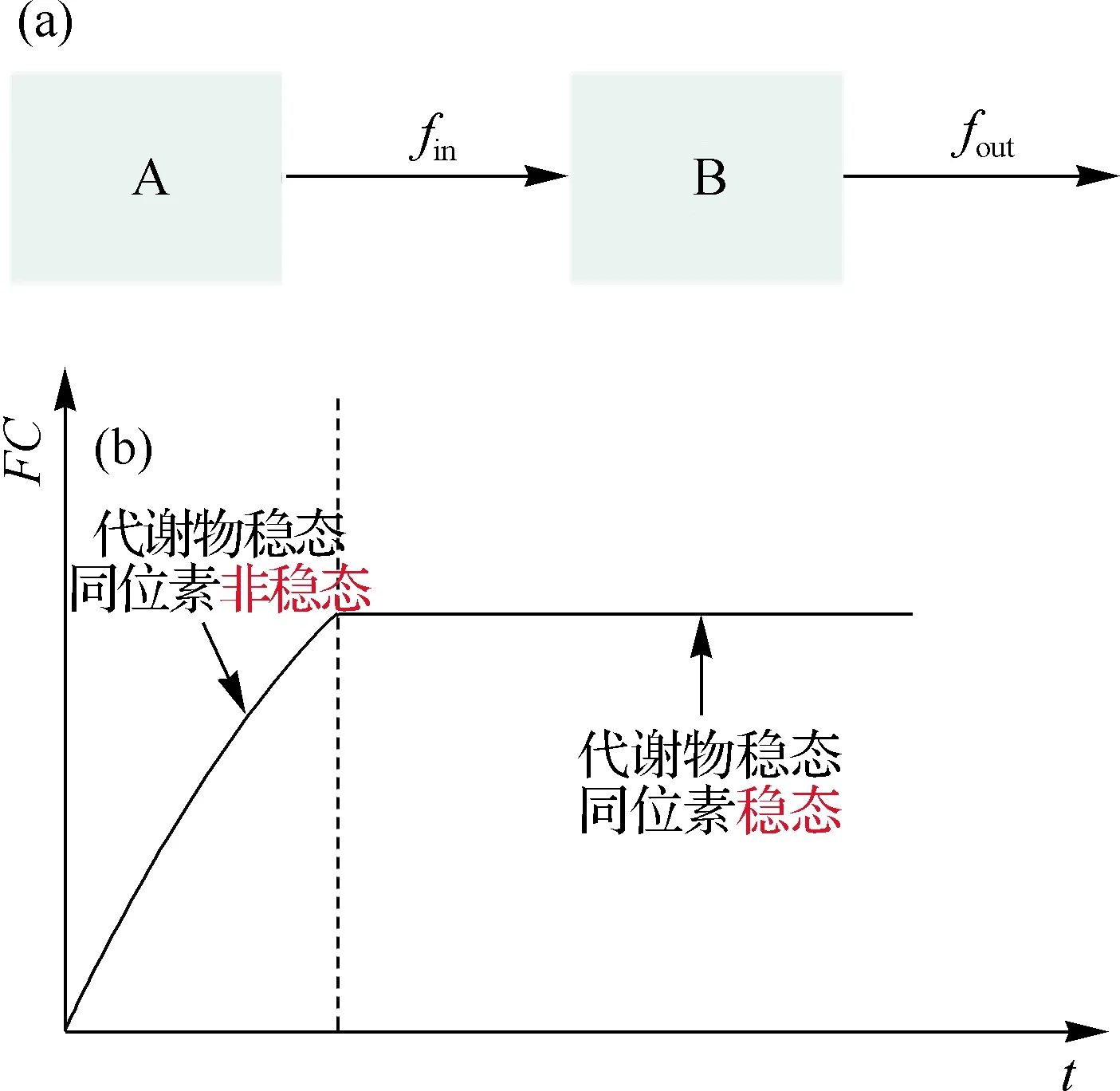
FC表示代谢物的同位素分布模式浓度占代谢物总浓度的百分比.
(4)
其中,cB,U表示未标记的B的浓度,cB,T表示代谢物B的总浓度,其解析解为
(5)
此时即可求得稳定状态下B的代谢通量fB.
然而在非稳定状态下求解代谢通量较为复杂,对于B的标记变化情况可列出
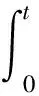
(6)
其中,ΔmB表示经过t时间后B的标记模式(同位素标记分布比例)净改变,mA和mB分别表示代谢物A和B的标记模式,V表示细胞的体积.
已知非稳态代谢模式下,代谢物的标记模式受代谢物的生成通量和浓度大小影响,
(7)
当明确cB,T以及mA、mB后,即可求得此时fin的值.
有关MFA中常用的稳定同位素标记及其所示踪的关键代谢通路见表1.

表1 常用稳定同位素示踪剂及其在代谢通路示踪中的应用
3 代谢流分析技术应用以及肿瘤代谢的解析
3.1 葡萄糖的代谢命运——新生化途径的发现
代谢性疾病发生的一个重要原因是过多的营养摄取导致溢流代谢(overflow metabolism)的发生,主要表现为代谢底物的不完全氧化及代谢副产物的产生.如Warburg效应指出:在肿瘤细胞中,不论氧气是否充足,葡萄糖代谢都更倾向于向乳酸的转化[52-53].乙酰辅酶A是一个中心碳代谢的中间代谢物,被广泛用于生物大分子合成和能量产生,以支持细胞生长和增殖,在人体中其主要来自葡萄糖或其他常规碳源,如谷氨酰胺和脂肪酸等[54-55].已有研究报道在一些压力应激条件下(如缺氧),肿瘤细胞会利用乙酸作为其主要的碳源以支持细胞存活和增殖.乙酸盐的代谢为乙酰辅酶A的产生提供了一个并行途径,因此乙酸盐可以支持蛋白乙酰化及脂肪酸合成,而与柠檬酸转化为乙酰辅酶A无关[56].鉴于可替代的碳源通常来自溢流代谢,Locasale课题组[39,57-58]开展了对细胞内乙酸合成路径的研究:通过引入18O标记的氧气,运用液相色谱-高分辨质谱检测肿瘤细胞中新生成的被18O标记的乙酸,证明活性氧(ROS)可以作为亲核试剂;随后结合[13C3]-丙酮酸稳定同位素标记,证实丙酮酸经非酶促反应生成乙酸盐.上述结果提示葡萄糖代谢在清除ROS中发挥一定作用[59].如何结合葡萄糖代谢与氧化应激并将其作为抗癌的合成致死策略,可能是肿瘤治疗未来研究的一个新方向.
3.2 谷氨酰胺的代谢命运——碳与氮的协同代谢
增殖的肿瘤细胞会进行细胞代谢重编程,以适应不利的生长环境(如缺氧、营养物质缺乏等).Warburg效应提及肿瘤细胞会增加葡萄糖的代谢通量用以分泌乳酸,这提示肿瘤细胞的生长缺失了重要的碳源葡萄糖[60].然而细胞中另一种营养物质谷氨酰胺,是血液中含量最丰富的氨基酸,也可作为一种重要的碳源以支持能量产生及物质积累.一个谷氨酰胺分子包含5个C原子和2个N原子.当谷氨酰胺中的C被过度利用时,已有研究报道谷氨酰胺可通过谷氨酰胺酶(GLS)和谷氨酸脱氢酶(GLUD)的脱氨作用为细胞提供α-酮戊二酸[61],伴随此过程产生大量的溢流氨会对细胞产生毒性,这对于增殖的肿瘤细胞非常不利.
近期,李兵辉团队[62]揭示了谷氨酰胺中C和N的协同代谢机制.目前谷氨酰胺中的C用于合成脂类已得到广泛认可,已有研究报道谷氨酰胺的N在肿瘤细胞中代谢成氨,具有潜在毒性[63].在缺氧条件下,核苷酸的前体在肿瘤细胞中积累,主要包括氨甲酰天冬氨酸、二氢乳清酸和乳清酸等;进一步使用多种稳定同位素标记的示踪分析,发现谷氨酰胺的N在缺氧条件下主要富集在二氢乳清酸和乳清酸中,并被排出体外[63-65].该研究揭示了谷氨酰胺中C和N的协同代谢命运,为临床上肿瘤的靶向治疗提供了重要参考.
实际上,异常改变的、高活性的代谢过程中生成的氨可以作为“代谢废物”回收,被重新利用合成氨基酸为肿瘤细胞提供氮源[66];而且氨的过度累积可以被鸟氨酸脱羧酶的蛋白翻译过程所“感知”,具有调控多胺合成从而影响肿瘤细胞增殖的生物学功能[67].
3.3 亚细胞结构之间的代谢互作——线粒体与细胞质
代谢活动的亚细胞区室定位是定义真核细胞的重要标志之一.不同代谢底物和酶的混合池提供了细胞代谢的灵活性,以适应细胞的内部需求并响应外部干扰.已有报道指出在细胞器之间的代谢互作可支持肿瘤细胞的存活与生长[68-70].如胞质中的一碳通量可以弥补线粒体中叶酸代谢途径的缺失,线粒体与胞质间的苹果酸-天冬氨酸穿梭机制在电子传递链受损时可以支持肿瘤细胞的生长等,然而细胞器之间的代谢交互目前尚不清晰[71].Lee等[68]建立了基于亚细胞器区室分离的空间代谢组学方法,描述了在肿瘤细胞中谷氨酰胺代谢的全景.已有研究报道了多种快速分离细胞器的方法及丰富的肿瘤细胞内代谢物信息;为了进一步明确定量线粒体与胞质之间的代谢通量,以宫颈癌HeLa细胞为研究对象,结合稳定同位素标记([U-13C6]-葡萄糖和[U-13C5]-谷氨酰胺)、线粒体快速分离技术、高效液相色谱-质谱联用及数学模型建立的空间代谢流组学方法,定量谷氨酰胺在线粒体及胞质之间的代谢通量,揭示了在标准常氧条件下,还原型IDH1调控的谷氨酰胺可以作为细胞中脂肪酸生物合成的碳源净贡献者[68].该工作将代谢流的研究进一步拓展到亚细胞器层次,具有重要的参考意义.从这一角度来讲,关于细胞内其他细胞器(如溶酶体、过氧化物酶体、内质网等)中所包含的代谢生化反应及代谢互作仍有待于研究,且此方法是否可应用于临床诊断或寻求生物标志物仍需深入探索.
3.4 能量代谢中被忽视的碳源
哺乳动物组织通过血液循环促进营养物质包括糖、脂肪、蛋白等的供应[72].在有氧条件下,通常认为葡萄糖被组织经三羧酸循环方式完全“燃烧”产生CO2.然而Warburg效应提示组织和肿瘤细胞会更倾向于将大部分葡萄糖进行糖酵解,经分解代谢成为乳酸.长久以来,基于剧烈运动下的肌肉或缺氧组织中积累的特性,乳酸都被视作无氧条件下细胞呼吸代谢产生的废物.尽管被认知为代谢废物,但机体并不能直接排泄乳酸,关于血液中乳酸代谢的生理意义及潜在代谢机制也尚不明确.
Joshua Rabinowitz团队[73]提出了颠覆性观点:乳酸不仅是无氧条件下的代谢产物,更可能是人体最重要的能量载体,同时它还是癌细胞最重要的直接营养来源.通过13C标记追踪血液循环中葡萄糖、乳酸、谷氨酰胺等30种含碳代谢物的流通量,他们得出循环通量最大的是乳酸,这表明乳酸不仅是缺氧条件下的一种代谢产物(即所熟知的代谢废物),而且是与葡萄糖、氨基酸和酮体一样关键的能量载体,甚至比这些以往认为的供能物质更重要[73].这一发现为今后糖尿病和其他有关能量代谢疾病的研究提供了新思路,对于癌症的研究也有重要意义.实验室传统的研究均基于体外培养的细胞,而不能使细胞完全模拟体内环境,因此真正在体内水平了解癌症的代谢特性才更有助于发现癌症的代谢弱点并给予治疗.
类似地,丙氨酸可以逆转为丙酮酸进入三羧酸循环,特别是在自噬条件下,肿瘤细胞可利用丙氨酸作为能量来源的替代碳源[74].此外,肌苷通过嘌呤核苷磷酸化酶产生1-磷酸核糖,转化成5-磷酸核糖,进而通过磷酸戊糖途径和糖酵解通路进入三羧酸循环以提供能量[75].丝氨酸消旋酶(serine racemase)不仅可以把L-丝氨酸转化为D-丝氨酸,还可以水解产生丙酮酸,为肿瘤细胞提供能量[76].通常可以采用稳定同位素标记的示踪分析检测三羧酸循环中间产物的标记情况,从而获悉感兴趣的代谢物能否在某些特定病理、生理条件下作为替代碳源参与能量代谢.
3.5 果糖——真实的代谢命运
由于人们对甜味的满足感,在过去的两个世纪里,果糖的人均消费量增大约100倍[77].高果糖的摄入也逐渐被认为是代谢疾病的罪魁祸首.流行病学统计显示果糖摄取与肥胖、非酒精性脂肪肝、Ⅱ型糖尿病、肾功能紊乱和心血管疾病之间具有很强的相关性[38],然而这种联系的生物学机制仍存在争论.已有研究报道,果糖转变为果糖-1-磷酸主要是由己酮糖(磷酸)激酶(KHK)调控的,且KHK主要在肝脏中表达,因此一般认为饮食中摄入的果糖代谢主要在肝脏中完成[78].Joshua Rabinowitz团队[73]在小鼠实验中发现:正常饮食摄入的果糖约90%主要在小肠中代谢,而并非过去认为的肝脏;如果摄入果糖量过高,那么多余的部分会被转移至肝脏中进行分解代谢.上述研究通过稳定同位素标记的代谢流分析证实小肠是果糖代谢的主要场所,这提示体内代谢流分析技术对于鉴定重要小分子的代谢命运具有重要意义.
4 代谢流分析技术在肿瘤动态变化中的应用
肿瘤细胞代谢重编程是肿瘤发生发展的重要特征.根据具体的科学问题,选择合适的稳定同位素示踪剂开展代谢流分析,有助于解析代谢通路活性随肿瘤发生发展的动态变化,从而鉴定肿瘤的代谢弱点,实现个性化治疗[79].以受体酪氨酸为例,不同受体酪氨酸可能驱动不同的代谢模式.为此,本课题组[80]采用多种稳定同位素标记的示踪剂,发现表皮生长因子受体(EGFR)驱动的肿瘤细胞多依赖于丝氨酸合成通路,而成纤维细胞生长因子受体(FGFR)驱动的肿瘤细胞则依赖于乳酸代谢;因此,使用丝氨酸合成通路的限速酶3-磷酸甘油酸脱氢酶抑制剂或LDH抑制剂,可分别有效抑制EGFR或FGFR驱动的肿瘤生长.对于小鼠体内的代谢流分析,则可通过颈静脉插管灌流稳定同位素标记的示踪剂,同样可以定量分析癌组织与癌旁组织的代谢通路活性差异[81].当使用[1,2-13C2]-葡萄糖作为示踪剂时,鉴定了非氧化型戊糖磷酸途径的转酮醇酶促进肝癌发生发展的一个重要机制,即促进氧化型戊糖磷酸途径回流至糖酵解通路而产生过量乳酸;而当敲除转酮醇酶基因时,5-磷酸核糖出现累积并促进核苷酸合成,从而稳定基因组,减缓肝脏损伤和肿瘤的生长[82].在肺癌研究中,以13C标记的谷氨酰胺或谷氨酸示踪还原型谷胱甘肽的合成,发现小鼠体内肺癌组织比癌旁组织中的谷胱甘肽合成更快[83].
代谢流分析技术还可以揭示体内循环系统代谢物的周转通量,以及组织中糖酵解中间代谢物的来源,这将有助于鉴定器官代谢交流[84].最近一项研究将体内代谢流分析技术应用于黑色素瘤的斑马鱼(Daniorerio)模型,结果发现肝脏与黑色素瘤之间存在丙氨酸循环[85].稳定同位素标记的示踪分析还可以解析肿瘤微环境中的代谢物竞争与交换.近期的一项研究中,用稳定同位素标记的代谢流分析技术证实了肿瘤微环境中的B细胞可以分泌出γ-氨基丁酸,进而发挥抗肿瘤的免疫调节作用[86].综上所述,开发和运用稳定同位素标记的代谢流分析技术,有助于解析代谢通路活性、代谢重编程规律与代谢物交换等生物化学机制.
5 总结与展望
本文所提及的体外研究均最大程度地利用了代谢流分析的优势和特点,着眼于某一关键代谢底物或中间代谢产物,通过监测代谢物在特定代谢途径和局部代谢网络上的流通发现新机制.不仅如此,在体内研究中,甚至发现了新的颠覆性代谢通路的可能性,即肿瘤细胞的营养来源.由于体内环境复杂,细胞间、器官间的信号传递十分频繁,所以研究人员将整个研究置于更复杂的层次上,以组织、器官整体以及血液循环作为研究对象,再通过代谢流分析技术监测和定量代谢物的分布与通量变化.体内与体外的代谢流分析分别从宏观与微观的角度研究代谢,两者互补且充分结合了定性与定量的思想,从而精准地追踪代谢物的代谢命运.可以预见,代谢流技术方法的进步与完善将为人们揭开更多生物代谢的谜团.
目前代谢流分析技术尚存一些未解决的问题,如在亚细胞层次上的研究进展有限,所需成本较高,且如何保持代谢物的状态也是关键.针对这些问题,有必要发展快速分离细胞器以及同时分离多种细胞器的方法,提高检测更多代谢物的能力,更新代谢模型和分析软件,并兼顾降低成本的问题.
