E3泛素连接酶Pellino蛋白的研究进展
2022-05-20赵保兵
徐 艳,赵保兵
(山东大学药学院,新药药理研究所,山东 济南 250012)
泛素(ubiquitin)是一种由76个氨基酸组成的小分子蛋白质,广泛存在于真核细胞中.泛素化是指泛素在一系列酶的催化作用下共价结合到靶蛋白上的过程.泛素激活酶(E1)依赖三磷酸腺苷(adenosine triphosphate,ATP)与泛素形成不稳定的硫酯键,然后泛素结合酶(E2)接受来自E1的泛素,最后泛素连接酶(E3)从E2转移泛素并将其连接到目标蛋白质的赖氨酸残基上.蛋白质可发生单个赖氨酸残基的单泛素化或者多位点的多聚泛素化,以及泛素赖氨酸残基(Lys6、Lys11、Lys27、Lys29、Lys33、Lys48和Lys63)上的多聚泛素化[1].由于泛素化的多样性,蛋白质泛素化修饰在蛋白质降解、蛋白与蛋白的相互作用、蛋白质细胞定位以及信号传导中发挥重要作用,参与各种生理过程的调控.
E3具有底物识别特异性,根据其C末端功能域可分为两大类:RING 结构域和HECT结构域,此外还有一些靶向N末端含有特定不稳定残基底物蛋白的E3[2].RING结构域 E3 是迄今为止最大和最复杂的泛素连接酶家族,在新发现的 RING 结构域E3中,Pellino蛋白是最初在果蝇(Drosophilamelanogaster)中发现的一种新型pelle相互作用蛋白分子,随之在其他动物(包括哺乳动物)中也发现了多个与Pellino相似的序列[3].在哺乳动物中,Pellino家族由3个成员组成:Pellino1、Pellino2和Pellino3(包括两个剪接变体Pellino3a和Pellino3b)[4].Pellino蛋白与Toll样受体(Toll-like receptor,TLR)信号通路中的多个蛋白分子相互作用,通过蛋白质泛素化参与炎症、细胞固有免疫和获得性免疫的分子信号转导调控.此外,Pellino蛋白与肿瘤发生发展和代谢异常等相关.本文总结了 Pellino蛋白的分子特性、活性调控和生物学研究进展,同时探讨了Pellino蛋白在自身免疫、炎症、癌症、心脏疾病及肥胖疾病中的调控作用.
1 Pellino蛋白的分子特征
1.1 组织分布
Pellino基因在哺乳动物细胞中广泛表达,但在不同组织中表达水平存在显著差异.Pellino1在胎盘、肺、肝、肾、脾、胸腺、骨骼肌和脑等组织中表达,尤其是在外周血白细胞中高表达,而在小肠、结肠和心脏中表达水平较低[5].Pellino2在胚胎期显著表达,而成年后主要在肝脏、睾丸和皮肤中表达[6].Pellino3主要在脑、心脏和睾丸中表达[7].这些表达差异暗示了不同Pellino蛋白的生物学功能具有组织特异性.
1.2 分子结构
Pellino家族成员在进化过程中非常保守,哺乳动物Pellino1和Pellino2具有82%的氨基酸同源性,而Pellino3分别与Pellino1和Pellino2具有70%和71%的氨基酸同源性[8](图1).Pellino蛋白C端具有一段保守的半胱氨酸和组氨酸残基序列(Cys-X1-His-X19-Cys-X2-Cys-X30-Cys-X1-His-X25-Cys-X2-Cys),即RING结构域.经典的RING结构域可以结合两个锌离子,RING结构域E3大致分为单组分RING结构域E3和由多蛋白亚基组成的复合RING结构域E3.RING结构域赋予Pellino蛋白E3活性,通过各种E2介导靶蛋白分子的Lys48(K48)或者K63多聚泛素化[7,9].例如,Pellino1可与Ubc13/Uev1A结合以催化K63多聚泛素链的形成,与UbcH3结合以催化K48多聚泛素链的形成,而在UbcH5a、UbcH5b或UbcH4存在的情况下,Pellino1主要诱导靶蛋白发生K48或者K11链接多聚泛素链[8,10].K48链接多聚泛素链标记靶蛋白以供蛋白酶体降解,而K63链接多聚泛素链则提高靶蛋白的稳定性,促进蛋白质分子间的相互作用和信号传导[11-12].
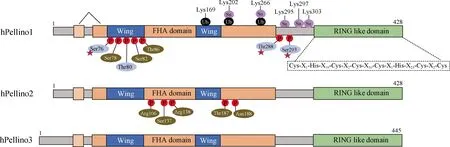
hPellino表示人类Pellino;FHA表示叉头相关;Ub和Su分别表示Pellino蛋白中的相应氨基酸残基被泛素化和小泛素相关修饰物(small ubiquition-related modifier,SUMO)化;Pellino蛋白磷酸化位点以红色显示,其中被白细胞介素1(interleukin 1,IL-1)受体相关激酶1(IL-1 receptor-associated kinase 1,IRAK1)和IRAK4唯一磷酸化氨基酸残基以棕色显示,被IRAK和TANK结合激酶1(TANK-binding kinase 1,TBK1)磷酸化的氨基酸残基以浅蓝色显示;红色星号表示Pellino1单个磷酸化位点激活E3活性.
Pellino蛋白N端包含一个FHA结构域,通过识别磷酸化苏氨酸肽与靶蛋白(如IRAK)结合.蛋白晶体数据显示,Pellino蛋白的FHA结构域包含一个“翼”状结构,由位于FHA同源区域内的两个长插入物组成,这一结构有助于增加底物结合的亲和力和特异性[13].FHA结构域和“翼”状结构在Pellino家族中是保守的,识别并催化磷酸化靶蛋白的泛素化可能是这一家族蛋白的共有特性.
1.3 蛋白活性调控
1.3.1 磷酸化
Pellino蛋白的磷酸化在调节其靶蛋白结合能力和E3活性中起重要作用[8,12,14].IRAK1或IRAK4可磷酸化Pellino蛋白,显著增强其E3活性[9,14].研究表明,Pellino1中7个氨基酸残基的磷酸化对于Pellino1的激活至关重要:5个磷酸化位点聚集在FHA结构域(Ser76、Ser78、Thr80、Ser82和Thr86),并且与FHA结构域的“翼”状结构相关;其他2个磷酸化位点位于RING结构域之前的Thr288和Ser293(图1).这些氨基酸残基单个磷酸化或者组合磷酸化,可以促进Pellino1识别并介导靶蛋白的泛素化[14].多个免疫刺激物,如IL-1、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和TLR配体等,通过蛋白激酶催化Pellino1磷酸化.例如,IRAK1在人胚胎肾细胞293(human embryonic kidney 293 cell,HEK-293)和小鼠胚胎成纤维细胞中介导IL-1引起的Pellino1磷酸化;TLR7在巨噬细胞中介导相关配体诱导的Pellino1磷酸化.另外,核因子κB抑制剂激酶(inhibitor of nuclear factor-κB(NF-κB)kinase, IKK)相关激酶和TBK1也可以磷酸化Pellino1[15].
1.3.2 泛素化
在哺乳动物细胞中共表达Pellino蛋白与IRAK1或IRAK4时,Pellino蛋白不仅能介导IRAK的K63多聚泛素化,其自身也会被泛素化导致蛋白降解[7].Pellino蛋白泛素化可能是一种自身泛素化,但也不排除有其他E3的参与.例如:IRAK1在泛素结合酶UbcH4存在下可介导Pellino1发生自泛素化[10];Pellino2和IRAK1共表达时,两者的表达水平均降低,表明泛素化介导两者降解[16].目前已报道的Pellino1自泛素化的3个赖氨酸残基中,K169和K202分别位于“翼”状结构和FHA结构域,而K266位于C端和FHA结构域之间[14].
1.3.3 SUMO化
SUMO化是近年来新发现的类似泛素化的蛋白翻译后修饰.研究表明,在SUMO结合酶 Ubc9 作用下Pellino1发生SUMO化,定点突变实验进一步确证了5个潜在的SUMO化位点(K202、K266、K295、K297 和 K303)[17].其中2个赖氨酸残基(K202和K266)也可以发生泛素化修饰,提示Pellino1蛋白的SUMO化和泛素化之间可能存在竞争性.Pellino蛋白的磷酸化、泛素化和SUMO化位点具有高度保守性,这也提示不同Pellino蛋白可能受到相似分子机制的调控.
1.3.4 转录调控
Pellino蛋白的另一个活性调控机制是基因表达调控.肝再生过程中Pellino1的信使RNA(messenger RNA,mRNA)的水平与微小RNA-21(microRNA-21,miR-21)的水平呈负相关,miR-21过表达显著抑制Pellino1表达,表明Pellino1是miR-21的靶标[18].在T细胞活化过程中,T细胞受体(T cell receptor,TCR)和共刺激分子CD28的作用下上调Pellino1表达[19].此外,脂多糖(lipopolysaccharide,LPS)刺激可诱导Pellino3表达,而自噬激活通过TLR4信号途径导致Pellino3泛素化降解[20].
2 Pellino蛋白的生物学功能
Pellino家族成员的序列和结构表现出高度同源性,各成员具有相似的生物学功能.Pellino蛋白通过靶蛋白泛素化参与IL-1R/TLR依赖的NF-κB和有丝分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路(图2)、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、核苷酸结合寡聚化结构域2(nucleotide-binding oligomerization domain 2,NOD2)信号通路以及T细胞活化等调控.
2.1 Pellino蛋白调控炎性反应信号转导
2.1.1 Pellino蛋白调控IL-1R/TLR依赖的NF-κB和MAPK信号转导
固有免疫系统利用独特的模式识别受体(pathogen recognition receptors,PRRs)识别外源性病原体相关分子(pathogen-associated molecular patterns,PAMPs).TLRs是PRRs的关键成员,其识别PAMPs后招募含TIR(Toll/IL-R)结构域的接头蛋白,包括髓样分化因子88(myeloid differentiation primary response protein 88,MyD88)和干扰素β(interferon β,IFN-β)TIR结构域衔接蛋白(TIR domain-containing adapter protein inducing IFN-β,TRIF).MyD88是TLRs所有成员(除TLR3外)共有的接头蛋白,而TRIF主要参与TLR3和TLR4介导的信号通路;TLR3直接招募TRIF,而TLR4以TRIF相关接头分子(TRIF-related adapter molecule,TARM)作为支架蛋白间接招募TRIF.IL-1受体(IL-1 receptor,IL-1R)/TLR信号途径通过激活下游NF-κB、MAPK等信号共同诱导促炎细胞因子和趋化因子的表达(图2).

TIRAP.TIR结构域的接头蛋白;Peli.Pellino蛋白;IRF7.IFN调节因子7;TAK1.转化生长因子β(transforming growth factor β,TGF-β)活化激酶1;TAB.TAK1结合蛋白;IAP2.细胞凋亡蛋白2抑制剂;JNK.Jun N-末端激酶;NEMO.NF-κB 必需调节剂;DEAF1.变形表皮自动调节因子1;TRAF3.TNF受体相关因子3;p38.丝裂原活化蛋白激酶;CREB.反应元件结合蛋白;ssRNA.单链RNA;IκB.NF-κB 抑制剂;AP1.转录因子激活蛋白1.
IL-1结合IL-1R后刺激Pellino1与IRAK4、IRAK1和TRAF6之间的相互作用,激活MyD88依赖的NF-κB信号和IL-8基因表达[5].TGF-β刺激下,Pellino1与Smad6或者Smad7相互作用,竞争性阻止IL-1β介导的IRAK1-Pellino1-TRAF6复合物形成,从而抑制IκB降解、NF-κB激活以及促炎因子表达[21-23].在LPS刺激下,Pellino1介导IRAK1、TBK1、TAK1和TRAF6的K63多聚泛素化,参与TLR2/4/NF-κB信号通路调控[24-25].敲低Pellino1可抑制炎性细胞因子、趋化因子和黏附分子的表达以及NF-κB RelA的转录活性[26].此外,小胶质细胞中Pellino1介导IAP2的K63多聚泛素化可增强其蛋白稳定性,激活的IAP2介导TRAF3的K48多聚泛素化导致其降解,从而解除TRAF3对MAPK的负调节[27-28].然而,Pellino1介导的NF-κB和MAPK信号转导仅限于免疫细胞,在非免疫性细胞中未发现相似的调控作用[29-32].
有研究表明,Pellino1通过介导受体相互作用蛋白1(receptor-interacting protein 1,RIP1)的K63多聚泛素化,招募TAK1和IKK复合物,促进IKK复合物的磷酸化激活,最终导致NF-κB的激活和促炎细胞因子的增加;敲除Pellino1能显著抑制TLR3/4配体对炎性细胞因子的诱导,并使小鼠对感染性休克具有更强的抵抗力[30].而另一项研究发现Pellino1缺失对聚肌胞苷酸(polyinosinic-polycytidylic acid,poly(I:C))诱导的RIP1泛素化、IKK和MAPK信号通路激活以及炎性细胞因子表达均没有影响[33].因此,Pellino1是否介导TRIF依赖的NF-κB和MAPK信号转导有待进一步明确.
在LPS刺激的RAW264.7细胞中,B细胞淋巴瘤10(B cell leukemia/lymphoma 10,BCL10)与TLR4结合,随后与Pellino2相互作用以激活NF-κB通路,但是Pellino2缺失并不能完全消除BCL10对NF-κB的激活作用,表明Pellino2部分参与BCL10激活NF-κB信号通路[34].另一项研究也发现,敲低Pellino2不能完全抑制IL-1和LPS诱导的炎症反应[11].此外,Pellino2过表达不能激活NF-κB信号转导,但可增强其下游基因的表达[6,25].这些研究表明,Pellino2在IL-1R/TLR依赖的NF-κB信号转导中的调控作用有待深入探讨.Pellino2是否调控IL-1R/TLR依赖的MAPK信号通路也存在争议.Pellino2与TRAF6和TAK1相互作用,介导其泛素化,从而激活MAPK信号通路,导致AP-1和Elk-1(Ets-like protein1)的活化[32].在Pellino2敲低的293细胞和巨噬细胞中,IL-1和LPS介导的JNK和胞外信号调节激酶(extracellular regulated protein kinase,ERK)磷酸化减弱[11].然而,在其他研究中发现,Pellino2缺失并不影响IL-1和LPS介导的MAPK信号通路的激活[16,35].由于序列和结构具有高度同源性,Pellino蛋白成员之间可能存在功能性代偿,导致Pellino2缺失细胞中MAPK信号通路变化不明显.
Pellino3b通过介导IRAK的K63多聚泛素化竞争性抑制K48多聚泛素化,增强IRAK蛋白稳定性,从而抑制MyD88、IRAK1和TAK1依赖性NF-κB通路[8,25,36].Pellino3b也可通过介导TBK1的泛素化,抑制由TRIF或TBK1过表达诱导的NF-κB激活[36].敲除Pellino3导致LPS依赖性炎性细胞因子IL-1β 的表达上调[20].这些研究表明Pellino3负向调节IL-1R/TLR依赖的NF-κB信号通路.此外,也有研究表明Pellino3正向调节IL-1R/TLR依赖的MAPK信号通路,Pellino3通过介导TRAF6和TAK1的泛素化,诱导c-Jun、JNK、p38和Elk-1的激活[7,37].在Pellino3敲减细胞中,IL-1诱导的MAPK信号通路激活被减弱[38].
2.1.2 Pellino蛋白调控TNF信号通路
TNF既可以激活NF-κB以诱导炎性和抗凋亡蛋白的表达,也可以触发caspase级联反应促进细胞凋亡.TNF与其受体TNFR1结合后,TNFR1发生多聚化并与细胞质中TNFR1相关死亡结构域蛋白(TNFR1-associated death domain protein,TRADD)相互作用,招募RIP1、TRAF2或TRAF5以及细胞凋亡抑制蛋白,形成复合物Ⅰ.TRAF2和IAP可导致RIP1的K63多聚泛素化以增强其稳定性,然后招募 IKK 复合物和TAK1,最终激活NF-κB和抗凋亡基因的表达.同时,NF-κB也会上调A20和肿瘤抑制因子CYLD的表达,对RIP1去泛素化以解除其激活NF-κB 的作用.此外,未泛素化的RIP1可以与TNFR1 分离,与Fas相关死亡域(Fas-associated death domain protein,FADD)蛋白相互作用,该蛋白反过来招募procaspase-8以形成细胞内信号传导复合物Ⅱ.复合物Ⅱ进而触发caspase-8的酶切加工和激活,启动caspase级联反应.更多细节和相关进展可参阅文献[39].
Pellino1是TNF-α介导的细胞死亡途径的关键调节剂,可以促进坏死性凋亡而抑制细胞凋亡.一方面,Pellino1介导受体相互作用蛋白激酶1(receptor-interacting protein kinase 1,RIPK1)的K63多聚泛素化,增强其与RIPK3的结合以促进RIPK3和MLKL(mixed lineage kinase domain-like protein)的激活,从而诱导细胞坏死性凋亡;另一方面,Pellino1的缺失通过上调c-Myc的表达和下调caspase-8抑制分子c-FLIP(cellular FLICE inhibitory protein)的表达,使细胞对TNF-α诱导的RIPK1依赖性和RIPK1非依赖性细胞凋亡更敏感[40].敲减Pellino1也导致TNF刺激下NF-κB RelA(p65)的转录活性及其下游促炎细胞因子、趋化因子和黏附分子的表达下调[26].另一项研究发现,TNF-α刺激的293T或宫颈癌HeLa细胞中,Pellino1可介导RIP3的K48多聚泛素化,导致其降解并抑制细胞死亡[41].这些研究说明Pellino1在不同的细胞背景中参与调控TNF信号转导的分子机制存在差异.
Pellino3也可以介导RIP1的泛素化,进而激活TNF诱导的复合物Ⅰ介导的NF-κB信号通路,发挥促炎抗凋亡作用以促进细胞存活;同时抑制TNF诱导的复合物Ⅱ形成,抑制caspase-8介导的细胞凋亡[42].
2.1.3 Pellino2调控炎性小体信号通路
炎性小体是一种由NOD样受体热蛋白结构域相关蛋白(NOD-like receptor thermal protein domain associated protein,NLRP)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)和半胱天冬酶-1前体(pro-cysteinyl aspartate specific proteinase-1,pro-caspase-1)组成的胞浆多蛋白复合物,能被多种病原相关分子模式或损伤相关分子模式激活.NLRP3炎性小体将接头蛋白ASC和caspase-1募集到寡聚复合物中,导致pro-caspase-1自动蛋白水解加工成活性形式,将pro-IL-1β和pro-IL-18切割为成熟的分泌形式,引发炎性反应和细胞焦亡.研究证实 Pellino2的FHA和RING结构域通过促进NLRP3的K63泛素化来促进NLRP3激活,介导LPS刺激下成熟IL-1β蛋白的产生;Pellino2缺陷小鼠的骨髓细胞在TLR启动、NLRP3 刺激和细菌攻击时,NLRP3的激活受损,对LPS刺激也有很强的耐受性;此外,Pellino2 还可通过泛素化IRAK1解除IRAK1对NLRP3的抑制作用[35].
2.2 Pellino蛋白参与免疫反应调节
2.2.1 Pellino蛋白调控IFN-Ⅰ的表达
IRF是调控IFN基因表达的关键转录因子,在抗感染免疫中发挥重要作用.小鼠胚胎成纤维细胞中Pellino1缺失不影响TLR3/4诱导的IKKε激活和IFN-β表达,提示Pellino1不参与调控TRIF依赖的IRF3激活和随后的IFN-β表达[30].然而,在病毒双链RNA的刺激下,Pellino1敲除小鼠的骨髓细胞和成纤维细胞中IFN-β表达下调,IRF3与IFN-β基因启动子的相互作用受损,表明Pellino1对病毒感染等因素刺激下的IFN-β基因表达具有重要调控作用[33].进一步研究证实Pellino1与转录因子DEAF1同源物存在相互作用,两者促进IRF3与IFN-β启动子的结合,促进IFN-β的转录[43].研究发现Pellino2 缺陷的树突状细胞经TLR9 激活后,小鼠IFN-Ⅰ的产生受损[44].
Pellino3通过两种途径参与IFN-Ⅰ的表达调控:1)介导TRAF6的泛素化,抑制其结合并磷酸化激活IRF7,导致IFN-Ⅰ表达下调[4];2)巨噬细胞中LPS激活TLR4后,TRIF依赖的信号级联将TRAF3、TANK、TBK1组装成复合体,进而磷酸化IRF3,磷酸化的IRF3易位到细胞核中,与其反应元件结合并激活IFN-β和IP-10基因的转录.当巨噬细胞中加入氧化型低密度脂蛋白后,上调的Pellino3通过介导TANK的单泛素化,抑制TANK依赖性TBK1招募以及下游信号传导,从而抑制IFN-β表达[45].
2.2.2 Pellino1调控T细胞活化
T细胞活化需要两个信号刺激,即TCR和共刺激信号分子(如CD28).T细胞中TCR和CD28的共刺激信号招募IKK复合物,催化IκB蛋白的磷酸化,导致其降解以及NF-κB家族Rel亚基的释放,游离c-Rel 易位至细胞核中增强CD28效应分子的转录(如IL-2),从而驱动T细胞的活化和增殖[38].
Pellino1在B细胞和T细胞中高表达,其敲除导致T细胞过度活化,并使T 细胞难以被调节性T细胞和TGF-β抑制[19].Pellino1作为T细胞活化的关键负调节因子可缓解自身免疫,Pellino1敲除小鼠可自发地发生以多器官炎症和自身抗体产生为特征的自身免疫疾病[19].TCR和CD28的共刺激信号增强Pellino1表达,后者通过介导c-Rel K48泛素化导致其降解,抑制细胞因子(如IL-2)表达,最终导致一种与外周T细胞耐受相关的效应称“T细胞无能”[19].此外,有研究发现Pellino1通过介导c-Rel的泛素化调控滤泡辅助性T(T follicular helper,Tfh)细胞的生成和功能.miR-155通过靶向抑制Pellino1的表达,进而抑制NF-κB家族转录因子c-Rel的降解,抑制Tfh细胞增殖和CD4+T细胞上的CD40配体表达[46].
2.2.3 Pellino3调控NOD2信号通路
Pellino3是NOD2信号通路的重要调控因子,通过介导激酶RIP2的泛素化参与肠道炎症反应[47]:细菌侵入肠上皮细胞产生肽聚糖衍生肽(如胞壁酰二肽),触发NOD2 的寡聚化,活化的NOD2招募蛋白激酶RIP2.Pellino3通过FHA结构域与RIP2相互作用并介导其K63多聚泛素化,促使TAK1和IKK复合物的共同招募,激活IKK和下游NF-κB 信号通路.TAK1还可以激活MAPK信号通路(p38、JNK和ERK),从而激活AP-1等转录因子,与NF-κB协同诱导细胞因子、趋化因子和杀菌肽的表达.
2.3 Pellino蛋白参与其他信号通路调控
DNA双链断裂(DNA double-strand break,DSB)和重组修复对于维持基因组完整性至关重要.DSB触发DNA损伤反应信号,激活DNA损伤修复和细胞周期检测点机制.多项研究证实Pellino1参与DNA损伤修复信号通路的调控:DNA损伤传感蛋白激酶ATM(ataxia-telangiectasia mutated gene)招募并磷酸化Pellino1到DSB位点,磷酸化组蛋白H2AX促使Pellino1与NBS1(Nijmegen breakage syndrome 1)相互作用并介导其发生K63泛素化,导致ATM的进一步激活,从而加强DNA末端切除和重组修复;DNA损伤后也激活p53信号通路及其靶基因p21的转录,形成细胞周期G1检查点,以减少受损DNA的复制和积累[48].另一项研究发现,Pellino1通过FHA结构域与磷酸化的p53相互作用介导其转录活化[49].Pellino1也可以通过与p53抑制蛋白Mdmx相互作用介导其泛素化,从而抑制其细胞核易位,解除其对p53的抑制作用[50].
此外,Pellino1也参与G蛋白偶联受体信号转导的调控.骨架蛋白β-arrestin-1被证实是一个新的糖皮质激素受体(glucocorticoid receptor,GR)互作蛋白,敲低后促进Pellino1表达;Pellino1与GR相互作用并介导其泛素化降解,改变糖皮质激素信号传导[51].
3 Pellino蛋白与疾病
3.1 Pellino蛋白与炎症及免疫疾病
Pellino1是TLR信号转导和炎症反应的重要调控因子,与炎症及免疫疾病密切相关.鼻病毒(rhinovirus,RV)是慢性阻塞性肺疾病恶化的主要原因,其感染的支气管上皮细胞中Pellino1表达增加,导致致炎因子表达失调,炎症反应增强[52].敲除Pellino1可抑制RV诱导的固有免疫细胞因子如C-X-C基序趋化因子配体8(C-X-C motif chemokine ligand 8,CXCL8)的产生,减轻呼吸道病毒引起的气道炎症.该过程受到TLR3的调控,不依赖于IRAK1,因此不影响抗病毒的IFN表达[29].在慢性细菌性支气管炎中,Pellino1也呈现高表达[53-54].
Pellino1介导小胶质细胞中趋化因子和促炎细胞因子的产生,并促进T细胞和巨噬细胞浸润到中枢神经系统,抑制Pellino1对神经炎症[55-56]、脑损伤[57]以及酪氨酸血症相关神经系统疾病[58]具有治疗作用.同时,Pellino1还促进巨噬细胞和树突状细胞中的抗病毒先天免疫反应,负调控T细胞中IFN-γ的表达.Pellino1的缺失诱导小胶质细胞中IFN-β的表达,对致命的西尼罗河病毒感染具有更强的抵抗力[59-60].此外,在自身免疫性脑脊髓炎和蛛网膜下腔出血(subarachnoid hemorrhage,SAH)后的早期脑损伤中也发现Pellino1的高表达[61-62].SAH刺激TLR4信号,表达上调的Pellino1介导凋亡抑制蛋白cIAP1/2的激活,正向调节MyD88依赖性的MAPK信号通路,从而激活促凋亡信号[63].Pellino1通过介导CCAAT/增强子结合蛋白(CCAAT/enhancer-binding protein,C/EBPβ)泛素化降解,降低C/EBPβ的蛋白水平和 CD36 的表达,从而抑制小胶质细胞对淀粉样蛋白-β的吞噬能力,表明靶向Pellino1用于治疗小胶质细胞介导的神经系统疾病很有前景[64].
系统性红斑狼疮(systemic lupus erythematosus,SLE)的标志是B细胞不受控制地产生对核抗原(如双链DNA和染色质)具有特异性的自身抗体,导致免疫复合物的形成和沉积,从而造成组织损伤.研究发现Pellino1水平与SLE的严重程度呈负相关,敲除Pellino1会导致B细胞增殖及自身抗体的产生,加重SLE病情[65-66].Pellino1与NF-κB诱导激酶(NF-κB inducing kinase,NIK)作用并介导NIK的K48泛素化和降解,从而负调节非经典NF-κB信号传导,抑制浆细胞及抗体的产生,减缓SLE的发病进程[67-68].
目前对Pellino2在炎症及免疫疾病中的研究十分有限.在以严重肺部炎症或损伤为特征的急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)模型中,Pellino2蛋白表达显著增强,miR-802通过下调Pellino2表达对LPS诱导的急性肺损伤起到保护作用,提示miR-802/Pellino2信号轴可作为治疗ARDS的潜在药物靶标[69].此外,有研究表明,Pellino2受HOXA13(Homeo-box gene A13)调控,可能介导女性绝经后骨质疏松症伴肾阴虚疾病的发生[70].
Pellino3 在克罗恩病患者的结肠中低表达,敲除Pellino3可加重小鼠结肠炎模型.Pellino3通过泛素化RIP2介导NOD2诱导的NF-κB和MAPK信号通路激活,在结肠炎中发挥保护作用[46].肥胖引起的慢性炎症会增加溃疡性结肠炎、克罗恩病和结直肠癌的风险.一项饮食诱导的肥胖小鼠结肠基因组学研究中发现,Pellino3与肥胖诱导的结肠病变相关,是肥胖相关结肠疾病早期的潜在生物标志物[71].
3.2 Pellino蛋白与心脏疾病
近年来,研究发现Pellino1在心脏功能维持和应激中发挥重要调控作用:1)心肌梗死(myocardial infarction,MI)造成局部缺氧,导致心肌细胞内Pellino1表达增强;Pellino1通过介导RIP1和 TRAF6泛素化、激活NF-κB及其下游炎性细胞因子的表达,导致心肌中炎症细胞浸润;敲除Pellino1可改善MI引起的心脏功能障碍,包括疤痕大小和胶原蛋白沉积等,表明Pellino1在MI的发病机制中起重要作用,靶向Pellino1可改善MI后的心脏功能障碍和重塑[72].2)心脏成纤维细胞的活化是导致心脏纤维化进程中心力衰竭的关键事件.在超负荷压力下的大鼠心脏以及暴露于机械拉伸的大鼠心脏成纤维细胞中,Pellino1的表达增强;Pellino1介导TRAF6和RIP1的泛素化,激活NF-κB、p38和AP-1,从而增强NF-κB和AP-1与TGF-β1基因启动子区域的结合,促进TGF-β1的表达,引发心脏成纤维细胞的激活和增殖[73].3)肌醇需求酶1α(inositol-requiring enzyme 1α,IRE1α)是一种内质网应激传感器,被TLR激活可导致心脏微血管损伤.Pellino1在糖尿病小鼠的心脏内皮细胞和晚期糖基化终末产物处理的心脏微血管内皮细胞中均显著上调,通过RING结构域与热休克蛋白Hsp90结合以激活IRE1α,导致心脏微血管损伤;小鼠心脏内皮细胞中敲除Pellino1可改善糖尿病诱导的心脏微血管通透性,促进微血管再生,抑制细胞凋亡,并减少有害的心脏重塑[74].以上研究提示,Pellino1蛋白的表达异常可能参与心脏疾病的发生发展.
3.3 Pellino蛋白与肥胖
Pellino1介导肥胖诱导的葡萄糖耐受.IRF5是巨噬细胞M1型极化的关键转录因子,通过调节巨噬细胞参与肥胖诱导的胰岛素抵抗[75]:与正常个体相比,肥胖人群脂肪组织中巨噬细胞内的IRF5转录活性和Pellino1表达增强,这些变化与胰岛素抵抗相关.Pellino1与IRF5相互作用并介导其K63泛素化,导致IRF5的细胞核易位和转录活性增强,从而促进巨噬细胞M1型极化.敲除Pellino1将导致M1型巨噬细胞极化受损,可以改善高脂饮食小鼠的葡萄糖耐受不良状况[76].最新一项研究也证实,TGF-β1上调Pellino1的表达,促进IRF5细胞核易位,促进巨噬细胞M1型极化,加重急性肺损伤[77].
Pellino3在肥胖个体的脂肪组织和高脂饮食并显示胰岛素耐受的小鼠脂肪组织中呈低表达,其缺失引发更严重的炎症和胰岛素耐受[78]:脂肪组织中M1型巨噬细胞在各种刺激(LPS、棕榈酸酯和缺氧)下激活TRAF6,通过NF-κB信号通路诱导炎症发生.同时作为E3,TRAF6介导缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)发生K63多聚泛素化以增强其蛋白稳定性,促进IL-1β的表达,从而引发胰岛素耐受.Pellino3介导TARF6发生泛素化,抑制其与HIF-1α的相互作用,导致HIF-1α泛素化水平下调和蛋白降解,最终抑制IL-1β的表达并减轻胰岛素耐受.高脂肪饮食诱导的Pellino3缺陷小鼠表现出严重的炎症、肝脏脂肪变性、IL-1β表达上调及胰岛素抵抗.
3.4 Pellino蛋白与肿瘤发生发展
Pellino1在肿瘤发生发展的过程中扮演着促癌因子的角色.在淋巴瘤中,Pellino1表达水平与致癌基因MYC、BCL6、BCL2和MUM1(multiple myeloma oncogene 1)等表达呈正相关,也与弥散性大B细胞淋巴瘤的恶性程度和不良预后密切相关[79].机制研究表明Pellino1直接与BCL6相互作用并介导其发生K63多聚泛素化,从而稳定BCL6促进淋巴瘤发生[80].Pellino1在肺癌中也呈异常高表达,促使肿瘤细胞对抗癌药物顺铂和紫杉醇产生耐受;Pellino1过表达增强细胞凋亡抑制分子cIAP2的表达,并直接结合和介导cIAP2发生K63多聚泛素化,增强其蛋白稳定性,促进肺癌的发生[81].此外,Pellino1通过磷脂酰肌醇3激酶/蛋白激酶B(phosphoinositide 3-kinase/protein kinase B,PI3K/Akt)和ERK信号通路促进肺腺癌细胞的增殖和存活;介导Snail和Slug的K63多聚泛素化而稳定这些蛋白分子,调控肺腺癌细胞的上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT),增强肺癌细胞的迁移和侵袭能力[82].抵抗霉素可通过抑制Pellino1并诱导Snail和Slug的降解减轻三阴性乳腺癌的EMT[83].Pellino1通过激活乳头状甲状腺癌中的PI3K/Akt通路促进细胞增殖和迁移[84].
p53是重要的肿瘤抑制因子,其抑制分子Mdmx与p53蛋白相互作用抑制其转录活性.体外和体内研究均证实Pellino1结合并介导Mdmx的泛素化,促进Mdmx的细胞质定位,进而导致p53激活.敲除Pellino1诱导Mdmx的核易位并抑制p53活性,且加速致癌因子Myc诱导的小鼠肿瘤发生[50].染色体非整倍性是癌细胞的重要特征,而在正常细胞中存在有丝分裂纺锤体检查点机制以确保细胞分裂过程中染色体正确分离.Pellino1与BubR1(有丝分裂纺锤体检查点的关键组成部分)相互作用,通过泛素化诱导其降解,抑制有丝分裂纺锤体检查点的正常功能,从而有助于肿瘤染色体非整倍体的发生和发展[85].这些研究表明Pellino1可能是癌症的潜在治疗靶点.然而,也有研究发现Pellino1通过肿瘤微环境中的巨噬细胞极化抑制肿瘤发生发展:M2型巨噬细胞分泌抗炎因子以减少炎症反应,具有抗肿瘤作用;Pellino1介导IRAK1的K63多聚泛素化而增加其蛋白稳定性,促使IRAK1磷酸化激活信号转导及转录激活因子1(signal transduction and activator of transcription 1,STAT1),从而抑制IL-10诱导的巨噬细胞M2c型极化,抑制体内肿瘤生长[86].
Pellino2在胃癌中呈现高表达,通过增强血管内皮生长因子C的表达促进胃癌细胞的增殖、迁移和侵袭[87].然而,其具体的分子调控机制有待进一步探讨.
Pellino3也参与肿瘤发生发展的调控.Pellino3在非小细胞肺癌(non-small cell lung cancer,NSCLC)中异常高表达,且与不良预后正相关,敲减Pellino3在体内和体外均抑制NSCLC的增殖、迁移和侵袭[88].而在卵巢癌中,Pellino3的mRNA水平在卵巢癌患者血清中呈低表达,可作为生物标志物用于区分卵巢癌、良性肿块和正常对照[89].
综上,Pellino蛋白通过靶蛋白泛素化参与NF-κB、MAPK、TNF和NOD2信号通路调控,介导自身免疫、炎症、癌症、心脏疾病及肥胖等疾病的发生发展(表1).
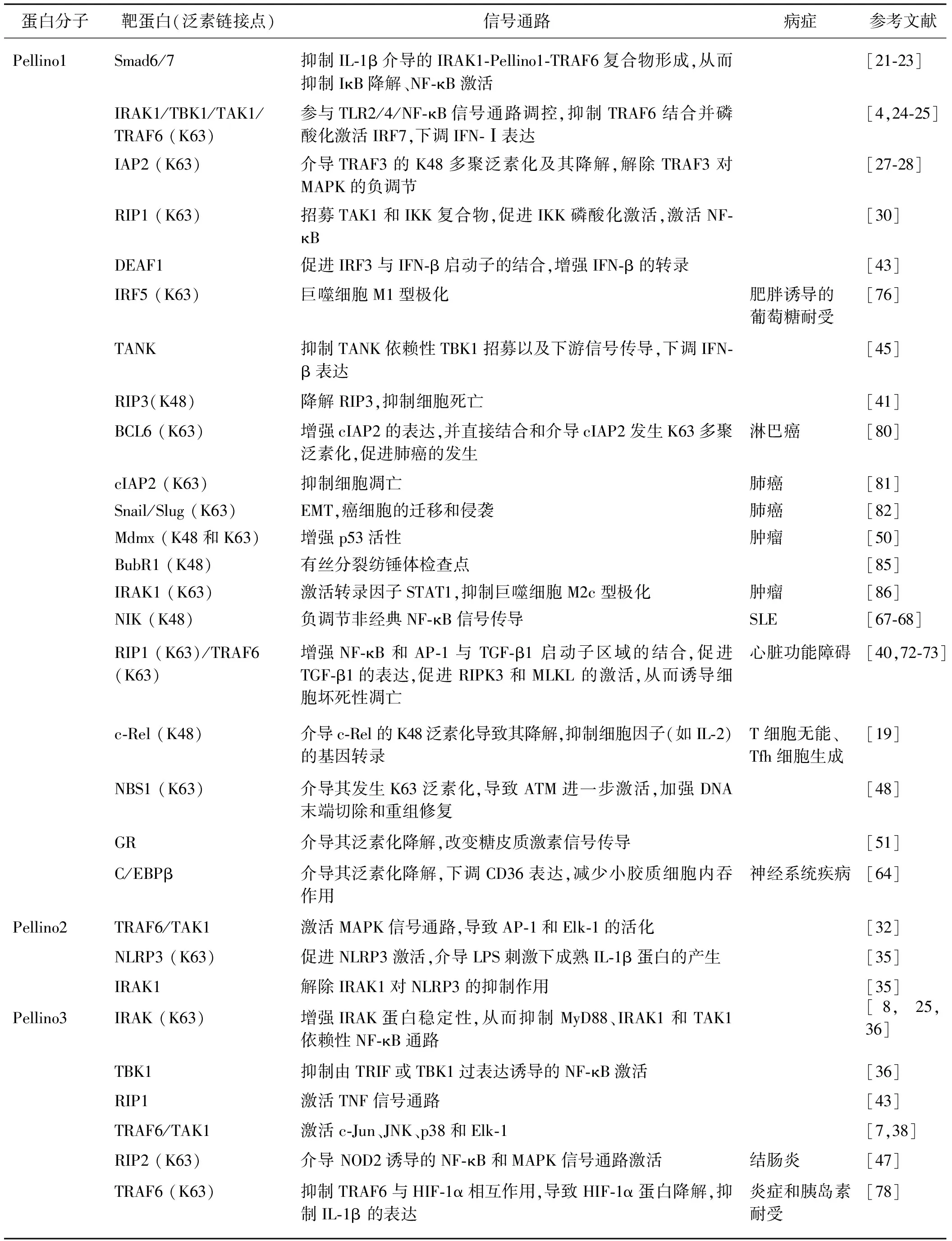
表1 Pellino蛋白通过靶蛋白泛素化介导信号转导和疾病发生发展
4 展 望
自Pellino蛋白被发现以来,人们对这个进化保守的E3的生物学功能认识还十分不足.基于Pellino蛋白的广泛表达,其生物学功能可能不局限于炎症和免疫调节.Pellino蛋白在免疫相关疾病中异常表达,虽然调控其表达的分子机制尚不明确,但是目前研究已表明Pellino蛋白是多种疾病的潜在药物靶标.
由于各成员的序列和结构具有高度同源性,且目前已发现Pellino蛋白在信号转导和分子调控机制上有许多交叉,各成员之间如何调配以介导靶蛋白的泛素化及相关信号通路的调控,成员之间是否存在功能性代偿,这些问题还有待深入探讨.基因编辑技术和小鼠组织特异性敲除技术的发展,将大大推动Pellino蛋白的生物学功能研究.
