大蒜果聚糖的水解方法及其定量分析
2022-05-20王启璋钟启文
田 洁 王启璋 钟启文
(1 青海大学农林科学院/青海省蔬菜遗传与生理重点实验室,青海 西宁 810016;2 省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 810016)
果聚糖由蔗糖与一个或多个果糖基线性或分支型通过β-1,2-糖苷键聚合而成,是一种水溶性的非还原性多糖,其相对分子质量变化范围为3 500~5 500[1]。 果聚糖味甜、热量低,具有调节血糖血脂、改善肠道菌群等功能,目前已被多个国家批准为食品和营养增补剂[2-4]。
大蒜(AlliumsativumL.)又名蒜、胡蒜,为百合科葱属植物,是重要的经济作物[5-6]。我国作为最主要的大蒜生产国,其大蒜种植面积、产量及出口额均位居世界之首[7-8]。研究表明,大蒜果聚糖占其干物质含量的75%~80%,很大程度上影响着大蒜产品的口感,是收获期大蒜产品的重要品质参数。大蒜中的果聚糖以聚合度为2~9的低聚果糖为主,包括蔗果三糖、蔗果四糖、新蔗果三糖等[9-10]。大蒜中的低聚果糖能够促进肠道双歧杆菌增殖、抑制肠道有害细菌生长,具有很高的药用价值和保健功能[11]。因此,果聚糖含量成为影响大蒜风味形成及药理作用的重要指标,对其检测方法的探索需沿着灵敏准确、快速稳定的方向发展。
目前测定植物果聚糖含量的方法主要包括比色法、试剂盒酶解法、高效液相色谱法(high performance liquid chromatography,HPLC)及离子色谱法[12-15]等。但比色法对于组分复杂的果聚糖检测准确度不高;试剂盒酶解法价格昂贵且操作步骤复杂;离子色谱法检测成本高;HPLC已成为应用最广泛的果聚糖检测方法,如利用HPLC法能够测定烟草中单糖或二糖含量[16]、菊芋中聚合度≤5的果聚糖含量[17]以及大蒜中菊糖和聚合度≤4的果聚糖含量[18]。但这些检测均受到果聚糖标准品的限制,并未测定聚合度>5的果聚糖含量,无法计算果聚糖总含量。因此,为建立一种快速、经济、高效的大蒜果聚糖总含量测定方法,本试验利用强酸将不同聚合度的多种大蒜果聚糖彻底水解,在对总糖的提取方法、果聚糖的水解试剂、水解浓度、水解时间和温度进行单因素试验筛选的基础上,采用响应面法优化最佳降解工艺,对比不同检测方法,并通过方法学验证和品种差异比较,以期确立适宜的果聚糖总量检测体系。
1 材料与方法
1.1 材料、试剂与仪器
供试品种乐都紫皮大蒜及其他10份大蒜资源均取自青海省农林科学院园艺所资源圃,按照常规方法种植及田间管理。选取新鲜、大小一致的乐都紫皮大蒜鳞茎,经蒸馏水清洗后用滤纸擦干,切片,105℃杀青15 min,80℃烘干,粉碎,过40目筛备用。
蔗糖、D-无水葡萄糖、D-果糖的标准品,北京索莱宝科技有限公司;果聚糖标准品,东京化成工业株式会社;盐酸(HCl)、浓硫酸(H2SO4)、三氯乙酸(TCA)、乙醇、氢氧化钠(NaOH),均为分析纯,天津北辰方正试剂厂。
LC-20A液相色谱仪,日本岛津公司;Specord 210 Plus紫外可见分光光度计,德国耶拿分析仪器股份公司;Milli-Q IQ 7000 超纯水仪,美国Millipore公司;HH-600数显恒温水浴锅,江苏金坛大地自动化仪器厂。
1.2 试验方法
1.2.1 大蒜可溶性总糖提取方法的确定 在4种提取方法下,分别精确称取1.0 g大蒜鳞茎干样,每种提取方法设3份重复,共计12份样品。参考宋可珂等[19]和闫训友等[20]的方法按照以下4种方法提取大蒜可溶性总糖。① 热水提取法:分别在3份鳞茎干样中加入10 mL双蒸水,沸水(94℃,西宁,海拔2 261 m)提取30 min,浸提、离心重复3次,合并3次上清液定容至100 mL;② 超声波提取法:分别在3份鳞茎干样中加入25 mL双蒸水,500 W超声波下提取15 min,提取温度为60℃,间歇提取3次,离心合并上清液定容至100 mL;③ 超声波-热水提取法:分别在3份鳞茎干样中加入25 mL双蒸水,500 W超声波下提取15 min,提取温度为60℃,超声波间歇提取2次后,沸水提取30 min,离心合并上清液定容至100 mL;④ 乙醇提取法:分别在3份鳞茎干样中加入12 mL 80%乙醇,80℃水浴30 min,溶液冷却至室温后,离心取上清液转入容量瓶,再向沉淀中加入12 mL 80%乙醇溶液,80℃水浴30 min,重复提取2次,合并上清液定容至100 mL。采用蒽酮比色法测定可溶性总糖含量[21],确定最佳提取方法。
1.2.2 大蒜果聚糖的水解方法及试验设计 精确称取0.84 g大蒜鳞茎干样3份,分别加入17.4 mL双蒸水。在样品提取液中,加入1 mL 3 mol·L-1的HCl。然后利用1.2.1筛选出的最佳方法提取大蒜可溶性总糖并水解果聚糖,水解1 h,冷却至室温后,加入1 mL 3 mol·L-1的NaOH及0.6 mL 8.75 mmol·L-1的 Al2(SO4)3溶液平衡pH值,定容至20 mL。以不加强酸未水解的样品作为对照。反应物过0.2 μm微孔滤膜,作为下一步检测的样品。①单因素试验设计:在 3 mol·L-1HCl煮沸1 h的恒定条件下,以水解试剂类型(HCl、H2SO4和TCA)、水解试剂pH值(pH值0.1、1、2、4)、HCl浓度(1、3、6、9 mol·L-1)、水解时间(0.5、1、2、4 h)和水解温度(60、70、80℃和沸水)5个影响大蒜果聚糖水解效果的因素做单因素试验,重复3 次,确定各因素适宜范围。②响应面优化试验方案:基于单因素试验结果,固定水解试剂类型、水解pH,选取水解温度、水解试剂浓度和水解时间为主要因素。根据 Box-Behnken 响应面法试验设计原理及Design-Expert 12软件建立二次多项式数学模型,以水解温度(A)、水解试剂pH(B)和水解时间(C)为响应变量,以大蒜中果聚糖含量为响应值,采用三因素三水平的响应面中心组合法对大蒜中果聚糖提取工艺的主要参数进行分析优化。
1.3 大蒜果聚糖检测方法的研究
强酸水解-高效液相色谱法:经强酸试剂水解后的及未反应的样品,通过HPLC法测定大蒜果聚糖的含量。测定条件:Shodex SUGAR KS-801串KS-802色谱柱,示差检测器RID-10A,柱温80℃,进样量10 μL;流动相为超纯水,流速1 mL·min-1。通过蔗糖、葡萄糖、果糖标准品及外标法进行蔗糖、葡萄糖及果糖的定量分析,以mg·g-1DW来表示。按照以下公式计算果聚糖含量(mg·g-1DW):
果聚糖含量=(S1+G1+F1)-(S0+G0+F0)
式中,S1为水解后蔗糖含量;G1为水解后葡萄糖含量;F1为水解后果糖含量;S0为水解前蔗糖含量;G0为水解前葡萄糖含量;F0为水解前果糖含量。
强酸水解-分光光度计法:参照侯大海等[12]的方法测定果聚糖含量。
1.4 大蒜果聚糖含量测定方法的评价
对筛选得到的果聚糖含量测定方法进行评价,考察该方法的精密度、重复性、稳定性及回收率[22-23]。精确称取一定质量的果聚糖标准品及大蒜样品,按照筛选确立的方法分别测定标准品及样品中果聚糖含量,重复6次,根据所得结果计算相对标准偏差(relative standard deviation,RSD),考察该测定方法的精密度及重复性。取精密度试验中的待测样品,室温放置0、1、2、4、8 h后测定果聚糖含量并计算RSD,判断该测定方法的稳定性。分别对相同质量的大蒜样品添加0.2、0.3、0.4 g的果聚糖标准品,每个添加水平3次重复,进行加标回收率的测定。
1.5 数据处理
采用SPSS 16.0、Design-Expert 12和SigmaPlot 10.0软件进行试验数据处理及作图。
2 结果与分析
2.1 不同提取方法对大蒜可溶性总糖含量的影响
由表1可知,通过不同方法提取的大蒜可溶性总糖含量存在差异。热水提取法所得大蒜总糖含量达72.67 mg·100mg-1DW,显著高于其他方法,其次为超声波法和超声波-热水法,二者之间无显著差异性。乙醇提取法所得大蒜总糖仅为17.40 mg·100mg-1DW。以提取总糖含量为参照,4种方式的提取效率大小关系为热水法>超声波法>超声波-热水法>乙醇法。热水法的提取效率明显高于其他方法,这可能是由提取温度差异引起的。为了避免乙醇挥发、减小超声过程中的局部高温高压[24],本研究中,超声波法、超声波-热水法以及乙醇法的提取温度分别为60℃、60℃和80℃,使得大蒜总糖未能充分溶解在溶剂中。因此,热水提取法是大蒜可溶性总糖的最佳提取方法。
2.2 不同水解条件对大蒜果聚糖降解效果的影响
2.2.1 水解前后大蒜糖组分的HPLC分析及其标准曲线建立 可溶性糖标准品的色谱图如图1所示。果聚糖总量的检测由于受到高聚果糖标准品纯度、成本以及仪器灵敏度的限制,通常无法准确测定。为了避免高聚果糖的影响,本研究利用强酸将大蒜可溶性总糖彻底水解,降解大蒜果聚糖组分,并利用HPLC法分析,果聚糖水解前后的检测结果见图2。在果聚糖水解前,通过可溶性糖标准品的比对,检测到少量的蔗糖、葡萄糖及果糖(图2-A);而利用强酸进行水解后,葡萄糖及果糖含量增加,其中果糖的峰面积增加最明显(图2-B),这是因为果聚糖β-1,2-糖苷键的断裂释放了大量果糖基导致果糖含量明显升高。

表1 不同提取方法下大蒜可溶性总糖含量差异Table 1 Differences in total sugar content of garlic in different extraction methods
在HPLC检测体系下,分别将0、0.25、0.5、0.75、1、1.25和1.5 mg·mL-1的蔗糖、葡萄糖及果糖标准溶液进样分析,根据峰面积与标准物质含量进行线性回归,结果见表2。蔗糖、葡萄糖及果糖标准品的线性关系良好,决定系数均达到0.999以上,可以用于下一步大蒜果聚糖水解产物的含量检测。
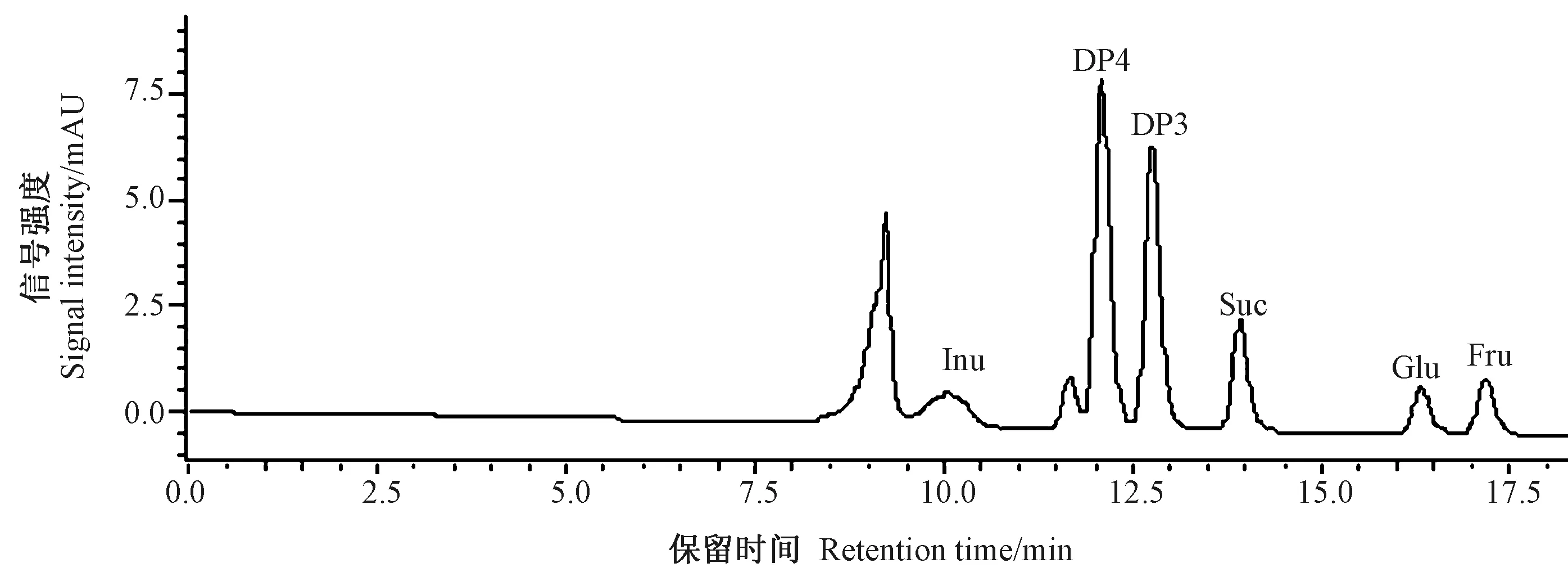
注:Suc:蔗糖;Glu:葡萄糖;Fru:果糖;Inu:菊糖;DP4:蔗果四糖;DP3:1-蔗果三糖。Note: Suc: Sucrose. Glu: Glucose. Fru: Fructose. Inu: Synanthrin. DP4: Nystose. DP3: 1-Kestose.图1 可溶性糖混合标准品HPLC色谱图Fig.1 HPLC chromatogram of standard mixture of soluble sugar
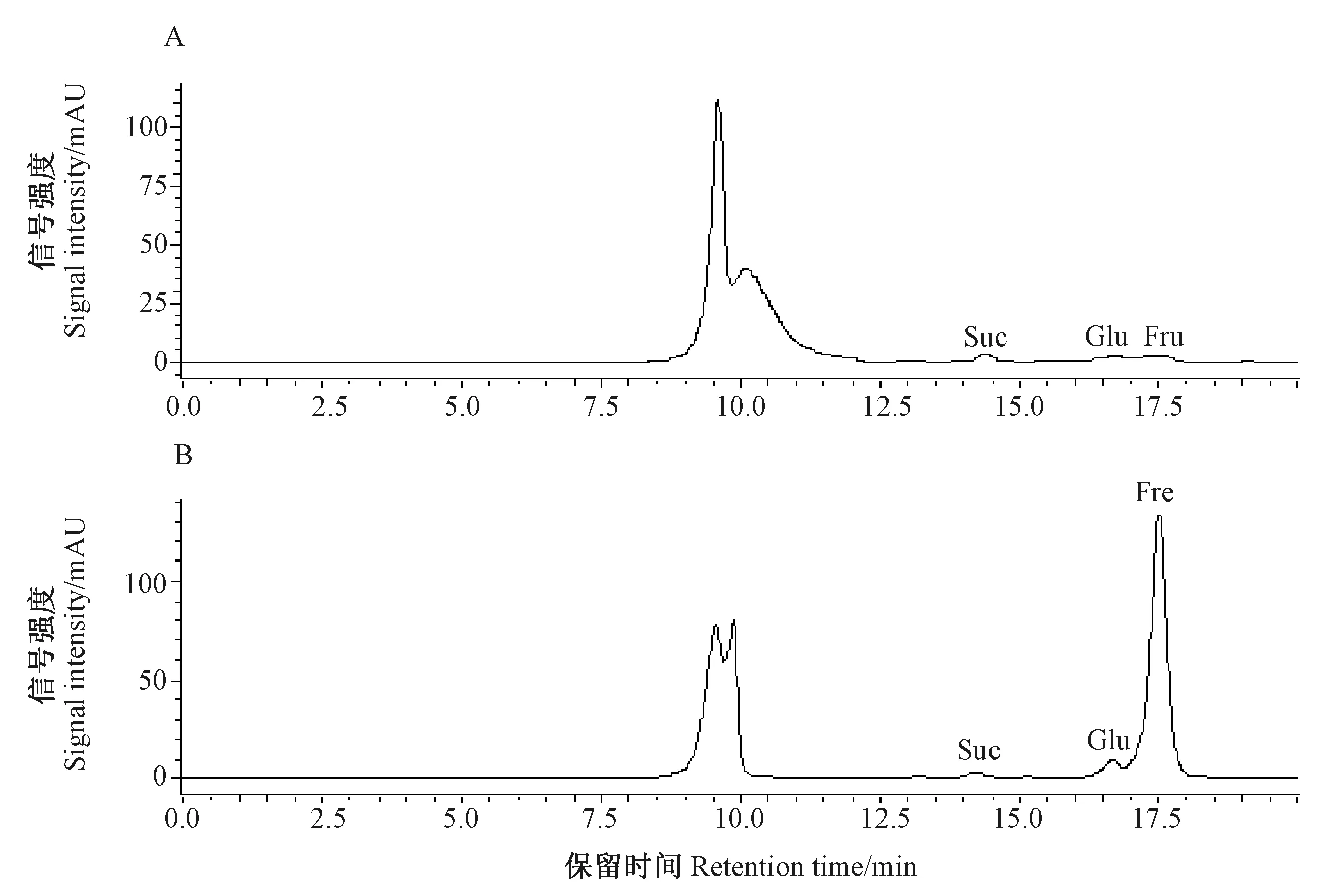
注:A:水解前;B:水解后。Suc:蔗糖;Glu:葡萄糖;Fru:果糖。Note: A: Before hydrolysis. B: After hydrolysis. Suc: Sucrose. Glu: Glucose. Fru: Fructose.图2 大蒜果聚糖水解前后HPLC色谱图Fig.2 HPLC chromatogram of fructan in garlic before and after hydrolysis
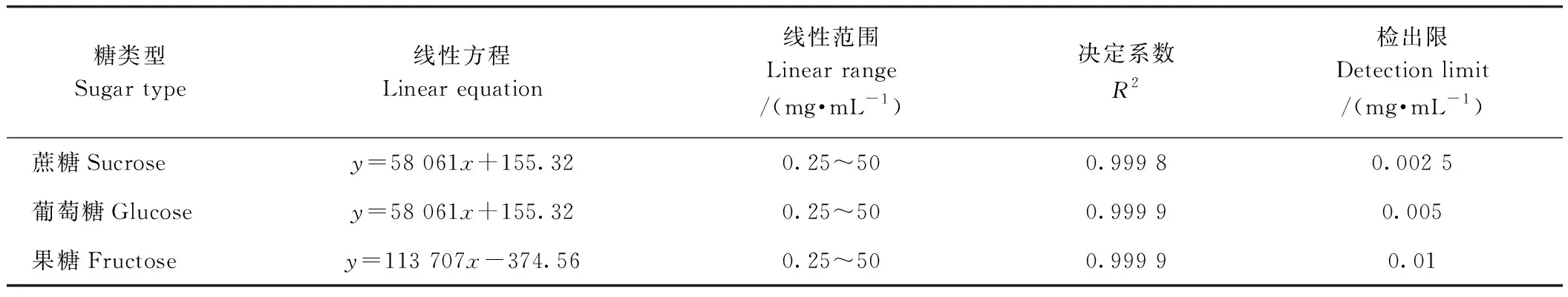
表2 蔗糖、葡萄糖和果糖标准品的标准曲线回归方程Table 2 Regression equation of standard curve for standard sucrose, glucose and fructose
2.2.2 不同水解试剂对大蒜果聚糖含量的影响 为了确定水解果聚糖的最适强酸类型,以相同H+浓度的3种强酸作为水解试剂,通过水解前后蔗糖、葡萄糖及果糖的含量差值即可推算大蒜果聚糖的总含量,结果见表3。利用HCl、H2SO4和TCA水解大蒜可溶性碳水化合物,测得的果聚糖含量分别为641.22、649.10

表3 不同酸水解大蒜果聚糖含量的差异Table 3 The difference of the content of fructan in garlic hydrolyzed by different acids
和649.07 mg·g-1DW,三者无显著差异,说明强酸类型不是影响大蒜果聚糖水解的主要因素。考虑到H2SO4脱水性对果糖的破坏以及TCA对植物多糖水解的选择性,故筛选出HCl作为大蒜果聚糖的水解试剂。
2.2.3 不同pH值对大蒜果聚糖含量的影响 根据2.2.2的结果及3种强酸不同的理化性质,选择HCl作为水解试剂进行下一步研究。分别在pH值0.1、1、2、4的HCl下煮沸1 h。由图3可知,随着盐酸pH值升高,大蒜果聚糖含量逐渐降低。pH值为0.1时,果聚糖含量最高(589.80 mg·g-1DW),显著高于其他pH值条件下的果聚糖含量。这说明盐酸pH的降低加速了大蒜果聚糖的水解,原因在于果聚糖分子结构中的糖苷键易被质子酸打断,增强酸性更有利于苷元质子化[25]。因此,盐酸pH值为0.1时果聚糖具有最佳分解效果。

注:不同小写字母表示处理间差异显著(P<0.05)。下同。Note: Different lowercase letters indicate significant difference at 0.05 level. The same as following.图3 不同pH值下大蒜果聚糖含量差异Fig.3 Differences in fructan content of garlic under different pH value
2.2.4 不同浓度对大蒜果聚糖含量的影响 由2.2.3结果可知,HCl溶液水解果聚糖的最适pH值为0.1。而当HCl浓度≥1 mol·L-1时,溶液pH值均为0.1,因此本试验进一步研究1、3、6、9 mol·L-1的 HCl溶液对大蒜果聚糖含量的影响。由图4可知,不同浓度HCl溶液中煮沸水解1 h后,果聚糖含量存在差异。随着HCl浓度的增加,果聚糖含量先升高后降低。当HCl浓度为3 mol·L-1时,果聚糖含量达最大值(620.47 mg·g-1DW),而9 mol·L-1HCl水解后推算所得果聚糖含量仅为466.01 mg·g-1DW。这可能是因为果聚糖只有在一定HCl浓度范围内才能水解成单糖,浓度超过阈值,将引起酸性过高导致单糖结构被破坏[10]。因此,3 mol·L-1左右的HCl是大蒜果聚糖水解的最优浓度。

图4 不同HCl浓度下大蒜果聚糖含量差异Fig.4 Differences in fructan content of garlic under different HCl concentration
2.2.5 不同水解时间对大蒜果聚糖含量的影响 以3 mol·L-1的HCl煮沸水解0.5、1、2、4 h为降解条件,果聚糖含量如图5所示。在水解0.5~1 h,果聚糖含量显著增加,由455.50 mg·g-1DW急剧上升至620.47 mg·g-1DW。 在水解1 h达最大值,显著高于其他水解时间处理;而后(水解2~4 h)果聚糖含量缓慢下降,趋于平稳,水解2 h和4 h的果聚糖含量无显著差异。由此可见,水解时间的延长不一定提高果聚糖的降解程度。这是因为在适宜的酸性条件下,水解1 h即可使大蒜果聚糖完全水解。故水解1 h是大蒜果聚糖的最优水解时间。

图5 不同水解时间下大蒜果聚糖含量差异Fig.5 Differences in fructan content of garlic under different time
2.2.6 不同水解温度对大蒜果聚糖含量的影响 以3 mol·L-1的HCl在60、70、80和94℃(沸水)不同温度下水解1 h为水解条件,果聚糖含量呈现逐渐升高的趋势。随着水解温度从60℃提高至80℃,果聚糖含量由160.37 mg·g-1DW增加至362.53 mg·g-1DW。而将水解试剂煮沸,果聚糖含量达峰值(620.47 mg·g-1DW), 显著高于其他温度条件。说明温度的升高有利于糖苷键的断裂。这是因为盐酸在高温环境下氧化性增强,水解速度与温度条件呈正相关关系[26]。因此,94℃(沸水)是大蒜果聚糖的最优降解温度。

图6 不同温度下大蒜果聚糖含量差异Fig.6 Differences in fructan content of garlic under different tempreture
2.3 响应面优化试验结果
2.3.1 响应面试验影响因子筛选确定 基于单因素试验结果,确定选取对大蒜果聚糖降解影响较大的水解温度、HCl浓度和水解时间等3个因素及水平编码值(表4)。本试验采用三因素三水平设计 Box-behnken 响应面优化试验,并以果聚糖含量测定值为评价指标,筛选果聚糖最优水解条件[27]。

表4 因素与水平表Table 4 Orthogonal experimental factors and level table
2.3.2 响应面设计试验优化 利用DesignExpert 12软件分别设12组析因试验和5组中心试验,对表5的数据进行多元回归拟合[28],拟合得到二次响应面回归模型为果聚糖含量(mg·g-1DW)=393.45+169.05A+38.9B+32.26C-55.70AB-37.63AC+43.44BC+28.57A2-38.20B2+39.70C2。
2.3.3 响应因素水平的优化 图7为各因素之间交互作用的等高图和三维曲面图,通过分析两两因素间的交互作用对果聚糖含量的影响效应,从而确定最佳试验组合。三维曲面图能直观反映各因素间的交互作用,响应面越平缓,表明该因素对果聚糖含量的影响越小,反之说明该因素对果聚糖含量的影响更显著[30]。图7-A~B表示HCl浓度和水解温度之间的交互效应,果聚糖含量随着水解温度的升高而增大;但是随着HCl浓度的升高,果聚糖含量在HCl浓度达到3 mol·L-1以后逐渐下降,这可能是过高的酸浓度导致糖组分的碳化所致,与单因素试验结果一致。图7-C~D是水解时间和水解温度间的交互作用,果聚糖含量随着水解温度的升高而升高,而水解时间的延长对果聚糖含量的升高无明显促进作用。图7-E~F为水解时间和HCl浓度之间的交互效应,随着水解时间的延长,果聚糖含量增长缓慢,说明水解时间的延长对果聚糖含量的升高促进效果较小;同时HCl浓度达到3 mol·L-1左右时响应面中间部分呈现凸起趋势,两端呈现下降趋势,说明3 mol·L-1的HCl是水解果聚糖的最佳条件。

表 5 响应面试验设计结果Table 5 Response surface test design results
2.3.4 最优工艺参数确定及验证 利用响应面分析确定大蒜果聚糖含量。最优工艺参数为水解温度89.758℃、HCl浓度3.229 mol·L-1、水解时间1.138 h,此试验组合果聚糖含量预测值为627.903 mg·g-1FW。 为便于试验操作,将上述优化试验组合调整为水解温度90℃、HCl浓度3 mol·L-1、水解时间 1 h。 经过3次平行重复试验测得果聚糖含量为620.470 mg·g-1FW,模型预测值与真实测定值之间差异不显著(P<0.05),从而验证了该模型及优化工艺参数的可靠性。
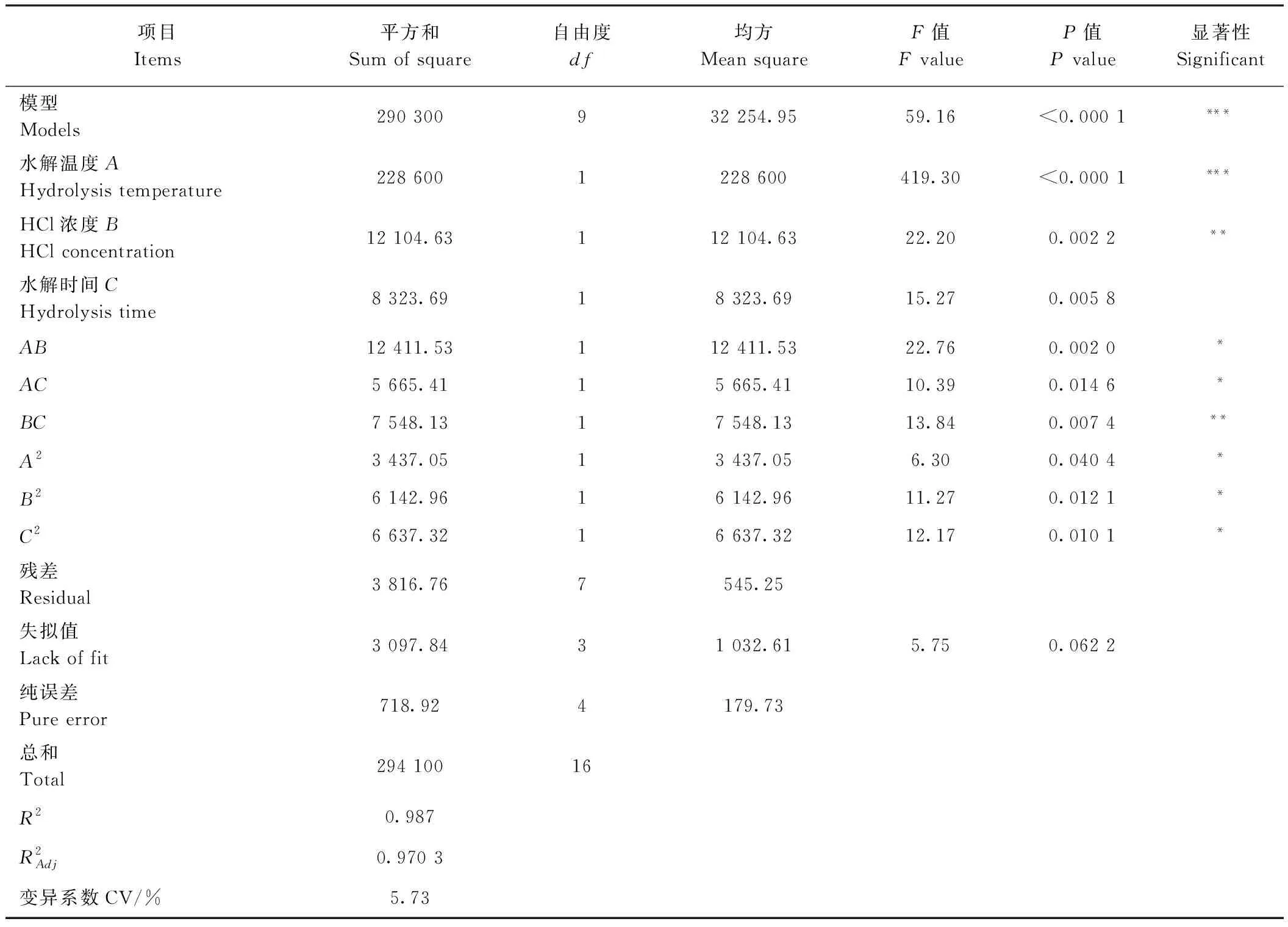
表6 回归模型方差分析Table 6 Analysis of variance for regression model

图7 各因素交互作用响应面和等高线Fig.7 Response surface and contour plots for the effects of process conditions on the extraction rate of flavonoids
2.4 不同测定方法对大蒜果聚糖含量检测效果的影响
利用分光光度计法、高效液相色谱法检测大蒜果聚糖的含量。结果表明(表7),通过强酸水解后,不同检测方法下果聚糖的含量差异显著。HCl水解-高相液相色谱法下果聚糖含量达到669.73 mg·g-1DW,显著高于分光光度计检测法。这是因为分光光度计法基于不同类型的衍生反应,只能检测到少数糖类,对于组分复杂的果聚糖检测准确度和灵敏度不高。综上,强酸水解-高效液相色谱法所测得的果聚糖含量最高,即可达到相对较好的检测效果。
2.5 大蒜果聚糖水解及含量检测的方法学验证
2.5.1 线性关系及检出限 称取不同质量的果聚糖标准品(菊糖),在上述筛选确定的最优条件下,水解果聚糖标准品并测定其含量。以测得峰面积为纵坐标,标准品质量为横坐标,建立果聚糖标准曲线,得到回归方程y=706.57x+16.168,R2=0.999 7,果聚糖标

表7 不同测定方法大蒜果聚糖含量差异Table 7 Differences in the content of fructan from garlic in different detection methods
准品在0.5~50 mg·mL-1间线性关系良好,检出限为0.01 mg·mL-1,相关系数大于0.999,表明该水解工艺及含量测定方法灵敏度高。
2.5.2 精密度、重复性及稳定性 将20 mg·mL-1的果聚糖标准品溶液按上述筛选获得的最优方法水解,重复进样6次,其果聚糖含量的RSD是1.23%,表明该方法的精密度良好。称取0.84 g乐都紫皮大蒜样品按上述方法水解,重复6次,其果聚糖含量的RSD是0.83%,表明该水解及含量检测方法重复性较好;同一份果聚糖标准品的检测样品分别在0、1、2、4、8 h内检测,RSD为0.20%,稳定性良好。
2.5.3 回收率 取3份乐都紫皮大蒜样品,分别加入高(1.00 g)、中(0.30 g)、低(0.01 g)3个质量的果聚糖标准品溶液,在加标回收率的测定中,样品果聚糖平均回收率为98.45%~101.04%,RSD为0.59%~1.75%(表8),表明样品水解过程中损失少,该方法回收率良好。综合以上方法学验证结果,说明该水解及检测方法准确性较高,试验结果可靠,可用于大蒜果聚糖含量的定量分析。

表8 大蒜样品果聚糖加标回收率试验结果Table 8 Recovery rates of fructan in garlic samples
2.6 不同大蒜品种果聚糖含量的测定
利用建立的大蒜果聚糖含量测定方法,对10份大蒜品种按上述最优方法进行水解及果聚糖含量检测,结果如图7所示。不同大蒜品种的果聚糖含量在448.82~677.86 mg·g-1DW之间,大多数品种间差异显著。说明该方法可检测不同大蒜资源果聚糖含量差异,可作为大蒜果聚糖含量的定量分析方法。
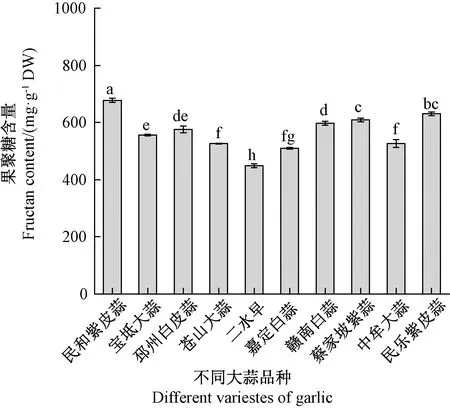
图8 不同品种大蒜果聚糖含量差异Fig.8 Difference of fructan content among different varieties of garlic
3 讨论
大蒜是一种药食兼用蔬菜,营养物质和功效成分丰富。研究发现,大蒜鳞茎富含多糖、低聚糖和单糖等碳水化合物,其中大蒜多糖种类多样,包括半乳聚糖、果聚糖以及杂多糖等[31]。果聚糖作为大蒜多糖中含量最高的产量因子及活性成分,约占大蒜糖类物质的96%[32],对大蒜产品的品质及保健功效具有较大影响。然而,大蒜果聚糖组分多样,包含了1-蔗果三糖、1-蔗果四糖等聚合度(degree of polymerization, DP)<10的低聚果糖[33]以及部分DP=58的菊糖型果聚糖新生系列[34],而且结构复杂,如索慧[10]发现大蒜果聚糖的分支度≥17%。以上特征导致糖链长、分支多的果聚糖混合物难以被常规离子交换或气相层析等方法区分,分离纯化难度极大,迄今尚无果聚糖含量统一有效的测定方法。因此建立一种快速、方便、准确的大蒜果聚糖含量检测体系显得尤为重要。
目前,HPLC法是检测植物果聚糖含量最常用的方法,研究人员利用果聚糖标准品能够对小分子的低聚糖进行定量分析[35-38]。而果聚糖总量的检测由于受到了高聚果糖标准品纯度、成本以及仪器灵敏度的限制,常无法准确测定。为了避免高聚果糖的影响,本研究在青海省蔬菜遗传与生理实验室前期建立的大蒜果聚糖测定方法[39]基础上进一步优化,提取大蒜可溶性总糖后,利用强酸将不同聚合度的多种大蒜果聚糖彻底水解,通过水解前后双糖及单糖(蔗糖、葡萄糖、果糖)含量差值的计算,能够快速简便地检测大蒜组织中所有果聚糖的总含量。
为了将大蒜组织中所有果聚糖彻底水解,本研究首先将大蒜可溶性糖充分提取,对大蒜总糖的提取方法进行筛选。结果发现,热水提取法下大蒜总糖含量最高,提取效果明显优于超声波、超声波-热水以及乙醇提取法,这是因为大蒜可溶性糖在水中具有较高的溶解性,并且溶解度会随着温度的升高而增大[40],这与陈秀枝等[41]利用热水浸提法从菊粉中提取果聚糖的研究结果一致。同时,本研究利用单因素试验分别考察了水解强酸类型、水解方式和反应时间等对大蒜果聚糖的降解效果。在筛选果聚糖水解试剂方面,通过对比3种强酸(HCl、H2SO4及TCA)对大蒜果聚糖的降解效果发现,在强酸的H+浓度达到一定值时,推算得到的大蒜果聚糖含量处于同一水平,说明强酸类型不是影响大蒜果聚糖水解的主要因素。但H2SO4具有强脱水性,可能会碳化蔗糖[42]、破坏果糖,高温下(70℃)H2SO4会使果糖分解为5-羟甲基糠醛[10];而TCA对植物细胞壁多糖、糖胺聚糖和糖蛋白的水解具有专一性,利用TCA作为水解强酸,大蒜多糖可能水解不完全[43]。鉴于H2SO4的脱水性以及TCA的水解选择性,故筛选出HCl作为果聚糖的水解试剂。为了进一步确定果聚糖的最佳降解条件,对HCl水解的pH、时间及浓度进行了单因素筛选,发现3 mol·L-1HCl 对果聚糖的降解效果明显优于高浓度(>3 mol·L-1), 且水解时间的延长并不能提高水解度。这是因为在密闭的高温条件下,HCl的氧化性和强酸性易使大蒜果聚糖的糖苷键断裂。HCl水解速度会随着温度升高和HCl浓度的增大而加快。但大蒜果聚糖只在一定的酸浓度以及适当的温度和时间下,才水解为果糖和葡萄糖,否则过度水解将会破坏单糖的结构,故水解时间的延长并不一定会提高水解效率。本研究中,利用3 mol·L-1HCl水解1 h即可使大蒜果聚糖完全水解。这与于淑娟等[44]针对甜菜果胶中性糖的水解研究结果类似。考虑到果聚糖降解受到水解温度、HCl浓度、水解时间等因素的协同影响,本研究利用响应面分析进一步对降解工艺进行了优化,最终确定大蒜果聚糖最佳水解工艺条件为水解温度90℃、HCl浓度3 mol·L-1、水解时间1 h。
为了进一步筛选果聚糖降解产物的检测方式,本研究对比了分光光度法和酸解-高效液相(HPLC)法,发现HCl水解-HPLC法下检测的果聚糖含量更高。这是由于HPLC法具有灵敏度高、检出限低、分离效果好等优点。经过方法学验证,结果显示本方法精密度、重复性及稳定性良好,三者的相对标准偏差(RSD)均小于1.5%;平均回收率为98.45%~101.04%,其RSD为0.59%~1.75%。说明本研究筛选确立的检测方法准确性较高,试验结果可靠,适用于大蒜果聚糖含量的测定分析,这将为大蒜果聚糖的开发利用提供理论依据。
4 结论
本研究建立了大蒜果聚糖的水解和定量检测方法,通过热水法提取大蒜可溶性总糖后,利用3 mol·L-1HCl 90℃反应1 h彻底水解大蒜组织中不同聚合度的果聚糖,再通过高效液相色谱法检测水解前后蔗糖、葡萄糖和果糖含量并计算差值,即可得到大蒜组织中所有果聚糖的总含量。本方法准确性较高、结果可靠、简便快速,适用于大蒜组织果聚糖总含量的测定分析。
