几种环境因子对微拟球藻营养物质积累的影响
2022-05-20张元博田娇娇叶凌志叶正威徐继林
张元博 田娇娇 叶凌志 叶正威 张 琳,3,* 徐继林,3,*
(1 宁波大学海洋学院,浙江 宁波 315211;2 浙江省海洋生物工程重点实验室(宁波大学),浙江 宁波 315211;3 浙江省海洋生物技术重点实验室(宁波大学),浙江 宁波 315211)
作为海洋生态系统的初级生产者,微藻富含糖、蛋白质、脂肪酸和色素等营养物质,且光合效率高、繁殖速度快,被广泛用作水产动物饵料[1-3]。许多微藻代谢产物具有较高的营养和药用价值。其中,二十碳五烯酸(eicosapentaenoic acid,EPA)可提高脂肪细胞线粒体氧化能力,在一定程度上避免氧化应激反应[4]; β-胡萝卜素能清除水产动物体内的活性氧,提高机体免疫力[5];虾青素能够使甲壳类、鱼类保持健康体色,提高其观赏和经济价值[6];从椭圆小球藻(Chlorellaellipsoidea)中提取的紫黄素具有一定的抗炎活性[7]。同时,微藻还可为幼鱼生长提供优质蛋白,并能促进双壳贝类生长[8]。
饵料微藻营养物质积累受多种环境因子影响,如光强、光质、温度、盐度、营养盐等[9-10]。据报道,300 μmol photons·m-2·s-1光强能显著提高缺刻缘绿藻(Parietochlorisincisa)的生物量并促进其脂肪酸积累[11],而50 μmol photons·m-2·s-1光强比210 μmol photons·m-2·s-1光强更能促进普通小球藻(Chlorellavulgaris)生长[12]。红(80%)、蓝(20%)光混合照射可促进螺旋藻(Spirulinasp.)生长,并显著提高其叶绿素a、藻蓝素和类胡萝卜素含量[13]。类似地,LED白蓝混合光照射可大大提高普通小球藻的生物量[14]。而171 μmol photons·m-2·s-1纯蓝光比混合白光更能促进湛江等鞭金藻(Isochrysiszhanjiangensis)光合作用[15]。此外,在一定范围内(10~30 mg·L-1)增加氮浓度可提高钝顶螺旋藻(Spirulinaplatensis)比生长速率、生物量、蛋白和可溶性糖含量,而氮浓度过高(40 mg·L-1)则会抑制其生长[16]。在氮充足条件下,蛋白核小球藻(Chlorellapyrenoidosa)对氮源的吸收效率受磷浓度影响,且在蓝光辅助照射下对磷吸收效率最高,达90.80%[17]。可见,不同环境因子间可相互影响,共同作用于微藻生长和代谢,光和营养盐是其中重要的环境因子,颇具研究意义。
微拟球藻(Nannochloropsissp.)是一类分布广泛的单细胞微藻,既有海水种也有淡水种[18],个体微小,生长迅速,被广泛应用于水产养殖领域[19]。微拟球藻富含油酸、亚油酸、EPA等多不饱和脂肪酸,其中,EPA含量最高可达总脂肪酸的30%[20]。此外,微拟球藻色素组成十分独特,只含有叶绿素a,不含叶绿素b和叶绿素c[21],富含β-胡萝卜素、角黄素、叶黄素、紫黄素和无隔藻黄素等,一些微拟球藻还能积累虾青素[22]。可溶性糖和蛋白作为微拟球藻中最丰富的有机成分,占细胞干重比重较大,其中蛋白含量最高可达30%[23]。
环境因子对微拟球藻营养组成的影响已有部分报道。当氮、磷、铁的浓度分别为24.6、1.1和0.2 mg·L-1时,微拟球藻可获得最高生物量和蛋白含量[24]。Sung等[23]比较了相同光强的白光、红光和蓝光对微拟球藻的影响,发现在红、蓝光下其生物量积累分别提高40.3%、35.1%。相较于150 μmol photons·m-2·s-1光强,微拟球藻在50 μmol photons·m-2·s-1光强下能获得更高的生物量和脂肪酸(尤其是EPA)产量[25]。研究表明,相同培养条件下,高生物量与高营养物质积累往往不能兼得,需采用“两阶段培养法”:第一阶段为微拟球藻提供最适生长条件,短期内获得更多生物量;第二阶段将扩繁后的微拟球藻转移至目标营养物质最适积累条件下培养,优化营养组成,提高目标营养占比[26]。通过调控环境因子,使微拟球藻短期内获得最大生物量进而积累更多目标营养物质,可大大促进微拟球藻在饵料领域的应用,是现阶段研究的重要方向之一。
基于此,本试验系统分析了4种不同环境因子(光质、光强、氮、磷)对微拟球藻生长及营养物质积累的影响,分析其生长最适环境因子与营养物质积累最佳因子,旨在为后续大规模培养微拟球藻提供理论依据。
1 材料与方法
1.1 试验材料
试验藻种选取海洋微拟球藻(Nannochloropsisoceanica),由浙江省海洋生物工程重点实验室提供,编号NMBluh014。藻种培养选用高压灭菌(121℃、20 min)后的NMB3#培养基[27]。培养温度25℃,光强80 μmol photons·m-2·s-1,光暗比12 h∶12 h。每天摇瓶数次,防止藻细胞贴壁。
1.2 试验方法
试验分为光质、光强、氮浓度和磷浓度梯度试验四部分。所有试验组微拟球藻初始接种密度统一,并同时采用细胞计数法与紫外分光光度计法(OD值)在波长750 nm处测定藻细胞密度(2±0.5×106cell·mL-1;OD750=0.050±0.003)。除所设环境因子变量外,其余环境因子保持一致,隔天测定OD750。培养25 d后取5 mL藻液进行色素分析,离心(8 000 r·min-1,10 min)收集藻细胞,冷冻干燥48 h后测定脂肪酸、可溶性糖及蛋白含量。每组设置3个平行。
1.2.1 光质试验方法 使用N600H2-S-K06-06可调式液冷复合光谱试验灯组(厦门三安光电有限公司),调节不同试验组中红、蓝、绿光分别占比为100%、50%、0%,并依据RGB三原色原理(Red∶Green∶Blue=2∶1∶1)[28]将剩余比例单色光补齐(表1)。
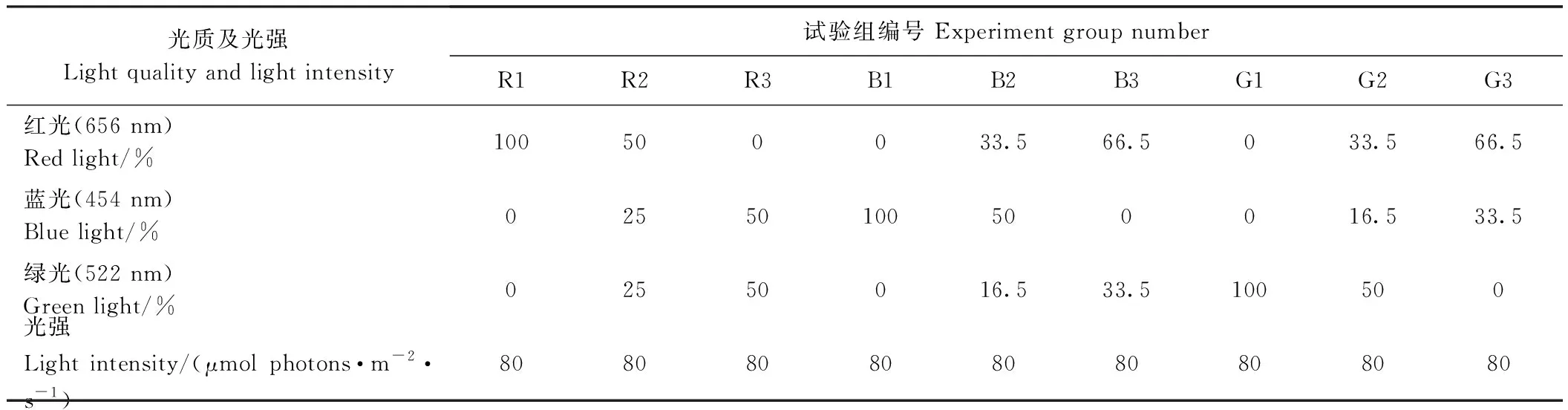
表1 不同试验组光质组成Table 1 Light quality composition of different experimental groups
1.2.2 光强试验方法 微拟球藻培养在恒温GXZ-280B光照培养箱(宁波江南仪器厂)内完成。设置光强分别为20、80、140和200 μmol photons·m-2·s-1,编号L1~L4。
1.2.3 氮浓度、磷浓度试验方法 以NMB3#培养基氮、磷工作浓度(氮13.85 mg·L-1、磷2.24 mg·L-1)为对照。设置氮元素55.40、13.85、3.46、1.73 mg·L-14个梯度(编号N1~N4),磷元素8.96、2.24、0.56、0.28 mg·L-14个梯度(编号P1~P4),梯度设置基于预试验结果,其余营养盐浓度保持不变。其中,N2与常规NMB3#培养基中氮浓度一致,且其余环境因子均相同,因此将N2视为常规对照组。
1.2.4 脂肪酸组成测定方法 藻粉冷冻干燥后置于10 mL玻璃试管中,加入HPLC级正己烷1 mL和甲酰氯1.5 mL(甲醇∶乙酰氯=10∶1),漩涡震荡30 s,65℃水浴2.5 h,加入6%碳酸钾2.5 mL、正己烷1 mL,漩涡震荡30 s,取上清液至2 mL EP管中,3 000 r·min-1离心10 min,用0.22 μm针式有机相滤膜过滤至2 mL棕色进样瓶,使用7890B/7000C三重四极杆气相色谱-质谱分析仪(美国安捷伦科技有限公司)进行脂肪酸组成分析,采用面积归一化法计算相对百分含量。
1.2.5 色素组成测定方法 色素提取操作严格避光。取5 mL藻液,用47 mm GF/F玻璃纤维滤膜真空抽滤,剪碎滤膜至15 mL离心管中,加入HPLC级甲醇5 mL,涡旋震荡5 min,冰浴超声20 min后用0.22 μm有机相针式过滤器(直径13 mm)过滤上清液去除杂质,2 mL棕色进样瓶收集滤液,使用HPLC-Q-Orbitrap超高液相色谱-静电场轨道阱高分辨质谱(美国赛默飞世尔科技公司)进行色素组成分析,采用面积归一化法计算相对百分含量。
1.2.6 蛋白和可溶性糖含量测定方法 采用蒽酮-硫酸比色法测定可溶性糖含量,考马斯亮蓝法测定蛋白含量,测定使用对应浓度试剂盒(南京建成生物技术有限公司),步骤谨遵说明书。
1.3 数据处理与分析
利用GraphPad Prism 8.0软件进行数据处理与制图。使用SPSS 20软件进行单因素方差分析及差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 不同环境因子下微拟球藻生长

注:A:7 d时各试验组OD值;B:15 d时各试验组OD值;C:23 d时各试验组OD值;L1~L4分别表示光强20、80、140和200 μmol photons·m-2·s-1; N1~N4分别表示氮浓度55.40、13.85、3.46、1.73 mg·L-1;P1~P4分别表示磷浓度8.96、2.24、0.56、0.28 mg·L-1;不 同小写字母表示差异显著(P<0.05)。下同。Note: A: OD value of each experimental group at 7 d. B: OD value of each experimental group at 15 d. C: OD value of each experimental group at 23 d. L1~L4 represent the light intensity 20, 80, 140, 200 μmol photons·m-2·s-1, respectively. N1~N4 represent nitrogen concentration of 55.40, 13.85, 3.46, 1.73 mg·L-1, respectively. P1~P4 represent phosphorus Concentration 8.96, 2.24, 0.56, 0.28 mg·L-1, respectively. Different lowercase letters indicate significant differences at 0.05 level. The same as following.图1 不同时间点不同环境因子下微拟球藻生长Fig.1 Growth of N. oceanica with different environmental factors at different time points
图1为微拟球藻在不同环境因子下的生长情况,选取时间点分别为指数期(7 d)、平台初期(15 d)和平台末期(23 d),7 d时,绿光G2组生长最为缓慢,并与红、蓝光组存在显著性差异(P<0.05)。氮浓度试验组中,N1组生长速度最快,N3、N4生长较为缓慢。培养7~15 d时,随着氮、磷的缺乏,N3、N4和P4组生长速率变慢,与之相比,其他试验组生物量积累均稳步提高,15 d时,L4组生长最为迅速。培养至23 d,L4组获得最大生物量。氮、磷试验组生长情况与营养盐浓度呈正相关,N1和P1组生物量积累较大,N4组生物量最少。光质试验中,R1组生物量积累较大,并与其他光质试验组存在显著性差异(P<0.05)。值得注意的是,所有光质比例下微拟球藻均可保持健康生长,预示着微拟球藻光谱适应性较广。纯红光或氮富足条件下指数期微拟球藻生长增速较大,更高的光强对于微拟球藻在指数末期至平台期生长增速较大。
2.2 不同环境因子对微拟球藻脂肪酸组成影响
不同环境因子下微拟球藻脂肪酸组成见表2。共检出二十碳五烯酸(C20:5n-3,EPA)、花生四烯酸(C20:4n-6)、硬脂酸(C18:0)、油酸(C18:1)、亚油酸(C18:2n-6)、棕榈酸(C16:0)、棕榈油酸(C16:1)和肉豆蔻酸(C14:0)8种脂肪酸,其中饱和脂肪酸(saturated fatty acid, SFA)3种,占比为31.767%~58.436%,不饱和脂肪酸(unsaturated fatty acid, UFA)5种,占比为41.564%~68.233%。
光强试验中,光强在80~200 μmol photons·m-2·s-1范围内时,SFA比例随光强增强呈上升趋势,UFA比例则逐渐下降。除C14:0在L1与L3组存在显著性差异外,其余脂肪酸组分在不同光强下差异均不显著。光质试验中,EPA的积累量随着红光比例的的下降而增大,随着蓝光比例下降而减少,SFA与UFA则未呈现明显的变化趋势。整体来看,单色光和光强对微拟球藻脂肪酸组成影响不大。
相较于光质和光强,氮、磷浓度变化对脂肪酸积累影响更大。氮浓度试验中,随着氮浓度降低,SFA比例呈上升趋势,UFA比例则逐渐下降。N1组UFA比例达到最大值,为68.233%,EPA积累也达到最大值20.502%。N4组SFA比例达到最大,为58.436%,而UFA最低,为41.564%,说明氮元素的缺乏是导致微拟球藻UFA比例下降的主要原因。磷浓度试验中,随着磷浓度降低,SFA比例先下降后上升,UFA比例先上升后下降,推测微拟球藻UFA最适积累磷浓度为2.24 mg·L-1,C14:0和C18:0在P1组中分别达到最大积累量4.398%和7.941%,C20:4n-6在P2组积累量最大,为3.368%。
2.3 不同环境因子对微拟球藻色素组成影响
微拟球藻中共检出11种色素,分别是叶绿素a、β-胡萝卜素、角黄素、硅甲藻黄素、叶黄素、玉米黄素、虾青素、紫黄素、隐藻黄素、异黄素和百合黄素。其中叶绿素a和β-胡萝卜素占比最大,非胁迫状态下两者含量之和可达总含量的70%。
由表3可知,随着光强的增加,叶绿素a和虾青素占比逐渐降低,β-胡萝卜素、玉米黄素占比逐渐增大。在L1中,叶绿素a占比达到全试验组最大,为55.114%,β-胡萝卜素占比最小,为23.889%,整体来看,弱光有利于微拟球藻积累叶绿素。
与光强试验不同,光质试验中β-胡萝卜素在G1组占比最大(48.281%),叶绿素a在G1组占比最小(18.962%),表明绿光有利于微拟球藻积累β-胡萝卜素。百合黄素在B3组占比最大(4.282%),在其余试验组内则无显著性差异。整体来看,光质和光强对微拟球藻中高含量色素的影响较大,如叶绿素a和β-胡萝卜素,对微量色素的影响相对较小。
氮、磷试验组中,随着氮浓度降低,叶绿素a占比逐渐增大,β-胡萝卜素、异黄素和百合黄素占比逐渐降低,在N4组中,虾青素、角黄素和玉米黄素占比最大,分别为6.280%、10.557%和5.665%。随着磷浓度降低,角黄素、硅甲藻黄素、紫黄素和隐藻黄素占比逐渐降低,硅甲藻黄素、叶黄素、紫黄素和隐藻黄素在P1组占比最大,分别为3.556%、11.932%、2.340%和6.658%,可见绝大多数类胡萝卜素积累的极值均出现在氮、磷胁迫试验组,表明相较于光质和光强,氮、磷浓度对微拟球藻中微量类胡萝卜素积累的影响更大。
2.4 不同环境因子对微拟球藻可溶性糖和蛋白含量影响
由图2可知,随着光强增加,微拟球藻中可溶性糖和蛋白含量均逐渐增大,可溶性糖和蛋白含量在L4组中达到最大值,分别为5.17 mg·mL-1和2.40 mg·L-1。 氮浓度试验中,随着氮浓度降低,可溶性糖和蛋白含量均有所降低(P<0.05)。类似地,在磷浓度试验中,随着磷浓度降低,细胞中蛋白含量逐渐下降,而可溶性糖含量呈现先上升后下降趋势,在磷2.24 mg·L-1时达到峰值,表明该浓度或许为其积累可溶性糖的最佳浓度。光质试验组中,R3组蛋白含量较其余所有光质组显著升高,G1组蛋白含量较其余所有光质组显著下降(P<0.05),B1组可溶性糖含量最低,可见,强烈的光照对可溶性糖和蛋白积累的影响远大于其他环境因子,强光能促进微拟球藻细胞中可溶性糖和蛋白的积累,而氮浓度的降低则会抑制其积累。同样,纯绿光亦会抑制蛋白积累。
3 讨论
3.1 不同环境因子对微拟球藻生长的影响
微拟球藻生长不仅可以利用二氧化碳、无机氮等无机物,还可以利用葡萄糖、醋酸等有机物,同时还受营养盐浓度、接种密度、温度、光照等多种环境因子影响[29-30]。本研究发现,光照强度对微拟球藻生长影响较为明显,在20 μmol photons·m-2·s-1光强下,微拟球藻在指数期生长较为缓慢,平台期则迅速增长,200 μmol photons·m-2·s-1光强下生长速度始终最快,且最终生物量最高。光质试验中,微拟球藻在纯红光下生长速度最快,且表现出较广的光谱适应性。据报道,相比于其他光质条件,微拟球藻在100 μmol photons·m-2·s-1蓝光下有更多的生物量积累[31],这与本研究结果不同,由此推测更高的光强可能会提高微拟球藻对于蓝光的利用率。氮、磷浓度试验中,N1与N4、P1与P4生长差异显著。氮浓度试验中,N1组生长速度最快,表明足量的氮源有利于微拟球藻在指数期积累生物量。培养至平台期时,N4、P4组由于氮、磷的缺乏导致其生长速度变慢,且与其他试验组生物量积累出现显著性差异(P<0.05)。可见,氮磷的缺乏是导致微拟球藻生物量积累匮乏的最主要原因。
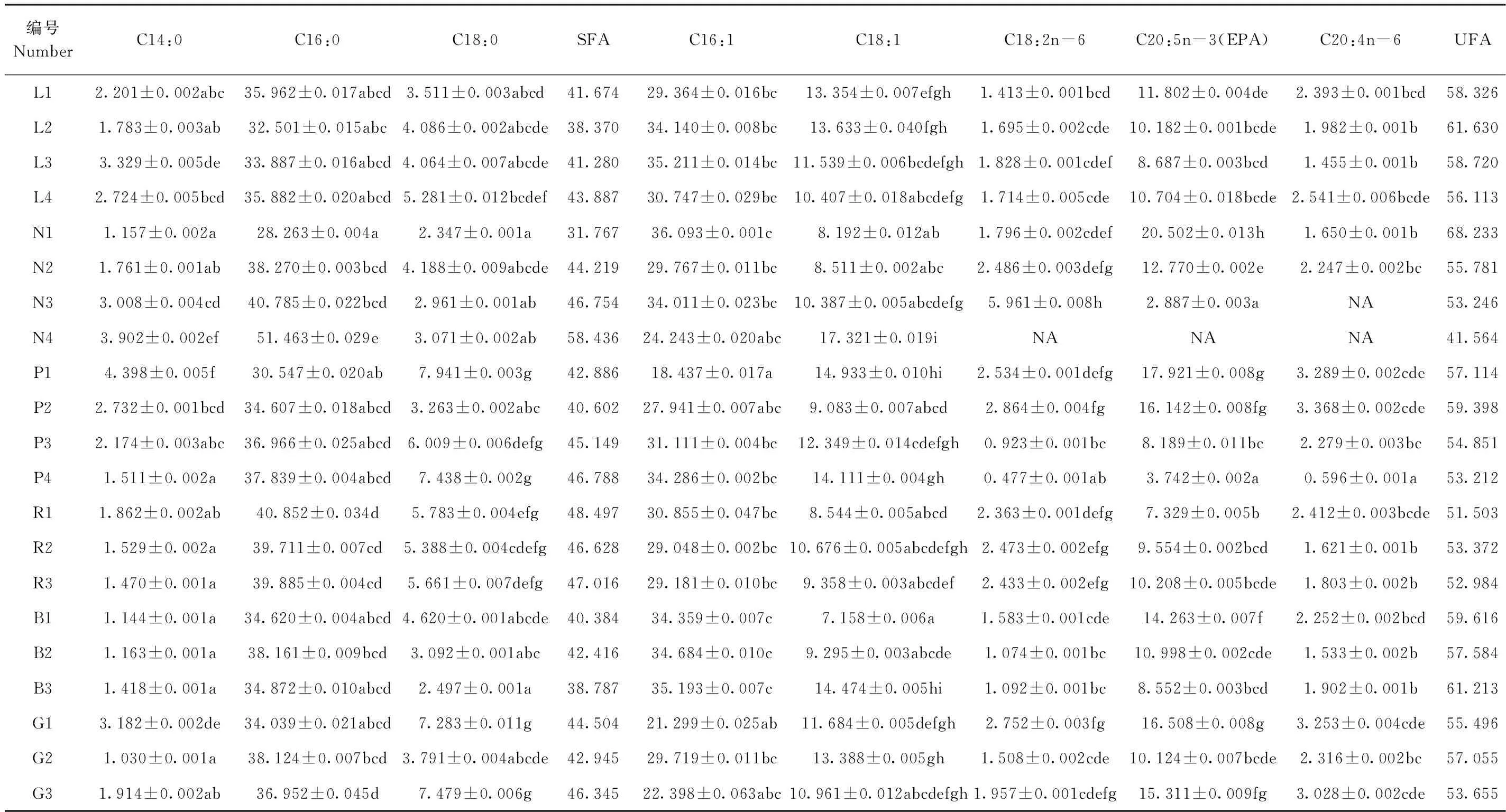
表2 不同环境因子对微拟球藻脂肪酸组成影响Table 2 The influence of different environmental factors on the fatty acid composition of N. oceanica /%
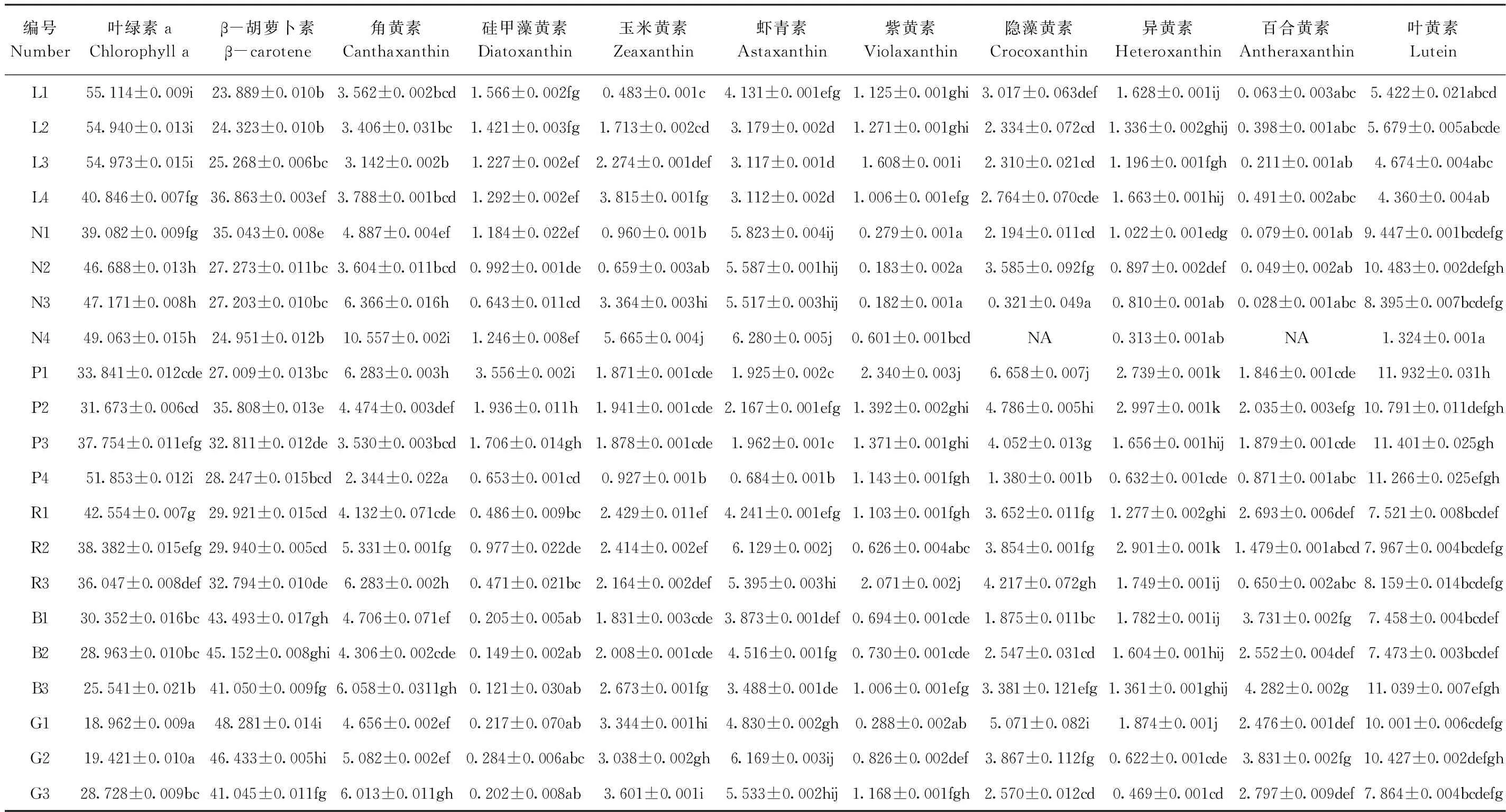
表3 不同环境因子对微拟球藻色素组成影响Table 3 The influence of different environmental factors on the pigment composition of N. oceanica /%
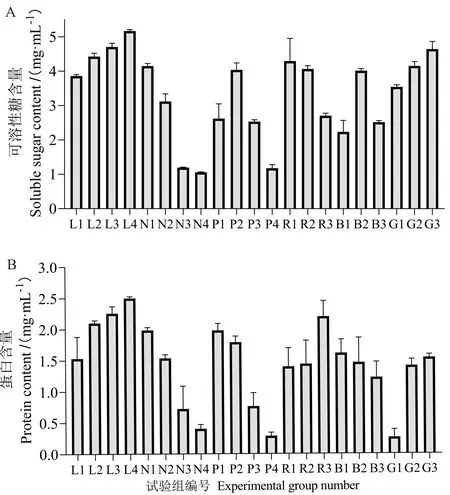
图2 不同环境因子对微拟球藻可溶性糖和蛋白含量影响Fig.2 The influence of different environmental factors on the soluble sugar and protein content of N. oceanica
以上结果为微拟球藻培养提供了新思路,可采用指数期供应高浓度氮源外加红光辅助其生长,到达平台期则提供高光强白光,不同阶段采用不同生长策略,以期在短时间内积累更多生物量。
3.2 不同环境因子对微拟球藻脂肪酸积累的影响
微拟球藻以富含EPA等多不饱和脂肪酸而备受关注,其脂肪酸主要以结构脂(磷脂、糖脂)以及储存脂(甘油三酯)两种形式存在,可用于制备高品质生物柴油[32]。诸多研究表明,不同环境因子下微拟球藻脂肪酸积累存在明显差异[33]。因此,解析不同环境因子对其脂肪酸积累的影响,确定其最优积累条件,是高效利用微拟球藻的基础[34]。
本研究中,培养25 d的微拟球藻,光强从140 μmol photons·m-2·s-1降至20 μmol photons·m-2·s-1时,EPA含量从8.687%增至11.802%,与Pal等[35]的结果类似,即当微拟球藻培养7 d,光强从700 μmol photons·m-2·s-1降低至170 μmol photons·m-2·s-1时,EPA含量从10.8%增加到17.8%。可见,微拟球藻中EPA含量与光强呈反比。据报道,在光胁迫条件下,微拟球藻UFA含量会随着光强的增加而减少,而在光饱和条件下,微拟球藻UFA含量则随着光强的增强而增加,可能由于在强光胁迫下,微拟球藻细胞膜流动性降低,而UFA尤其是EPA的大量合成能抑制强光对其细胞膜流动性的影响[36]。
本研究发现(表2),氮、磷对于微拟球藻脂肪酸积累的影响明显大于光强和光质。据报道,将氮浓度从60 μmol·L-1增至2 200 μmol·L-1时,微拟球藻中EPA含量从总脂肪酸的8.60%增至24.88%[37]。硝酸盐浓度从1 800 μmol·L-1降至75 μmol·L-1时,微拟球藻EPA含量显著降低[36]。这与本试验结果类似,当氮浓度从3.46 mg·L-1提高至55.40 mg·L-1时,微拟球藻EPA含量从2.887%增至20.502%,UFA含量从53.246%增至68.233%。表明充足的氮源更有利于EPA的合成。氮浓度过低会导致细胞营养不良,生长受限,而氮浓度过高也会导致细胞因大量合成铵离子而产生铵中毒现象[38]。据报道,在氮缺乏条件下,额外添加碳源可提高脂肪酸合成前体的供给,减少UFA的循环利用,以增加其在细胞内的含量,应对氮缺乏所带来的压力[39]。Shi等[40]研究发现,将微拟球藻(N.oceanica)分别培养于正常条件和无磷培养基中,无磷试验组中脂肪酸迅速积累,其中 C18:1 和 C16:0 最为显著,多不饱和脂肪酸C20:5和C20:4积累则相对减少。最终结果显示,大多数脂肪酸在磷缺乏条件下的积累速率显著高于正常培养条件。本试验得到类似的结果,当磷浓度从2.24 mg·L-1继续降低时,C18:1 和 C16:0含量明显上升,C20:5n-3和C20:4n-6含量显著下降,表明磷浓度变化对不同脂肪酸的影响不同。
本试验发现,在不同光质照射下,微拟球藻胞内SFA比例为38.787%~48.497%,UFA比例为51.503%~61.213%。G1组EPA占比最大,且随着红光比例的降低,EPA积累逐渐增多,随着蓝光比例的下降,EPA积累逐渐降低。有研究证实,红蓝光更有利于微拟球藻生物量的积累,而纯绿光则更有利于不饱和脂肪酸尤其是EPA的积累[31]。由此可知,在微拟球藻作为高脂饵料的制备过程中,想要获得更多的EPA积累,降低红光同时增加蓝绿光比例,也许是一个新思路。
3.3 不同环境因子对微拟球藻色素积累的影响
叶绿素a广泛存在于大型陆生植物到小型单细胞微藻中[41],起着分离电荷和固定光能、实现高效捕光以驱动光合反应的作用[42]。β-胡萝卜素颜色鲜艳,能够富集在动物体内使之呈现不同颜色,如小丑鱼鲜艳的外表以及鲑鱼的肉[43]。此外,β-胡萝卜素在植物应对环境胁迫(如干燥和低温)中也起着重要的保护作用[44]。
本研究结果表明,微拟球藻在适宜培养条件下,藻液外观呈翠绿色,而在环境胁迫状态下,会呈橘黄色甚至黄褐色,表明环境因子对其色素积累有影响。光强试验中,微拟球藻颜色随着光强增加而逐渐由绿变黄,这种变化主要是由β-胡萝卜素和叶绿素a的比例变化导致的,与高保燕等[45]的研究结果类似。由于叶绿素a呈现蓝绿色,β-胡萝卜素呈现橙黄色[46],在弱光20 μmol photons·m-2·s-1下胞内叶绿素a比例最高,因此藻液呈现翠绿色,而在强光200 μmol photons·m-2·s-1下叶绿素a比例降低,β-胡萝卜素比例升高,藻液则变为黄褐色,这解释了微拟球藻在环境因子胁迫下呈现黄褐色的原因。
据报道,微拟球藻在250 μmol photons·m-2·s-1光强下,叶绿素a合成受限[47]。微藻在适宜的光强下才能有效地进行光合作用,当光强达到甚至超过光饱和点时,光合作用被抑制,活性氧(reactive oxygen species, ROS)上升,光合作用细胞器受损[48],这可能是导致叶绿素a含量下降的原因。本试验中,弱光对叶绿素a积累影响较为显著,而氮、磷则对多种微量类胡萝卜素积累影响更大,表明光强和营养盐对于微拟球藻色素积累的影响大于光质,其原因可能是微藻色素大分子的生物合成过程对氮、磷等营养物质的浓度比较敏感[49]。光质试验中,G1组叶绿素a比例最低,这可能表示微拟球藻对绿光吸收效率较低。因此,合理设置营养盐组成和光照强度等条件,可以作为调控微拟球藻目标色素产量的有效手段之一。
3.4 不同环境因子对微拟球藻可溶性糖和蛋白积累的影响
微拟球藻在L4组有最大可溶性糖和蛋白含量,同时该试验组生物量也最大,推测在该光强下,由于营养充分,光线充足,此时微藻胞内碳源分配策略以供应细胞分裂和合成蛋白骨架为主。光质试验中,光质条件不同,微拟球藻的碳分配策略也不同,R1~R3组,红光比例逐渐降低,导致蛋白积累量提升,可溶性糖积累量则下降,表明红光条件下微拟球藻碳分配策略主要以积累可溶性糖为主。与其余所有先质组相比,G1组蛋白积累量显著下降,推测纯绿光会抑制微拟球藻积累蛋白质。氮浓度和磷浓度试验中,N4和P4试验组由于营养缺乏,细胞生长受到明显抑制,蛋白积累量极低,分别为0.40和0.26 mg·mL-1,且N4试验组SFA合成含量大幅上升,推测在营养盐缺乏条件下,部分蛋白质转化为脂肪酸以帮助细胞应对不良环境。Sun等[50]研究表明,在不良环境下,蛋白质的降解是脂质和可溶性糖合成的主要底物来源,氮源缺乏导致微拟球藻应激增强,淀粉合成路径则会转向类胡萝卜素和脂质的合成路径,因此在氮制约下,细胞内部碳分配出现显著变化。本试验N4组可溶性糖含量下降也与Sun等[50]的结果一致,由于脂肪酸能够帮助细胞抵御外界不良环境,因此微拟球藻由合成淀粉、蛋白为主的碳分配策略转而以脂质合成为主,进而影响微拟球藻的逆境适应性。
4 结论
本试验探究了4种环境因子对微拟球藻营养物质积累的影响,通过测定其生长及营养指标,发现纯红光或氮浓度为55.40 mg·L-1条件下,指数期生长速率较快,而200 μmol photons·m-2·s-1光强条件下微拟球藻在指数末期至平台期生长速率较快。氮、磷对脂肪酸、类胡萝卜素积累的影响较大。氮浓度为55.40 mg·L-1时UFA有最大积累比例(68.233%),同时EPA比例也达到最大(20.502%)。弱光20 μmol photons·m-2·s-1组叶绿素a占比达到最大(55.114%),β-胡萝卜素在纯绿光下有最大比例(48.281%)。高光强200 μmol photons·m-2·s-1组中可溶性糖和蛋白含量最大,表明一定程度的强光会促进可溶性糖和蛋白的积累。
