基于原生微生物MICP的土体加固试验研究
2022-05-19张家铭朱纪康
周 杨,张家铭,朱纪康,余 梦
(1.中国地质大学(武汉) 地质探测与评估教育部重点实验室,武汉 430074;2.中国地质大学(武汉) 工程学院,武汉 430074)
1 研究背景
微生物诱导碳酸钙沉淀(Microbial Induced Calcite Precipitation,MICP)是利用脲酶微生物产生脲酶,催化尿素水解产生碳酸根,与可溶性钙盐反应生成具有胶结作用的碳酸钙晶体[1]。MICP目前已在文物保护[2]、降低岩土体渗透性[3-4]、堤坝加固[5]、土体加固[6-10]、微生物水泥[11-13]、污染土治理[14-15]等方面取得了一系列研究成果。
目前,MICP相关研究所用脲酶微生物大部分为外源引入的人工培养巴氏芽孢八叠球菌(s.p,ATCC11859)。然而,除巴氏芽孢八叠球菌外,大量存在于天然土体中的铜绿假单胞菌、普通变形杆菌等也可产脲酶[16];已有研究[17]表明,向土体中注入一定成分的溶液,可将赋存于其中的原生脲酶微生物激活,利用其参与MICP过程。由于土体中的原生脲酶微生物对环境的适应性好,在处理过程中脲酶活性持久性更强,而且可以节省菌液培养、储存及运输等费用,并能消除引入外源非原生微生物带来的潜在生态影响[18],因此利用原生微生物进行岩土体加固具有一定的优势。
国内外研究人员对原生微生物加固岩土体开展了初步研究:Burbank等[19]通过向土体中注浆,激活土中原生脲酶微生物,然后对土体进行胶结处理;Gomez等[20-21]和Graddy等[22]利用原生微生物和人工培养微生物对砂土进行了胶结对比试验,二者均能取得较好的胶结效果。
然而,上述研究仍存在以下问题:①在MICP试验中,一般选择自下而上的灌注方向注入溶液,这种单一方向的灌注方式导致碳酸钙较多沉淀在注入口附近,可能会影响激活和胶结效果,不利于MICP技术的现场实际应用;②在对土体中的天然原生微生物进行激活时,使用0.35 mol/L尿素时激活效果较好,微生物浓度和脲酶活性提升较快[21],但原生微生物被激活后进行的胶结处理过程中,灌注胶结液会导致微生物浓度和脲酶活性的下降,进而导致微生物分解尿素能力下降[16]。因此,胶结液若仍采用0.35 mol/L浓度的尿素,可能会导致尿素未被完全分解而进入环境中,造成污染和浪费;③在有机质选择中,Burbank等[19]使用糖蜜,但胶结处理后,样品完整性较差,Gomez等[20-21]和Graddy等[22]使用单一浓度的酵母提取物(YE),胶结效果稍好,但未进一步探究不同浓度YE在激活过程和胶结过程中的效果差异。基于此,本次研究采用单向灌注及双向交替灌注的方式、使用不同浓度的YE来激活土壤中的脲酶微生物,当土壤中的脲酶微生物达到一定浓度和活性后,对试样中的微生物进行鉴定与系统发育分析,然后进行胶结处理,胶结处理时使用不同浓度的YE及尿素溶液。试验过程中监测试样的生物化学变化,胶结完成后使用扫描电镜观察胶结样本的SEM图像,并进行无侧限压缩试验,综合评估有机质浓度、尿素浓度和灌注方式对激活及胶结效果的影响。
2 材料与方法
2.1 砂土采集和试样制备
试验所用砂土采自武汉东湖湖滨,采样深度0.5 m,试样基本物理性质参数见表1。

表1 试样基本物理性质参数Table 1 Basic physical property paramcters of soil samples
选用聚乙烯圆筒(内径50.0 mm,高180.8 mm,除去两端橡胶塞后装样,样品净高150.0 mm)作为模具,模具中间位置设置取样口,橡胶塞与砂土之间放置聚氨酯透水薄膜,以改善灌注时渗流均匀程度,并减小试验期间土颗粒的流失。流入和流出液锥形瓶顶端放置孔径≤0.22 μm的空气滤膜,以排除试验环境微生物的影响。采用分层制样的方法,保持砂土孔隙度与天然状态下相同。使用校准后的蠕动泵将预先配制好的激活液和胶结液按次序以2 mL/min的恒定流速灌注,试验装置见图1(图中显示自下而上灌注)。

图1 试验装置Fig.1 Model test system
2.2 MICP灌注试验
为揭示激活液和胶结液的灌注方式对胶结效果的影响,设计了两组对照试验,一组采用自下而上的单向灌注方式,试样编号为U11、U12、 U21、 U22、 U31、 U32;另一组采用自下而上和自上而下交替灌注的方式,样品编号为C11、 C12、 C21、 C22、 C31、 C32,两组试验灌注液成分相同。每次灌注处理后将试样置于30 ℃恒温箱中,利于微生物生长繁殖。
激活液和胶结液中的有机质为YE,YE营养丰富,含有大量氨基酸、微生物、碳水化合物以及维生素,能为微生物生长繁殖提供碳源及氮源。配制的激活液和胶结液YE浓度相同,如表2所示。氯化铵在脲酶微生物维持膜电位时可起到重要作用,尿素可筛选出脲酶微生物,因此,在激活液中添加了0.1 mol/L氯化铵、0.35 mol/L尿素,在胶结液中添加了尿素和等摩尔浓度的可溶性钙源(氯化钙),其浓度如表2所示。由于胶结过程中产生的过量铵根离子会抑制碳酸钙沉淀,且大多数脲酶微生物的最适合生长的pH值在8.5~9.2之间,因此待溶液配制好后,使用厂家Sigma-Aldrich生产的tris试剂调节溶液pH值至9.0。
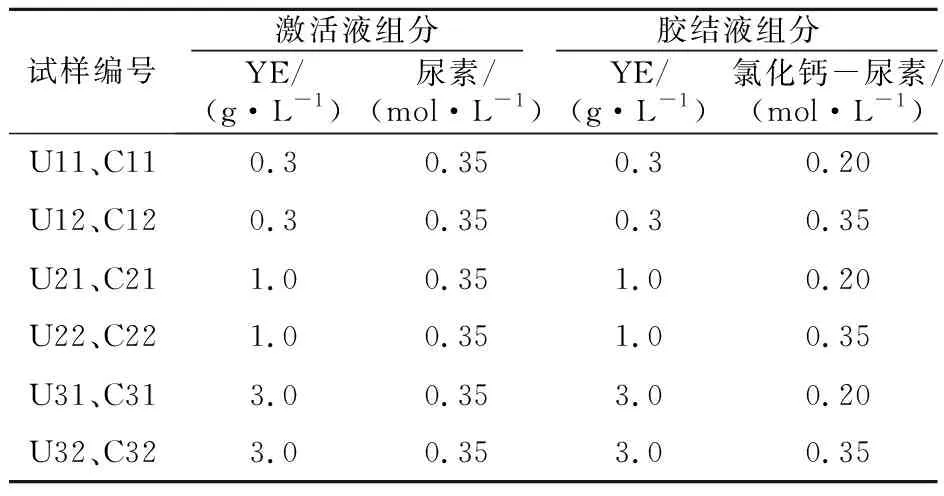
表2 溶液配比Table 2 Constituents and concentrations of treatment solution
试验开始首次注入120 mL(约1.2倍孔隙体积)激活液。由于此时原生微生物浓度很低,频繁的灌注操作将不利于原生脲酶微生物浓度的增加,故静置48 h后再进行第2次灌注,此后每24 h灌注1次。注入试样的尿素分解数量在一定程度上可以反映脲酶微生物的浓度和活性,在一定时间内尿素分解得越多,表明激活效果越好。本次试验以灌注24 h后试样中残余尿素浓度作为激活效果的评价标准,以注入尿素浓度的30%为阈值,当残余尿素浓度约为注入尿素浓度的30%时,可停止激活。停止激活后,取试样中液体鉴定其中的细菌,并做系统发育分析,然后向试样中灌注胶结液,进行胶结处理。为防止首次注入胶结液时在注入口附近产生大量碳酸钙沉淀而堵塞注入口,影响后续灌注,故在第1次注入胶结液之前,预先注入120 mL激活液以稀释尿素分解产生的高浓度碳酸根离子。在胶结阶段,胶结液灌注的时间间隔为12 h,灌注量为120 mL,循环灌注16次。
2.3 分析方法
2.3.1 生化分析
每次灌注前使用灭菌后的注射器从试样两端及中间的取样口抽取4 mL的液体,转移至无菌管中,分析测试其尿素浓度及微生物浓度。
2.3.1.1 尿素浓度测试
尿素浓度采用间接滴定的方式进行测定:在激活阶段,液体样品中的尿素(CO(NH2)2)分解后产生碳酸根(式(1)),未注入试样之前激活液中尿素浓度减去试样中的碳酸根浓度即为试样中的残余尿素浓度,使用氯化钙与液体样品反应生成碳酸钙沉淀(式(2)),再使用盐酸对碳酸钙沉淀进行滴定即可(式(3));在胶结阶段,由于胶结液中尿素和氯化钙的浓度相等,尿素分解产生的碳酸根与氯化钙反应后,残余尿素浓度等于残余氯化钙浓度,因此使用碳酸钠与样品进行沉淀反应(式(4)),得到碳酸钙沉淀,再使用盐酸对沉淀进行滴定,可得到残余氯化钙浓度(式(3)),即为残余尿素浓度。
(1)
(2)
CaCO3+2HCl→2H2O+CaCl2,
(3)
CaCl2+Na2CO3→CaCO3+2NaCl 。
(4)
2.3.1.2 微生物浓度测试
采用分光光度计在600 nm波长下测得液体样品在比色皿中的吸光度(OD600测试值),进行校正计数,计数公式[23]为
Y=8.59×107Z1.362 7。
(5)
式中:Y为微生物浓度;Z为OD600测试值,仅当OD600值在0.2~0.6范围内有效,OD600>0.6时需对液体进行稀释。
2.3.2 脲酶活性微生物种属鉴定及系统发育分析
试样中原生微生物被激活后取液体样本,进行脲酶微生物筛选:离心后取其上清液用无菌水进行梯度稀释,分别稀释105、106、107倍,然后使用移液枪吸取稀释后的上清液100 μL,均匀涂布于添加了酚红指示剂的LB固体筛选培养基上,在30 ℃下恒温培养,定期观察。挑取使固体筛选培养基颜色变红的不同菌株,在固体筛选培养基上划线纯化得到脲酶微生物,将纯化后的菌株送至中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC)完成测序,测序结果在美国国家生物技术信息中心网站(NCBI)上进行blast比对,以鉴定脲酶活性微生物的种类,并选取亲缘近的菌种进行系统发育分析。
2.3.3 胶结体强度及微观结构测试
2.3.3.1 无侧限抗压强度
胶结试验完成后,在拆模前将胶结的试样置于80 ℃的烘箱中干燥7 d,胶结前后砂土样如图2所示。为了评价胶结效果,按照《土工试验方法标准》(GB/T 50123—2019)进行无侧限压缩试验。

图2 胶结前后砂土样Fig.2 Sand samples before and after cementation
2.3.3.2 微观结构
为观察胶结完成后试样的微观结构特性,采取干燥后的试样,在2 kV的加速电压下,使用FEI Quanta场发射扫描电子显微镜获得SEM图像。
3 试验结果与分析
3.1 尿素浓度
3.1.1 激活阶段残余尿素浓度
U11与U12的激活处理相同,归为U1,同理可编号得到C1、U2、C2、U3、C3,图3为激活过程中各组试样不同位置处(试样上、中、下部)残余尿素浓度随时间变化曲线。残余尿素浓度下降越快,表明试样中脲酶微生物解脲能力越强。使用0.3 g/L YE的试样(U1、C1),解脲能力增长较为平缓,但在第5天单向灌注试样的中部以及上部有所波动,可能是测试误差所致,U1和C1试样的残余尿素浓度在第7天达到阈值附近;使用1.0 g/L的试样(U2、C2)前3天的解脲能力增长较慢,但第4天和第5天曲线斜率绝对值明显上升,解脲能力加速增长,在第5天其残余尿素浓度值达到了阈值;3.0 g/L YE的试样(U3、C3)解脲能力增长较为平稳,在第7天达到了阈值附近。

图3 激活阶段试样中的残余尿素浓度随时间的变化Fig.3 Residual urea concentrations for columns versus time since injection during stimulation
使用0.3、1.0、3.0 g/L YE分别在激活处理后的第7天、第5天、第7天达到了激活标准,使用相同配比溶液、不同灌注方式处理的试样,解脲能力变化较为接近,表明灌注方式对激活效果影响较小,而YE浓度对激活处理的影响较大。较高浓度的YE(3.0 g/L)并未让试样中原生脲酶微生物的解脲能力更快提升,使用较低浓度的YE(0.3 g/L)在激活原生脲酶微生物时表现不如稍高浓度的YE(1.0 g/L)。
3.1.2 胶结过程残余尿素浓度
图4显示残余尿素浓度随胶结次数的变化(0次对应的浓度表示初次灌注之前的初始浓度,1次对应第1次灌注处理12 h后试样中尿素浓度,也即第2次灌注前测得的尿素浓度,微生物浓度下同)。初始值的差异是由于各组在激活阶段使用的尿素浓度均为0.35 mol/L,而在胶结阶段有0.35 mol/L和0.20 mol/L 2种不同浓度的溶液。总体上使用1.0 g/L的YE的U2和C2组中残余尿素浓度低于使用0.3 g/L YE的U1、C1及使用3.0 g/L的YE的U3、C3。使用0.20 mol/L尿素的试样残余尿素较少,而使用0.35 mol/L尿素的试样残余尿素较多,使用0.3 g/L与1.0 g/L YE的试样中,残余尿素浓度在0.125~0.200 mol/L之间,而使用3.0 g/L YE的试样中,残余尿素浓度更高。对于单向灌注的试样,同一试样不同高度的尿素残余浓度差别较大,残余尿素浓度最高者为单向灌注试样的上部,最低者为其下部,而差值最大(见图4(a),U12的上部和下部的差值)可达0.110 mol/L。胶结过程试样中的残余尿素浓度表明,YE浓度对试样中尿素分解有显著影响,使用1.0 g/L的YE较使用0.3 g/L和3.0 g/L的YE,有利于分解更多的尿素。灌注方式对试样不同部位尿素的分解有显著影响,单向灌注时,在下部的尿素被分解较多,双向灌注的试样,上部、中部和下部的残余尿素浓度无显著差异,分布较为均匀。各个试样中,较高浓度(0.35 mol/L)的尿素不能被完全分解,而稍低浓度(0.20 mol/L)的尿素残余较少,使用1.0 g/L YE 时尿素基本被完全分解。

图4 胶结阶段试样中的残余尿素浓度随处理次数的变化Fig.4 Residual urea concentrations for columns versus treatment time since injection during cementation
3.2 微生物浓度
图5表示试样各高度微生物浓度与胶结处理次数的关系。所有试样在胶结前的微生物浓度均为1.0×108个/mL左右,表明灌注方式在激活阶段对微生物浓度的影响较小。开始胶结后,微生物浓度在第1次胶结过程中有所下降,之后均在较窄范围内波动,幅度不超过1个数量级。总体来看,使用1.0 g/L YE的试样微生物浓度最高,0.3 g/L的试样次之,3.0 g/L的试样最低。单向灌注的试样,上部微生物浓度比下部低1~3倍,而双向交替灌注试样中的微生物浓度总体在中部最低,较上部和下部低1倍左右,表明灌注方式会影响试样中微生物的分布,双向灌注的试样微生物分布均匀程度更高。使用相同浓度YE、不同浓度尿素和不同灌注方式的试样,微生物浓度较为接近,而YE使用量不等的试样,微生物浓度差别较大,表明提供营养的YE的浓度对微生物浓度的影响最大,且在胶结处理过程中,YE浓度过高并不会使微生物浓度随之升高。

图5 微生物浓度与胶结处理次数之间的关系Fig.5 Bacteria densities measured versus treatment times
3.3 无侧限压缩试验
部分试样(C12、U12、U21、U31、C32、U32)在胶结完毕后较为松散,拆模干燥之后达不到做压缩试验的长度标准,因此选择剩余的6个试样进行了无侧限压缩试验,结果如图6所示。
C11、U11、C21、C22、U22、C31的无侧限抗压强度分别为1.09、0.95、1.55、1.32、1.21、0.60 MPa。双向交替灌注处理的试样,取得4个完整试样(C11、C21、C22、C31),而采用单向灌注方式处理的试样,在拆模时完整性较差,仅取得2个完整试样(U11、U22),表明灌注方式对试样胶结效果影响较大;使用0.3、1.0、3.0 g/L YE处理的试样,分别取得2、3、1个完整试样,表明1.0 g/L YE处理的试样胶结效果最好。试验结果表明,采用双向交替灌注、1.0 g/L YE 处理的试样较完整,其中,C21的无侧限抗压强度(UCS)值最大,达1.55 MPa。
3.4 微观结构
图7为胶结后双向灌注试样样品表面的SEM图像。双向灌注试样与单向灌注试样的SEM图像未见显著差异,因此本文仅附双向灌注试样样品表面的SEM图像。SEM图像中可见棒状印模,为微生物参与胶结的痕迹,其长度在1~4 μm之间,直径约0.5 μm。C11、C12和C21、C22中微生物所留棒状印模(图7中白圈所示)清晰,而C31、C32没有明显印模。不同试样的碳酸钙晶体尺寸和形态不同,使用1.0 g/L YE处理的试样(C21、C22)的晶体颗粒明显大于使用0.3 g/L YE(C11、C12)处理的试样,且使用1.0 g/L YE处理的试样(C21、C22)中,晶体之间的连接较为紧密,表明较高浓度的YE(3.0 g/L)作用下,微生物在胶结过程中不一定更加活跃,生成的碳酸钙晶体的尺寸也不一定更大。

图7 胶结处理后土样的SEM图像Fig.7 Scanning electron microscope images of soil samples after cementaion treatment
3.5 试样脲酶微生物系统发育分析
在激活完成后,采用16SrRNA序列分析的方法对脲酶微生物进行了鉴定。本试验共计发现3属7种微生物(图8中粗体字)具有脲酶活性,在blast过程中选取与分离出的菌种亲缘关系相近的23个菌种进行系统发育分析,结果如图8所示。试样中分离的菌种有芽孢八叠球菌属(Sporosarcina)3种、赖氨酸芽孢杆菌属(Lysinibacillus)1种、动性球菌属(Planococcus)3种。试样中分离的菌种亲缘关系相近的23个菌种均属厚壁菌门,分属芽孢八叠球菌属(Sporosarcina)、赖氨酸芽孢杆菌属(Lysinibacillus)、类芽孢杆菌属(Paenisporosarcina)、嗜冷芽胞杆菌属(Psychrobacillus)、动性球菌属(Planococcus)、游动球菌属(Planomicrobium)、房间芽胞杆菌属(Domibacillus)。这些微生物均属于厚壁菌门,说明激活处理后的试样中的菌群具有明显特异性,厚壁菌门为绝对优势类群。

图8 试样中分离出的脲酶微生物的系统发育树Fig.8 Phylogenetic tree of cultural urease bacteria in soilcolumns
其中,YE浓度为0.3 g/L与1.0 g/L的试样中均出现6种微生物,分别是Sporosarcinapasteurii、Sporosarcinaterrae、Sporosarcinaureae、Planococcusversutus、Planococcusdonghaensis、Planococcusplakortidis;YE浓度为3.0g/L试样中仅出现3种微生物,分别是Sporosarcinapasteurii、Planococcusplakortidis、Lysinibacillusxylanilyticus,说明YE浓度过大不利于一些脲酶微生物的生长繁殖。
4 讨 论
在本次研究中,单向灌注处理的试样,从下到上微生物浓度依次降低,残余尿素浓度依次升高;双向交替灌注使溶解氧和有机质更为均匀地分布在整个试样中,尿素分解的均匀程度更高。这可能是因为灌注注入口直接接触溶解氧含量高的胶结液,且稀释了代谢废物。
相对于低浓度(0.3 g/L)的溶液,较高浓度的YE(3.0 g/L)未表现出更高的尿素分解速率。较高浓度的有机物不利于尿素分解,而且从微生物系统发育分析的结果来看,高浓度的YE对试样中微生物的多样性产生了消极影响。低浓度有机质(0.3 g/L的YE)无法为脲酶微生物提供足够的营养物质,在处理后期尿素分解能力增幅变小,这可能是有机质耗尽的标志。较高浓度的YE(3.0 g/L)处理下,胶结效果不佳,可能是因为浅地表土壤样品的微生物群落更多地适应有氧环境,而高浓度的有机质会消耗大量氧气,不利于脲酶微生物在胶结中的活动[24]。
激活处理后,试样中的脲酶微生物均属厚壁菌门,可能是由于厚壁菌门的菌株不光具有较厚的细胞壁保护,也能形成芽孢,具有极强的抗逆性[25]。
5 结 论
本文基于MICP技术,探究了激活液和胶结液的灌注方式、有机质浓度、尿素浓度对激活土中原生脲酶微生物与胶结处理效果的影响,得出了以下结论:
(1)在激活过程中,使用不同灌注方式处理的试样,原生脲酶微生物的浓度以及分解尿素的能力的提升情况无显著差异。胶结处理时,相比于单向灌注,双向灌注试样中的微生物分布及尿素分解更为均匀,胶结后的试样完整性更优。
(2)在激活和胶结处理过程中,1.0 g/L YE处理的试样,生成的碳酸钙晶体颗粒最大,胶结效果最好,UCS值达1.55 MPa;0.3 g/L YE处理的试样胶结效果次之;较高浓度的YE(3.0 g/L)在激活过程中对试样中微生物多样性产生了不利影响,胶结处理后生成的试样完整性较差,UCS值低,仅达0.60 MPa。
(3)胶结过程中使用0.35 mol/L尿素处理的试样,残余尿素浓度较高,而使用0.20 mol/L的尿素的试样在胶结过程中残余尿素较少,胶结效果较优,UCS值可达1.55 MPa。
