PLR和NLR与Ⅲ期非小细胞肺癌临床特征及同步放化疗联合免疫治疗疗效及预后的相关性
2022-05-19刘建清骆华春沈志勇林秀华
刘建清 骆华春 沈志勇 谭 平 林秀华
肺癌在全球范围内是发病率和死亡率最高的恶性肿瘤,非小细胞肺癌(NSCLC)是其中常见的病理类型[1]。Ⅲ期NSCLC总体预后相比于其他肿瘤存在较大距离[2]。Pacific研究奠定PD-L1联合同步放化疗在Ⅲ期NSCLC的地位,但Ⅲ期NSCLC患者具有较强的肿瘤异质性,有效的预后评估标志物可以对治疗方案的早期干预提供理论支持[3]。血小板与淋巴细胞比值(PLR)和中性粒细胞与淋巴细胞比值(NLR)均作为炎性因子的重要代表,已被证实可作为胃癌、食管癌、胰腺癌等实体瘤的独立预后因素,对疗效和预后可以进行有效的评估[4],但对于Ⅲ期NSCLC接受PD-L1联合同步放化疗的效果是否仍具有较好的预测价值,尚不明确。因此,本研究就此进行探讨。
1 资料与方法
1.1 临床资料
收集2017年12月至2020年1月于我院初治的Ⅲ期非小细胞肺癌患者的临床资料,纳入标准:①经组织学或者细胞学证实为非小细胞肺癌;②经外科评估后不可行根治性手术切除;③ECOG评分0~2分;④年龄18~65岁;⑤经评估无同步放化疗禁忌证,如肝肾功能损伤、肺功能评分低等;⑥经影像学证实TNM分期为Ⅲ期,且接受PD-L1联合同步放化疗。排除标准:①既往有免疫系统、血液系统疾病;②治疗前2周内使用激素治疗;③既往接受过抗肿瘤治疗;④孕期妇女。共64例患者纳入研究,全组患者的中位NLR值为2.66(1.17~8.63)、中位PLR值为177.52(73.2~338.74)、中位年龄48.2岁。基线评价时,各性别、年龄、ECOG评分之间的NLR、PLR具有可比性(P>0.05),Ⅲc期患者的PLR、NLR均值高于Ⅲa和Ⅲb期(P<0.05);T3+T4期患者的PLR、NLR均值高于T1+T2(P<0.05);N3患者的PLR、NLR均值高于N1和N2(P<0.05);见表1。本研究经医院伦理委员会批准,所有研究对象均签署知情同意书。

表1 不同临床特征患者的NLR、PLR水平比较
1.2 治疗方法
所有患者均接受同步放化疗联合PD-L1治疗。放射治疗方案:患者仰卧位,采用热塑记忆体模固定体模联合真空垫定位,西门子大孔径4.0CT扫描,扫描范围上界为舌骨水平、下界至肝下缘,扫描层厚为0.5 mm。将CT扫描图像传至Eclips系统后进行靶区勾画,肿瘤靶区体积(gross target volume,GTV)为肺部病灶(GTV1)和纵隔淋巴结病灶(GTV2),其中GTV1应包含肺窗下肺部病灶周围毛刺征;临床靶区体积(clinical target volume,CTV)为肿瘤病灶的纵隔淋巴结累及野照射。靶区定义及剂量如下:GTV1外放0.6 cm(腺癌)或者0.8 cm(鳞癌或其他病理类型)为PGTV1,95%PGTV1剂量为60 Gy/ 30 F/ 6 w;GTV2均匀外放0.5 cm为PGTV2,95% PGTV1剂量为54 Gy/ 30 F/ 6 w;CTV1上下外放1 cm,余方向均匀外放0.5 cm为PCTV,95%PCTV剂量51 Gy/ 30 F/ 6 w。采用三维适形静态调强放射治疗技术,同时正常器官限量:双肺V20<25%;脊髓最大剂量<45 Gy。
化疗方案:放疗第1天同步奈达铂120 mg 静脉续滴,每3周重复1次;PD-L1方案:同步放化疗后结束后1周使用,200 mg静脉续滴,每3周重复1次,持续6个月。
1.3 观察指标
PLR定义为血小板与淋巴细胞比值、NLR定义为中性粒细胞与淋巴细胞比值。按中位NLR值为2.46(1.17~8.63)和中位PLR值为177.52(73.2~338.74)为界,将研究对象分为高PLR组和低PLR组、高NLR组和低NLR组,比较不同组别之间临床特征的差别。按照RECIST 3.0评价不同组别之间近期疗效的差别,其中CR定义为:对比基线,靶病灶完全消失;PR定义为:对比基线,靶病灶的直径之和减少至少30%;SD定义为:未达到PR标准、也未达到PD标准;PD定义为:靶病灶增加超过20%,或者出现新发病灶;客观缓解率(objective relieve rate,ORR)为 CR+PR/总人数×100%。
1.4 随访
患者的OS定义为疾病诊断当天至失访或者死亡的时间;无疾病进展生存定义为疾病诊断当天至影像学检查证实出现局部复发或者远处转移的时间。随访内容包括血常规、血生化、胸部和腹部CT、头颅磁共振等,治疗结束后每3个月复查1次。
1.5 统计学方法
采用SPSS 18.0软件进行数据分析。计数资料采用n形式表示,组间比较采用χ2检验;各组的PLR、NLR采用均值±标准差表示,组间比较采用独立样本t检验;生存分析用Kaplan-Meier法并行Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 高PLR组和低PLR组、高NLR组和低NLR组之间临床特征的差别
高PLR组和低PLR组分别为28例和36例,高NLR组和低NLR组分别为25例和39例。高PLR组和低PLR组、高NLR组和低NLR组之间性别、年龄、ECOG评分之间比较无统计学意义(P>0.05);高PLR组和高NLR组的Ⅲc期患者分别多于低PLR组和低NLR组,且组间差异均具有统计学意义(P<0.05);高PLR组和高NLR组的T3+T4患者多于低PLR组和低NLR组,组间比较均具有统计学意义(P<0.05)。见表2。

表2 高低PLR、NLR组间临床特征的比较结果(例,%)
2.2 高PLR组和低PLR组、高NLR组和低NLR组之间临床疗效的差别
放疗结束时,高PLR组的客观缓解率为71.4%(20/28),低于低PLR组的91.7%(31/36),组间比较有统计学意义(χ2=4.532,P=0.03);高NLR组的客观缓解率为80.0%(20/25),低于低NLR组97.4%(38/39),组间比较有统计学意义(χ2=5.451,P=0.01);放疗结束后3月,高PLR组的客观缓解率为82.1%(23/28),低于低PLR组的94.4%(34/36)(χ2=4.061,P=0.04);高NLR组的客观缓解率为80.0%(20/25),低于低NLR组的97.4%(38/39),组间比较有统计学意义(χ2=5.451,P=0.01);见表3。

表3 高低PLR、NLR组间临床疗效的比较结果/例
2.3 高PLR组和低PLR组、高NLR组和低NLR组之间预后的差别
截止至2021年1月,随访时间12~36个月,中位随访时间(22.7±4.3)个月。高PLR组和高NLR组的1年PFS分别为85.7%(24/28)和80.0%(20/25),均低于低PLR组和低NLR组的94.4%(34/36)和92.3%(36/39),组间比较有统计学意义(P<0.05);高PLR组和高NLR组的1年OS分别为96.4%(27/28)和92.0%(23/25),低于低PLR组和低NLR组的100.0%(34/36)和97.4%(38/39),但组间差异无统计学意义(P>0.05)。
2.4 影响Ⅲ期NSCLC同步放化疗联合免疫治疗预后的单因素和多因素分析
单因素结果分析显示:TNM分期、T分期、N分期、PLR和NLR与Ⅲ期NSCLC同步放化疗联合免疫治疗预后有关(P<0.05);Cox多因素分析结果显示,N分期、PLR和NLR是Ⅲ期NSCLC同步放化疗联合免疫治疗预后的危险因素(P<0.05)。见表4。
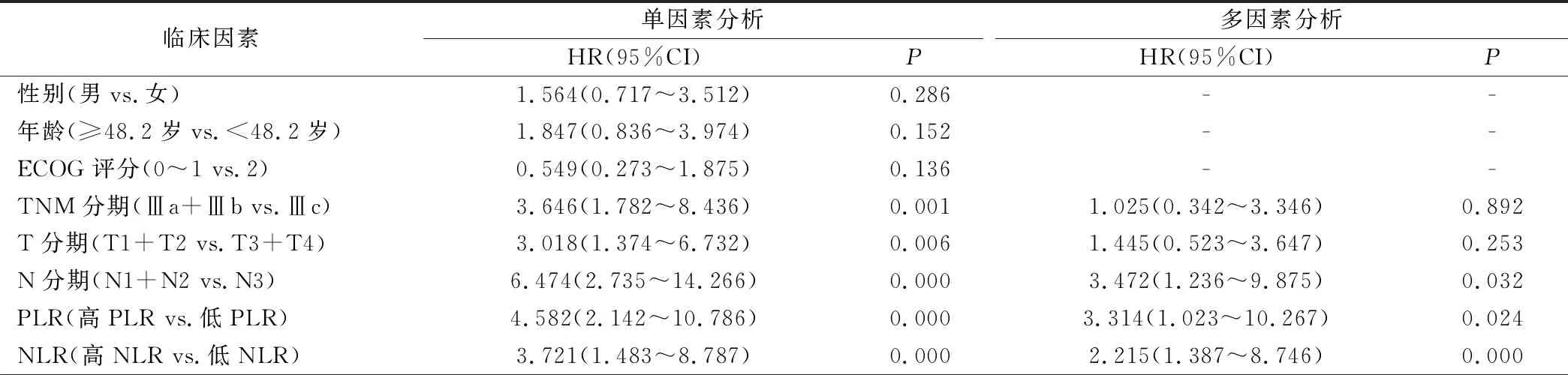
表4 影响Ⅲ期NSCLC同步放化疗联合免疫治疗预后的单因素和多因素分析
3 讨论
免疫治疗与放化疗相结合的治疗模式,是目前非小细胞肺癌研究的热点。虽然多项临床试验也证实该模式具有提高局控率等优势,但仍存在诸多问题,如:优势人群筛选、预后指标评估等[6]。本研究针对Ⅲ期NSCLC患者在接受同步放化疗联合免疫治疗的模式下,对外周血PLR和NLR进行检测,并进一步评价PLR和NLR与预后、临床生理病理特点的相关性,为Ⅲ期NSCLC患者的治疗方案确定提供数据支持。
PLR和NLR是外周血主要的炎症指标,已被证实可用于评价实体肿瘤的预后和治疗模式的疗效[7-9]。同时,PLR和NLR水平高低可反映早期肿瘤的浸润深度,与T分期密切相关,T分期越晚、PLR和NLR水平越高[10]。本研究纳入的研究对象为Ⅲ期NSCLC患者,T分期、N分期及TNM分期的研究结果也证实这一结论,可能与PLR和NLR水平与机体的炎症反应密切相关,肿瘤负荷的增加又加速了炎症反应[11],但是否对于Ⅳ期NSCLC和出现转移的NSCLC也具有一致的研究结果,尚需进一步证实;另外,PLR和NLR水平与各个分期的最佳截断值尚不明确,需扩大样本量进一步明确。ECOG评分是评价肿瘤患者体力状态的有效指标之一,可以间接评价肿瘤患者临床疗效和预后[12]。但不同的ECOG评分之间的PLR和NLR并未体现出差异,可能与不同观察指标对肿瘤患者的评估存在较大的特异性有关,初步证实Ⅲ期NSCLC患者的体力状态与机体的炎症反应并无直接的相关性。
炎性指标的高低与肿瘤的微环境密切相关[13],对于实体肿瘤患者,高NLR提示肿瘤具有的侵袭性和转移性,外周血NLR指标越高,肿瘤的负荷和活性越大[14,15]。血小板计数与肿瘤的扩散存在较强的相关性,血小板增多常反映肿瘤患者处于高凝状态,PLR可反映机体的炎症状态和血小板活化[16]。本研究中高PLR组和高NLR组中T分期、N分期和TNM分期偏晚的患者占比明显高于低PLR组和低NLR组,这与其他实体瘤的研究结果基本一致,间接进一步证实肺癌患者肿瘤的进展与机体的炎性反应密切相关,具体机制尚不明确[17]。慢性炎症的发生是机体的自我保护反应,保证机体内环境失衡能够得到延长,在癌变的过程中,扮演重要的角色,蛋白测定和炎症细胞计数是评估预后的重要指标[18]。Ⅲ期NSCLC患者不同PLR组和NLR组间的性别、年龄和ECOG评分未体现出差异,这与既往的研究结果类似,可能与一般临床特征对于预后的评估敏感度差有关[19],是否有更优的全血细胞计数来源的炎症生物标志物,如单核细胞与淋巴细胞比例等,或者营养指数评分用于评估预后,尚需进一步研究[20]。
现有的数据往往都是依靠严谨的随机临床试验获得,但在免疫治疗联合放化疗的临床研究中,常合并高龄、体力状态差等患者,这部分特殊人群的治疗效果和预后如何,更具有临床指导意义[21]。在有基因突变的NSCLC患者中,炎症指标与预后呈强烈相关性[22],本研究中纳入的人群均为非小细胞肺癌,在含有基因突变患者的总体人群随访中,高PLR和高NLR组的近期疗效和1年OS低于低PLR组和低NLR组,间接证实无论基因突变与否,Ⅲ期NSCLC患者的炎症指标与预后均呈相关性。一项有关PLR和NLR预测Ⅲ期NSCLC患者接受同步放化疗的疗效预测研究,结果显示PLR与OS显著相关,NLR等相关参数与OS无显著相关[23]。这与本研究的结论存在差异,可能与免疫治疗增加了机体炎症反应有关,具体机制尚需进一步研究。动态检测是客观评价过程中减少误差的方法之一,局部晚期NSCLC接受同步放化疗疗效的相关性研究显示,治疗期间NLR和PLR升高的患者,预后更差,治疗结束后1月后PLR和NLR是OS和PFS的预后因素[24]。受研究设计影响,本研究并未进行动态评估,该模式是否可以增加炎症指标评估的敏感性和特异性,尚不明确。虽然纳入研究对象例数仅64例,但证实NLR和PLR可作为评价Ⅲ期NSCLC患者预后的标志物,这与既往的研究结果一致[25]。即使免疫检查点抑制剂的使用药物存在差异,但在结果方面却呈现一致性,可能与各个药物所作用的靶点一致有关。在多因素分析中,也间接证实这一结论。
综上所述,PLR和NLR与Ⅲ期NSCLC的临床分期相关,且能够作为疗效及预后的评价指标,用于Ⅲ期NSCLC接受同步放化疗联合PD-L1治疗效果的评估。但受研究条件限制,本研究纳入的病例数较少,外周血检测炎症指标的干扰因素较多,这可能对研究结果造成偏倚。
