胃癌同时性肝转移22例临床手术治疗效果分析
2022-05-19章含昀邹兵兵熊茂明
章含昀,邹兵兵,熊茂明
(1. 安徽医科大学临床医学院,安徽 合肥 230031;2. 安徽医科大学第一附属医院,安徽 合肥 230022)
胃癌是临床上较常见并且病死率非常高的恶性肿瘤之一,目前胃癌发病率有逐年增高的趋势[1-2]。胃癌发展到晚期,易发生癌细胞转移,导致患者死亡率居高不下,其中,胃癌肝转移的致死率为最高,肝脏是胃癌最易转移的器官,患者一旦出现肝转移,生存期有限,治疗难度极大[3-4]。
胃癌肝转移(gastric cancer with liver metastasis,GCLM)目前在临床上一般分成两类,包含胃癌同时性肝转移与胃癌异时性肝转移,前者指胃癌患者在手术前或者手术后6个月内发现肝转移灶,而后者则指胃癌患者在手术6个月后发现肝转移灶。近年来,医学技术发展很快,治疗模式及治疗手段日益多样化,特别是手术理念不断更新,手术限制条件不断突破,很多晚期胃癌患者争取到外科手术切除病灶的机会。目前,针对胃癌同时性肝转移病人的外科手术切缘的系统性研究缺乏[5]。本研究选取胃癌同时性肝转移病人行外科手术治疗的病例,探讨GCLM病人适宜的治疗手段,以期延长GCLM患者的生存时间,改善患者生存质量。
1 资料与方法
1.1 临床资料 采集在2015年1月—2017年12月之间就诊于安徽医科大学第一附属医院的22例胃癌同时性肝转移病人的临床资料。12例患者行胃癌治愈性手术(R0),术后继续化疗,设定为R0手术治疗组(简称R0组);10例患者行胃癌治愈性手术(R1),术后继续化疗,设定为R1手术治疗组(简称R1组)。两组病人共计22例,其中男18例,女4例,年龄43~71岁,平均(62.40±7.90)岁。经病理学诊断,有20例患者为腺癌,另外在R0手术治疗组有1例患者为神经内分泌癌,在R1手术治疗组有1例患者为贲门溃疡型小细胞癌。两组病人入院就诊时的一般病理及临床资料分析比较,差异无统计学意义(P>0.05),见表1。本研究通过安徽医科大学第一附属医院伦理委员会的批准,经患者和家属同意并签署知情同意书。
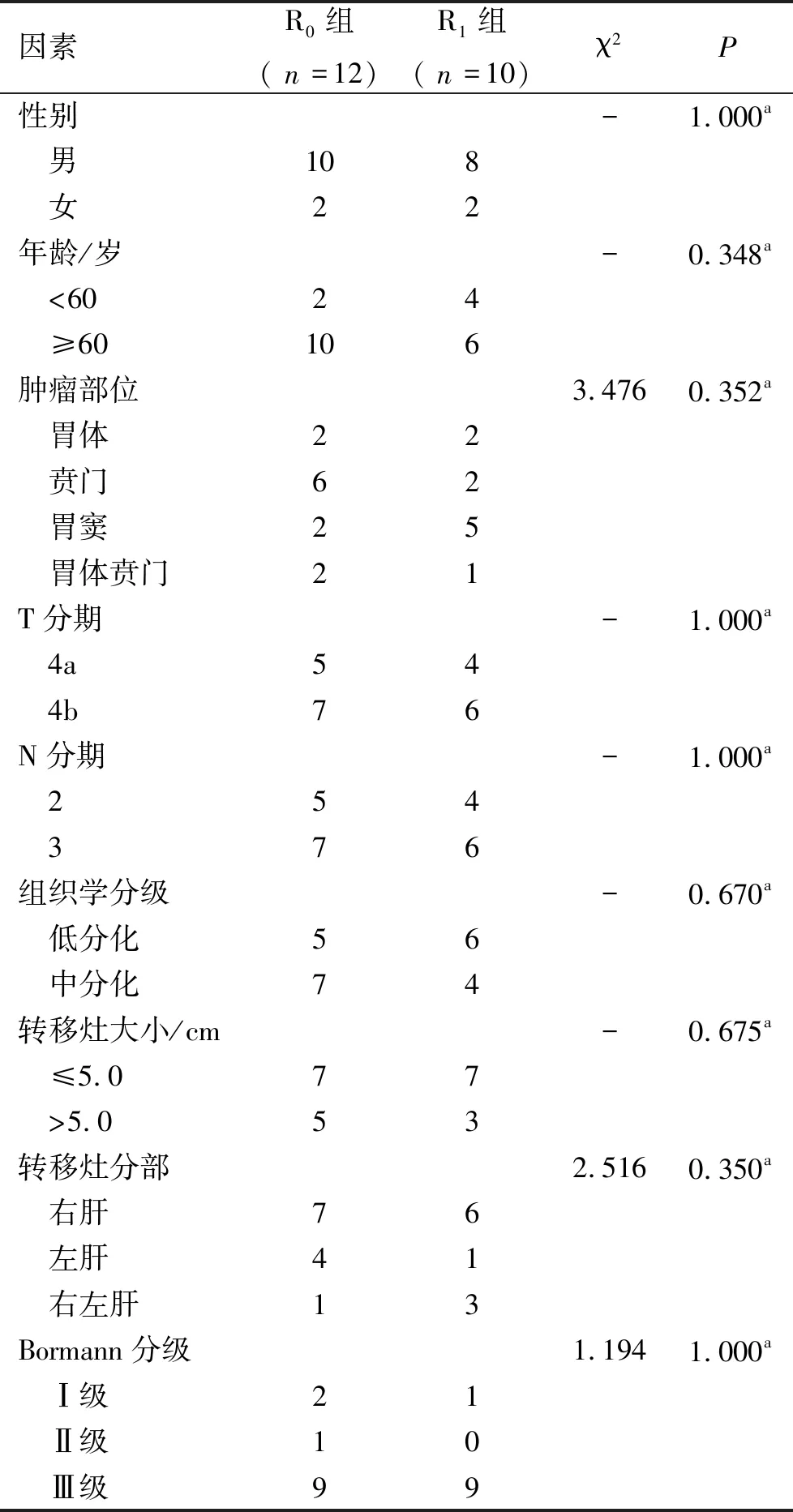
表1 两组患者入院时的一般病理及临床资料比较
1.2 纳入和排除标准 纳入标准:①患者年龄在40~75岁之间,可以耐受手术;②患者术前经过胃镜取活组织进行病理学检查以及术后对患者病理组织进行病理学检查,确诊为原发性进展期胃癌,依据国际抗癌联盟与美国癌症联合会于2017年发布的恶性肿瘤TNM分期标准第8版对肿瘤TNM分期的划分,确诊为胃癌Ⅳ期[6];③通过对患者的计算机X线断层扫描(CT)、彩超、病理标本等的检测,所有GCLM患者全部确诊为胃癌同时性肝转移,患者病灶可测,且明显[7];④临床病理资料齐全。排除标准:①患者不属于胃癌同时性肝转移的病例;②患者有其它恶性肿瘤病史;③患者重要脏器功能有障碍,不能耐受手术;④患者临床病理资料存在缺陷;⑤患者转为其它非外科手术的治疗方案。
1.3 治疗方法 22例患者均实行胃癌D2或者D2+根治术以及肝脏部分切除术,外科手术方式依照日本胃癌学会发布的《胃癌处理规约》(第14版)的操作要求[8]。术前接受化学药物治疗的患者有9例,没有接受化学药物治疗,直接手术的患者为13例。患者术后预防性使用广谱抗生素输液进行治疗,防止切口感染。及时根据致病菌检验结果决定是否使用特效抗生素对患者进行针对性治疗[9]。1~2 d后提醒患者下床在医院内进行适量走动,活动量以适度为宜。详细记录病人的手术时间、术中出血量、术后住院时间、病理分期、淋巴结清扫数目及患者病理组织检查结果、术后康复过程等,观察病人外科手术中以及术后的并发症发生情况。GCLM患者手术后达到如下标准即可出院:①患者各项生命体征在正常范围;②可以下床进行适量活动;③食欲正常,能流质饮食,患者大、小便正常;④不适症状得到控制或消失;⑤患者手术切口已愈合,无并发症或者并发症已治愈;⑥CT显示患者病灶已切除,无明显病理性占位现象。
1.4 随访与分析 患者行根治性手术切除病灶后定期进行随访,开始2年内随访间隔时间为3~6个月,第3年开始随访间隔时间为6~12个月。所有随访结果安排专人负责认真整理、仔细登记。随访主要内容如下:①询问患者本人或家属有关患者近期的身体与精神状况,仔细记录患者的饮食量、饮食习惯、睡眠时间、每日活动量、体重增减情况及大小便次数与外观等。②记录患者近期的生化检查结果(血常规、肿瘤标志物、肝肾功能和大小便常规)、胃镜、影像学检查结果(胸腹盆腔CT与超声检查,其中部分患者根据需要进行PET-CT检查)等。③询问患者或其家属近期患者治疗康复状况,详细记录患者治疗过程与治疗方案;如果患者已经死亡,询问患者家属有关患者的死亡原因,记录患者的死亡时间。另外对患者或患者家属随访的方式可以多样化,可邀请患者或家属进入微信群进行交流,随时回答患者及家属提出的问题。电话随访时,耐心聆听患者或家属的诉求,指导患者及时门诊随访,调查者如果使用书信调查方式随访,可充分发挥微信及电子邮件的作用,采用电子信函的方式传递患者随访调查表,增强与患者及家属的沟通,保持与患者的联系,另外住院病历查询也是随访方式之一,信息丰富,内容全面,资料详实,查阅极其方便。
根据患者住院期间诊疗情况以及对患者的随访结果,统计分析GCLM患者的预后及对生存期的影响因素,22例患者生存期的开始时间从胃癌同时性肝转移确诊之日算起,终止时间为GCLM病人的死亡时间或者本研究的最后一次随访时间。以月为随访单位计算,随访截止时间为2021年9月30日,在随访截止时间依然存活的病人用删失数据显示。
1.5 统计学方法 采用EXCEL及SPSS 24.0软件对患者诊疗和随访过程中记录及整理的数据纳入统计学分析。检验两组患者间临床病理特征的差异显著性,运用SPSS 24.0软件中比较平均值(M)法统计患者的平均生存时间和中位生存时间(Median Survival Time,MST),运用生存分析(s)中的Kaplan-Meier法计算两组患者的1~4年累积生存率,采用秩的对数(Log-rank)法分析比较两组患者总体生存状况,采用COX回归法对22例患者的相关临床病理因素进行单因素与多因素分析。计数资料以频数表示,采用χ2检验。分析结果以统计量P<0.05表示组间差异具有统计学意义。
2 结果
2.1 患者手术及并发症的情况 R0手术治疗组:12例患者外科手术治疗均获得成功。手术时间为105~315 min,平均为(202.92±68.31) min,术中出血量为50~200 ml,平均为(122.50±39.11) ml。术后第1天或第2天下床适度活动,术后有效住院5~15 d,平均(9.33±3.39) d。R1手术治疗组:10例患者外科手术治疗均顺利完成,1例为胃切除阳性,9例为肝切除阳性。手术时间为120~435 min,平均为(215.30±102.68) min,术中出血量为50~150 ml,平均为(92.00±40.50) ml。患者术后第1天或第2天下床在院区适量活动,术后住院4~11 d,平均(7.70±2.06) d。22例患者手术中没有发生大出血情况,全部痊愈,术后未出现腹腔脓肿、吻合口瘘以及肠梗阻等并发症。两组病人的外科手术时间、术中的出血量及术后的住院时间比较,差异无统计学意义(P>0.05)。所有患者手术安全性良好,术后经过一段时间治疗,能流质饮食,二便正常,可下床适度走动,无明显不适症状,手术切口愈合正常,经CT检查,病灶已切除,全部达到出院标准,顺利出院。
2.2 淋巴结清扫数目及淋巴结转移情况分析 R0手术治疗组总共清扫淋巴结数目为253枚,其中清扫阳性淋巴结数目共有28枚。平均每例病人清扫淋巴结的数目为(21.08±10.29)枚、每例患者平均检获的D1站淋巴结数目及D2站淋巴结数目分别为(14.83±6.77)枚及(6.25±6.11)枚。R1手术治疗组总共清扫淋巴结数目为199枚,其中清扫阳性淋巴结数目共有56枚。平均每例病人清扫淋巴结的数目为(21.60±13.66)枚、每例患者平均检获的D1站淋巴结数目及D2站淋巴结数目分别为(11.40±6.95)枚及(10.20±8.35)枚。与R0手术治疗组相比较,差异无统计学意义(P>0.05)。但R0手术治疗组清扫的淋巴结中阳性癌细胞转移率(11.07%,28/253)比R1手术治疗组检获的淋巴结中阳性癌细胞转移率(28.14%,56/199)明显偏低,二者比较差异有统计学意义(χ2=21.460,P<0.001)。
2.3 术后化疗和随访 所有患者手术治疗后均行2~6次辅助化疗,消灭体内残存的癌细胞,化疗不良反应主要表现为胃肠道症状以及周围神经中毒症状等。22例患者全部获得随访,时间截止为2021年9月,随访时间为50~80个月,中位随访时间64.6个月,随访结束时,仍有2例患者存活,2例患者生存时间分别为52个月及60个月,均为R0手术治疗组患者。
2.4 R0手术治疗组与R1手术治疗组患者的生存情况比较 运用SPSS 24.0软件比较平均值(M)法观察两组病人的生存情况,分析结果显示R0手术治疗组病人的平均生存时间为(29.92±16.00)个月,中位生存时间(MST)为23.50(14~60)个月;R1手术治疗组患者的平均生存时间仅有(10.10±4.68)个月,MST为10.50(4~18)个月。
通过SPSS 24.0软件Kaplan-Meier法观察两组患者的预后情况,结果显示R0手术治疗组病人的生存曲线优于R1手术治疗组病人的生存曲线,R0手术治疗组病人的1年、2年、3年及4年的累积生存率分别为100.00%、41.67%、33.33%及16.67%;R1手术治疗组病人的1年、2年及3年累积生存率分别为50.00%、0.00%和0.00%,两组患者的累积生存率比较,差异具有统计学意义(χ2=19.098,P=0.000012<0.05),见图1。

图1 GCLM病人R0手术治疗组和R1手术治疗组的累积生存曲线
2.5 影响病人预后的单因素及多因素分析 使用SPSS 24.0软件COX回归法对影响GCLM病人预后的相关临床病理因素考察患者性别、发病年龄、病理T分期、病理N分期、组织学分级、转移灶大小、D2淋巴结、Borrmann分型、术前化疗及肿瘤根治程度与患者生存时间分别作为变量输入COX回归模型进行COX单因素分析,结果显示:肿瘤患者的病理T分期、N分期、D2淋巴结、术前化疗及手术分组为影响同时性GCLM病人预后的相关病理因素(P<0.05),见表2。
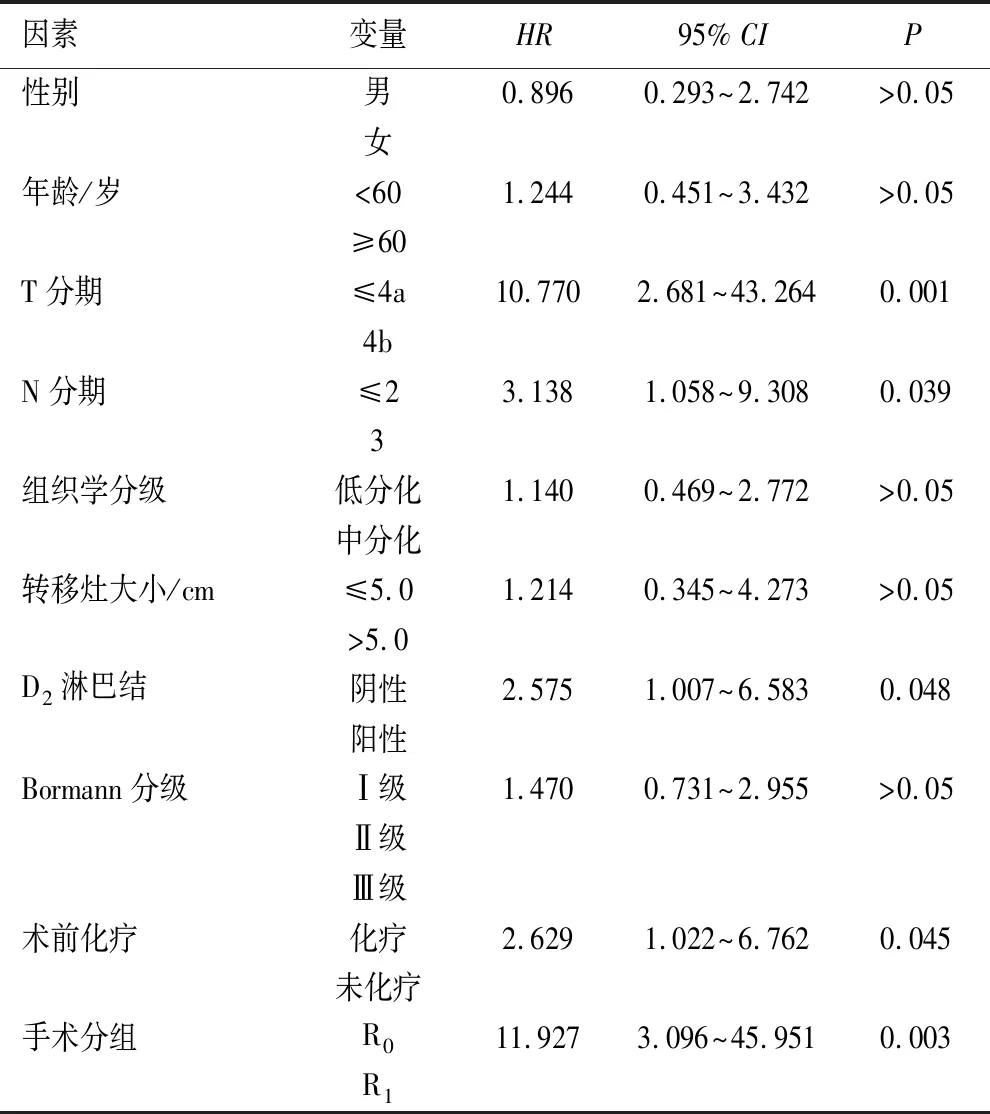
表2 GCLM病人总生存期的单因素分析
为了排除单因素分析中各客观病理因素之间发生相互影响的现象,将上述GCLM病人预后的单因素分析中表现出具有统计学差异的病理因素变量进行总生存期的多因素分析,分析结果显示:GCLM病人的病理T分期及手术分组(R0组/R1组)是影响患者预后的重要因素(P<0.05),见表3。

表3 GCLM病人总生存期的多因素分析
3 讨论
胃癌在全球范围内呈现高发状态,年发病率增长速度达到 30万人/年[10],在我国该病的发病率居高不下,胃癌晚期患者一旦出现肝转移,预后极差[11-12]。
针对GCLM病人的治疗方法有很多种,临床上常见的有外科手术治疗、化学药物治疗、介入治疗与分子靶向药物的精准治疗等,然而治疗患者的最佳方法仍存在争议,尚在探索之中[13],其中以外科手术治疗为首选的综合治疗是临床上认为比较合理的治疗方法,但对于其远期治疗效果仍需要更多的多中心与多学科临床实验去探索。Markar SR等[14]研究报道,在掌握良好外科手术指征的情况下,同期联合行GCLM患者的原发灶及转移灶根治性手术切除可改善患者的生存预后;Sonoda I等[15]对 24 例胃癌肝转移病人治疗手段研究中发现,对GCLM患者联合行肝转移灶R0切除可延长患者生存期;Cheon SH等[16]报道,对GCLM病人行外科手术联合原发灶与转移灶切除,即使患者手术切缘为阳性,即未做到R0切除但行胃癌原发灶与肝转移灶的联合同期手术切除,也可使患者的生存受益,取得较好的临床效果,但患者生存期依然十分有限,难以达到长期生存的预期。本研究于2021年9月随访结束时,有2例患者存活,生存期均已超过4年,其中1例患者生存期超过5年,2例患者均为R0切除,获得长期生存的良好预后;R1切除组患者2年生存率为0.00%,该组患者生存期在4~18个月之间,可见R1切除组患者生存期有限,R0切除组患者有长期生存的机会。
GCLM患者根治性外科手术中的淋巴结清扫计数对于评估GCLM患者治疗疗效、改善GCLM患者的预后意义重大。为此,外科医师在术前准确评估患者淋巴结的转移及分布情况非常重要。如果患者体内大量无转移的阴性淋巴结在手术中被清除,患者淋巴系统的屏障保护作用即遭到破坏,结果将直接导致患者机体抵御疾病的免疫保护能力下降,引起患者体内出现较低的淋巴水平,可能缩短患者的生存期[17]。判断患者病灶周围淋巴结转移情况,目前还没有形成统一的诊断标准,一般可以从患者病灶周围淋巴结短径、短径和长径的比值、淋巴结形态以及CT影像学测定结果进行综合统计与分析。淋巴结参数来源于外科医师手术中切除患者病灶的完整组织标本,需在手术后将淋巴结从完整的组织标本中分离开来,然后做淋巴结病理检查,这一过程需要非常仔细和认真地操作。 根治性GCLM患者切除手术的淋巴结计数来源于送检组织的淋巴结计数,其计数准确性可能对胃癌的病理分期以及手术效果的评价带来影响。对切除组织淋巴结计数的准确性影响较大的因素主要有如下几点:①手术中病灶周围淋巴结切除范围和解剖程度;②手术后从送检组织标本中成功分离出来用于统计分析的淋巴结数量;③淋巴结阳性的病理学检查计数。淋巴结统计总数和GCLM患者体内癌细胞转移的淋巴结数量存在正相关的关系,但是定量评价晚期胃癌恶性程度和淋巴结计数的关系仍有争议,Qiu MZ等[18]进行一项淋巴结计数研究总共纳入221例胃癌患者数据,结果显示淋巴结计数阳性比例与胃癌患者根治性切除手术的预后评估存在关联。本研究R0手术治疗组检获的淋巴结计数中癌细胞阳性比例为11.07%,R0手术治疗组患者3年累积生存率为33.33%;R1手术治疗组检获的淋巴结计数中癌细胞阳性比例为28.14%,R1手术治疗组患者3年累积生存率为0.00%,可见淋巴结计数阳性比例和GCLM患者根治性切除手术的预后有负相关关系。
本研究对影响GCLM患者生存预后的相关临床病理因素进行分析,结果表明,患者病理T分期和N分期、术前化疗、D2淋巴结阴性及GCLM根治性手术R0切除是影响患者预后的相关因素,病理T分期与手术根治度是影响患者预后的独立因素。梁品等[19]研究进展期胃癌的临床疗效发现胃癌肝转移(GCLM)患者的T分期、N分期、术前化疗及外科手术的R0切除等因素对GCLM患者的生存预后有重要影响,与本研究相似。韩龙才等[20]研究GCLM外科手术治疗的相关影响因素发现术前化疗是外科治疗效果的影响因素,分析原因可能是术前化疗可以一定程度上使肿瘤降期,进而尽量避免因手术操作造成的癌细胞脱落种植,另外,GCLM患者往往伴随着一定程度的微小转移灶,术前化疗可以有效地杀灭微小癌细胞转移灶,进一步保证手术效率。孙新增等[21]研究GCLM的手术治疗与预后相关因素分析,表明浆膜侵犯、淋巴转移及手术根治度(R0/R1手术切除)等因素为影响GCLM患者生存预后的相关因素。Ito S等[22]研究晚期GCLM患者行根治性手术R0切除后,MST较行R1手术切除患者的MST显著延长,二者比较,差异存在统计学意义(P<0.05)。Yamamoto M等[23]报道进展期胃癌患者行R0切除的中位总生存期(overall survival,OS)较行R1切除的中位OS明显延长(794 d vs.485 d,P<0.05)。本研究中,GCLM患者行根治性手术R0切除病人的中位OS为23.50个月,R1切除病人的中位OS为10.10个月。可见,对于GCLM患者行R0根治性切除后可以明显延长生存时间,R0根治性切除是影响患者生存预后的重要因素。
综上所述,GCLM患者总体预后需进一步改进,对于GCLM病人积极采取外科手术的R0切除,其效果明显优于R1手术切除效果,并且不引起患者外科手术中出血量的明显增加及术后住院时间的明显延长,手术安全性良好,患者可获得较长的生存期。病理T分期及外科手术R0切除是影响GCLM患者预后的独立因素。 因此在诊治GCLM患者时,应对相关因素综合考量,采取术前化疗等手段降低患者肿瘤分期,合理治疗,为患者创造R0手术切除的机会,达到进一步延长GCLM患者生存时间,改善患者生存质量的目标。
