暗黑鳃金龟碱性磷酸酶HpALP的基因克隆、表达及其与Bt Cry8Ea3的结合特性
2022-05-19乔英翠陆秀君李瑞军
乔英翠, 赵 丹, 王 哲, 陆秀君,3,*, 郭 巍,2,*, 李瑞军
(1.河北农业大学植物保护学院, 河北保定 071001; 2.中国农业科学院研究生院, 北京 100081;3.河北省核桃工程技术研究中心, 河北临城 054300)
暗黑鳃金龟Holotrichiaparallela属鞘翅目(Coleoptera)鳃金龟科(Melolonthidae),其幼虫蛴螬是主要的地下害虫之一,寄主范围广,防治困难(Zhangetal., 2018; Lietal., 2021)。目前常用的化学防治措施可能对天敌等非靶标昆虫产生危害,利用病原微生物防治害虫的生物防治方法具有明显优势,并已在农林害虫防治上应用。苏云金芽胞杆菌Bacillusthuringiensis(Bt)是目前研究最深入的微生物杀虫剂,为了高效防控暗黑鳃金龟,对不同的Bt晶体蛋白的杀虫活性进行了筛选和评价,结果表明,Cry3和Cry8类是对暗黑鳃金龟有高毒力的Cry蛋白,Cry1类对鳞翅目害虫具高毒力而对鞘翅目暗黑鳃金龟无毒力(Höfte and Whiteley, 1989; 黄颖等, 2018)。Cry8类蛋白中尤以Cry8Ab, Cry8Ea, Cry8Ga和Cry8Na1等对暗黑鳃金龟具较高的杀虫活性(Shuetal., 2009; Lietal., 2014)。
Cry蛋白的作用机制主要有细胞穿孔和信号转导两种模型,Cry类蛋白杀虫的关键在于其与受体蛋白结合使昆虫肠道形成孔洞导致死亡(Beletal., 2020)。目前Cry类蛋白的中肠受体主要有碱性磷酸酶(alkaline phosphatase, ALP)、钙黏蛋白(cadherin,CAD)、氨肽酶N(aminopeptidase N, APN)和三磷酸腺苷结合盒转运蛋白(ATP-binding cassette transporter, ABC)及其他中肠蛋白(Zhangetal., 2017)。碱性磷酸酶是一类高度保守的磷酸水解酶,主要分布于柱状细胞微绒毛上以及中肠上皮细胞(袁向东等, 2017)。 目前,碱性磷酸酶ALP作为Cry蛋白的受体已经在烟草天蛾Manducasexta、亚洲玉米螟Ostriniafurnacalis、甜菜夜蛾Spodopteraexigua、斜纹夜蛾Spodopteralitura、棉铃虫Helicoverpaarmigera、二化螟Chilosuppressalis等多种鳞翅目昆虫中进行了报道(Qiuetal., 2017; Shuetal., 2017; Renetal., 2018)。 在埃及伊蚊Aedesaegypti、冈比亚按蚊Anophelesgambiae等双翅目昆虫中发现ALP蛋白与不同类型的Cry蛋白结合并发挥作用(Batooletal., 2019)。而有关鞘翅目昆虫Cry蛋白碱性磷酸酶ALP受体的报道尚很缺乏,目前仅在黄粉虫Tenebriomolitor中分离得到与Cry3Aa特异性结合的ALP蛋白(Zúiga-Navarreteetal., 2013),并发现棉铃象甲Anthonomusgrandis中肠的ALP是Cry1Ba6的受体蛋白(Martinsetal., 2010)。有关重要农业害虫暗黑鳃金龟Cry蛋白受体的研究尚不成熟,对暗黑鳃金龟Cry8Ea3的碱性磷酸酶受体蛋白的研究尚未见报道。
本实验室前期分离鉴定出cry8Ea及cry1Ab35,并构建了相应的工程菌株HD8Ea3和HD1Ab35。Cry8Ea3和Cry1Ab35分别对鞘翅目暗黑鳃金龟、鳞翅目美国白蛾Hyphantriacunea产生较高毒力,Cry8Ea3对暗黑鳃金龟1龄第12天幼虫LC50为103.75 μg/g(王伟, 2017; Zhang, 2017)。为了明确Cry8Ea3蛋白对暗黑鳃金龟的作用机制,本研究利用暗黑鳃金龟转录组数据,克隆碱性磷酸酶基因HpALP并在体外进行表达,制备多克隆抗体;对该基因进行时空表达分析;将HpALP重组蛋白与Cry8Ea3进行体外结合分析,以期为明确Cry蛋白对暗黑鳃金龟的作用机制提供理论依据。
1 材料与方法
1.1 供试材料
暗黑鳃金龟成虫采集于河北省保定市莲池区军校广场,室内用榆树叶片饲养得到虫卵,孵化后用无毒自制饲料饲养至3龄幼虫。
大肠杆菌EscherichiacoliDH5α、BL21以及质粒pET-30a由本实验室保存;HD8Ea3和HD1Ab35工程菌株由本实验室前期构建并保存。限制性核酸内切酶BamHⅠ和Hind Ⅲ,T4 DNA连接酶,高保真酶(PrimeSTAR®Max DNA Polymerase),反转录试剂盒(cDNA Synthesis Kit),荧光定量酶(SYBR®Premix Ex TaqTMⅡ)等均购自宝生物工程(大连)有限公司;动物组织总RNA提取试剂盒购自中国北京天根生化科技有限公司;羊抗小鼠IgG-AP抗体、羊抗兔IgG-AP抗体均购自中国武汉博士德生物工程有限公司。
1.2 HpALP的克隆
选取状态良好的暗黑鳃金龟3龄幼虫,置于冰上预冷3 min,解剖取中肠置于1%焦碳酸二乙酯(DEPC)中,反复冲洗直至无残渣及其他组织,迅速放于液氮中,于-80℃保存备用。参照动物组织总RNA提取试剂盒说明书提取暗黑鳃金龟3龄幼虫中肠RNA。以提取的RNA作模板用反转录试剂盒合成cDNA。
根据已知的暗黑鳃金龟转录组数据,利用DNAMAN V6.0设计带有酶切位点BamHⅠ和Hind Ⅲ的特异性引物HpALP-F和HpALP-R(表1),以暗黑鳃金龟幼虫中肠cDNA作为模板进行PCR扩增。PCR扩增体系(25 μL): 中肠cDNA模板1 μL, 上下游引物(10 μmol/L)各1 μL, 2×PrimeSTAR Max Premix 12.5 μL, 灭菌的ddH2O 9.5 μL。反应条件: 94℃ 3 min; 95℃ 45 s, 59℃ 45 s, 72℃ 2 min, 30个循环;72℃延伸10 min。PCR产物经纯化回收后与pET30a质粒进行连接,重组质粒转化大肠杆菌DH5α感受态细胞,挑取阳性克隆,验证正确的重组子送至华大基因测序。
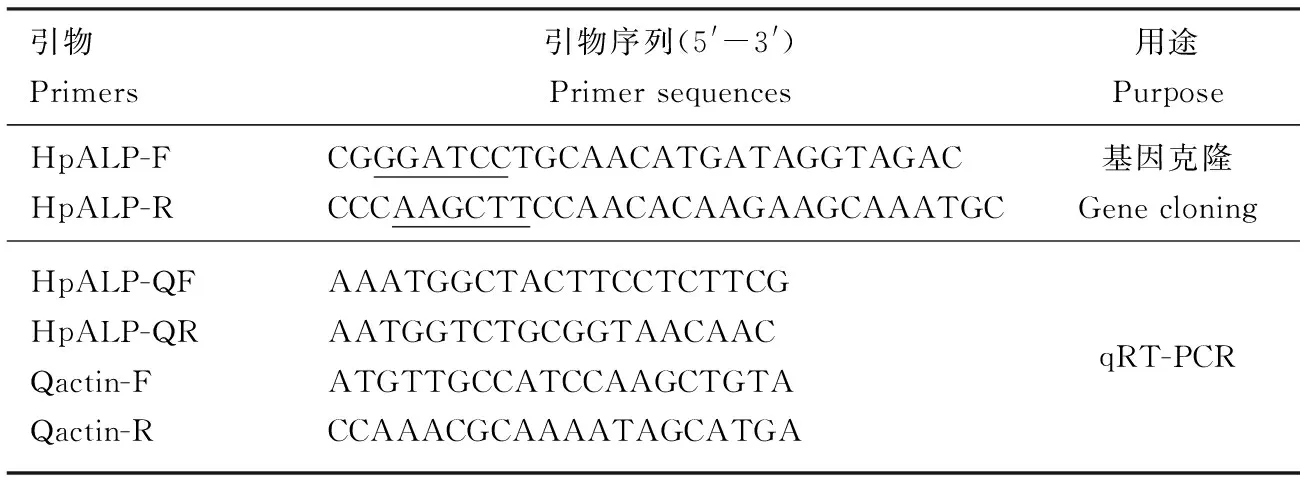
表1 本研究所用引物Table 1 Primers used in this study
下划线分别为BamH Ⅰ和Hind Ⅲ酶切位点。The restriction sites ofBamH Ⅰ andHind Ⅲ are underlined, respectively.
1.3 HpALP的序列分析和系统发育树构建
利用DNAMAN V6.0软件对HpALP基因序列的开放阅读框以及编码氨基酸、蛋白分子量和等电点进行预测,利用SignalP 5.0 Server(https:∥services.healthtech.dtu.dk/service.php?SignalP-5.0)和Big-PI Predictor(https:∥mendel.imp.ac.at/gpi/gpi_server.html)对信号肽及GPI锚定位点(glycosylphos-phatidyl-inositol anchor, GPI-anchor)进行分析,利用NetOGlyc 4.0 Server(https:∥services.healthtech.dtu.dk/service.php?NetOGlyc-4.0)和NetNGlyc1.0 Server(https:∥services.healthtech.dtu.dk/service.php?NetNGlyc-1.0)分别对O-糖基化位点和N-糖基化位点进行预测。将得到的HpALP蛋白在NCBI上进行Blast,检索到10种鞘翅目昆虫即蜂巢小甲虫Aethinatumida、白蜡窄吉丁Agrilusplanipennis、光肩星天牛Anoplophoraglabripennis、中欧山松大小蠹Dendroctonusponderosae、玉米根萤叶甲Diabroticavirgifera、马铃薯甲虫Leptinotarsadecemlineata、食粪金龟Onthophagustaurus、北美萤火虫Photinuspyralis、米象Sitophilusoryzae和赤拟谷盗Triboliumcastaneum的ALP氨基酸序列,利用ClustalX 和MEGA 5软件进行序列比对并构建系统发育树。
1.4 HpALP的原核表达和抗体制备
将1.2节构建的重组质粒pET-30a-HpALP转化至BL21感受态细胞,挑取重组子,活化培养,提取质粒,进行酶切和PCR验证。筛选出正确的重组菌过夜培养,次日转接培养至OD600=0.5加入终浓度为0.5 mmol/L的IPTG,37℃诱导4, 6和8 h后取样各1 mL,以未诱导的菌液作为阴性对照,10%聚丙烯酰胺凝胶电泳分离HpALP蛋白,并将HpALP蛋白转移至PVDF膜上,以实验室前期保存的Anti-His抗体为一抗,带有碱性磷酸酶标记的羊抗小鼠抗体为二抗,Western blot分析重组蛋白的表达情况。将HpALP蛋白大量表达后,利用亲和层析方法纯化重组蛋白,送至河北省生物研究所制备特异抗体。
1.5 HpALP在暗黑鳃金龟幼虫组织中的表达检测
参考1.2节方法分别制备暗黑鳃金龟3龄第2天幼虫的前肠、中肠、直肠、回肠、马氏管、脂肪体和体壁等组织的cDNA模板。HpALP及内参基因Hpactin的qRT-PCR引物见表1。利用SYBR GREEN法进行qRT-PCR,每样品来自3头个体,3次技术重复。反应体系(20 μL): SYBR(2×)10 μL, cDNA模板1 μL, 上下游引物(10 μmol/L)各1 μL, 灭菌ddH2O 7 μL。反应条件: 95℃ 30 s; 95℃ 5 s, 55℃ 30 s, 72℃ 30 s, 40个循环。以内参基因的表达量为标准参量,利用2-ΔΔCt法计算相对表达量。
1.6 Cry8Ea3毒素与HpALP蛋白配体结合特性分析
活化培养工程菌HD8Ea3,等电点法提取Cry8Ea3毒素蛋白,27℃胰蛋白酶(trypsin)消化1 h活化毒素,活化后得到大小为60 kD的Cry8Ea3毒素蛋白(王伟, 2017),参考常梦颖等(2019)的方法,以同处理对鳞翅目美国白蛾高毒力的Cry1Ab35(Zhangetal., 2017)毒素(实验室保存的活性毒素蛋白)为对照。将纯化的1.4节制备的HpALP重组蛋白用5×上样缓冲溶液溶解,分别与2 μg Cry8Ea3和Cry1Ab35活性毒素蛋白孵育1 h,在Cry8Ea3和Cry1Ab35抗体稀释10 000倍条件下进行配体印记实验,分析HpALP蛋白与Cry8Ea3毒素的结合特性。
1.7 Cry8Ea3与HpALP的亲和力测定
运用ELISA方法,以Cry1Ab35为对照,分别测定Cry8Ea3和Cry1Ab35毒素与HpALP重组蛋白的亲和力。将1.4节制备的经磷酸盐缓冲液稀释为终浓度5 μg/mL的HpALP重组蛋白100 μL加入酶标板于4℃包被过夜。次日加入200 μL 1% BSA于37℃封闭1 h后,用TBST/TBS清洗,分别加入浓度为0, 50, 100, 150, 200, 250, 500, 1 000和2 000 nmol/L的Cry8Ea3的活性毒素于37℃孵育1 h,经TBST/TBS清洗后,加入一抗(实验室保存的Cry8Ea3)于37℃孵育1 h,再次用TBST/TBS清洗,加入二抗(AP标记羊抗兔)于37℃孵育1 h,经pNPP显色15 min,加入3 mol/L NaOH终止反应,使用iMark酶标仪在单波长405 nm的波长下进行测定。采用同样方法对Cry1Ab35与HpALP亲和力进行测定(实验室保存的Cry1Ab35抗体),计算Cry8Ea3和Cry1Ab35毒素与HpALP蛋白间解离常数Kd与最大亲和力Bmax。
1.8 数据分析
数据采用Excel 2007进行整理,利用SPSS Statistics 26.0单因素分析方法进行差异显著性分析。解离常数Kd、最大亲和力Bmax及作图采用Graphpad Prism 5.0软件进行分析整理。
2 结果
2.1 HpALP基因的克隆及序列特征
PCR扩增获得了HpALP的cDNA全长序列(GenBank登录号: MZ004964),长1 536 bp,共编码512个氨基酸残基,预测蛋白质分子量和等电点分别为57.32 kD和4.70;SignalP 5.0 Server预测N端具有17个氨基酸的信号肽序列;NetNGlyc1.0 Server预测N端具有1个N-连接型糖蛋白的糖基化位点(292N);NetOGlyc 4.0 Server预测有3个O-糖基化位点(257S,406S,413T);不具有C端GPI锚定位点。
将暗黑鳃金龟HpALP氨基酸序列与10种鞘翅目ALPs蛋白通过MEGA5分析,结果显示,暗黑鳃金龟HpALP氨基酸序列与食粪金龟OtALP(GenBank登录号: XM 023060601.1)聚为一支,相似性最高,支持率为94%(图1)。

图1 基于氨基酸序列构建的暗黑鳃金龟与10种鞘翅目昆虫ALPs的系统发育树Fig.1 Phylogenetic tree of ALPs from Holotrichia parallela and 10 Coleoptera insects based on amino acid sequences
2.2 HpALP的原核表达
重组质粒pET-30a/HpALP经BamHⅠ单酶切后得到约7 kb大小的条带;经BamHⅠ和Hind Ⅲ双酶切后产生的两片段分别为约5.4 kb的pET-30a载体和约1.5 kb的HpALP的目的基因(图2)。经IPTG诱导表达,Western blot结果表明(图3),获得约60 kD的HpALP重组蛋白,大小与预期一致,诱导8 h时表达量最高。

图2 pET-30a/HpALP重组质粒验证Fig.2 Validation of pET-30a/HpALP recombinant plasmidM: λ-EcoT14 digest; 1: pET-30a/HpALP质粒BamHⅠ和Hind Ⅲ双酶切产物Digestion products of pET-30a/HpALP plasmid with BamHⅠ and Hind Ⅲ; 2: pET-30a/HpALP质粒BamH Ⅰ单酶切产物Digestion products of pET-30a/HpALP plasmid with BamH Ⅰ; 3: pET-30a; 4: HpALP PCR产物PCR product of HpALP.

图3 HpALP重组蛋白Western blot分析Fig.3 Western blot analysis of the recombinantHpALP proteinM: 蛋白质分子量标准Protein molecular weight marker; 1: 未经IPTG诱导的pET-30a/HpALP pET-30a/HpALP non-induced by IPTG; 2-4: pET-30a/HpALP经IPTG分别诱导4, 6和8 h pET-30a/HpALP induced by IPTG for 4, 6 and 8 h, respectively.
2.3 HpALP基因在暗黑鳃金龟幼虫不同组织中的表达水平
qRT-PCR结果表明,HpALP在3龄第2天幼虫的前肠中丰度最高,在中肠中次之,在直肠和回肠中的表达量最低,且两者之间无显著性差异(P>0.05)(图4)。

图4 HpALP基因在暗黑鳃金龟3龄第2天幼虫不同组织中的表达谱Fig.4 Expression profiles of HpALP in different tissuesof the day-2 3rd instar larvae of Holotrichia parallela图中数据为平均值±标准误;柱上不同小写字母表示基因表达量在不同组织间经Duncan氏新复极差法检验在P<0.05水平差异显著。Data in the figure are mean±SE. Different small letters above bars indicate significant difference in the gene expression level among different tissues (P<0.05, Duncan’s new multiple range test).
2.4 Cry8Ea3和HpALP蛋白的配体结合特性
配体印记结果表明,HpALP重组蛋白与Cry8Ea3孵育,出现了57 kD的目的条带,而同处理的HpALP重组蛋白与对照Cry1Ab35孵育,未出现条带(图5),表明HpALP与Cry8Ea3能够特异结合,推测HpALP为Cry8Ea3毒素的中肠受体蛋白。
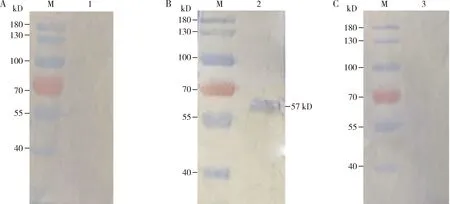
图5 HpALP重组蛋白与Cry8Ea3和Cry1Ab35的配体印记实验Fig.5 Ligand blot analysis of Cry8Ea3 and Cry1Ab35 with the recombinant HpALP proteinM: 蛋白质分子量标准Protein molecular weight marker; 1: HpALP蛋白未与Cry8Ea3蛋白孵育HpALP protein was not incubated with Cry8Ea3 protein; 2: HpALP蛋白与Cry8Ea3蛋白孵育HpALP protein was incubated with Cry8Ea3 protein; 3: HpALP蛋白与对照Cry1Ab35蛋白孵育HpALP protein was incubated with the control Cry1Ab35 protein.
2.5 Cry8Ea3与HpALP蛋白的亲和力
ELISA结果显示,活化的Cry8Ea3与HpALP重组蛋白发生结合,且结合存在饱和现象。在Cry8Ea3蛋白浓度为0~500 nmol/L范围内,吸光度随着Cry8Ea3蛋白浓度的增大而增强,当Cry8Ea3蛋白浓度大于500 nmol/L时,二者的结合近乎饱和状态;两者间的解离常数Kd值为76.21±26.44 nmol/L,最大亲和力Bmax为0.59±0.068(图6: A)。而对照组活化的Cry1Ab35与HpALP重组蛋白的解离常数Kd值为142.50±137.30 nmol/L,Bmax为0.013±0.005(图6: B)。Cry8Ea3与HpALP重组蛋白的解离常数Kd值显著低于Cry1Ab35与HpALP重组蛋白的Kd值,证明Cry8Ea3与HpALP间亲和力强。

图6 Cry8Ea3(A)和Cry1Ab35(B)与HpALP重组蛋白的亲和力Fig.6 Affinities of Cry8Ea3 (A) and Cry1Ab35 (B) with the recombinant HpALP protein
3 讨论
为了高效防治暗黑鳃金龟幼虫蛴螬,前期本实验室得到了暗黑鳃金龟幼虫蛴螬高毒力蛋白Cry8Ea3基因,并得到了工程菌。为了明确Cry8Ea3对暗黑鳃金龟幼虫蛴螬作用机制,本研究进行了Cry蛋白中肠受体蛋白基因的克隆与鉴定工作,克隆得到暗黑鳃金龟HpALP基因并进行序列分析;组织表达谱结果表明HpALP基因在暗黑鳃金龟3龄第2天幼虫前肠中表达量最高(图4),而甜菜夜蛾和美国白蛾的SeALP和HcALP均在中肠中表达量最高(袁向东等, 2017; 常梦颖等, 2019),而鞘翅目其他昆虫该类基因的组织表达差异性相关研究未见报道。推测该类基因的丰度在组织的差异表现可能与物种差异有关,该基因的分布可能因昆虫种类不同存在差异。
研究表明,配体结合实验和酶联免疫吸附测定是体外研究蛋白互作的重要技术,在Cry蛋白与昆虫中肠受体蛋白互作机制研究中应用广泛。Hu等(2018)利用这两种技术研究推断小菜蛾Plutellaxylostella中肠的Cadherin-like(CR7-CR11)蛋白可能是Cry1Ac的受体蛋白;展恩玲等(2017)采用Western blot及配体结合技术证实Polycalin蛋白可能是Cry1Ac 毒素的受体蛋白;王哲等(2020)利用Western blot及配体结合技术对美国白蛾中肠受体蛋白HcCAD-1, HcCAD-2, HcALP1和HcALP3与Cry2Ab毒素蛋白结合特性进行了研究,推测可能为Cry2Ab杀虫蛋白的受体。本研究采用Western blot及配体印记技术分析了暗黑鳃金龟HpALP与Cry8Ea3毒素蛋白的结合特性,结果表明HpALP与Cry8Ea3发生特异结合,而与Cry1Ab35不结合(图5),研究结果为明确Cry8Ea3对暗黑鳃金龟的作用机制提供了材料。
RNAi和CRISPR/Cas9基因编辑技术结合生物测定是体内研究Cry蛋白中肠受体蛋白的重要手段。Zhang等(2018)利用ELISA及RNAi技术研究了埃及伊蚊Cry蛋白的受体蛋白,并鉴定得到ALP1中肠受体蛋白,ELISA实验验证了ALP与Cry11Aa的结合,RNAi实验得到了与ELISA同样的结论;Pan等(2017)利用配体结合实验和RNAi技术研究了小菜蛾PxAPN5蛋白与Cry2Ab蛋白的互作;赵丹等(2021)同样利用配体结合实验及RNAi技术证实了美国白蛾HcALP3为Cry1Ab35毒素的潜在功能受体。以上研究结果均表明,受体蛋白与Cry蛋白之间结合,即可推断此受体蛋白为Cry蛋白的潜在受体,能够与体内RNAi实验得出相同的结论,配体结合实验与ELISA体外研究方法可作为判定是否为Cry蛋白受体的重要依据。
本研究利用配体印记及ELISA技术分别分析了HpALP蛋白与Cry8Ea3活化毒素体外结合特性和亲和力,结果表明Cry8Ea3与HpALP的解离常数Kd值显著低于与对照组Cry1Ab35的,说明HpALP是Cry8Ea3的潜在受体。研究结果为明确Cry8Ea3对暗黑鳃金龟作用机制提供了基础资料。由于暗黑鳃金龟一年发生1代,人工养殖技术不成熟,尚未进行活体相关实验,后续还需利用RNAi技术对HpALP蛋白的功能进行进一步验证。
