ADC值联合18F-FDG PET/CT最大标准摄取值对乳腺癌新辅助化疗疗效的预测价值
2022-05-19张玉袁权汤增辉高春芳张雪原
张玉, 袁权, 汤增辉, 高春芳, 张雪原
乳腺癌在全球女性癌症的发病率中居首位,新辅助化疗是局部晚期乳腺癌的标准治疗方式,可降低肿瘤负荷、提高手术及保乳治疗的可能性、改善患者预后。乳腺癌新辅助化疗后如果达到病理完全缓解(pathological complete response,pCR),患者的无病生存期和总生存期也将会延长[1],故pCR可作为乳腺癌患者长期生存的替代早期临床终点。然而,新辅助化疗并不能使所有患者都受益,部分不敏感的患者可能会错过手术时机。因此,寻找早期预测新辅助化疗后疗效的方法具有重要意义。之前的研究表明[2-4],一些乳腺癌组织的分子标志物表达水平可能对预测乳腺癌新辅助化疗的疗效具有一定预测价值,但目前检测这些分子标志物,需穿刺获取活体组织标本,并结合病理及免疫组化检测而获得,取材局限且有创,无法全面、动态评估肿瘤的生物学特征变化。通过扩散加权成像(diffusion weighted imaging,DWI)计算得出的表观扩散系数(apparent diffusion coeffi-cient,ADC)值可以反映组织水分子扩散能力和肿瘤的生物学、细胞结构等微观结构特征。多项研究显示,ADC值不仅与乳腺癌的组织学分级、淋巴结转移、雌激素受体表达状态等因素存在联系,而且与肿瘤的侵袭性和预后密切相关[5,6]。18F-脱氧葡萄糖 (18F-fluorodeoxy glucose,18F-FDG) 正电子发射计算机断层扫描 (positron emission tomography/computed tomography,PET/CT) 可从形态学和功能学方面对肿瘤进行评估,其中的最大标准摄取值(maximum standard uptake value,SUVmax)在恶性肿瘤的诊治、疗效和预后评估中的作用也备受关注[7,8]。之前的研究表明,ADC值和SUVmax值在乳腺癌新辅助化疗后的疗效预测中具有一定价值[6,7],然而预测效能较为一般,而目前还未有研究将这两者结合起来预测乳腺癌新辅助化疗后的效果。因此,本研究旨在探讨ADC值联合SUVmax值对乳腺癌新辅助化疗疗效的预测价值,以期为临床实现个体化治疗提供参考依据。
材料与方法
1.研究对象
纳入2017年1月-2019年6月首次接受全程新辅助化疗并进行手术切除评估的女性乳腺癌患者作为研究对象。病例纳入标准:①年龄18~80周岁,且病灶为单侧单发肿块;②经组织病理学确诊为乳腺癌;③TNM临床分期为Ⅱ~Ⅲ期;④化疗前行DWI和18F-FDG PET/CT检查;⑤无乳腺放、化疗史。病例排除标准:①合并其他部位肿瘤;②合并严重心血管、脑、肝、肾疾病;③临床、病理或影像学资料不完整;④依从性不高或中途失访。最终,共有132例患者被纳入本研究,平均年龄为(55.29±7.39)岁。本研究所有程序均符合赫尔辛基宣言,得到了医院伦理委员会的批准。所有研究对象均自愿参与本研究,并签署了知情同意书。
2.研究方法
MRI检查方法及图像分析:化疗前,采用飞利浦全数字Ingenia 3.0T MRI扫描仪进行MRI检查,四通道表面专用乳腺线圈,患者取俯卧位,双乳自然悬垂于线圈内。常规MRI扫描采用脂肪抑制T1WI、T2WI序列。DW-MRI检查采用单次激发的EPI序列,扫描参数:TR 96 ms,TE 8000 ms,b值为0和1000 mm2/s,层厚4.0 mm,层间距2 mm,激励次数3。由1位资深乳腺影像诊断医师在不知病理结果的情况下单独测量乳腺病灶的ADC值。采用Functool软件生成表观扩散系数ADC图,在DWI(b值为=1000 mm2/s)图像上选取病灶最大层面,手动绘制感兴趣区(regions of interest,ROI),勾画范围包含整个病灶层面,且避开明显的出血、坏死、钙化及血管区域;软件自动复制ROI到ADC图中对应病灶位置,记录病灶的平均ADC值。每个病灶测量3次,取平均值并记录为最终结果。
PET/CT检查方法及图形分析:化疗前,采用飞利浦GEMINI型PET/CT显像仪进行检测,18F-FDG由中国原子能科学研究院广州市同位素中心提供,放化纯度>95%。检查前,患者禁食不少于6 h,将18F-FDG从肘静脉中注射进入,剂量为4.44~5.18 MBq/kg,静息60 min后行PET/CT显像,数据经Ramla 3D方法获得衰减校正图像。由1位经验丰富的核医学医师独立阅片,根据 PET/CT 融合图像沿乳腺病灶最大层面勾画ROI,由工作站自动计算出SUVmax并记录。每个病灶测量3次,取平均值并记录为最终结果。
临床病理特征的收集:在医院信息管理系统中查阅患者的临床、病理资料,收集患者的年龄、身体质量指数(body mass index,BMI)、月经状态、家族史、肿块直径、临床分期、病理类型、化疗方案、有无淋巴结转移、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)、Ki-67表达状态(≥14%为高增殖活性,<14%为低增殖活性)及分子亚型。
新辅助化疗治疗方案及疗效评价标准:所有患者均接受4~6个周期的新辅助化疗。所采取的化疗方案包括:①TEC方案:多西他赛+表阿霉素+环磷酰胺;②AT方案:紫杉醇+多柔比星;③CMF方案:环磷酰胺+甲氨蝶呤+5-氟尿嘧啶。新辅助化疗结束后2周内行肿块切除术,由两位资深病理学医师依据Miller and Payne分级标准对病理学反应进行分级,共分为5级:1级,浸润癌细胞数量总体未减少或仅有个别减少;2级,浸润癌细胞数量减少比例<30%;3级,浸润癌细胞数量减少比例为30%~90%;4级,浸润癌细胞数量减少比例>90%;5级,无浸润癌细胞残存,仅有纤维化间质存在(可含有原位癌)。将5级判定为pCR组,而1~4级判定为非pCR组。
3.统计学处理
采用SPSS 22.0软件进行统计学分析。符合正态分布的定量资料以均数±标准差表示,组间比较采用t检验。定性资料以频数表示,组间比较采用χ2检验。应用受试者工作特征(receiver operating characteristic,ROC)曲线评估ADC、SUVmax值在新辅助化疗后疗效预测中的效能。以P<0.05为差异有统计学意义。
结 果
1.研究对象的基本情况
本研究共纳入132例患者,平均年龄为(55.29±7.39)岁,平均BMI为24.79 kg/m2,53例(40.15%)患者处于绝经前,79例(59.85%)患者处于绝经后;108例(81.82%)患者有乳腺癌家族史,24例(18.18%)患者无乳腺癌家族史;肿块直径≤2 cm者60例(45.5%),>2 cm者72例(54.5%);临床分期为Ⅱ期患者70例(53.03%),Ⅲ期患者62例(46.97%);54例(40.91%)患者无淋巴结转移,78例(59.09%)患者有淋巴结转移;浸润性癌113例(85.61%),导管原位癌19例(14.39%);采用TEC方案治疗的有47例(35.61%),AT方案治疗的有52例(39.39%),CMF方案治疗的有33例(25.00%);73例(55.30%)患者ER表达阴性,59例(44.70)患者ER表达阳性;64例(48.48%)患者PR表达阴性,68例(51.52%)患者PR表达阳性;62例(46.97%)患者HER2表达阴性,70例(53.03%)患者HER2表达阳性;44例(33.33%)患者Ki-67表达阴性,88例(66.67%)患者Ki67表达阳性;Luminal A型患者60例(45.45%),Luminal B型患者36例(27.27%),Basal-like型患者19例(14.39%),HER2+型患者17例(12.88%)。
2.新辅助化疗后不同疗效患者的临床病理特征比较
新辅助化疗后,共有40例(30.30%)患者达到PCR(图1),92例(69.70%)患者为非PCR(图2)。非PCR组与PCR组患者的年龄、BMI、月经状态、家族史、肿块直径、临床分期、病理类型、化疗方案及ER、PR、HER2表达状态间差异均无统计学意义(P值均>0.05),而有无淋巴结转移、Ki-67表达状态、分子亚型在两组间差异均有统计学意义(P值均<0.05,表1)。
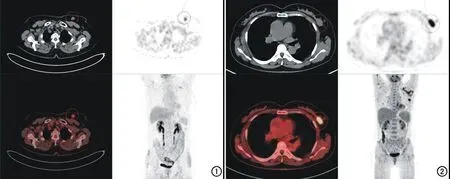
图1 pCR患者,女,62岁,PET-CT示左乳结节影(红圈),放射性摄取增加,SUVmax=6,左侧腋窝淋巴结未见放射性核素异常摄取。 图2 非pCR患者,女,49岁,PET-CT示左乳结节影(红圈),放射性摄取增加,SUVmax=9.8,左侧腋窝淋巴结放射性核素异常摄取。

表1 新辅助化疗后不同疗效患者的临床病理特征比较 (n,%)
3.新辅助化疗后不同疗效患者的ADC、SUVmax值比较
pCR组的ADC值为(0.82±0.11)×10-3mm2/s,显著低于非pCR组的(0.94±0.12)×10-3mm2/s,差异有统计学意义(t=-5.580,P<0.001)。pCR组的SUVmax值为(8.54±0.86) g/mL,显著高于非pCR组的(6.94±1.32) g/mL,差异有统计学意义(t=8.325,P<0.001)。对于Luminal A型乳腺癌,pCR组化疗前的ADC值显著低于非pCR组,SUVmax值显著高于非pCR组,差异有统计学意义(P<0.05);对于Luminal B型乳腺癌,pCR组化疗前的ADC值显著低于非pCR组(P<0.05),而SUVmax值在两组间差异无统计学意义(P>0.05);对于Basal-like和HER2+型乳腺癌,pCR组与非pCR组化疗前的ADC值和SUVmax值比较差异均无统计学意义(P值均>0.05,表2、3)。

表2 基于分子分型分组的不同疗效患者的ADC值比较 (×10-3mm2/s)

表3 基于分子分型分组的不同疗效患者的SUVmax值比较 (g/mL)
4.ADC值、SUVmax值预测乳腺癌新辅助化疗疗效的效能
分别以ADC值、SUVmax值及两者联合对乳腺癌新辅助化疗的疗效预测效能进行ROC曲线分析,结果显示ADC值预测化疗后非pCR的曲线下面积(area under the curve,AUC)为0.731(0.641~0.821),截断值为0.95×10-3mm2/s,敏感度和特异度分别为57.5%和80.4%;SUVmax值预测化疗后非pCR的AUC为0.880(0.817~0.944),截断值为7.63 g/mL,敏感度和特异度分别为85.0%和77.2%;ADC值联合SUVmax值预测化疗后非pCR的AUC为0.921(0.870~0.972),截断值为ADC值取0.88×10-3mm2/s,SUVmax值取7.79 g/mL,敏感度和特异度分别为87.5%和89.1%(图3)。
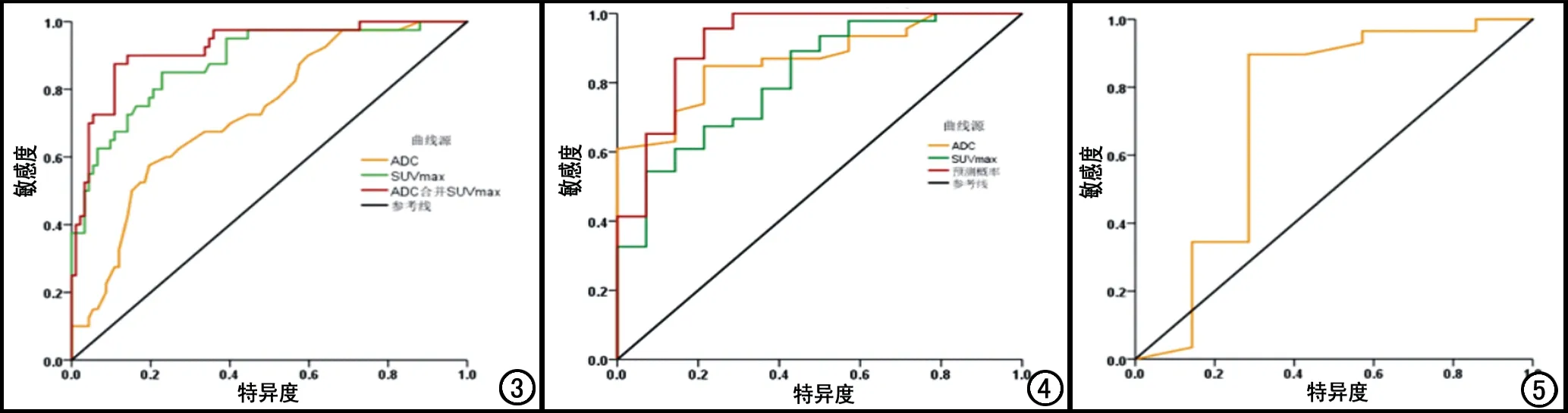
图3 ADC值、SUVmax值及两者联合预测乳腺癌新辅助化疗疗效的ROC曲线。 图4 ADC值、SUVmax值及两者联合预测Luminal A型乳腺癌新辅助化疗疗效的ROC曲线。 图5 ADC值预测Luminal B型乳腺癌新辅助化疗疗效的ROC曲线。
在Luminal A型乳腺癌中,ADC值预测化疗后非pCR的AUC为0.866(0.774~0.959),截断值为0.88×10-3mm2/s,敏感度和特异度分别为84.8%和78.6%;SUVmax值预测化疗后非pCR的AUC为0.814(0.689~0.938),截断值为7.41 g/mL,敏感度和特异度分别为60.9%和85.7%;ADC值联合SUVmax值预测化疗后非pCR的AUC为0.921(0.828~1.000),截断值为ADC值取0.87×10-3mm2/s,SUVmax值取7.50 g/mL,敏感度和特异度分别为87.0%和85.7%(图4)。在Luminal B型乳腺癌中,ADC值预测化疗后非pCR的AUC为0.729(0.456~1.000),P=0.063,因此无统计学意义 (图5)。
讨 论
近年来,乳腺癌在中国女性人群的发生率呈逐年上升趋势,新辅助化疗是局部进展期乳腺癌的标准治疗方式,对于肿瘤降期具有重要意义。因此,早期预测乳腺癌患者新辅助化疗后的病理反应程度对选择个体化治疗方案具有重要作用。已有研究表明,一些分子生物标志物对于乳腺癌新辅助化疗效果具有较高的预测价值,如ER、PR及Ki-67的表达状态等[2,4]。然而,这些乳腺癌组织中分子标志物的检测均需获取活体组织标本,结合病理学诊断才能完成,因而都是有创性的。MRI和PEC/CT在乳腺病变的鉴别诊断、分期及治疗效果中的评估价值已被患者和临床医生广泛接受和认可[9,10]。本研究探讨了MRI联合PEC/CT预测乳腺癌新辅助化疗后的效果,旨在为早期选择治疗方法及改善患者预后提供参考依据。
本研究结果表明,新辅助化疗后达到pCR的患者比例为30.30%,这与之前的研究报道结果类似[9]。本研究结果显示,乳腺癌新辅助化疗后的疗效与淋巴结转移、Ki-67表达状态和分子亚型有关,有淋巴结转移及Ki-67表达阳性的患者新辅助化疗后的疗效显著优于无淋巴结转移及Ki-67表达阴性者,这与之前的研究报道结果具有一致性[9,11]。出现淋巴结转移的患者,其肿瘤恶性程度增加,而相对于恶性程度低的肿瘤,恶性程度较高的肿瘤组织对化疗更为敏感[12,13]。韦晓霞等[11]的研究显示,Ki-67在预测乳腺癌新辅助化疗后的疗效中具有一定价值,大多数的化疗药物都是在DNA复制环节中或以细胞周期调节基因为目标靶点而发挥作用,Ki-67蛋白在细胞从G2期进入M期的过程中发挥着重要调控作用,此外,Ki-67的表达水平与细胞周期调节基因及其产物呈显著正相关,因此拥有高增殖活性的乳腺癌对化疗更为敏感。体外实验表明,ER、PR与Ki-67的表达水平呈负相关[14],这也可能是ER、PR高表达者在新辅助化疗后获得较好效果的原因。此外,我们的研究结果显示,Basal-like型和HER2+型乳腺癌患者经新辅助化疗后的疗效显著优于Luminal A型和Luminal B型,这与之前的研究报道结果一致[15]。Luminal A型乳腺癌ER和PR均阳性表达,因而对内分泌治疗较为敏感,但对化疗不敏感。Luminal B型乳腺癌ER和/或PR阳性,因此也对内分泌治疗的效果较好。HER2+型乳腺癌可行分子靶向治疗,且恩环类化疗药物对其治疗效果较好。Basal-like型乳腺癌的ER、PR和HER2表达均为阴性,因此不适合内分泌治疗和靶向治疗,但与其他亚型相比,Basal-like型的血管内皮生长因子水平较高,而血管内皮生长因子可促进肿瘤新生血管生成,增加血管通透性,因此有助于化疗药物的吸收[15]。
本研究结果显示,pCR组的ADC值显著低于非pCR组,而SUVmax值显著高于非pCR组,这一结果提示,ADC值和SUVmax值可能在乳腺癌新辅助化疗效果的预测中具有一定价值,因此笔者继续进行了ROC曲线分析。结果显示,ADC值预测化疗后非pCR的敏感度和特异度分别为57.5%和80.4%,SUVmax值预测化疗后非pCR的敏感度和特异度分别为85.0%和77.2%,而ADC值联合SUVmax值预测化疗后非pCR的敏感度和特异度分别为87.5%和89.1%。因此,ADC值联合SUVmax值在乳腺癌新辅助化疗效果的预测中具有较高的效能,可能具有一定的临床应用价值。此外,本研究在不同分子亚型乳腺癌患者中探讨了化疗前ADC值、SUVmax值与化疗后效果的关系,结果显示,Luminal A型乳腺癌pCR组的ADC值显著低于非pCR组,SUVmax值显著高于非pCR组;Luminal B型乳腺癌pCR组化疗前的ADC值显著低于非pCR组;而Basal-like和HER2+型乳腺癌pCR组与非pCR组的ADC值和SUVmax值比较差异均无统计学意义。之前的研究显示,Basal-like型和HER2过表达型的ADC值显著低于Luminal A和Luminal B型乳腺癌,而SUVmax值均高于Luminal A和Luminal B型乳腺癌[9,15]。HER2表达阳性常提示肿瘤的恶性程度增高、侵袭能力增强,从而水分子的扩散度降低,因此ADC值降低[9]。张月明等[16]的研究显示HER2阳性表达乳腺癌患者的SUVmax值显著增加,这可能与HER2促进细胞分裂、蛋白水解酶分泌增多,从而导致癌细胞生长加快有关。此外,笔者分别在Luminal A和Luminal B型乳腺癌患者中对化疗前ADC值和/或SUVmax值预测新辅助化疗疗效的效能进行了ROC曲线分析,结果显示,ADC值联合SUVmax值预测Luminal A型患者化疗后非pCR的敏感度和特异度分别为87.0%和85.9%,效果较好。刘洋等[15]的研究显示,基线ADC值在预测Luminal A型乳腺癌患者新辅助化疗疗效中具有较好的效能,敏感度和特异度分别为80.0%和85.7%,稍低于本研究采用ADC值联合SUVmax值的预测效能。李雯等[17]的研究结果显示,在三阴性乳腺癌中,化疗前SUVmax值不能有效预测新辅助化疗的疗效。在本研究中,虽然我们在Basal-like型也取得了类似的结果,但是对于所有乳腺癌患者及Luminal A型乳腺癌患者而言,化疗前SUVmax值对化疗后的疗效仍存在一定预测价值。
本研究存在以下局限性:①本研究所有研究对象均来自同一家医院,且样本量不大,这可能会造成选择偏倚;②本研究未探讨MRI其他序列或参数对乳腺癌新辅助化疗后疗效的预测价值,在未来有条件的情况下会进一步对此进行研究。
综上所述,ADC值和SUVmax值在乳腺癌新辅助化疗效果的预测中具有一定价值,ADC值联合SUVmax值对乳腺癌新辅助化疗后的疗效具有较高的预测效能。
