凝血酶抑制剂亭扎肝素对肺癌血管生成的抑制作用及分子机制研究
2022-05-18付文娜王慧莉
付文娜, 吴 琼, 王慧莉
(1. 辽宁省盘锦辽油宝石花医院, 辽宁 盘锦, 124010;2. 中国人民武装警察部队辽宁省总队大连支队勤务保障大队卫生队, 辽宁 大连, 116011)
目前,肺癌的发生率和病死率均较高,大多数患者就诊时已发展至晚期或转移期[1]。血管生成对肿瘤的生长和发展至关重要,可为肿瘤提供氧气和营养,浸润肿瘤细胞,并为其转移提供途径[2]。血管生成过程高度复杂,并受多种促血管生成和抗血管生成因子的调控,如血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGF)和生长停滞特异性蛋白 6(Gas6)等[3-4]。非小细胞肺癌(NSCLC)约占原发性肺癌的85%, 血管生成阻断或可成为其有效的治疗策略[5]。VEGF及血管内皮细胞生长因子受体2(VEGFR2)被认为是癌症抗血管生成治疗最重要的靶点之一,许多靶向VEGF/VEGFR2的单克隆抗体和抑制剂已被开发并应用于NSCLC的治疗中,但效果不够理想,患者5年生存率仍然很低[6]。凝血酶会影响VEGF的合成分泌,还会影响血管内皮细胞的通透性,使其功能紊乱。亭扎肝素是一种低分子量肝素(LMWH), 属于凝血酶抑制剂,可抑制血管内皮细胞激活,从而抑制肿瘤生长,使患者存活率升高[7]。亭扎肝素还可调节黑色素瘤中VEGF和磷酸化蛋白激酶B(p-Akt)的表达,从而抑制血管生成[8]。本研究探讨亭扎肝素对肺癌血管生成的抑制作用及分子机制,现报告如下。
1 材料与方法
1.1 实验动物
4~6周龄健康雄性裸鼠(BALB/cA-nu)30只购自广州医科大学实验动物中心,均饲养于恒定湿度、温度的无菌条件下。根据动物实验研究报告指南(ARRIVE指南),所有动物实验经广州医科大学实验动物伦理委员会审核批准。
1.2 细胞系培养
人脐静脉内皮细胞(HUVEC)购于Sciencell公司,人肺癌细胞系HCC827购于美国典型培养物保藏中心。HUVEC于含5%胎牛血清(FBS)和1%内皮细胞生长补充剂的内皮细胞培养基(ECM)试剂盒中培养。HCC827于含10%FBS的1640培养基中培养,并向培养基中加入100 U/mL青霉素和0.1 mg/mL链霉素。所有细胞均在37 ℃、5%CO2的孵育箱中培养,并分为对照组(不加亭扎肝素)和10 U/L亭扎肝素组、20 U/L亭扎肝素组、50 U/L亭扎肝素组、100 U/L亭扎肝素组。
1.3 实验材料
亭扎肝素购自Selleck公司,细胞计数试剂盒(CCK-8)购自 Beyotime公司。蛋白激酶B(Akt)、p-Akt、VEGF、凝血酶和β-actin购自Cell Signaling Technology公司。血管内皮生长因子A(VEGFA)、CD31、Ki-67和辣根过氧化物酶偶联的抗兔/小鼠IgG抗体购自ABclonal Technology公司。
1.4 细胞活力检测
采用CCK-8法检测细胞活力,将细胞置于96孔板上, 37 ℃培养过夜,与不同浓度药物孵育72 h。加入CCK-8试剂,并将混合物在 37 ℃下孵育0.5~4.0 h。使用酶标仪检测450 nm处的吸光度(OD)值。与对照组相比评价细胞生长速率,并使用GraphPad Prism 7.0软件计算50%抑制浓度(IC50)值。
1.5 内皮细胞迁移实验
亭扎肝素对HUVEC细胞迁移的影响使用Transwell小室进行评估。Transwell迁移实验中,将无血清ECM的HUVEC悬浮后以2×104个/孔密度接种于板中,底部腔室充满0.6 mL新鲜ECM。HUVEC细胞于37 ℃培养24 h。用棉签除去膜表面的非迁移细胞后,用4%多聚甲醛固定, 0.1%结晶紫染色迁移至下膜表面的HUVEC。通过EVOS XL Core细胞成像系统拍照得到图像,每个孔中随机选择3个视野,并使用Image-Pro Plus 6.0软件分析迁移细胞。
1.6 体外试管形成试验
体外血管生成研究中,根据制造商(ibidi, 德国)说明书使用ibidi载玻片进行体外试管形成试验。将200 000个HUVEC悬浮在1 mL M199培养基中,细胞培养基中补充有指定浓度的亭扎肝素。将细胞悬液(50 μL)加至每个载玻片孔中,并于37 ℃加湿室中孵育。在细胞接种后0、0.5、3、6、9 h, 以10倍放大率对管形成情况进行成像。9 h后,采用ImageJ软件定量总管长。
1.7 网络形成分析
在存在或不存在亭扎肝素的情况下,将HUVEC以2×104个/孔密度接种于96孔板。细胞在37 ℃、5%CO2条件下孵育6 h。使用EVOS XL Core细胞成像系统观察和捕获网络,并使用Image-Pro Plus 6.0软件测量和分析。实验重复3次。
1.8 主动脉环测定
通过主动脉环测定结果确定亭扎肝素的抗血管生成作用。从BALB/c小鼠中分离胸主动脉并在磷酸盐缓冲液(PBS)中冲洗。切除纤维脂肪组织后,将胸主动脉切成1.0~1.5 mm长的环,并将环接种在预涂Matrigel的96孔板中,再铺上 80 μL Matrigel。温育2 h后,将主动脉环用含亭扎肝素的新鲜ECM处理6 d。使用EVOS XL Core细胞成像系统观察并拍摄发芽的微血管,使用ImageJ软件对MVD进行量化。实验独立重复3次。
1.9 绒毛尿囊膜(CAM)检测
对受精鸡蛋进行CAM检测,鸡蛋已在 37 ℃下于湿度60%~65%的加湿孵化器中孵化5 d, 在毒气室一侧的蛋壳处切开1个约1 cm2的小窗口以开发人造毒气室。分离壳和壳膜,以暴露 CAM。将CAM随机分为对照组和亭扎肝素 0.2 mg/kg组,每组8个鸡蛋。用透明胶带密封窗口后,再将鸡蛋孵化48 h。使用Olympus SZX18解剖显微镜观察和捕获CAM中的血管,并应用Image-Pro Plus 6.0软件对微血管进行量化。
1.10 蛋白质印迹法(Western blot)分析
使用RIPA缓冲液裂解用或未用亭扎肝素处理的HUVEC和HCC827细胞,获得全细胞提取物。使用NE-PERTM核和细胞质提取试剂盒(美国Thermo Fisher Scientific公司)分离细胞质和核蛋白,并使用二喹啉甲酸(BCA)蛋白检测试剂盒(碧云天生物技术有限公司)测定总蛋白浓度。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质并转移至聚偏二氟乙烯膜(美国Millipore公司)。将膜与抗体一起孵育并使用增强的化学发光检测系统进行检测,采用ImageJ 软件测量定量数据。实验独立重复3次。
1.11 体内小鼠异种移植试验
将悬浮在100 μL Matrigel中的HCC827细胞(1×106个)接种到4~6周龄雄性裸鼠(BALB/cA-nu)右侧皮下。当肿瘤长至100 mm3时,将荷瘤小鼠随机分为3组,每组5只。各组小鼠分别腹腔注射赋形剂、亭扎肝素60 IU/kg。根据公式(0.5×宽度2×长度)用卡尺进行2次垂直测量。实验结束时,使用戊巴比妥钠麻醉小鼠,切除肿瘤,称重并拍照。将肿瘤用4%多聚甲醛固定,以进行下一步实验。采用免疫组化方法检测肿瘤组织中Ki-67、CD31和VEGFA表达情况。采用脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL法)检测肿瘤组织中的凋亡细胞。
1.12 统计学分析
2 结 果
2.1 亭扎肝素对HUVEC增殖和迁移的影响
本研究采用增殖和迁移试验评估亭扎肝素对HUVEC的抗血管生成作用,其中细胞活力测定可为进一步体外实验提供合适的浓度。Tranwell迁移试验显示, 20、50、100 U/L亭扎肝素均可有效抑制HUVEC迁移,其细胞迁移距离与对照组比较,差异有统计学意义(P<0.05), 见图1A; CCK-8检测结果显示,亭扎肝素以剂量依赖性方式降低HUVEC细胞活力,不同浓度亭扎肝素组间差异有统计学意义(P<0.05), 见图1B。以上实验结果表明, 20 U/L亭扎肝素具有有效的抗血管生成作用。

A: 各组HUVEC细胞迁移距离比较; B: 各组HUVEC细胞活力比较。与对照组比较, *P<0.05; 与20 U/L亭扎肝素组比较,#P<0.05; 与50 U/L亭扎肝素组比较, △P<0.05。
2.2 亭扎肝素对体外和体内血管生成的影响
本研究采用网络形成试验和主动脉环试验进一步验证亭扎肝素的抗血管生成作用。网络形成试验显示,相较于对照组, 20 U/L亭扎肝素可有效抑制HUVEC的管形成,管状结构数量减少且管状结构不稳定,差异有统计学意义(P<0.05)。主动脉环测定结果显示,相较于对照组, 20 U/L亭扎肝素减少了血管生成,差异有统计学意义(P<0.01)。相较于对照组, 20 U/L亭扎肝素抑制了CAM模型中的新血管形成,差异有统计学意义(P<0.01)。见图2。

A: 2组HUVEC管形成的网络形成试验结果(放大倍数400倍); B: 2组相对管型长度比较; C: 主动脉环测定HUVEC血管生成结果(放大倍数400倍); D: 2组HUVEC微血管数量比较; E: CAM模型中的新血管形成结果(放大倍数400倍); F: 2组CAM模型中微血管数量比较。与对照组比较, *P<0.05, **P<0.01。图2 亭扎肝素对体外和体内血管生成的影响
2.3 亭扎肝素对VEGF和AKT的影响
Western blot检测结果显示, HUVEC和HCC827细胞中, 20 U/L亭扎肝素组的凝血酶含量均低于对照组,差异有统计学意义(P<0.01); HCC827细胞中, 20 U/L亭扎肝素组的VEGF、p-Akt和Akt蛋白含量均低于对照组,差异有统计学意义(P<0.05或P<0.01)。见图3。
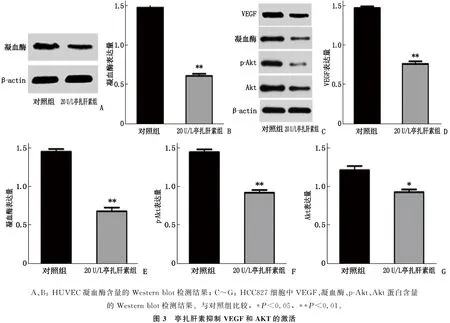
A、B: HUVEC凝血酶含量的Western blot检测结果; C~G: HCC827细胞中VEGF、凝血酶、p-Akt、Akt蛋白含量的Western blot检测结果。与对照组比较, *P<0.05, **P<0.01。图3 亭扎肝素抑制VEGF和AKT的激活
2.4 亭扎肝素对HCC827异种移植物中肿瘤
生长和肿瘤血管生成的影响
本研究通过HCC827异种移植物进一步验证亭扎肝素的抗肿瘤和抗血管生成作用,发现20 U/L亭扎肝素组的肿瘤质量、肿瘤体积均小于对照组,差异有统计学意义(P<0.01), 表明亭扎肝素显著抑制了肿瘤生长。进一步评估亭扎肝素对肿瘤增殖、细胞凋亡和血管生成的影响(采用TUNEL法检测凋亡细胞,将Ki-67作为增殖标志物,将CD31和VEGFA作为血管内皮细胞标志物),结果显示,与对照组比较, 20 U/L亭扎肝素可抑制肿瘤增殖,促进肿瘤细胞凋亡,并抑制血管生成。见图4。
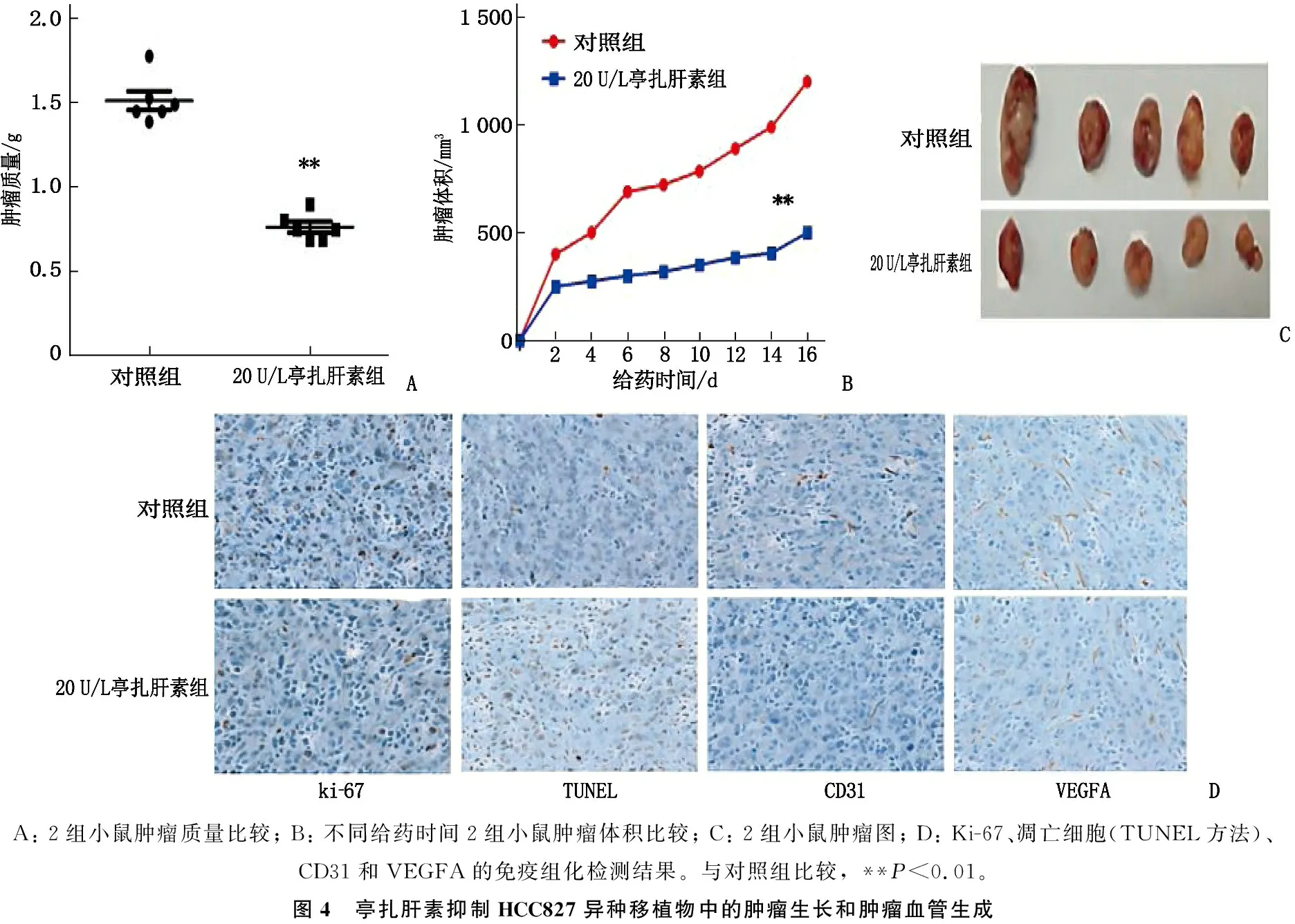
A: 2组小鼠肿瘤质量比较; B: 不同给药时间2组小鼠肿瘤体积比较; C: 2组小鼠肿瘤图; D: Ki-67、凋亡细胞(TUNEL方法)、CD31和VEGFA的免疫组化检测结果。与对照组比较, **P<0.01。图4 亭扎肝素抑制HCC827异种移植物中的肿瘤生长和肿瘤血管生成
3 讨 论
目前,肺癌的发病率呈逐年上升趋势,严重危害人类的生命健康。血管生成在肿瘤的发生发展中起着重要作用[9-11], 而VEGF/VEGFR是参与血管生成的关键信号通路[6]。亭扎肝素是一种凝血酶抑制剂,可抑制凝血酶表达。本研究发现,亭扎肝素不仅可抑制血管生成过程中HUVEC细胞运动(增殖、迁移和管形成),还具有抗血管生成和抗肿瘤活性,而在肿瘤异种移植模型中,亭扎肝素也对肿瘤生长具有抑制作用。
细胞增殖和抵抗细胞凋亡是癌症的两大标志[12], 癌细胞通过自身产生生长因子或刺激正常细胞提供各种生长因子来促进增殖[13]。细胞凋亡是癌症发展的天然屏障,但癌细胞已进化出多种方法来限制细胞凋亡[14]。本研究结果显示,亭扎肝素治疗对体外和体内肿瘤细胞的增殖均具有抑制作用并可显著诱导其凋亡。血管生成是癌症的另一个重要标志,血管生成对其生理和病理生理过程至关重要,目前已有一些血管生成抑制剂被应用于临床[15]。相关研究[16]在肺癌模型中研究抗凝血酶对肿瘤生长的抑制作用时发现,抗凝血酶的裂解构象具有强大的抗血管生成和抗肿瘤活性,完整抗凝血酶的稳定锁定和潜伏形式的构象与分子的裂解形式基本相似,也在体内抑制血管生成和肿瘤生长,并选择性地作用于内皮细胞和肿瘤血管系统。研究[17]显示,凝血酶活性可促进血管生成,诱导血小板释放VEGF, 并增加VEGF及其受体的表达,驱动肿瘤血管生成。本研究发现,亭扎肝素可抑制VEGF蛋白表达和体内体外的血管生成,且亭扎肝素可通过抑制细胞增殖、促进肿瘤细胞凋亡和抑制血管生成来抑制肿瘤生长。
Akt是VEGFR的重要下游信号分子,参与肿瘤细胞增殖、存活和血管生成[18]。本研究结果表明,亭扎肝素可显著抑制Akt的磷酸化。本研究还发现,在HCC827异种移植模型中,亭扎肝素抑制了增殖标志物Ki-67, 增加了细胞凋亡,且亭扎肝素可抑制肿瘤生长,使血管标志物CD31显著下降和VEGFA显著减少,表明亭扎肝素可抑制HCC827异种移植物中的肿瘤生长和肿瘤血管生成。
综上所述,凝血酶抑制剂亭扎肝素可抑制细胞增殖和血管生成,促进肿瘤细胞凋亡,明显抑制HCC827异种移植物中的肿瘤血管生成和肿瘤生长,其抗血管生成作用与Akt及其下游信号通路的失活有关,为进一步研究凝血酶抑制剂对肺癌血管生成的抑制作用提供了有力证据。
