基于纳滤溶解扩散理论探索热毒宁注射液醇沉浓度对绿原酸分子态比例及传质行为的调控规律
2022-05-18章莲王智李存玉支兴蕾彭国平
章莲,王智,李存玉,2,3,4,5,支兴蕾,彭国平,2,3,4,5
(1.南京中医药大学药学院,江苏 南京 210023;2.江苏康缘药业股份有限公司,江苏 连云港 222001;3.中药制药过程新技术国家重点实验室,江苏 连云港 222001;4.江苏省经典名方工程研究中心,江苏 南京 210023;5.江苏省中药资源产业化过程协同创新中心,江苏 南京 210023)
在中药制剂生产过程中,中药成分存在状态决定了其物化性质,进而影响提取、醇沉、浓缩、制剂成型等环节的成分转移率,造成制剂批次间的质量差异性[1]。目前,多是通过量化生产参数,如浸膏相对密度、水分含量、溶液pH等[2-3],进行生产过程的标准化控制,但是表观数据对于质量内涵控制仍存在局限性。
目前,成分存在状态的分析手段主要为红外光谱、核磁共振、差示热分析等[4-6],但检测过程中成分需要脱离原溶液环境,引起存在状态比例或官能团结合位点变化,难以准确分析中药制剂涉及的复杂溶液环境下的成分状态,且无法实现定量分析,限制了现代分析技术在中药制剂质量控制技术中的应用。纳滤依靠成分与膜分离层的电荷效应实现常温化分离,前期研究发现[7],中药成分的纳滤传质系数与成分浓度呈幂值相关,为中药成分存在状态的定量分析提供了理论依据。
热毒宁注射液由金银花、青蒿、栀子提取精制而成,临床用于外感风热所致感冒、咳嗽,其中绿原酸属于抗菌、消炎类有效成分,在制剂生产过程中,因热处理精制引起成分转变,给制剂生产过程中的标准化控制带来挑战。前期研究发现,纳滤适用于水溶液环境的常温浓缩,而针对醇沉中间体的高浓度乙醇分离存在一定局限性。
热毒宁注射液的醇沉精制环节,以绿原酸为代表酚酸药效物质群,均会因热处理转变影响制剂质量[8],而纳滤对于高浓度乙醇溶液环境的分离仍处于探索阶段[9]。本研究以热毒宁注射液醇沉中间体为研究对象,基于纳滤传质模型分析乙醇浓度与绿原酸存在状态的内在关系,定量计算绿原酸分子态比例,明确乙醇浓度对纳滤传质行为的影响规律,以期阐明有机溶剂的纳滤分离机制以及为中药制剂的标准化控制提供技术支撑。
1 材料
1.1 材料与试剂
复合聚酰胺纳滤膜(450 Da),购自南京拓鉒医药科技有限公司。金银花、青蒿饮片购自苏州市春晖堂药业有限公司,经南京中医药大学严辉副教授鉴定为忍冬科植物忍冬LonicerajaponicaThunb.的干燥花蕾或带初开的花,菊科植物黄花蒿ArtemisiaannuaL.的干燥地上部分,符合《中国药典》2020年版相关项下要求。绿原酸对照品(批号:110753-201817,质量分数96.8%)购自中国食品药品检定研究院。绿原酸提取物(批号:JBZ-2019,质量分数99.0%),购自南京金益柏生物科技有限公司;乙腈为色谱纯,乙醇、磷酸为分析纯,水为纯化水,其他试剂为分析纯。
1.2 仪器
Waters e2695高效液相色谱仪,PDA检测器,美国Waters公司。TNZ-1型纳滤分离设备,南京拓鉒医药科技有限公司。PB-10型pH计,德国sartorius。MS105十万分之一电子天平,瑞士METTLER TOLEDO集团;KH-250B型超声波清洗器,昆山禾创超声仪器有限公司。
2 方法
2.1 溶液制备
2.1.1 绿原酸对照品溶液 精密称取干燥至恒定质量的绿原酸对照品适量,置棕色量瓶中,加甲醇制成每1 mL含0.50 mg的溶液,即得。
2.1.2 热毒宁注射液醇沉中间体 根据热毒宁注射液处方称取青蒿、金银花饮片,浸润,提取挥发油后,药渣加水提取2次,合并提取液,减压浓缩至相对密度1.10~1.12(50 ℃),加95%乙醇达目标含醇量,充分搅拌,静置24 h,滤过,即得。
2.1.3 绿原酸单体溶液 精密称取干燥至恒定质量的绿原酸提取物,根据醇沉中间体中的乙醇浓度以及pH,分别采用60%、70%、80%的乙醇水溶液超声溶解,制成每1 mL含0.82 mg的溶液,即得。
2.2 构建纳滤传质数学模型
组装纳滤分离设备,将纳滤膜置于TNZ-1型纳滤分离设备的膜管中,采用纯化水清洗至截留液及纳滤液端的流出液呈中性。进而根据分离对象的乙醇浓度,采用相应的乙醇水溶液进行膜组件平衡清洗,待膜通量稳定后,排空纳滤分离设备中残留的溶液。将待分离的溶液置于纳滤分离系统中,通过转速和截留阀调节分离压力,待溶质与膜组件吸附-解吸附处于动态平衡时,分别从储液罐和纳滤管道取样平衡液和纳滤液。
基于纳滤传质模型中的“传质系数是溶质多种存在状态的综合分离表现”理论[10],调节绿原酸单体溶液pH至3.00,使得溶液中绿原酸以分子态形式存在,拟合不同乙醇浓度下的绿原酸传质系数。以绿原酸单体溶液为参照,计算热毒宁注射液醇沉中间体中绿原酸在达到相同传质系数时对应的溶质浓度,单体溶液与醇沉中间体的浓度比值,即为绿原酸分子态存在状态的比例。
取绿原酸单体溶液,采用相应乙醇浓度稀释系列浓度,调节溶液pH为3.00,调节纳滤分离压力为0.2、0.4、0.6、0.8、1.0、1.2 MPa,收集系列质量浓度单体溶液不同操作压力下的Jv、R。
(1)
根据式(1)拟合ln[(1-R)·Jv/R]与Jv的线性方程,斜率为1/k,截距为ln,Jv为膜通量,m·s-1;R为截留率;δ为膜厚度,cm;DK/δ用于表征膜传质性能,m·s-1。根据线性方程斜率计算传质系数k,通过式(1)计算k与溶质初始质量浓度C0的相关性,其中a为相关系数,n为幂值。
(2)
根据绿原酸单体成分传质数学模型中k与C0的相关性,进行热毒宁注射液醇沉中间体纳滤分离,收集并计算系列浓度条件下的Jv、R,根据式(1)计算k,根据式(2)拟合k与C0的相关性,方程回归系数大于0.90,说明二者相关性强,传质数学模型成立。
2.3 样品检测
2.3.1 色谱条件[11]Hanbon Hedera C18色谱柱(4.6 mm×250 mm,5 μm);检测波长327 nm;流速0.7 mL·min-1;进样量10 μL;流动相乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱(0~8 min,14%~19%A;8~14 min,19%A;14~34 min,19%~31%A;34~35 min,31%~90%A;35~40 min,90%A)。
2.3.2 线性关系 精密吸取绿原酸对照品溶液0.10、0.20、0.50、1.00、2.00 mL分别置于5 mL量瓶中,50%甲醇稀释至刻度,Waters e2695高效液相色谱仪检测,以峰面积为纵坐标(Y),绿原酸浓度为横坐标(X),进行线性回归计算,绿原酸Y=2 791.1X+6 858.3,r=0.999 4,在10.0~200 mg·L-1线性关系良好。
3 结果
3.1 成分存在状态拟合
3.1.1 60%醇沉中间体 对不同浓度、溶液条件下的绿原酸的ln[(1-Ro)·Jv/Ro]和Jv进行相关性拟合(图1),根据相关性散点分布图,可以看出ln[(1-Ro)·Jv/Ro]和Jv呈现线性相关性,对比绿原酸单体溶液和60%醇沉溶液,散点分布存在差异,说明不同溶液环境影响绿原酸的纳滤传质行为。进而对传质系数与绿原酸浓度进行幂相关拟合,结果见图2,二者呈现较高的幂值相关,回归系数均大于0.98,纳滤传质数学模型成立。
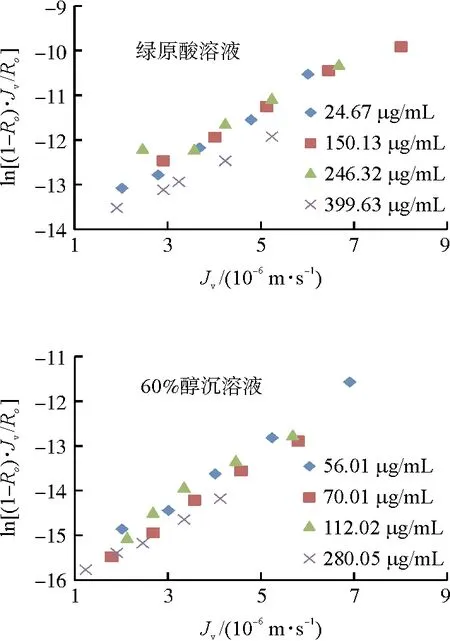
图1 绿原酸ln[(1-Ro)·Jv/Ro]对Jv的相关性Fig.1 The correlation of ln[(1-Ro)·Jv/Ro] and JV of chlorogenic acid

图2 绿原酸纳滤传质系数与浓度的相关性曲线Fig.2 Correlation curve between k and C0 of chlorogenic acid
纳滤分离时溶质存在状态决定了纳滤传质行为,pH 3.00时,绿原酸主要以分子态形式存在,以绿原酸单体溶液为参照,根据传质系数与浓度的相关性方程,计算60%醇沉溶液中以分子态形式存在的绿原酸浓度,结果见表1,随着60%醇沉溶液的逐步稀释,溶液中绿原酸存在状态相对稳定,大部分以离子态、缔合态形式存在,60%醇沉液原液中以分子态形式存在的比例为22.21%。
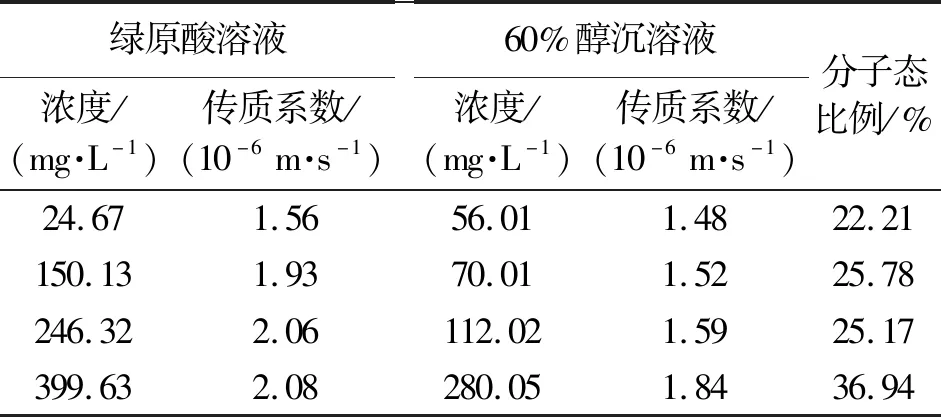
表1 60%醇沉溶液中绿原酸分子态比例Table 1 Molecular form proportion of chlorogenic acid in precipitate solution with 60% ethanol
3.1.2 70%醇沉中间体 拟合70%乙醇溶液环境下绿原酸ln[(1-Ro)·Jv/Ro]和Jv的相关性(图3),ln[(1-Ro)·Jv/Ro]与和Jv呈现线性相关性,回归系数均大于0.98。根据线性方程斜率计算传质系数,进而与浓度进行幂相关拟合,结果见图4,二者呈现良好的幂值相关,回归系数均大于0.99,纳滤传质数学模型成立。
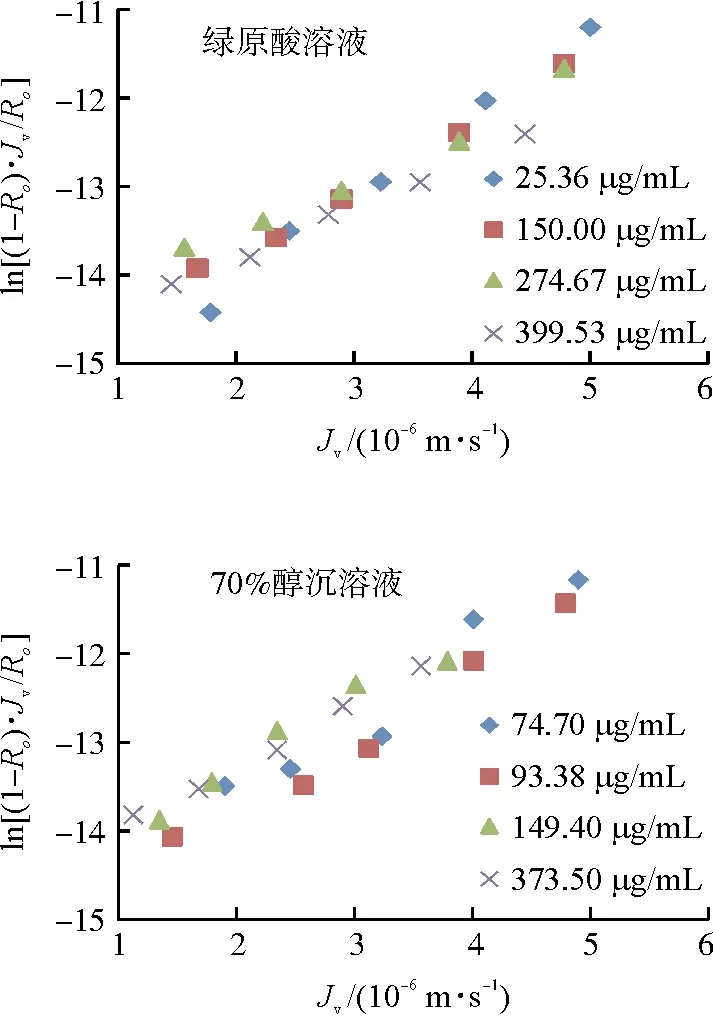
图3 绿原酸ln[(1-Ro)·Jv/Ro]对Jv的相关性Fig.3 The correlation of ln[(1-Ro)·Jv/Ro] and JV of chlorogenic acid

图4 绿原酸纳滤传质系数与浓度的相关性曲线Fig.4 Correlation curve between k and C0 of chlorogenic acid
根据绿原酸单体成分传质系数与浓度的相关性方程,计算70%醇沉溶液中相应传质系数下的对应浓度,进而计算绿原酸分子态存在的比例,结果见表2,其中70%醇沉中间体中占比为70.12%,说明醇沉浓度升高,复杂溶液环境中绿原酸的主要存在状态由离子态、缔合态向分子态过渡。

表2 70%醇沉溶液中绿原酸分子态比例Table 2 Molecular form proportion of chlorogenic acid in precipitate solution with 70% ethanol
3.1.3 80%醇沉中间体 如图5所示,ln[(1-Ro)·Jv/Ro]与和Jv相关性分布点基本呈现线性相关,回归系数均大于0.98。进而拟合传质系数与浓度的相关性,结果见图6,二者呈现良好的幂值相关,回归系数均大于0.98,纳滤传质数学模型成立,可以用于80%乙醇溶液环境下的绿原酸存在状态定量计算。

图5 绿原酸ln[(1-Ro)·Jv/Ro]对JV的相关性Fig.5 The correlation of ln[(1-Ro)·Jv/Ro] and JV of chlorogenic acid

图6 绿原酸纳滤传质系数与浓度的相关性曲线Fig.6 Correlation curve between k and C0 of chlorogenic acid
根据绿原酸单体成分传质系数与浓度的相关性方程,计算80%醇沉中间体中绿原酸相应传质系数下的以分子态存在的绿原酸浓度,结果见表3,80%醇沉中间体中占比为82.43%。结合表1和表2中数据,热毒宁注射液醇沉过程中,绿原酸分子态迁移程度表现为80%醇沉>70%醇沉>60%醇沉,说明乙醇浓度与绿原酸存在状态存在相关性,随着乙醇浓度升高破坏了绿原酸与其他酚酸以及溶剂发生缔合反应比例以及离子化程度。

表3 80%醇沉溶液中绿原酸分子态比例Table 3 Molecular form proportion of chlorogenic acid in precipitate solution with 80% ethanol
3.2 乙醇浓度与传质系数的相关性
3.2.1 绿原酸单体溶液 分析乙醇浓度对绿原酸单体成分的传质系数影响,如图7所示,以溶质浓度基本相同为前提,随着乙醇浓度的增加,溶质浓度与传质系数的相关性曲线呈现出差异性,方程系数减小、幂值增加。根据溶质浓度与传质系数间的指数方程计算系列浓度(25、150、275、400 mg·L-1)对应的传质系数,以60%乙醇浓度与80%乙醇浓度时传质系数差值为参照,计算乙醇浓度升高10%对传质系数变化的贡献百分比,结果见表4。乙醇浓度由60%增加至70%,系列溶质浓度下的乙醇浓度对传质系数的贡献百分比均大于57%,说明此阶段乙醇浓度升高引起的溶剂孔道占位作用强于70%→80%乙醇浓度阶段。同时溶质浓度升高16倍,传质系数贡献比下降31.03%,说明因溶质浓度改变带来的溶解-扩散效应可以抑制乙醇溶剂的孔道占位效应[12]。

图7 乙醇浓度对绿原酸传质行为的影响Fig.7 Effect of ethanol concentration on k of chlorogenic acid

表4 乙醇浓度对绿原酸传质系数的贡献百分比Table 4 Percentage contribution of ethanol concentration to k of chlorogenic acid
3.2.2 醇沉中间体 热毒宁注射液醇沉中间体中乙醇浓度对绿原酸的传质行为与单体溶液存在差异,对比图7和图8可知,热毒宁注射液醇沉中间体中绿原酸浓度为25 mg·L-1时,乙醇浓度由60%增加至70%,传质系数的贡献百分比大于100%,从图8中可以得出,在80%乙醇环境下,随着溶液中绿原酸浓度的增加其传质系数相对稳定。对比图7中80%乙醇溶液中的绿原酸相关性曲线,说明乙醇的孔道位阻效应、离子态绿原酸电荷效应的综合作用下,因浓度变化引起的溶解-扩散效应对传质行为不产生明显影响。

图8 乙醇浓度对醇沉中间体传质行为的影响Fig.8 Effect of ethanol concentration on k of ethanol precipitation intermediates
表4和表5中,绿原酸浓度在150~275 mg·L-1范围内,乙醇浓度由60%增加至70%,乙醇浓度对传质系数的贡献百分比均大于64%,醇沉中间体与绿原酸单体溶液相似,溶剂孔道占位作用强于70%→80%乙醇浓度阶段。随着绿原酸浓度下降至25 mg·L-1,70%与80%乙醇浓度的相关性曲线相交,提示在低于70%乙醇溶液环境下,醇沉中间体中绿原酸浓度仍会对其传质系数产生影响,绿原酸的纳滤分离行为可通过位阻效应、电荷效应和溶解扩散效应进行调控分离[13-15]。

表5 乙醇浓度对醇沉中间体传质系数的贡献比例Table 5 Percentage contribution of ethanol concentration to k of ethanol precipitation intermediates
4 讨论
基于纳滤传质数学模型中成分状态与传质行为的相关性,在相同溶剂体系环境下,选择绿原酸单体成分为参照,拟合浓度与传质系数的幂值方程,构建热毒宁醇沉中间体溶液中绿原酸存在状态定量分析模式。醇沉中间体溶液中绿原酸以分子态形式存在,比例在22.21%~82.43%范围内,随着乙醇浓度升高分子态比例增加,提示乙醇促进醇沉中间体中缔合态、离子态向分子态形式转变。因此,量化醇沉中间体中绿原酸存在状态,并进一步明确乙醇浓度对纳滤分离的调控规律,将有助于热毒宁注射液醇沉中间体常温化精制的标准化控制[16-17]。中药制剂生产过程中,成分间存在缔合、复合等多种行为,且成分存在状态与其药效直接相关,采用纳滤传质模型计算传质系数,拟合成分存在状态,将有助于解明中药复杂溶液环境下的真实存在状态,结合纳滤膜截留分子量分布特征,所构建传质模型适用于分子量100~1 000 Da的中药成分。
有机溶液环境下的纳滤分离行为是溶剂、溶质、膜组件相互作用的结果,在低浓度的绿原酸单体溶液中,乙醇浓度60%→70%阶段对传质系数的影响起主导作用,但是在所考察乙醇浓度范围内,绿原酸浓度带来的溶解-扩散效应可以抑制乙醇溶剂的孔道占位效应。而在醇沉中间体中,在乙醇浓度60%→70%阶段与绿原酸单体的传质行为相似,但传质系数因成分存在状态以及成分间的竞争透过等因素,稍低于绿原酸单体溶液,而在80%醇沉中间体的纳滤分离过程中,绿原酸浓度对传质系数未产生明显影响,传质曲线相对平稳,此时的纳滤分离是由位阻效应和电荷效应所主导,而乙醇浓度低于70%,则是位阻效应、电荷效应、溶解扩散效应综合作用的结果。同时,通过明确高浓度乙醇溶液环境下的绿原酸存在状态和传质行为,为有机溶液环境下的成分有序分离带来了机遇[18]。
