死亡相关蛋白激酶1、KLF4、6-氧-甲基鸟嘌呤-DNA甲基转移酶甲基化状态检测及与宫颈癌人乳头瘤病毒16感染的关系
2022-05-17刘婷婷邹学红周红玉余桂梅
倪 茗, 刘婷婷, 汪 俊, 邹学红, 周红玉, 王 燕, 余桂梅
(1. 武汉科技大学附属汉阳医院 妇科, 湖北 武汉, 430050;2. 湖北省妇幼保健院 妇产科, 湖北 武汉, 430070)
宫颈癌是一种常见的妇科恶性肿瘤,随着宫颈癌筛查技术及疫苗水平不断提高,宫颈癌得以较好预防与治疗,但其发生发展机制尚未完全阐明[1]。研究[2]显示,高危型人乳头瘤病毒(HPV)长期感染是宫颈病变的重要因素,其中HPV-16较为常见,但仅有20% 的HPV-16感染者会最终发展为宫颈癌,推测HPV感染需与其他因素协同作用促进宫颈癌发展。研究[3]显示,个体对环境暴露因素的遗传易感性在宫颈癌的发病中发挥重要作用。
近年来,基因甲基化引起的抑癌基因表达下调与宫颈癌的关系已成为研究重点。死亡相关蛋白激酶1(DAPK1)是γ干扰素介导的凋亡正性调节因子,是一种与多种细胞凋亡相关信号通路联系的抑癌基因[4]。研究[5]显示,DAPK1甲基化水平与宫颈癌的疾病进展有关,参与宫颈癌的发生。转录因子KLF4在肿瘤中发挥抑癌或促癌基因功能[6-7]。娄雪玲等[8]研究显示,宫颈癌患者癌组织中KLF4表达显著低于子宫颈炎患者。6氧-甲基鸟嘌呤-DNA甲基转移酶(MGMT)是宫颈癌的抑癌基因[9]。检测MGMT基因启动子区甲基化可能有助于宫颈癌的早期诊断和筛查[10]。基于HPV-16感染在宫颈癌中的重要作用,本研究分别对慢性子宫颈及宫颈癌患者宫颈脱落组织DAPK1、KLF4、MGMT甲基化及HPV感染状态进行比较,并探讨DAPK1、KLF4、MGMT甲基化与HPV感染状态相关性,为宫颈癌变的致病机制提供理论依据。
1 资料与方法
1.1 一般资料
选取2017年9月—2021年6月武汉科技大学附属汉阳医院初治宫颈癌患者103例作为研究对象(宫颈癌组)。年龄27~74岁,平均(50.38±5.12)岁; Ⅰ期16例, Ⅱ期18例, Ⅲ期31例,Ⅳ期38例; 高分化31例,中分化51例,低分化21例; 鳞癌31例,腺癌57例,腺鳞癌15例。纳入标准: 经临床表现、影像学、病理组织切片确诊为宫颈癌者; 患者均接受手术切除治疗,且治疗前未经化放疗; 患者临床病理资料完备。排除标准: 合并其他恶性肿瘤者; 合并自身免疫疾病者; 患者处于急性感染期; 合并脏器功能不全者。另选取同期因慢性子宫颈炎进行宫颈筛查的体检者110例作为对照组,年龄26~73岁,平均(51.62±5.48)岁。研究对象均签署知情同意书。2组研究对象在年龄等方面比较差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 DNA提取及DAPK1、KLF4、MGMT基因甲基化状态检测: 采用液基薄层细胞学检测标本收集细胞采集标本。按照ZR Genomic DNA II KitTM试剂盒说明书提取组织DNA, 通过 EZ DNA Methylation GoldTM Kit试剂盒说明书进行基因甲基化修饰后进行聚合酶链式反应(PCR), 上、下游引物序列见表1。反应体系为10×buffer 2.0 μL, MgCl21.5 μL, dNTP 1.5 μL, 样本4.0 μL, 上、下游引物各1.0 μL, ddH2O 8.25 μL, Taq酶0.25 μL。PCR反应条件: 95 ℃预热10 min, 95 ℃, 57 ℃, 72 ℃循环40次, 72 ℃延伸10 min。反应产物4 ℃保存,行琼脂糖凝胶电泳并对电泳结果进行分析。
1.2.2 HPV16感染检测: 收集研究对象脱落宫颈细胞标本,通过原位杂交法[11]检测研究对象HPV16感染情况。

表1 引物序列
1.3 统计学方法
采用统计学软件SPSS 17.0进行数据分析,计数资料用[n(%)]表示,采用检验; 采用Spearman相关分析,分析HPV16感染与DAPK1、KLF4、MGMT基因异常甲基化间的相关关系。检验水准α=0.05(双侧),P<0.05表示差异有统计学意义。
2 结 果
2.1 HPV16感染检测情况
与对照组相比,宫颈癌组患者HPV16感染阳性率升高,差异有统计学意义(P<0.05)。见表2。

表2 对照组与宫颈癌组患者HPV感染情况比较
2.2 宫颈癌组与对照组DAPK1、KLF4、MGMT基因甲基化情况
与对照组相比,宫颈癌组DAPK1、KLF4、MGMT基因异常甲基化率升高,差异有统计学意义(P<0.05)。见图1、表3。
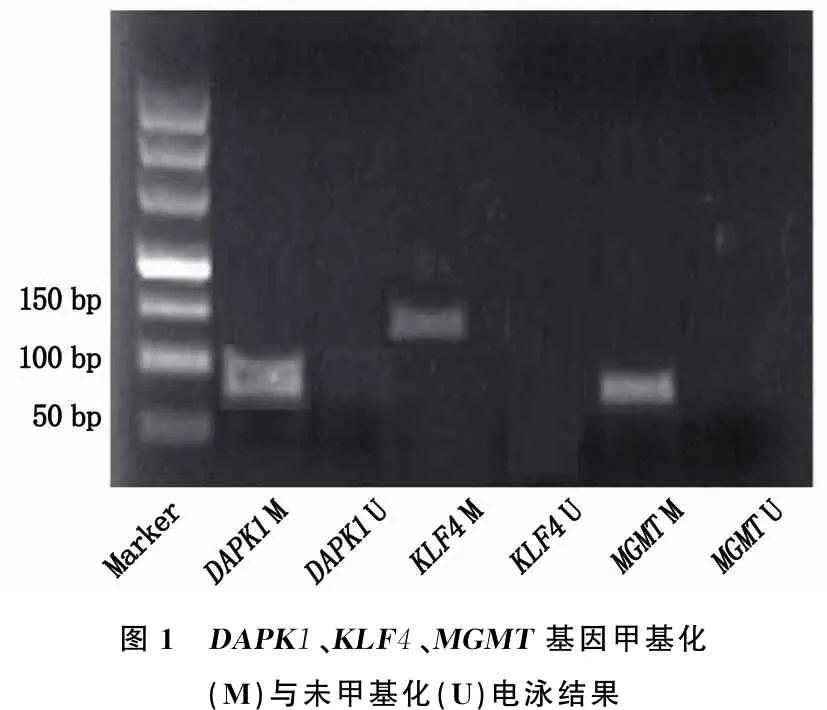
图1 DAPK1、KLF4、MGMT基因甲基化(M)与未甲基化(U)电泳结果

表3 对照组与宫颈癌组DAPK1、KLF4、MGMT基因甲基化情况比较[n(%)]
2.3 宫颈癌组织中DAPK1、KLF4、MGMT基因甲基化状态与临床病理学特征关系
根据DAPK1甲基化状态将患者分为DAPK1甲基化组47例,DAPK1非甲基化组56例; 根据KLF4甲基化状态分为KLF4甲基化组53例,KLF4非甲基化组50例; 根据MGMT甲基化状态分为MGMT甲基化组31例,MGMT非甲基化组72例; 观察APK1、KLF4、MGMT甲基化状态与宫颈癌患者临床参数的关系。分化程度低、TNM分期Ⅲ~Ⅳ期、有淋巴结转移及有远处转移患者宫颈癌组织甲基化率高于分化程度高、中以及TNM分期Ⅰ~Ⅱ、无淋巴结转移、无远处转移者,差异有统计学意义(P<0.05); 在不同年龄、宫颈癌类型、肿瘤大小患者中比较,差异无统计学意义(P>0.05)。见表4。
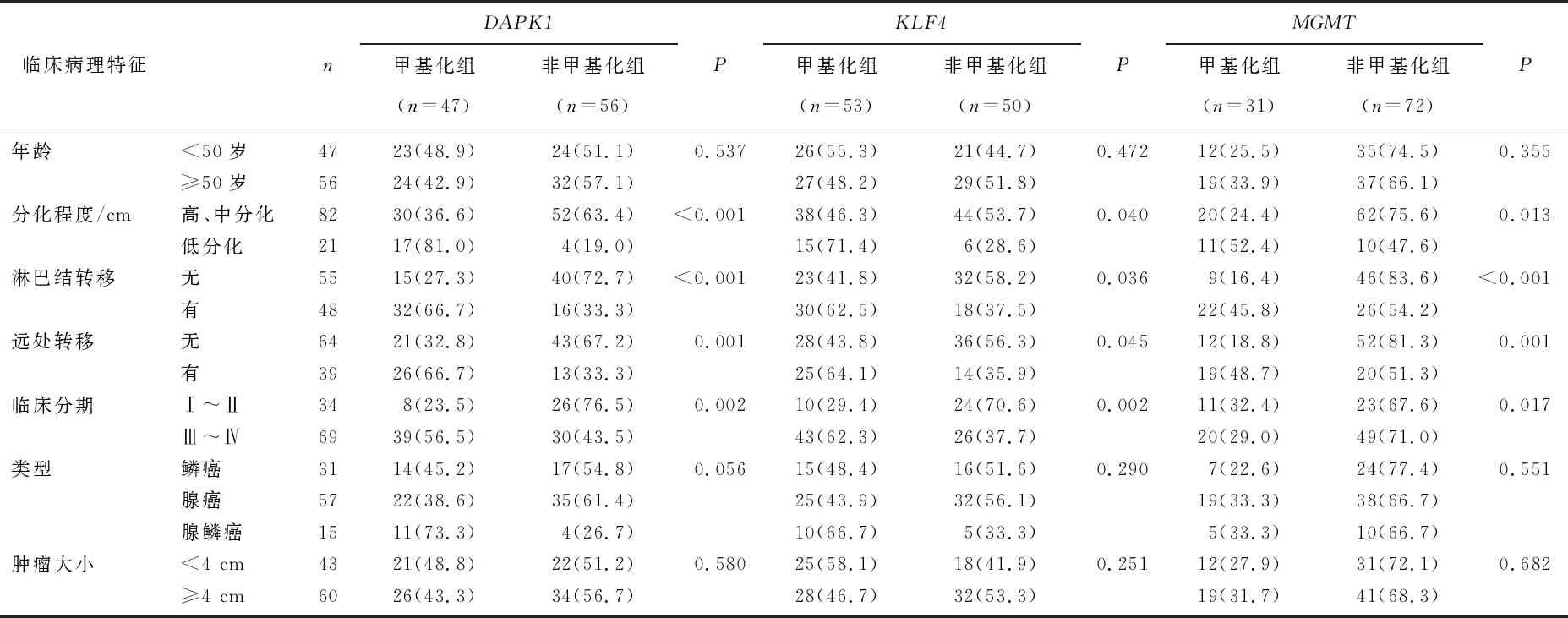
表4 DAPK1、KLF4、MGMT基因甲基化状态与临床病理特征关系[n(%)]
2.4 宫颈癌组APK1、KLF4、MGMT甲基化与HPV16感染相关性
与HPV16感染阴性相比, HPV16感染阳性患者中APK1、KLF4、MGMT甲基化比例升高,差异有统计学意义(P<0.05)。 见表5。HPV16感染情况与APK1、KLF4、MGMT甲基化呈正相关(r=0.454, 0.307,P<0.05)。
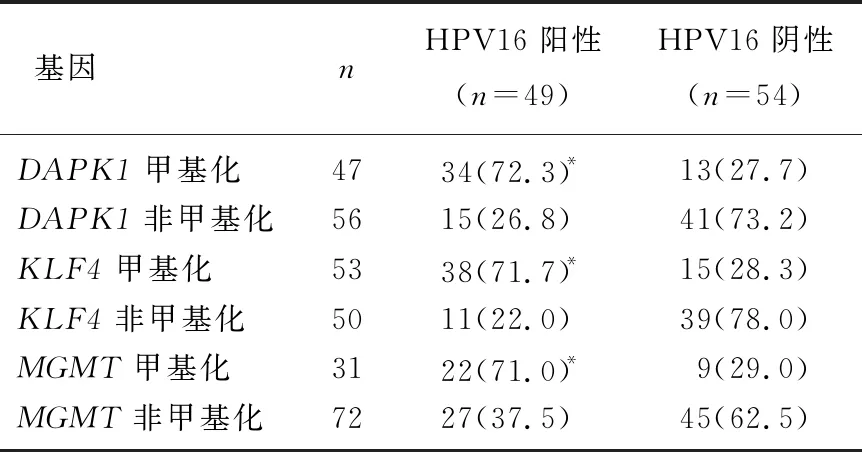
表5 宫颈癌组织APK1、KLF4、MGMT甲基化与HPV16感染相关性[n(%)]
3 讨 论
高危HPV持续感染是宫颈癌发病的重要原因,其中以HPV16为最常见类型,但部分感染HPV16患者可转阴,宫颈癌的发病是多种原因共同促进发展的结果。
DAPK1定位于9q34.1, 是一种丝氨酸/苏氨酸蛋白激酶,广泛参与多种途径介导的细胞凋亡过程,是近年来发现的抑癌基因,与肿瘤的发生发展密切相关[4]。石雪等[12]研究显示,DAPK1基因CpG岛甲基化是DAPK表达缺失的重要原因。TAN Y L等[13]研究显示,宫颈癌患者宫颈组织DAPK1高甲基化。本研究中,宫颈癌组织中DAPK1基因甲基化率为45.6%, 显著高于慢性子宫颈炎患者的22.7%, 提示DAPK1基因甲基化与宫颈癌的发生发展密切相关。进一步探究发现,分化程度低、TNM分期 Ⅲ~Ⅳ期、有淋巴结转移、有远处转移患者宫颈癌组织DAPK1基因甲基化率显著高于分化程度高、中以及TNM分期Ⅰ~Ⅱ、无淋巴结转移、无远处转移者,提示DAPK1基因甲基化与宫颈癌的发展紧密相关,而在年龄、宫颈癌类型、肿瘤大小方面比较差异不显著。本研究发现,DAPK1甲基化宫颈癌组织中HPV16阳性率为72.3%, 而DAPK1未甲基化宫颈癌组织中HPV16阳性率仅为26.8%, 提示DAPK1甲基化与HPV16感染密切相关。
KLF4可在不同肿瘤类型中发挥癌基因或抑癌基因作用,存在组织差异,其在胶质瘤中发挥癌基因作用[7], 而在胃癌、肝癌等上皮癌中发挥抑癌作用[14-15]。研究[16]显示,KLF4基因在宫颈癌的发生进展中作为肿瘤抑制因子失活,且DNA甲基化与KLF4蛋白表达呈负相关,去甲基化剂5-Aza处理宫颈癌SiHa和C33A细胞, KLF4蛋白表达恢复。本研究中,宫颈癌组患者癌组织KLF4甲基化率显著高于慢性子宫颈炎患者,提示KLF4甲基化与宫颈癌的发生有关; 与病理学关系研究显示,KLF4甲基化与宫颈癌患者分化程度、临床分期、淋巴结转移、远处转移等临床病理特征有关,而与肿瘤大小、肿瘤类型、年龄无关,提示KLF4甲基化在宫颈癌病情及预后中有一定价值。本研究中,KLF4甲基化与HPV16感染呈正相关,提示HPV16感染可能通过影响KLF4甲基化参与宫颈癌的发生发展。猜测KLF4基因甲基化可作为宫颈癌基因层次的标志物,在宫颈癌诊断、病情及预后中发挥作用。
MGMT基因编码DNA修复蛋白,能够保护细胞免受DNA损伤[17]。在宫颈癌中,MGMT基因沉默, HPV16病毒大量翻译,细胞倾向癌变。本研究中,MGMT基因甲基化率高于慢性子宫颈炎者,提示MGMT基因甲基化与宫颈癌患者的发病有关。进一步研究发现,MGMT基因甲基化与宫颈癌患者分化程度、TNM分期、淋巴结转移、远处转移等临床病理特征有关,提示MGMT基因甲基化与宫颈癌的发展关系密切,猜测MGMT基因甲基化可能能作为宫颈癌检测的标志物,但本研究未做研究,有待进一步探讨。研究[18]显示,MGMT表达下调可增加患者高危HPV感染概率。本研究中,MGMT基因甲基化与患者HPV16感染呈正相关,提示MGMT基因甲基化与HPV16感染相关。
综上所述, HPV16感染可能与APK1、KLF4、MGMT甲基化密切相关, HPV16感染可能与APK1、KLF4、MGMT协同参与宫颈癌的发生发展。本研究仍存在一定的不足,宫颈癌发病缓慢、机制复杂,是多种因素长期累积结果,鉴于DNA甲基化与宫颈癌变关系的复杂性,详细机制有待进一步探讨。
