程序性坏死诱导剂抗肿瘤作用研究进展
2022-05-16杨利军郑艳波弓建华
赵 琪,杨利军,郑艳波,弓建华
1山西医科大学药理教研室,太原 030001 2中国医学科学院 北京协和医学院 医药生物技术研究所肿瘤室,北京 100050
细胞程序性死亡在维持组织内稳态过程中发挥着重要作用,已知的程序性死亡方式主要包括凋亡、程序性坏死、焦亡、铁死亡等[1]。细胞凋亡是一种预防癌症发生的天然屏障[2],也是抗肿瘤药物发挥作用的重要机制,凋亡耐受会促进肿瘤的发生、发展以及耐药的产生,从而导致肿瘤治疗的失败。当凋亡机制受损时,程序性坏死作为抑制肿瘤发展的另外一道屏障,可以有效阻止肿瘤的进展[3]。程序性坏死在肿瘤生物学中的重要作用使其成为肿瘤治疗的新靶标,越来越多的化合物和药物通过诱导程序性坏死来抑制肿瘤的发展[4]。
程序性坏死特征及调节机制
坏死作为细胞死亡的一种方式,分为受调控的程序性坏死和不受调控的坏死。程序性坏死的概念最早于2005年提出[5],当细胞发生程序性坏死时,其形态学特征与坏死相似,包括细胞膜通透性改变、细胞和细胞器肿胀、细胞质膜破裂及细胞内容物释放等特征,但其受受体相互作用蛋白激酶(receptor interacting protein kinase,RIPK)1、RIPK3、混合系激酶区域样蛋白(mixed lineage kinase domain-like protein,MLKL)等关键分子的调控。坏死细胞质膜的破裂还会释放细胞内容物,这可能导致损伤相关分子模式(damage associated molecular pattern,DAMP)的暴露,并引发强烈的炎症反应[6]。
很多刺激因素能够引起程序性坏死,例如肿瘤坏死因子(tumor necrosis factor,TNF)家族包括TNF-α、FasL和肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis inducing ligand,TRAIL),以及病原体识别受体(PRR)包括TLR3、TLR4和Z-DNA结合蛋白1(ZBP1)等[1,7]。根据目前的研究,TNF-α及TNF受体1(TNF receptor1,TNFR1)调节程序性坏死的信号通路已经比较清楚[8- 11](图1)。
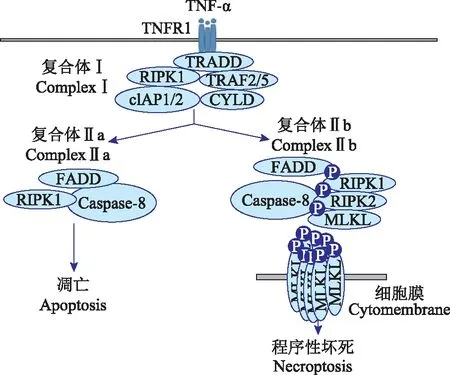
TNF-α:肿瘤坏死因子-α;TNFR1:肿瘤坏死因子受体1;TRADD:肿瘤坏死因子受体1型相关死亡结构域蛋白;RIPK1:受体相互作用蛋白激酶1;TRAF2/5:肿瘤坏死因子受体相关因子2/5;cIAP1/2:细胞凋亡抑制因子1/2;CYLD:去泛素化酶头帕肿瘤综合征蛋白;FADD:Fas相关死亡结构域蛋白;RIPK3:受体相互作用蛋白激酶3;MLKL:混合谱系激酶结构域蛋白
TNF-α与TNFR1相结合,诱导下游TNF受体相关死亡结构域蛋白(TNF-α receptor-associated death domain protein,TRADD)、RIPK1、细胞凋亡抑制因子(cellular inhibitor of apoptosis protein,cIAP)1/2、去泛素化酶CYLD及 TNFR相关因子(TNFR-associated factor,TRAF) 2/5等分子聚集形成膜相关复合物Ⅰ(Complex Ⅰ)。cIAP诱导RIPK1泛素化时,会抑制复合体Ⅱa (Complex Ⅱa)和复合体Ⅱb (ComplexⅡb,亦称necrosome)的形成,从而阻断RIPK1介导的细胞凋亡或程序性坏死。复合体Ⅱa由Caspase- 8、Fas相关死亡结构域蛋白(Fas-associated protein with death domain,FADD)和RIPK1等分子构成,复合体Ⅱb由Caspase- 8、FADD、RIPK1、RIPK3和MLKL等分子构成。而当CYLD使RIPK1去泛素化时可以促进复合物Ⅱa和Ⅱb的组装[12],CYLD对RIPK1的去泛素化对坏死体组装和激活至关重要[13]。
如果在ComplexⅡa内Caspase- 8活化,则切割破坏RIPK1及RIPK3,阻断程序性坏死通路,同时外源性凋亡通路被激活,最终导致细胞凋亡。如果此时抑制了Caspase- 8的活性,则会影响Caspase- 8的功能,使得RIPK1以及RIPK3无法被完全清除。此时RIPK1和RIPK3通过磷酸化形成ComplexⅡb,其构型就会发生变化,导致结合更加紧密。而后ComplexⅡb将向下游传递信号,MLKL已被确定为RIPK3的下游底物,RIPK3介导的MLKL磷酸化促进MLKL寡聚和膜定位,最终会导致细胞膜破裂[14- 15]。因此,Caspase- 8是否激活及RIPK1和RIPK3之间的相互作用可以称为“切换开关”,最终激活凋亡或程序性坏死。
程序性坏死与肿瘤之间的联系
程序性坏死具有促进和抑制肿瘤生长的双重作用[16]。在诱导凋亡失败的细胞中,程序性坏死可以作为细胞死亡的替代途径阻止肿瘤的发展。然而,作为一种诱导细胞坏死的死亡方式,程序性坏死可触发炎症反应,进而促进肿瘤的发生和转移。
一方面,诱导程序性坏死可以抑制肿瘤的发展。在不同类型的癌细胞中发现了程序性坏死信号通路中许多关键分子的下调,这表明癌细胞可能通过逃避坏死而存活。在许多癌细胞系中,RIPK3表达缺失或减少[17]。在患有黑色素瘤、胰腺癌和宫颈鳞状细胞癌的患者中,低水平的MLKL与总体生存率降低有关[18]。这些发现表明,RIPK3和MLKL是重要的肿瘤抑制因子,且与肿瘤预后密切相关。基于这些研究,通过激活或恢复程序性坏死相关信号通路,可能作为治疗癌症的一种方法。另一方面,程序性坏死也可以促进肿瘤的发生和转移[19]。例如在乳腺癌细胞系中,敲除RIPK3或MLKL或用MLKL抑制剂Necrosulfonamide处理可显著降低瘤细胞的致瘤性[20]。Strilic等[21]发现,小鼠和人肺癌细胞能诱导内皮细胞程序性坏死,促进肿瘤细胞外逃和转移;当运用RIPK1抑制剂Nec- 1处理内皮细胞或敲除内皮细胞中的RIPK3的表达时,可以减少肿瘤细胞诱导的内皮细胞程序性坏死,降低肿瘤细胞外逃和转移。研究表明,程序性坏死会募集免疫炎性细胞,从而促进血管生成及癌细胞增殖,加速肿瘤细胞转移[2,22]。
鉴于程序性坏死在肿瘤发生发展过程中双重作用,进一步研究程序性坏死发挥积极抗肿瘤效应的分子机制,可将程序性坏死抗肿瘤效应最大化。
诱导程序性坏死相关肿瘤治疗药物
近年来,研究发现许多化合物和药物通过作用于RIPK1、RIPK3、MLKL等程序性坏死通路关键分子,诱导或抑制程序性坏死。本文重点介绍通过诱导程序性坏死而产生抗肿瘤作用的化合物与药物。已报道能诱导程序性坏死的药物如表1所示,根据其化学性质和作用机制等的不同可分为天然产物、化疗药物、死亡受体配体、激酶抑制剂、无机盐、金属配合物和金属纳米颗粒以及其他程序性坏死诱导剂。
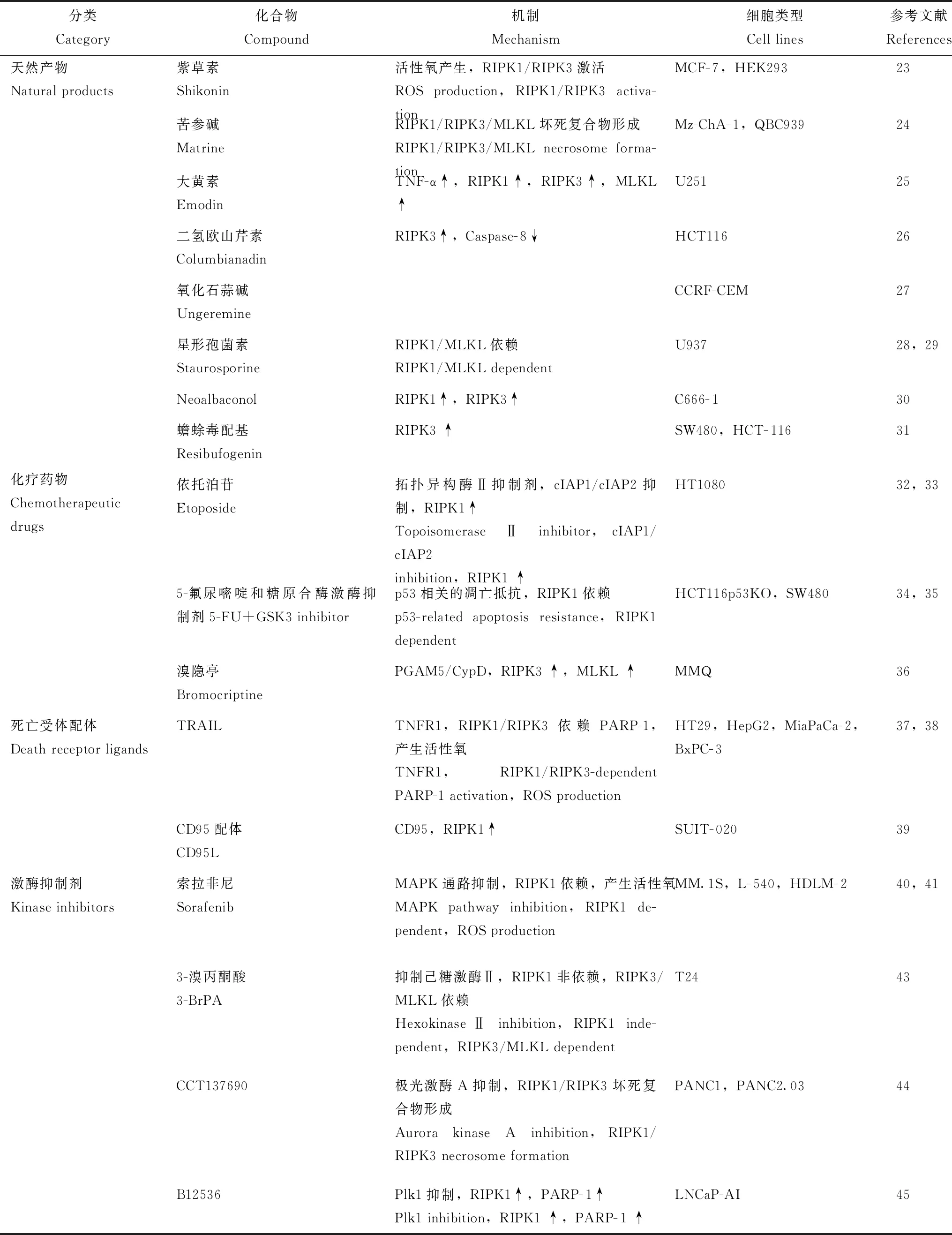
表1 诱导程序性坏死的癌症治疗药物

续表1
天然产物许多来源于植物、微生物或动物的天然产物能够引起程序性坏死,显示出抗癌活性。紫草素是从传统中药紫草中提取的萘醌类小分子化合物,研究发现它可以诱导P-糖蛋白、Bcl- 2或Bcl-xL高表达的MCF- 7和HEK293细胞程序性坏死,其特征为细胞器肿胀、质膜完整性丧失、线粒体膜电位下降[23]。苦参碱是从中草药苦参中提取的一种生物碱,研究表明苦参碱处理的胆管癌细胞Mz-ChA- 1和QBC939细胞质膜破裂,细胞核完整,与坏死细胞的形态一致;进一步研究证实苦参碱可以通过促进RIPK1/RIPK3/MLKL复合物的形成而诱导程序性坏死[24]。苦参碱能够上调RIPK3在Mz-CHA- 1细胞中的表达从而促进程序性坏死,为治疗RIPK3低表达的胆管癌提供了可能[24]。大黄素是从中药大黄中提取的一种蒽醌衍生物,体内外实验表明大黄素可促进胶质瘤细胞及肿瘤组织中TNF-α、RIPK1、RIPK3和MLKL的表达,进而诱导细胞坏死而发挥抗肿瘤作用[25]。二氢欧山芹素是一种植物提取物。研究表明,小剂量二氢欧山芹素可以诱导结肠癌细胞HCT116凋亡;高剂量则会导致RIPK3上调并抑制Caspase- 8活性,从而促进HCT116细胞发生程序性坏死[26]。氧化石蒜碱是一种从小沙棘中提取的生物碱,对多种肿瘤细胞株均显示出较强的杀伤活性;但其活性受Nec- 1抑制,氧化石蒜碱能够上调白血病CCRF-CEM细胞中RIPK3的表达,表明其可以通过诱导程序性坏死而杀伤肿瘤细胞[27]。
星形孢菌素是一种从细菌中分离的生物碱,可诱导多种类型细胞的凋亡[28]。但当Caspase活化受损时,星形孢菌素可诱导白血病细胞中RIPK1和MLKL依赖性的程序性坏死[29]。天然产物neoalbaconol是一种从真菌中提取的小分子化合物,研究表明neoalbaconol通过促进RIPK1/RIPK3的共定位及相互作用而诱导肿瘤细胞程序性坏死,而Nec- 1能够抑制neoalbaconol诱导的细胞死亡[30]。
蟾蜍毒配基是一种从蟾蜍毒素中提取的生物活性化合物,可通过RIPK3介导的途径诱导程序性坏死,从而抑制结直肠癌的生长和转移[31]。
化疗药物多种肿瘤化疗药物可通过诱导程序性坏死发挥抗肿瘤活性。依托泊苷是一种拓扑异构酶Ⅱ抑制剂,已被用于小细胞肺癌、淋巴瘤、睾丸癌等的治疗[32]。依托泊苷可以抑制cIAP1和cIAP2表达,促进RIPK1的表达而诱导程序性坏死[33]。胸苷酸合成酶抑制药5-氟尿嘧啶和糖原合酶激酶(GSK3α或GSK3β)抑制剂联用可以克服p53缺陷型结肠癌细胞的凋亡耐受,诱导RIPK1依赖的程序性坏死,并在化疗期间使耐药的结肠癌细胞重新敏感[34- 35]。溴隐亭是治疗垂体催乳素瘤最常用的多巴胺受体激动剂,能有效缩小催乳素瘤的肿瘤体积。研究发现,溴隐亭可通过磷酸甘油酸变位酶家族5/亲环素D途径诱导催乳素瘤细胞RIPK3/MLKL依赖性程序性坏死[36]。
死亡受体配体TRAIL是一种死亡受体配体,能够诱导癌细胞凋亡,而对正常细胞的细胞毒性很小。但当细胞外环境呈酸性时,TRAIL可以诱导结肠癌HT29细胞和肝癌HepG2细胞发生程序性坏死而非凋亡。运用RIPK1及PARP- 1抑制剂或siRNA下调RIPK1及RIPK3的表达,均能够抑制TRAIL诱导的程序性坏死及PARP- 1依赖性的胞内ATP耗竭,表明PARP- 1是RIPK1/RIPK3下游的活性效应分子[37]。胰腺癌细胞中,运用RIPK1抑制剂及siRNA下调RIPK3的表达能够抑制TRAIL诱导的细胞死亡,表明TRAIL也可以诱导人胰腺癌细胞的程序性坏死[38]。
CD95配体(CD95L),也称为Fas配体,也是一种死亡受体配体,在与受体CD95结合后可诱导凋亡。Pietkiewicz等[39]研究表明,CD95L和吉西他滨的联合可以同时诱导胰腺癌细胞的凋亡和程序性坏死。CD95L单独使用时,主要诱导Caspase依赖性的细胞凋亡,这一死亡方式可被Caspase抑制剂zVAD-fmk完全抑制。但当CD95L与吉西他滨联用时,zVAD-fmk及Nec-1均只能部分抑制细胞死亡。而zVAD-fmk与Nec-1联用则能完全抑制细胞死亡,表明与吉西他滨联用改变了CD95L诱导的细胞的死亡方式,吉西他滨显著增强了CD95L诱导的RIPK1介导的程序性坏死。
激酶抑制剂已发现程序性坏死与多种激酶抑制剂的抗肿瘤作用有关。索拉非尼是一种多激酶抑制剂,主要作用于MAPK通路。研究表明,当Caspase活性被抑制时,索拉非尼能通过程序性坏死诱导多发性骨髓瘤细胞死亡[40],这一过程可被Nec- 1抑制。索拉菲尼还可以诱导霍奇金淋巴瘤细胞RIPK1依赖性的程序性坏死[41]。据报道,烷化剂3-溴丙酮酸(3-BrPA)通过抑制糖酵解的关键酶之一,己糖激酶Ⅱ的活性诱导细胞死亡[42]。MLKL抑制剂NSA可以逆转3-BrPA诱导的膀胱癌细胞株T24死亡,RIPK1抑制剂Nec- 1处理并不能挽救3-BrPA诱导的细胞死亡,这表明3-BrPA通过非依赖RIPK1但依赖RIPK3/MLKL的途径诱导细胞死亡[43]。CCT137690是一种极光激酶A抑制剂,可通过抑制极光激酶A的活性而促进RIPK3与RIPK1形成坏死复合物,进而诱导程序性坏死,CCT137690在体外和体内都能显著抑制胰腺癌的生长[44]。BI2536是一种有丝分裂激酶Plk1的小分子抑制剂,抑制Plk1的活性可诱导前列腺癌LNCaP-AI细胞Caspase非依赖性的死亡,这一过程可被Nec- 1抑制,表明BI2536可诱导前列腺癌细胞程序性坏死[45]。
无机盐、金属配合物和金属纳米颗粒氯化钴(CoCl2)能够诱导细胞缺氧诱导因子- 1α(hypoxia inducible factor- 1,HIF1α)的表达,因此常用于体外缺氧模型的构建[46]。研究表明氯化钴可诱导结肠癌细胞HT- 29凋亡。但当氯化钴与zVAD-fmk联用时,则可增加RIPK1、RIPK3和MLKL蛋白的表达,从而诱导程序性坏死[47]。大量研究表明金属锂具有潜在的抗肿瘤作用。氯化锂(LiCl)可通过激活AKT/mTOR通路诱导神经鞘瘤细胞程序性坏死,程序性坏死抑制剂Nec- 1、ROS抑制剂NAC及AKT/mTOR通路抑制剂均可逆转上述作用,Nec- 1可抑制AKT/mTOR通路的激活,提示AKT/mTOR通路位于RIPK1的下游[48]。
铼[Re(Ⅳ) ]配合物体外实验显示对乳腺、卵巢和前列腺癌细胞具有很强的抗增殖活性[49]。铼氧配合物处理结直肠癌细胞后,荧光显微镜观察到细胞膜破裂、线粒体损伤、碘化丙啶摄取和ROS产生增加等程序性坏死特征,且受RIPK1及RIPK3的调控[50]。顺铂是一种具有抗癌活性的金属配合物,主要用于卵巢癌、前列腺癌、食管癌等的治疗[51]。研究表明,在凋亡耐受的食管癌细胞中,顺铂可以通过自分泌TNF-α信号诱导坏死复合物的形成,引起食管癌细胞RIPK3依赖性的程序性坏死,抑制食管癌细胞生长[52]。
纳米银颗粒(AgNPs)是已知可以诱导癌细胞凋亡的金属纳米颗粒。Zielinska等[53]研究发现,AgNPs可以诱导胰腺癌PANC- 1细胞程序性坏死和凋亡,诱导肿瘤抑制因子p53蛋白、程序性坏死相关蛋白RIPK- 1、RIPK- 3、MLKL和自噬相关蛋白LC3-Ⅱ的水平上调。硒纳米颗粒(SeNPs)在前列腺癌细胞系PC- 3中诱导ROS介导的程序性坏死,促进RIPK1的表达,但PC- 3细胞中RIPK3表达较低且SeNPs并未诱导MLKL磷酸化水平的提升,表明SeNPs通过非经典途径诱导细胞程序性坏死[54]。
其他程序性坏死诱导剂Caspases第二线粒体激活因子(Smac)是一种内源性蛋白质,可以通过抑制cIAP来促进细胞凋亡。Smac类似物是Smac的小分子模拟物,是一类新型抗癌药物[55]。Birinapant(TL32711)是一种二价Smac类似物,可在患者来源的急性淋巴细胞白血病细胞中诱导RIPK1依赖的凋亡和程序性坏死,并在小鼠体内显示出抗肿瘤作用[56]。Hannes等[57]报道,另一种Smac类似物(BV6)与TNF-α联合应用,可通过诱导RIPK1/RIPK3复合物的形成来诱导胰腺癌细胞发生程序性坏死并阻断细胞凋亡。在急性髓系白血病中,BV6可拮抗凋亡抑制蛋白的过表达,并触发TNF-α依赖的程序性坏死,从而杀死肿瘤细胞[58]。这些研究表明可以开发Smac类似物作为促进程序性坏死的新型化疗药物,从而克服凋亡耐受。
泛素-蛋白酶体系统是细胞选择性降解不需要或受损蛋白质的重要途径,在调控细胞周期和细胞死亡过程中起着重要作用[59]。蛋白酶体抑制剂在临床上被认为是一种很有前途的抗癌药物,经典的蛋白酶体抑制剂硼替佐米已用于治疗多发性骨髓瘤[60]。Moriwaki等[61]报道蛋白酶体抑制剂MG132和硼替佐米能激活小鼠成纤维细胞和人类白血病细胞中RIPK3/MLKL依赖性程序性坏死。不同于经典TNF样细胞因子诱导的坏死,蛋白酶体抑制剂诱导的坏死不需要Caspase活性的抑制,但依赖于RIPK3上完整的RIP同型相互作用基序(RHIM)。研究发现,硼替佐米和Toll样受体激动剂联合使用可激活RIPK3坏死性途径,z-VAD-fmk或MLKL抑制剂NSA处理可分别减少硼替佐米介导的白血病细胞THP-1死亡,说明硼替佐米可同时诱导细胞的凋亡和程序性坏死[62]。由此可见,泛素-蛋白酶体系统可能是依赖RIPK3的程序性坏死的潜在调控途径,蛋白酶体抑制剂可用作靶向程序性坏死途径的抗癌药物。
Obatoclax是一种抗凋亡蛋白Bcl- 2的小分子抑制剂,可通过诱导自噬而触发程序性坏死,这一发现将自噬与程序性坏死联系在一起[63]。聚肌胞苷酸(PolyIC)是一种病毒dsRNA类似物,在宫颈癌细胞中可以诱导程序性坏死,坏死的细胞会产生IL- 1α,从而激活树突细胞释放IL- 12,这一过程对于对抗肿瘤活性至关重要[64]。NUPRI1是固有无序蛋白的一员,能促进胰腺癌的发展,因此成为抗癌治疗靶点[65]。据报道,一种新合成的NUPR1抑制剂ZZW- 115通过引起线粒体功能障碍诱导程序性坏死,抑制小鼠体内胰腺移植瘤的生长[66]。双酚A是一种具有雌激素活性的化学物质[67],能诱导人神经母细胞瘤细胞SH-SY5Y发生凋亡,继而出现坏死。当Nec- 1与双酚A联用时,程序性坏死被细胞凋亡所取代,表明双酚A能部分诱导程序性坏死[68]。
总结与展望
程序性坏死是一种受调控的细胞死亡形式,这为药物干预这一过程提供了可能。一系列的研究表明,程序性坏死在肿瘤发生、发展及转移过程中发挥重要作用。目前已发现大量的化合物和药物可通过直接或间接作用于RIPK1、RIPK3及MLKL等关键分子调控细胞程序性坏死的发生。特别是对于肿瘤细胞凋亡耐受的情况,诱导程序性坏死的药物可以使细胞对死亡重新敏感,这为克服耐药提供了一种有效方法。虽然通过药物诱导程序性坏死具有一定的抗肿瘤效应,但研究也发现程序性坏死具有促进某些肿瘤发生和转移的作用。因此,对于诱导程序性坏死可能带来的不良反应也需要格外关注。综上,深入了解程序性坏死的作用机制及其对癌症进程的影响,探究程序性坏死诱导剂的适应证人群,将进一步拓展这类药物在抗肿瘤领域的应用。
