棕熊分子鉴定方法的建立与应用
2022-05-16谢培根胡馨予俞可心吴国生徐爱春
谢培根 胡馨予 俞可心 胡 娟 吴国生 蔡 平 管 峰 徐爱春*
(1.中国计量大学生命科学学院,杭州,310018;2.青海省西宁野生动物园,西宁,810001;3.青海省林业厅野生动植物和自然保护区管理局,西宁,810007)
棕熊(Ursusarctos)是世界上分布最广的大型食肉动物之一,分布在北美、欧洲和亚洲北部。作为陆地上食肉目(Carnivora)中体形最大的哺乳动物之一,棕熊在消灭鼠害、防止疫病蔓延和维持生态平衡等方面具有重要作用。我国主要有藏棕熊(也称马熊,U.a.pruinosus)、喜马拉雅棕熊(也称天山棕熊,U.a.isabellinus)和东北棕熊(U.a.lasiotus)3个亚种[1-2]。近年来,由于牧区扩大、农田开垦、定居点建设和其他经济活动,人类不断占领大型肉食动物的领域导致人与棕熊冲突不断加剧[3-6]。2000年以来,为避免人熊冲突和非法狩猎,棕熊在西欧大部分地区的数量急剧下降,甚至惨遭灭绝[7]。近年来,我国境内频繁发生棕熊与人冲突事件,在青海地区藏棕熊损坏房屋,取食存粮,甚至攻击人造成死伤[6]。为明确棕熊的数量、分布和日益严峻的人兽冲突,尤其是棕熊伤人事件频发的诱因,需要对其进行数量和分布以及生态、食性等多方面的调查研究。
传统的样线观察法和形态学鉴定是野生动物调查鉴定最常用的手段,在现代分子生物学基础上发展起来的DNA条形码技术可通过动物组织、残体、毛发或粪便等进行物种鉴定。棕熊的调查研究与鉴定中,传统形态学鉴定和直接观察法费时费力,存在潜在的人兽冲突风险;DNA条形码鉴定需要测序对比等环节,且数据库中棕熊信息较少。棕熊活动中会留下足迹、粪便和毛发等可视样品,粪便是最常见且数量较多的样品材料,但是也存在形态学辨识困难等问题。因此,建立一种基于棕熊粪便的物种鉴定方法,以利于提高棕熊调查研究的工作效率,这对于野外调查工作具有重要的实践意义。
本研究以粪便为材料,筛选棕熊的特异性mtDNA序列,设计并建立藏棕熊特异性PCR鉴定方法,为藏棕熊的分布、数量和活动踪迹调查等研究提供技术支持。
1 材料与方法
1.1 材料
本研究中藏棕熊、东北棕熊、马来熊(Helarctosmalayanus)、高原鼠兔(Ochotonacurzoniae)、兔狲(Felismanul)、藏羚(Pantholopshodgsonii)、金钱豹(Codonopsisjavanica)、貂(Martessp.)的阳性DNA和东北棕熊、喜马拉雅棕熊、北极熊(Ursusmaritimus)粪便均由青海省西宁野生动物园提供,鸡、牛、绵羊、家兔、小鼠、骆驼、家牦牛、梅花鹿(Cervusnippon)、猪、鸭、鱼和狗的DNA为试验室保存。53份疑似藏棕熊粪便样品为2018—2019年野外调查采集,-20 ℃冷冻保存。
1.2 方法
1.2.1 样本DNA提取与试剂
粪便DNA提取试剂盒分别购自杭州新景生物技术公司和天根生化科技(北京)有限公司;TaqDNA酶、蛋白酶K、dNTPs、核酸染料GelRed和DNA Marker C等购自生工生物工程(上海)股份有限公司。
1.2.2 DNA提取及质量检测
取粪便样品约50 mg,参照粪便组织DNA提取试剂盒说明进行DNA提取。提取后的DNA均置于4 ℃保存备用。用超微量分光光度计NanoDrop 2000(Thermo)检测DNA浓度和纯度OD260/OD280值。
1.3 鉴定引物
根据GenBank数据库的基因序列,以棕熊mtDNA全序列(EU497665,AF303110,GU573471,GU573491)为参照,并比较黑熊(Ursusamericanus,AF303109)、洞熊(U.spelaeus)(FN39 0869)和北极熊(JX196383)的mtDNA全序列,选择棕熊的特异性序列设计引物(表1),预期产物长度486 bp。引物由杭州擎科梓熙生物技术有限公司合成。
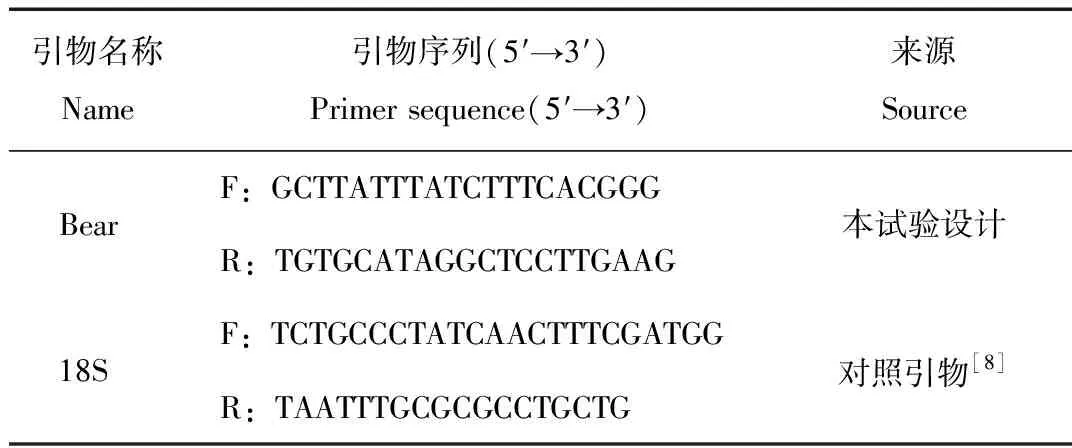
表1 棕熊鉴定的引物序列
1.4 PCR扩增和特异性
PCR扩增基础反应体系为20.0 μL,其中10×Buffer(含Mg2+)2.0 μL,dNTPs(2.5 mmol/L)1.6 μL,上、下游引物各2.0 μL,5 U/μLTaqDNA聚合酶0.4 μL,DNA模板3.0 μL(约50 ng),加双蒸水至20.0 μL。PCR反应程序为94 ℃预热变性5 min;94 ℃变性30 s,62 ℃退火32 s,72 ℃延伸45 s,共计31个循环;最后72 ℃延伸7 min,PCR程序结束后自动降温至4 ℃保存。
应用该PCR体系对东北棕熊、藏棕熊、喜马拉雅棕熊、高原鼠兔、兔狲、家牦牛、藏羚、金钱豹、貂、鸡、牛、绵羊、家兔、小鼠、骆驼、梅花鹿、家猪、鸭、鱼和狗的基因组DNA进行扩增反应,试验重复3次,依据有无PCR产物判定引物的特异性。
取5 μL PCR产物经1.5%的琼脂糖凝胶电泳检测,阳性产物送杭州擎科梓熙生物技术有限公司直接测序。
1.5 藏棕熊鉴定双重PCR方法
为降低藏棕熊粪便鉴定中的假阴性,在棕熊鉴定PCR体系中引入1对18S rRNA引物做参照,组成双重PCR。18S rRNA引物能够得到140 bp的产物[8]。双重PCR体系中引物Bear F和Bear R各2 μL(浓度均为10 μmol/L),18S rRNA基因引物各0.6 μL,加双蒸水补充至20 μL。PCR共计30个循环,61.5 ℃退火35 s,72 ℃延伸5 min。PCR产物用2.0%的琼脂糖凝胶电泳检测。
1.6 产物测序和物种鉴定
棕熊粪便样品采用5份阳性产物直接测序用以验证。测序结果参照Ferri等[9]报道的DNA条形码鉴定物种的序列对比法进行。双向测序结果经DNAstar 7.0和MEGA 6.0软件对比、编辑后拼接,分别提交NCBI和生命条形码数据系统(Barcode of Life Data System,BOLD),并用在线软件BLAST(https://blast. ncbi.nlm.nih.gov/Blast.cgi)和Identification(http://www.boldsystems.org)进行对比,相似度大于98%即为鉴定到种[10]。
2 结果与分析
2.1 DNA质量
粪便样品DNA的质量浓度为4.5~40.0 ng/μL,所有DNA样品纯度OD260/280为1.73~2.00。结果表明虽然粪便标本的DNA浓度差异较大,但纯度都适于进一步PCR分析。
2.2 棕熊鉴定引物PCR的特异性
使用本研究设计的藏棕熊特异性PCR引物,扩增东北棕熊、藏棕熊、喜马拉雅棕熊、高原鼠兔、兔狲、家牦牛、藏羚、金钱豹、貂、鸡、牛、绵羊、家兔、小鼠、骆驼、梅花鹿和猪等多个物种的DNA,结果表明除了东北棕熊、藏棕熊、喜马拉雅棕熊之外,其他动物均无PCR扩增产物,即无交叉反应,产物大小与预期长度486 bp相符。部分结果如图1所示。

图1 棕熊鉴定引物特异性Fig.1 The specificity of brown bear identification primers 注:M.DNA Marker C;1.藏棕熊DNA的阳性对照;2~6.分别为高原鼠兔、兔狲、牦牛、藏羚和鸡;N.阴性对照 Note:M,DNA Marker C.1,Brown bear positive control.2-6,Ochtona,Pallas’s cat,yak,Tibetan antelope and chicken.N,Negative control
2.3 棕熊鉴定双重PCR体系
优化后的双重PCR产物经2.0%琼脂糖凝胶电泳检测,结果表明藏棕熊、喜马拉雅棕熊和东北棕熊PCR产物均可见与预期大小一致的特异性产物和18S rRNA基因参照产物,其他物种则只有18S rRNA基因的参照产物,均未见特异性产物,说明棕熊鉴定引物和对照引物组合具有良好的特异性(图2),引入对照的双重PCR体系更适于棕熊的鉴定,参照引物可以降低各种因素造成假阴性结果带来的误判。
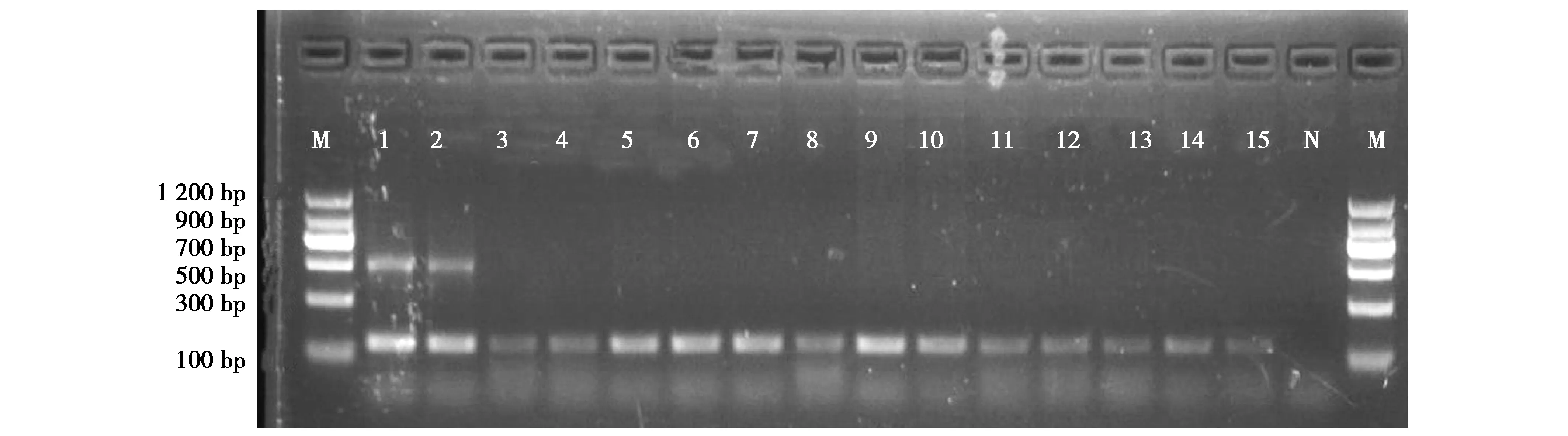
图2 棕熊鉴定引物和内参基因18S rRNA双重PCR结果Fig.2 The double PCR results of brown bear identification primers and internal reference gene 18S rRNA primers 注:M.DNA Marker C;1~2.藏棕熊和东北棕熊DNA的阳性对照;3~15.分别为高原鼠兔、兔狲、牦牛、藏羚、金钱豹、鸡、牛、绵羊、家兔、小鼠、骆驼、梅花鹿和猪;N.阴性对照 Note:M,DNA Marker C.1-2,DNA positive control of Tibetan and Northeast brown bear.3-15,Ochtona,Pallas’s cat,yak,Tibetan antelope,leopard,chicken,cattle,sheep,rabbit,mouse,camel,deer and pig.N,Negative control
2.4 测序和鉴定结果
本研究设计的棕熊特异性引物扩增阳性藏棕熊粪便DNA,产物与预期大小486 bp一致,测序结果在NCBI数据库对比为棕熊(EU497665),相似系数99.8%,与东北棕熊和喜马拉雅棕熊存在不同碱基,表明本方法可用于棕熊的物种鉴定。对53份疑似棕熊的粪便DNA双重PCR检测结果表明,3份无扩增产物,17份样品得到了140 bp和486 bp 2个扩增片段,33份仅有18S rRNA的扩增产物,表明53份粪便样本中有17份棕熊粪便,33份为非棕熊粪便样品,3份未知,确定了粪便的物种来源,进一步掌握了棕熊野外活动规律,为棕熊活动规律和防御等进一步相关研究提供了数据基础。
3 讨论
3.1 基于粪便DNA鉴定的优越性
随着生物技术和基因组研究的全面发展,棕熊鉴定技术包括了从整体形态到单分子细胞的多种材料的鉴定技术,可分为形态学鉴定、理化鉴定和分子鉴定三方面的技术,我国现行野生动物物种鉴定标准中明确要求使用2种技术互相验证才可最终确定物种类别[11]。从早期的动物外形外貌到骨骼碎片和粪便,甚至肌肉纤维和毛发的微观结构,形态学鉴定都能够依据这些特有形态进行物种辨识。理化鉴定则是依据物种特有的蛋白、化学基因或元素等成分及其在光谱或化学变化引起的特定反应进行鉴别的技术,多用于毛发、器官组织、血液、声音以及其加工成品等的鉴定。伴随着新仪器的使用,红外相机监测也属于形态学鉴定的范畴。在野生动物的物种鉴定实际应用中往往多种方法相互结合,提高鉴定效率和准确性[12-18]。由于在野生动物调查保护中获得动物样本的难度大,而棕熊作为一种具有攻击性的大型动物,对其观测或获得其活体样本的难度更大,这就需要对易于获得的粪便样品结合分子生物学方法进行鉴定[19-21]。如今,粪便分子生物技术是野生动物鉴定的重要方法和学科分支,相较于活体样本,粪便样品的获取更为便捷且无损,在野生动物鉴定和调查中逐步得到广泛应用[17,22-26],其便捷性和易于检测的优点还提高了执法部门对野生动物犯罪的监管公正性[27-28]。粪便鉴定在候鸟物种鉴定[29]、岩羊(Pseudoisnayaur)亲权分析[30]和岩羊个体识别[23]等研究中都获得良好效果,但尚无利用粪便DNA对棕熊进行特异性鉴定的研究报道。动物的新鲜粪便每克中含有10万个肠道上皮细胞[31],这足以提取DNA满足于棕熊的物种鉴定要求。本研究收集的53份粪便样品均成功提取DNA且50份(94.34%)成功鉴定,也说明了粪便材料用于棕熊鉴定具有可行性。
3.2 基于DNA分子的棕熊鉴定
分子鉴定是野生动物调查、生物多样性保护、解决人兽冲突以及开展生物科学领域诸多研究的技术基础。本研究基于DNA建立的棕熊分子鉴定方法,用于区分棕熊与其他野生动物物种,且使用易于获得的粪便为材料,为棕熊的数量和分布调查提供了便捷,建立的分子鉴定法可以有效鉴定我国分布的3种棕熊物种。
传统观测法和形态学鉴定在棕熊调研中发挥了重要作用,如人工固定样线观察或跟踪观察、粪便形态识别等[17],但这些方法费时费力,容易错过最佳调查时机,还可能给调查人员带来安全隐患,已经不能满足当今研究技术的发展需求。随着基因组和分子生物学技术发展起来基于DNA分子的鉴定技术为动物鉴定带来了新的突破,无论是残体、皮骨、粪便还是毛发,乃至1个细胞等,都能够进行准确的鉴定[32]。Cronin等[33]通过高通量基因组测序分析了北极熊、棕熊和黑熊的关系,发现棕熊拥有较多的SNP位点,为熊类的种属鉴定奠定了基础。本研究设计特异性PCR引物建立了棕熊鉴定方法,用于区分棕熊与其他物种。试验选择了mtDNA靶标,由于mtDNA广泛存在于各种细胞中,种内保守性高,种间差异性大且具有更高的拷贝数和更好的稳定性等优点[34-36],常被用作物种鉴定的靶标。在鹿(Cervidae)[37]、黄颊长臂猿(Nomascusgabriellae)、白颊长臂猿(Nomascussiki)[38]、岩羊、盘羊(Ovisammon)、雪豹(Pantherauncia)[11]以及爬行类鳄鱼(Crocodilian)[22,39]等的鉴定中广泛应用。本研究设计的棕熊特异性引物仅扩增藏棕熊、喜马拉雅棕熊和东北棕熊,而与高原鼠兔、兔狲和家牦牛等物种无扩增,具有良好的特异性。为进一步提高鉴定准确性,进行双重PCR优化,提高了棕熊鉴定的成功率。
