间充质干细胞来源外泌体对视网膜光感受器细胞PI3K/AKT通路及Ang-1蛋白水平作用的研究
2022-05-16王凤翔田春雨曹利群秦利维王丽君
洪 博,崔 蓓,王凤翔,田春雨,曹利群,秦利维,王丽君
常见的致盲性疾病有老年黄斑变性、糖尿病视网膜病变和视网膜色素变性。其中,老年黄斑变性和视网膜色素变性都属于视网膜退行性病变,与视网膜中的神经细胞-光感受器细胞的损伤有关。我国在脐带组织中分离出了探讨间充质干细胞(mesenchymal stem cell,MSC)转化为人脐带间充质干细胞(human umbilical cord derived mesenchymal stem cells,h UCMSCs),h UCMSCs具有分化潜力大、增殖能力强、免疫原性低、取材方便等特征,常用于治疗糖尿病[1]、软骨损伤疾病[2]。研究发现[3-4],给糖尿病视网膜病变大鼠注射h UCMSCs可改善视网膜的功能及结构,同时还可降低血糖水平。存活细胞可分泌外泌体改变受体细胞的生理功能。相关研究证实[5],h UCMSCs提取出的外泌体可自由穿梭进入卵巢癌细胞,并下调VEGF水平从而抑制新生血管生成达到抗肿瘤效果。另有研究证实[6]h UCMSCs外泌体对光损伤视网膜色素上皮细胞具有一定的治疗作用。此外,在光损伤视网膜光感受器细胞的过程中,离不开信号通路及相关因子的参与。PI3K/AKT(磷脂酰肌醇3激酶/蛋白激酶B)通过调控下游因子水平,参与细胞生物学行为。研究表明,PI3K/AKT信号通路在增殖性玻璃体视网膜病[7]、青光眼[8]等多种眼科疾病的发生和发展过程中发挥关键作用;在高眼压大鼠视网膜神经节细胞[9]、年龄相关性黄斑变性大鼠[10]光感受器细胞中为低表达。血管因子增加、出现微血管瘤等是造成糖尿病视网膜病变产生的较为基础的病理变化,Ang-1与血管的再生长关系密切。Ang-1与Tie2结合可以阻滞细胞的凋亡,促进血管的稳定生长,保护血管防止其渗漏。但h UCMSCs外泌体在光损伤视网膜光感受器细胞中对PI3K/AKT通路及Ang-1蛋白的影响目前尚未完全了解。因此,本研究对MSC下外泌体对视网膜光感受器细胞PI3K/AKT通路及Ang-1蛋白水平的研究进行分析。
1 材料和方法
1.1 材料
1.1.1 细胞 h UCMSCs购自武汉普诺赛生命科技公司,冻存备用。视网膜光感受器细胞株661W,购自上海奥陆谷生物科技有限公司。
1.1.2 主要试剂与仪器 流式细胞仪(上海三歪医疗设备公司,型号:FACSVia);透射电子显微镜(郑州一品仪器公司,型号:JPX-1500);CD63、CD90、PI3K、p-PI3K、AKT、p-AKT、Ang-1一抗(中国碧云天生物科技公司);辣根过氧化物酶二抗(北京索莱宝科技公司)。
1.2 方法
1.2.1 h UCMSCs的复苏 取出细胞冻存管,放入37℃水浴锅内水浴3 min。75%酒精擦拭消毒冻存管后,吸出细胞悬液注入离心管中,补加少量含有10%PBS的DMEM培养液,离心半径10 cm,800 r/min离心5 min,弃上清后常规培养,次日换液后常规培养。
1.2.2 h UCMSCs的传代 观察h UCMSCs贴壁生长至85%融合时,弃上清液,5 mL PBS液轻轻洗涤两次。培养瓶中加入0.25%胰蛋白酶消化液2 mL,轻摇培养瓶使其均匀覆盖瓶底,与细胞充分接触,在恒温培养箱中消化1 min,倒置显微镜下观察,当细胞间隙增大,形态变圆时加入含10%FBS的DMEM培养液终止消化。吹打细胞使悬液均匀,取细胞悬液放入离心管中,离心半径10 cm,800 r/min离心5 min后弃上清,加入2 mL 10%FBS的DMEM培养液重悬细胞,按1:2比例传代,培养瓶中补充培养液至15 mL放入恒温培养箱培养。
1.2.3 h UCMSCs外泌体的提取与电镜观察 取5~7代生长良好的h UCMSCs,按照细胞传代方法,弃上清,常规PBS冲洗及胰蛋白酶消化后用含10%Exo-FBS的DMEM培养液培养48 h后,收集上清液,2 000×g离心30 min,去细胞碎片,经滤膜过滤到离心管中,4℃1 000×g离心70 min,得到外泌体浓缩液。将浓缩液移至离心管中,上述条件离心,收集底部沉淀,PBS稀释,再次离心,洗涤,将外泌体浓缩液过滤除菌,于-80℃冷藏备用。按1:10的比例稀释,取少量稀释后外泌体液,于3%磷钨酸溶液中染色5 min,透射电子显微镜观察并拍摄照片。
1.2.4 视网膜光感受器细胞光损伤模型 将处于对数生长期的661W细胞消化后,接种于96孔板中培养24 h,在另一细胞培养箱中放人紫外线灯(radiant exposure=4.3 J/cm2),将96孔板放在紫外线灯上10 cm处,照射10 min后关闭紫外灯,将96孔板移入没有紫外线灯的细胞培养箱继续培养。
1.2.5 h UCMSCs外泌体干预及分组 将细胞分为5组,正常组、光损伤组、低浓度组、中浓度组、高浓度组。正常组与光损伤组细胞常规培养,低、中、高浓度组在处理前24 h将光损伤视网膜光感受器细胞植入6孔板,当细胞生长融合至70%时,分别将25μg/mL、50μg/mL、75μg/mL h UCMSCs外泌体添加到6孔板中与细胞共孵育48 h,加入PBS,收集细胞。
1.3 检测指标
1.3.1 线粒体膜电位检测 利用JC-1(5,5′,6,6′-Tetrachloro-1,1′,3,3′-tetraethyl-imidacarbocyanine iodide)检测线粒体膜电位(DΨm)。向待检测细胞内加入JC-1工作液后37℃避光20 min,JC-1稀释缓冲液冲洗3次,激光共聚焦显微镜检测。正常情况下,线粒体电位处于去极化状态,JC-1在590 nm波长的发射光下呈现红色点状荧光,在凋亡细胞中,JC-1仍保持其单体状态,530 nm波长的发射光为绿色弥散荧光。
1.3.2 免疫印迹检测h UCMSCs外泌体表面标志蛋白CD63及CD90将外泌体样品与5倍上样缓冲液(含β-巯基乙醇)混合后,煮沸变性5 min,冰浴5 min。取30μg蛋白样品上样进行十二烷基磺酸钠(sodium dodecyl sulfonate,SDS)变性,10%SDS-聚丙烯酰胺凝胶电泳至目的蛋白有效分离。转膜,脱脂奶粉封闭。将膜置于含对应小鼠抗人CD63及CD90单克隆抗体的Blotto溶液中,摇床上4℃轻轻摇动过夜。洗膜缓冲液洗涤后,将膜浸入含相应辣根过氧化物酶(horse reddish peroxidase,HRP)标记二抗的Blotto溶液中,室温轻轻摇动2 h。ECL试剂盒检测,显影。
1.3.3 流式细胞仪检测光损伤661W细胞凋亡 收集细胞(2×105/孔)接种于6孔板中,胰酶消化,完全培养基终止;PBS清洗,进行细胞计数,离心,离心半径8 cm,1 250 r/min离心6 min,弃上清,混入500 μL Binding Buffer(结合缓冲液)重悬。加入5μL Annexin V-FITC混匀、10μL PI混匀,室温避光孵育5~15 min,随即进行流式细胞仪检测。
1.3.4 免疫荧光检测Ang-1取各组光损伤661W细胞,用预温的1×PBS洗3次。4%的甲醛室温固定20 min,0.2%Triton X-100透化5 min,5%牛血清白蛋白(bovine serum albumin,BSA)室温封闭30 min,加入抗Ang-1一抗(用1%BSA稀释)放在湿盒里,4℃过夜。加入二抗(用1%BSA稀释),闭光孵育120 min。95%甘油封片,镜下观察。
1.3.5 免疫印迹检测PI3K、p-PI3K、AKT、p-AKT蛋白表达 将光损伤661W细胞进行裂解并提取核蛋白,并对核蛋白的浓度进行测量,分装后,保存在-20℃、PI3K、p-PI3K、AKT、p-AKT一抗按1:500稀释后孵育过夜,TTBS漂洗3次,每次10 min,最后加入辣根过氧化物酶二抗按1:2 000对溶液稀释,常温封闭。取出PVDF膜,每隔10 min漂洗1次,共3次,DAB显色后照相,后计算其蛋白表达含量。实验另设立抑制剂组(PI3K/AKT抑制剂LY294002)与激动剂组(PI3K/AKT激动剂740Y-P),实验细胞处于对数生长期时用PBS缓冲液将INS-1细胞洗3遍,将细胞以数量为5×104接种于6孔板,培养24 h后用浓度为25 nM的740 Y-P以及40μmol/L的LY294002刺激INS-1细胞48 h,规范处理细胞进行下一步试验。
1.4 统计学处理 应用GraphPad Prism 8.0软件,实验数据采用均数±标准差()表示,均符合正太分布,多组间比较采用单因素方差分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 h UCMSCs形态学 光镜下见正常的h UCMSCs呈单层贴壁生长,细胞形态呈梭形、圆形或多边形。细胞可成簇生长,胞内可见清晰核仁,部分细胞表现为双核或多核。传至5~7代后,细胞生长良好,活跃,可进行相关实验,图1。

图1 h UCMSCs形态学A:h UCMSCs原代;B:h UCMSCs5~7代
2.2 h UCMSCs外泌体形态学 透射电镜下可见h UCMSCs外泌体表现为一群类圆形的具有明显膜结构的小囊泡,直径在60~100 nm之间,囊泡内部可见低电子密度物质,图2。

图2 h UCMSCs外泌体形态学
2.3 h UCMSCs外泌体的表面特异性蛋白CD63及CD90结果显示,h UCMSCs外泌体表达外泌体共性标志蛋白CD63及h UCMSCs特异性表面蛋白CD90,证实其来源可靠,图3。

图3 免疫印迹检测h UCMSCs外泌体蛋白CD63、CD90表达
2.4 光损伤661W细胞模型形态学 照射10 min的紫外灯后,显微镜下可见细胞呈现出较为严重的皱缩,提示光损伤视网膜光感受器细胞模型建立成功,图4。

图4 光损伤视网膜光感受器细胞模型形态学
2.5 线粒体膜电位检测 利用JC-1染色各组细胞并在激光共聚焦显微镜下观察各组线粒体膜电位情况,红色颗粒状荧光为主是正常细胞在DΨm较高时表现出来的,图5A,而绿色荧光提示光损伤状态下细胞凋亡增多、线粒体膜电位较低,JC-1单体形成进而表现为弥散的绿色荧光,图5B,提示光损伤细胞模型建立成功。

图5 光感受器细胞线粒体膜电位
2.6 流式细胞仪测凋亡 正常组(0.11±0.02)较光损伤组(9.73±0.82)细胞凋亡率低(t=28.730,P<0.001)。光损伤组较低浓度组(5.24±0.42)细胞凋亡率低(t=11.940,P<0.001)。低浓度组较中浓度组(3.17±0.29)细胞凋亡率低(t=9.934,P<0.001)。中浓度组较高浓度组(0.25±0.03)细胞凋亡率低(t=24.530,P<0.001),图6。
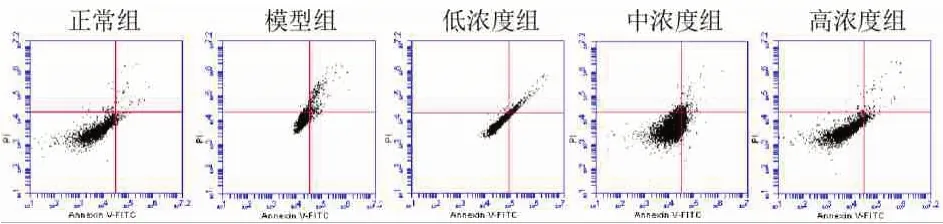
图6 各组细胞凋亡率比较
2.7 免疫荧光检测Ang-1荧光显微镜下,DAPI将细胞核染成蓝色,以辣根酶标记的二抗将Ang-1蛋白染成红色。光损伤组表达明显强于正常组,低浓度组Ang-1表达稍有减弱,但不明显,中浓度组表达有明显的下降,而高浓度组的Ang-1表达下降更明显,仅仅稍强于正常组,图7。

图7 不同浓度h UCMSCs外泌体作用后Ang-1的表达
2.8 PI3K、p-PI3K、AKT、p-AKT蛋白表达 正常组PI3K、p-PI3K、AKT、p-AKT水平高于光损伤组(P<0.05),光损伤组PI3K、p-PI3K、AKT、p-AKT水平低于低浓度组(P<0.05),低浓度组PI3K、p-PI3K、AKT、p-AKT水平低于中浓度组(P<0.05),中浓度组PI3K、p-PI3K、AKT、p-AKT水平低于高浓度组(P<0.05),高浓度组PI3K、p-PI3K、AKT、p-AKT水平与激动剂组比较无差异(P>0.05),抑制剂组PI3K、p-PI3K、AKT、p-AKT水平低于模型组(P<0.05),表1,图8。
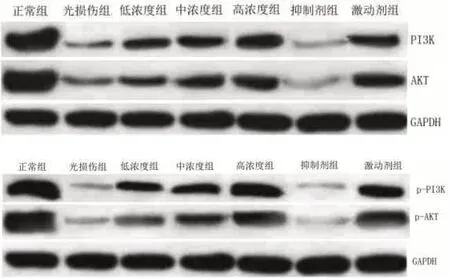
图8 PI3K、p-PI3K、AKT、p-AKT水平比较
表1 PI3K、p-PI3K、AKT、p-AKT水平比较(±s)

表1 PI3K、p-PI3K、AKT、p-AKT水平比较(±s)
与正常组比较aP<0.05;与光损伤组比较bP<0.05;与低浓度组比较cP<0.05;与中浓度组比较dP<0.05;与高浓度组相比eP<0.0;与抑制剂组相比fP<0.05
?
3 讨论
高强度的光照会引起视网膜光感受器细胞的凋亡,加快视网膜退行性疾病的进展,导致不可逆的视力损害。本研究证实提取出的h UCMSCs外泌体可用于后续实验,过程与何广辉[11]等的鉴定一致。为了进一步研究h UCMSCs外泌体对光感受器细胞的作用,本研究采用体外培养的紫外线诱导661W细胞损伤模型[12],结果显示,在紫外线照射培养的661W细胞10 min后,给予h UCMSCs外泌体干预,与光损伤组相比,随着浓度的增加,可显著减少光损伤视网膜光感受器细胞凋亡,从而对光损伤视网膜起保护作用,提示h UCMSCs蛋白对紫外线照射诱导661W细胞损伤模型有神经保护作用。马明明[13]等提示,h UCMSCs外泌体可抑制视网膜脱落的大鼠炎症反应及光感受器细胞凋亡。本研究与上述研究结果相似。
PI3K激活诱导Akt磷酸化调节对视网膜和中枢神经损害的神经保护作用已有报道[14]。PI3K被激活后通过生成磷脂产物激活AKT进而干扰线粒体细胞色素C释放,抑制细胞凋亡。相关研究发现[15]β-雌二醇可激活PI3K/AKT信号通路而抑制Bax参与的线粒体凋亡途径而保护视网膜神经细胞。另有研究提示[16],上调老年性黄斑变性视网膜色素上皮细胞PI3K/AKT通路,可降低细胞氧化应激损伤,发挥细胞保护作用。本研究结果显示,在经h UCMSCs外泌体干预后,p-PI3K、p-AKT蛋白水平升高,且呈现出明显的剂量依赖性。因此,推测h UCMSCs外泌体可能通过激活PI3K/AKT通路,抑制了视网膜光感受器细胞的凋亡。王辉[17]等研究提示,二十二碳六烯酸通过激活PI3K/AKT通路抑制年龄相关性大鼠光感受器细胞凋亡。刘辉[18]等研究提示,在h UCMSCs外泌体通过调控PI3K-AKT通路抑制缺氧诱导的心肌细胞凋亡。本研究与上述研究结果相似。
在眼底新生血管发生后,视网膜色素上皮层屏障被破坏,从而使血管渗漏,损伤光感受器细胞。Ang家族及其受体Tie2系统在血管的发育成熟与稳定、调控血管完整性方面具有重要意义。Ang-1不仅刺激内皮细胞增殖和迁移,从而促进新生血管生成,它还能起到破坏视网膜色素上皮层屏障的作用。Ang-1通过与Tie2受体结合后激活PI3K/AKT信号通路发挥对血管的发育成熟与稳定、抑制渗漏等重要作用。雷润佳[19]等研究发现,降低Ang-1水平后,通过与Tie2受体结合后激活PI3K/AKT信号通路发挥抑制血管渗漏等作用。杨梓超[20]等研究提示,通过下调糖尿病视网膜病变大鼠Ang-1表达,改善视网膜光感受器细胞层结构,减少细胞水肿等从而改善视网膜组织病变。本研究中免疫荧光结果显示,与正常组比较,光损伤组Ang-1的表达增加,给予h UCMSCs外泌体干预后,随着浓度的增加,Ang-1的表达逐渐降低,这提示h UCMSCs外泌体具有抑制血管渗漏的作用。
综上所述,间充质干细胞下外泌体可能是通过激活PI3K/AKT通路,抑制了视网膜光感受器细胞的凋亡以及Ang-1的水平,从而对光损伤视网膜起保护作用。
