猫传染性腹膜炎的诊断
2022-05-16郝振宇兰道亮李成燚
郝振宇,兰道亮,李成燚,李 键
(西南民族大学畜牧兽医学院,四川成都 610041)
猫传染性腹膜炎(Feline infectious peritonitis,FIP)是一种猫科动物致死性疫病。病原体是猫冠状病毒(Feline coronavirus,FCoV),有两种不同的致病类型,根据生物型可区分为无症状或轻微腹泻的猫肠道冠状病毒(feline enteric coronavirus,FECV)[1]和致命的猫传染性腹膜炎病毒(Feline infectious peritonitis virus,FIPV)[2]。
FCoV属于尼多病毒目(Nidovirale)、冠状病毒科、冠状病毒属,是一种有囊膜的单股正链RNA病毒。FCoV基因组大小约为29 kb,由11个开放阅读框(open reading frames,ORFs)组成,4个ORFs编码结构蛋白刺突蛋白S、包膜蛋白E、膜蛋白M、核衣壳蛋白N;5个ORFs编码非结构蛋白3a、3b、3c、7a、7b;2个ORFs编码复制酶1a和1ab。根据血清型,FCoV可分为Ⅰ型和Ⅱ型,Ⅰ型FCoV被认为是猫特异性毒株,但难以在体外培养;Ⅱ型FCoV是由Ⅰ型FCoV与犬冠状病毒重组产生,容易在体外培养。
有研究表明,在持续感染FECV的猫中,大约有5%可能出现FIP[3,17]。在同一窝猫中收集到的FIPV和FECV毒株的序列相似性远高于不同窝的FCoV序列,经过大量试验分析,科学家们提出目前普遍能接受的内部变异理论为FIPV是由FECV持续感染过程中内部突变而产生的。目前尚不清楚病毒具体的变异时间、部位以及变异方式[1-2],已知FIPV变异与ORF3c基因[17]、S基因[19]、M基因[21]等一系列基因有关。
通过免疫组织化学染色的方法是确诊猫传染性腹膜炎的金标准,然而该方法却缺乏一定的操作性。又因为单纯检出FCoV无法确诊FIP,因此现阶段对FIP的诊断往往是结合临床检查与实验室检查结果做出的综合判断。本综述罗列出目前常见的FIP诊断方法,为临床对FIP的诊断提供参考。
1 临床检查
由于逆转录-聚合酶链反应(reverse transcrip-tion-polymerase chain reaction,RT-PCR)只能检测出患猫体内存在FCoV,却无法区分到底是FECV还是FIPV,结合临床检查能更好的将普通的猫腹泻与猫传染性腹膜炎加以区分,对确诊FIP提供临床依据。
1.1 临床症状检查
FIP根据临床症状有无渗出液可分为干性FIP、湿性FIP和混合性FIP。干性FIP主要表现为葡萄膜炎,葡萄膜颜色发生改变,房水闪辉[3]甚至是眼前房出血,另外伴随共济失调、癫痫、跛行甚至瘫痪等神经症状;湿性FIP主要表现为腹腔积液,其腹腔积液抽出颜色往往偏黄色、澄清,部分较混浊,也有少数湿性FIP猫会出现胸腔积液,极少数出现心包积液;混合性FIP较为罕见,多数是干性到湿性或者湿性到干性的过渡阶段,因此,有时也会出现湿性FIP发生神经症状,而干性FIP出现腹腔积液[4]。
1.2 血常规和生化检查
FIP患猫往往出现红细胞、红细胞比容、血红蛋白的同步降低,部分患猫会出现严重贫血,这是因为病毒诱导T细胞的凋亡[5]。除此之外,淋巴细胞减少,单核细胞增加,同时嗜酸性粒细胞会下降。
生化检查中总蛋白含量会出现上升,并伴随丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸(aspartic acid ,AST)同步上升。白蛋白与球蛋白的比值(A/G比)对于FIP有诊断价值, A/G比小于0.4时,高度怀疑FIP;而大于0.8时基本可以排除[6]。
FIP作为病毒感染的疾病,其引起的急性炎症会导致血清淀粉样蛋白(serum amyloid A,SAA)水平升高,另外α1-酸性糖蛋白(α1-acid glycoprotein,AGP)同样作为急性时相反应蛋白,它的升高相较于SAA对FIP更具有诊断价值[7]。
1.3 影像学检查
FIP患猫超声检查主要表现为肝脏出现脓肿,并呈现弥漫样或局灶性低回声;淋巴结肿大,出现低回声;双肾出现髓缘征[8],皮髓质分界不清,皮质回声增强,血清信号弱;肠系膜处可能存在高回声团块;若为湿性FIP,胸/腹腔可能出现无回声或者低回声的胸/腹腔积液。
FIP患猫DR数字化X射线摄影检查主要表现有胸腔积液,心包积液导致的心脏轮廓变大,肺结节及支气管处周围出现浸润,腹部显示肝脏、脾脏、肾脏肿大[9]。
1.4 渗出液分析
FIP患猫渗出液往往偏黄色、澄清,部分较混浊是由于血液中含有较高的蛋白含量所呈现的蛋白凝块,另外渗出液若呈现红色或橘红色或带脓,或呈极异常黏稠状,有些腹水散发腥臭味或其他异味,往往FIP检出极低。
Rivalta试验(李凡他试验)可区别腹水为渗出液或漏出液:用10 mL试管装8 mL蒸馏水并滴加一两滴98%的乙酸,并将样本滴入试管内,若反应迅速消失,液体再次变回透明澄澈的状态则为阴性。若样本滴入试管内,样本保持原本性状,漂浮在液体表面亦或是缓慢沉降则为阳性[10]。这是由于FIP渗出液不仅蛋白含量高,并且纤维蛋白原和炎症介质浓度也高,其多糖和蛋白质复合物为酸性糖蛋白,当在大量稀醋酸中呈白色沉淀。渗出液是由炎症引起,往往区别由血管内压或血浆渗透压而导致的漏出液。
1.5 组织病理学
尸检往往可见,胸腔积液或心包积液,心肌肥大,纤维蛋白渗出导致的黏连;腹腔中也存在大量积液,液体无色或淡黄色,卵白状,腹膜上纤维蛋白样附着;肝脏、脾脏、肾脏会出现不同程度的肿大并有蛋白样附着。
1.6 脑脊液检查
对于一些干性FIP患猫常常会对脑脊液进行取样,通常可见混合性或化脓性炎症,FIP脑脊液中蛋白含量增加,细胞增多[11],也可见单核细胞浸润,然而,这些变化也可能出现在患有其他神经系统疾病的猫身上,也有部分FIP引起的神经症状,脑脊液分析结果却正常[12]。
1.7 房水检查
有报道,在确诊为FIP的患猫中,高达29%的猫眼受到房水的影响,包括化脓性肉芽肿葡萄膜炎、非化脓性肉芽肿性葡萄膜炎和脉络膜视网膜炎,伴随混合葡萄膜炎症细胞、B细胞和浆细胞浸润[13]。
2 实验室检查
第一种检测抗FCoV病毒抗体的方法是1976年建立起来的[14]。目前有多种不同的检测方法,包括间接免疫荧光试验(indirect fluorescence antibody test,IFAT)、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)、免疫组织化学(immunohistochemistry,IHC)、免疫细胞化学(immunocytochemistry,ICC)、RT-PCR等,理想的检测应适用于不同的液体[15],如血清、渗出液、脑脊液或房水,同时应允许小样本量,并且具有较高的灵敏度和特异性。
2.1 间接免疫荧光试验
通过将FCoV抗体进行荧光素的标记,然后进一步将其作为分子探针检查患猫体内的对应的抗原,抗原-抗体复合物中第一抗体结合,洗涤后在荧光显微镜下观察特异性荧光。IFAT比直接法敏感度提高5倍~10倍,缺点是易产生非特异性荧光[16]。
Sparkes A H等[17]的一项研究表明,血液中IFAT的敏感性为28%,特异性为64%,虽然在后面的研究[18]中 ,IFAT具有85%的敏感性和57%的特异性,但是显然这个结果差强人意。随着疾病的发展,血液中检测出病毒滴度的可能升高,这也许是FECV的再度感染,而非FIP的指标。积液中抗体检测的敏感性为86%,特异性为65%[18],相比血液对于FIP的诊断更具参考价值,但是无法作为确诊FIP的依据。
2.2 酶联免疫吸附试验
非保护性抗体的产生和免疫复合物的形成是FIP猫典型的免疫介导性病变形成的关键特征,在FCoV感染猫的血清和积液中均可检测到循环免疫复合物。与组织病理学对照, ELISA检测血清免疫复合物诊断FIP的敏感性为48%,特异性为91%[18]。其他研究证实,在没有FIP的健康猫中存在FCoV特异性免疫复合物[14]。因此,有人认为在感染FECV的猫中,尽管只有一段有限的时间,免疫复合物似乎也在循环。
2.3 免疫组化/免疫细胞化学
1989年首次报道了通过印迹涂片的免疫荧光染色在猫的瞬膜上皮细胞中检测到FCoV病毒抗原[19],随后,在组织病理学确诊的FIP猫中,IHC检测的敏感性高达97%~100%[20-21]。然而在许多情况下,IHC只能在死后进行,因为通过剖腹或腹腔镜采集死前组织样本是一种侵入性的行为,对患病的猫来说将会面临巨大的风险。虽然使用由微创超声引导的细针穿刺(fine needle aspiration,FNC)可以获得肝、肾或淋巴结样本[22],但是对其进行免疫细胞化学或免疫组织化学染色发现敏感性较低。
采用免疫荧光染色检测胸腔积液或腹腔积液中的FCoV抗原,在早期的研究中[23],这项测试具有100%的特异性,但根据近年的调查结果显示,对由FIP以外的其他疾病引起的积液的猫进行免疫荧光或ICC的检测发现没有FIP的猫身上检测到FECV[24-25]。
2.4 逆转录-聚合酶链反应
根据长期存在的假设,FECV仅存在于肠道内,所以通过RT-PCR在血液或除胃肠道以外的任何其他体液或组织中检测到的RNA表明存在FIPV。然而,这一假设已经被大量研究驳斥。众所周知,患有FIP的猫比FECV感染猫表现出更高的病毒载量[15,26-28]。所以,理想的RT-PCR方法不仅需要扩增FCoV,还应该能够量化病毒载量。
在FIP猫中,只有在有炎症变化的组织中才能发现大量的FCoV RNA。病毒载量最高的器官是大网膜、肠系膜淋巴结和脾脏,这些组织对RT-PCR分析最有用。相比之下,肾、肝、肺、心肌和窝淋巴结几乎不含有病毒RNA[42]。在有积液的FIP猫中,积液中的病毒载量远远高于血液中的病毒载量[29],并且PCR结果有较好的敏感性与特异性(大部分都可以达到90%以上),对于积液的RT-PCR检查已然成为临床最常用的检测手段[30]。
2.5 FCoV病毒变异的检测
FCoV S蛋白负责病毒细胞的进入,它包括受体结合亚基(S1)和介导膜融合的亚基(S2)[31]。FCoV S基因的突变、S2区更具特异性的突变以及S蛋白中相应的氨基酸替换被认为是导致病毒细胞嗜性改变的原因[32-33]。因此,只有FIPV而不是FECV能够在巨噬细胞中高效和持续地复制,产生大量病毒颗粒,并将感染传播到邻近细胞。S基因对于确定哪些突变导致FECV向FIPV的转变特别有意义。
对来自健康猫粪便和FIP猫组织(或腹水)的大量FCoV的S基因进行了序列测定发现2个单核苷酸多态性(single nuclotide polymorphism,SNP),这些SNP位于S基因内的23531和23537位核苷酸。在所有已测序的健康猫粪便FCoV病毒中,腺嘌呤位于23531位核苷酸,而92%的FIP猫腹水或组织中检出胸腺嘧啶或胞嘧啶,该SNP均导致S蛋白融合肽(M1058L)中1058位氨基酸的亮氨酸取代蛋氨酸[28];健康猫粪便FCoV中,胸腺嘧啶都在第2个核苷酸位置23537被检测到,而94%的FIP猫腹水或组织中含有鸟嘌呤,该SNP导致S蛋白(S1060A)1060位丝氨酸替代丙氨酸[32,34]。
根据上述结论,在原先RT-PCR的基础上,建立套式RT-PCR[33],对S基因23531和23537位核苷酸进行局部扩增,检测FCoV是否出现变异是目前较为准确的FIP诊断方法。
3 小结与展望
综上所述,无论何种样本,IFAT和ELISA这种针对FCoV病毒抗体检测的方法不能用于FIP的诊断,应该采用可以有效检测病毒载量的荧光定量RT-PCR。另外,RT-PCR的样本,渗出液应该优先于脑脊液、房水,而血液的参考价值并不高,对于没有渗出液的FIP猫,也可以采取细针穿刺活检(fine needle aspiration,FNA)采集组织样本。对于组织样本来说,免疫组化可以作为FIP诊断的金标准,但不建议采用FNA,而是需要剖腹/腹腔镜来获取组织样本。
完整的FIP诊断流程应包括临床检查、RT-PCR和S基因变异检查等,对临床检查结果符合标准的患猫,根据有无积液进一步采样进行RT-PCR(最好是RT-qPCR),再结合S基因变异阳性结果进行确诊,若低病毒载量且S基因未变异则需要采用免疫组化或组织病理学确诊。总结以上诊断思路,做出如下诊断流程图供兽医师参考(图1)。
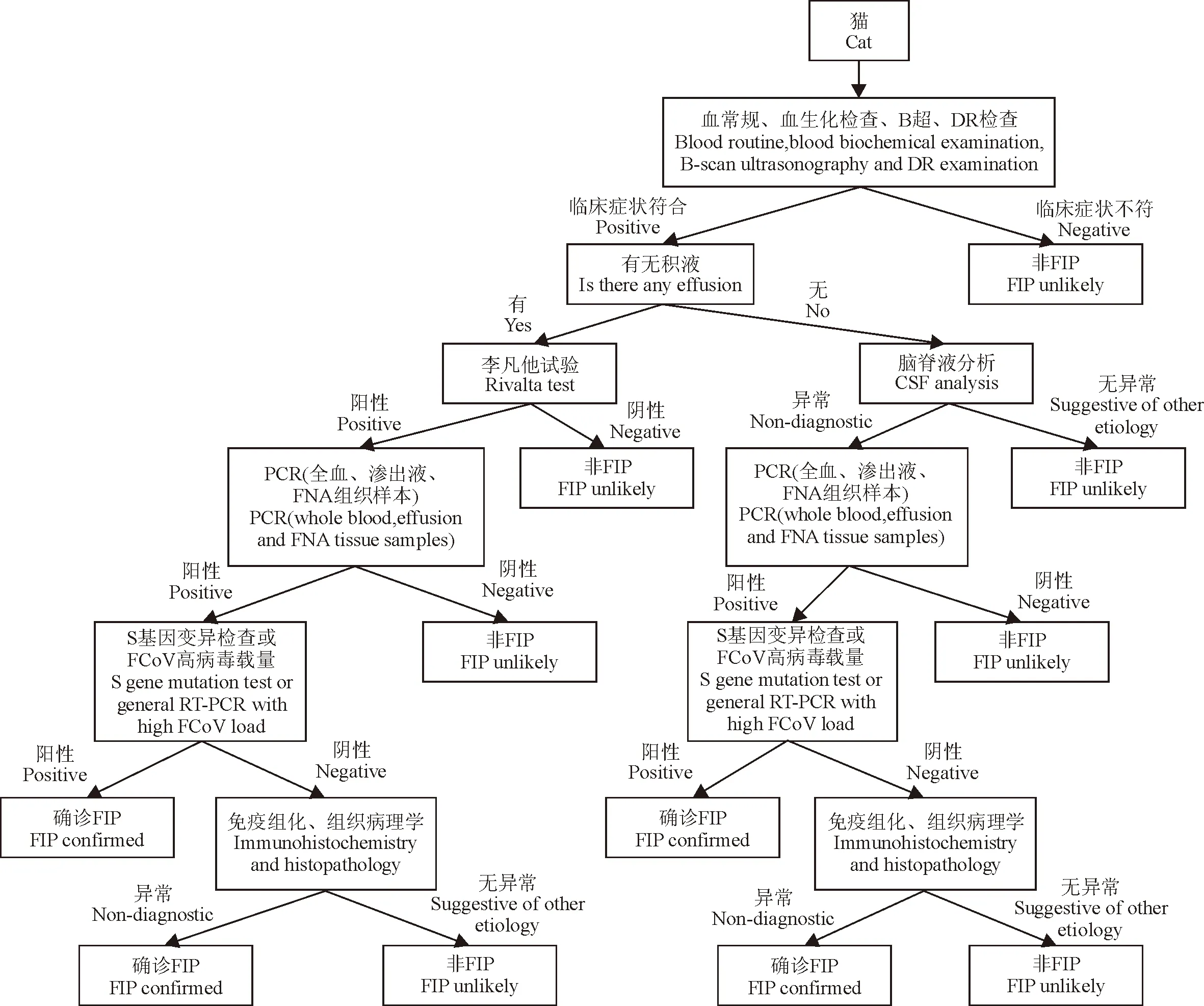
图1 FIP诊断流程
尽管目前对于猫传染性腹膜炎的发病机制和免疫机制尚不明确,也没有一个简单高效的检测方法,但随着经济的发展和人民生活水平的提高,伴侣动物在人民生活中的地位逐渐升高,猫传染性腹膜炎作为一个猫科动物高致死疾病,今后一定会得到更多学者的重视与研究。相信在不久的将来,该病的发病机制和免疫机制会被攻克,届时就会出现更多更好的诊断方法。
