外源蔗糖对紫背天葵采后品质及叶绿体的影响
2022-05-16谢意通张飞石洁冯莉姜丽
谢意通,张飞,石洁,冯莉,姜丽
外源蔗糖对紫背天葵采后品质及叶绿体的影响
谢意通,张飞,石洁,冯莉,姜丽*
南京农业大学食品科技学院,南京 210095
【背景】紫背天葵采后生理代谢活跃,加上对低温敏感,采后往往贮藏于略低于室温的黑暗环境中,但紫背天葵长期黑暗贮藏,会出现采后糖饥饿,影响紫背天葵的品质。黑暗贮藏也会抑制光合过程,导致光合同化产物减少,加剧采后糖饥饿,而蔗糖是植物体内光合产物运输的主要形式。【目的】研究采后外源蔗糖处理对紫背天葵采后品质、蔗糖代谢及叶绿体的影响,探讨蔗糖处理延缓采后衰老的相关机制。【方法】在筛选出最佳蔗糖处理浓度的基础上,检测紫背天葵贮藏期间淀粉、可溶性糖、还原糖、可溶性蛋白和叶绿素含量,研究蔗糖处理对紫背天葵采后品质的影响;检测贮藏期间蔗糖、果糖、葡萄糖含量和蔗糖代谢相关酶活性如淀粉酶(Amylase)、蔗糖磷酸合成酶(SPS)、蔗糖酸性水解酶(AI)、蔗糖合成酶(SS-s)和蔗糖分解酶(SS-c),研究蔗糖处理对紫背天葵蔗糖代谢的影响;利用透射电子显微镜观测叶绿体超微结构在贮藏期间的变化,检测贮藏期间叶绿体脂氧合酶(LOX)活性、丙二醛含量(MDA)、最大光化学效率(Fv/Fm)和实际光化学效率(QY),研究蔗糖处理对叶绿体生理和功能的影响。在生化水平和亚细胞水平上探究采后蔗糖处理对紫背天葵的影响。【结果】前期的蔗糖浓度筛选发现,12%的蔗糖保鲜效果最佳,尤其在贮藏后期,12%蔗糖处理组与对照组相比,呼吸强度降低39%、失重率降低7.8%、腐烂率降低15.87%。进一步研究发现,在贮藏后期,处理组与对照组相比,蔗糖含量比为1.82、淀粉含量比为1.10、可溶性糖含量比为1.11、可溶性蛋白含量比为2.20和叶绿素含量比为1.23,蔗糖处理显著延缓了糖类物质和含氮物质的降解。蔗糖处理显著抑制SPS、AI和Amylase活性的上升,说明蔗糖处理抑制了紫背天葵的蔗糖代谢,从而减少了蔗糖和淀粉的分解。后期对紫背天葵叶绿体生理功能研究发现,贮藏结束时,处理组与对照组相比,有效维持了叶绿体结构完整性、叶绿体脂氧合酶活性降低53.13%、叶绿体丙二醛含量降低33.33%、最大和实际光化学效率分别是对照组的1.35倍和1.97倍,说明蔗糖处理显著延缓叶绿体衰老。进一步分析发现,紫背天葵叶绿体功能与淀粉和可溶性糖含量显著正相关,表明糖饥饿引起的碳源匮乏会影响叶绿体功能。【结论】蔗糖处理通过降低紫背天葵采后呼吸强度、失重率和腐烂率、调控蔗糖代谢、降低叶绿体膜脂氧化程度和维持叶绿体结构完整,抑制了紫背天葵采后品质劣变,从而延缓了紫背天葵衰老。
蔗糖代谢;叶绿体;糖饥饿;紫背天葵;保鲜
0 引言
【研究意义】紫背天葵(D.C),又名观音菜、冲绳菠菜等,性喜温[1]。紫背天葵是一种药食同源的高档蔬菜,富含营养物质,具有很高的食用以及研究价值。由于紫背天葵采后的代谢旺盛,极易失水萎蔫和腐烂,因此保鲜极为需要。紫背天葵在采后阶段,为了减少强光带来的蒸腾效应和抑制呼吸作用,往往贮藏于弱光或黑暗环境,但长期处于黑暗环境,其自身糖类物质逐渐匮乏而发生糖饥饿,会引起其他物质如蛋白质、叶绿素的分解周转,从而加速衰老[2-3]。因此,研究紫背天葵采后糖饥饿影响品质变化的规律以及探索延缓采后糖饥饿的保鲜方法具有积极的意义。【前人研究进展】近些年,关于紫背天葵采后生理和保鲜的研究愈来愈多,如紫外线C(UV-C)照射[4]、1-甲基环丙烯(1-methylcyclopropene,1-MCP)[5]和一氧化氮(NO)熏蒸[6]以及纳米包装气调等[7],但都没有与采后糖饥饿的结合研究。目前,关于采后糖饥饿引发衰老的相关研究还鲜有报道,国内外对糖饥饿的相关研究主要集中在动植物的生长发育阶段[8-9]和细胞水平[10]。植物中糖饥饿的诱导因素主要有弱光、极端温度、干旱以及涝害等非生物胁迫[11-12]。这些胁迫的共同特点是破坏叶绿体,即通过破坏光合功能,影响糖类物质的生成,进而诱发细胞自噬相关基因()和衰老基因()的表达,调控周转叶绿体内的含氮物质(如叶绿素和蛋白质等)来响应机体内的低碳环境[13]。Izumi等[14]研究发现水稻叶片在黑暗处理后,叶绿体自噬周转过程和碳源状态高度相关,而不是氮源状态,揭示叶绿体的自噬周转是由碳源匮乏诱导。IZUMI等[15]后续研究发现外源添加蔗糖可以减少黑暗环境中自噬小泡的生成,证实在碳源匮乏状态下添加外源蔗糖可以抑制叶绿体自噬,暗示蔗糖对延缓糖饥饿有一定作用。姚笛[16]通过研究不同可溶性糖浸泡青花菜,发现蔗糖处理可以减缓青花菜叶绿素以及营养物质的降解。【本研究切入点】蔗糖往往被当作营养液应用于花卉的扦插培养,而用于农产品采后保鲜的研究较少,外源碳源如蔗糖的处理是否可以延缓蔬菜采后衰老以及维持采后贮藏较高的碳源状态还鲜有研究。【拟解决的关键问题】在采后利用蔗糖处理紫背天葵,研究蔗糖处理影响紫背天葵采后生理代谢和品质变化的规律,探讨蔗糖是否对紫背天葵采后衰老有抑制作用,为生产实践中的保鲜提供新方向。
1 材料与方法
试验于2020—2021年在南京农业大学食品科技学院进行。
1.1 材料与试剂
1.1.1 材料 紫背天葵,商品成熟度,于2020年11月采摘于苏州润汇农业基地,要求生理相近、无机械损伤和虫害,当天冰温运回实验室。
1.1.2 试剂 5尿苷二磷酸钠盐(UDP)、果糖6磷酸二钠(F-6-P)、尿苷二磷酸葡萄糖(UDPG)均为生物试剂,源叶生物科技有限公司;蔗糖、果糖以及葡萄糖为色谱纯,源叶生物科技有限公司;浸泡用蔗糖以及其余所有试剂均为国产分析纯,寿德试验器材有限公司。
1.1.3 仪器与设备 Alpha1860A紫外可见分光光度计,上海谱元有限公司;IMAGINGPAM叶绿素荧光检测仪,德国WALZ公司;Hitachi H7650透射电子显微镜,日本日立公司;岛津LC-20A高效液相ELSD检测系统(HPLCELSD),日本Shimadzu公司;H1750R台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;FE30电导率仪,梅特勒托利多仪器有限公司。
1.2 方法
1.2.1 不同蔗糖浓度处理方法 将新鲜的紫背天葵分别用0(蒸馏水)、4%、8%、12%和16%的蔗糖浓度进行浸泡处理,具体处理方式如下:将30株(约300 g)生理相近的植株作为一捆(底部预留3 cm左右的基部用于浸泡),分别浸泡于50 mL不同浓度蔗糖溶液中,用5号自封袋作为处理容器,轻柔扎紧袋口,于40 L泡沫箱暗置密封12 h,箱内放置0.1% KOH用于吸收CO2。处理完成后随机选取4捆分装于8 L左右的黑色PE塑料袋(用牙签在塑料袋表面均匀戳20个小洞)并挽口,每个处理各3袋,黑暗贮藏于(20±2)℃、湿度(90±5)%环境下,分别于第-1、0、1、3、5和7天取样(其中-1天指采摘样品当天,0 d代表蔗糖处理完当天,如无特殊说明,本研究指标测定所用材料均为第0、1、3、5和7天取样样品),选取去除顶部幼芽后由上往下数第3、4片叶作为研究材料。
1.2.2 蔗糖浓度的筛选 在第0、1、3和5天分别测定样品的呼吸速率[17]、失重率采用差重法、相对电导率[18]、腐烂率[19],用于评价不同浓度蔗糖的处理效果,选出最佳处理浓度后,用该浓度进行后续的研究。
1.2.3 相关糖类物质与可溶性蛋白的检测 淀粉采用酸水解法;可溶性糖采用蒽酮比色法;还原糖采用3, 5二硝基水杨酸法;可溶性蛋白采用考马斯亮蓝染色法;以上4个方法均参考曹建康等[20]方法。
葡萄糖、果糖和蔗糖参考高效液相色谱法[21]并稍作修改。1 g样品用4 mL 80%乙醇50℃ 100 W超声提取50 min,再80℃水浴1 h,冷却至室温后4℃、12 000×离心20 min,收集上清,过0.45 μm滤膜备用。色谱条件为:流动相为70%乙腈,色谱柱为ZORBAX Carbohydrate(4.6 mm×250 mm,5 μm),柱温为35℃;检测条件:检测器为ELSD,流速为1 mL∙min-1,进样量为20 μL,氮气压力为350 kPa,漂移管温度为50℃。
1.2.4 蔗糖代谢相关酶检测 取2 g样品,加入5 mL 100 mmol∙L-1Tris(pH 7.2)提取缓冲液(含2 mmol∙L-1EDTA、5 mmol∙L-1MgCl2、5 mmol∙L-1DTT、2%(v/v)乙二醇、0.2%(w/v)BSA和2%(w/v)PVP)涡旋混匀,于4℃下提取10 min,10 000×、4℃离心20 min。收集上清液,用100倍体积上清液的透析液(含1 mmol∙L-1EDTA、2.5 mmol∙L-1MgCl2、1 mmol∙L-1DTT和1%(v/v)乙二醇)于4℃透析24 h,期间多次更换透析液。透析后的提取液保存于4℃,用于酶活性检测,其中蔗糖磷酸合成酶(sucrosephosphate synthase,SPS)、蔗糖酸性转化酶(acid invertase,AI)、蔗糖合成酶(sucrose synthase,包括合成方向SS-S和分解方向SS-C)的活性采用WU等[22]的方法,用葡萄糖作标准曲线,总酶活定义为每mg可溶性蛋白单位时间生成或消耗的葡萄糖含量(mg),单位为U∙mg-1protein。总淀粉酶(Amylase)采用高俊凤[23]的方法,其中总淀粉酶活性定义为每mg可溶性蛋白单位时间水解淀粉生成麦芽糖含量(mg),单位为U∙mg-1protein,可溶性蛋白含量检测方法与1.2.3一致。
1.2.5 叶绿体膜脂氧化
1.2.5.1 叶绿体提取 参考AUSTIN等[24]研究并稍作修改,取3 g样品,加入10 mL预冷的缓冲液A(50 mmol∙L-1Tris(pH 3.6),内含25 mmol∙L-1EDTANa2、1.25 mol∙L-1NaCl、0.25 mol∙L-1Vc、1.5%(w/v)PVP),振荡,4℃静置10 min,涡旋,400目尼龙布过滤,用玻棒拧干,用5 mL缓冲液A冲洗滤渣,再次拧干,500×、4℃离心5 min,收集上清,用缓冲液定容至10 mL,3 000×、4℃离心10 min,弃上清。加入10 mL缓冲液B(50 mmol∙L-1Tris(pH 8.0),内含25 mmol∙L-1EDTANa2、1.25 mol∙L-1NaCl、2.5 mmol∙L-1DTT、0.1% BSA)振荡,静置5 min,涡旋,2 000×、4℃离心10 min,弃上清,再加10 mL缓冲液B重复操作。加入10 mL缓冲液C(50 mmol∙L-1Tris(pH 8.0),内含0.25 mol∙L-1NaCl、20 mmol∙L-1EDTANa2)振荡,静置5 min,涡旋,3 000×、4℃离心10 min,弃上清,再加3 mL缓冲液C重复操作,弃上清,最后用3 mL缓冲液C将叶绿体沉淀重悬后低温保存。
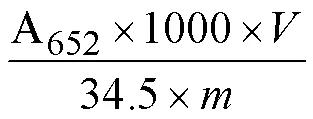
1.2.6 叶绿体超微结构 参考吴正锋等[26]方法,选取第-1、3、5和7天的叶片,在叶片主叶脉两侧用刀片切取大小为4 mm×2 mm的组织块,浸入2.5%(v/v)戊二醛溶液中,4℃初固定24 h以上,然后采用1%(w/v)的锇酸溶液增加固定,用0.1 mol∙L-1的磷酸缓冲液反复洗涤多次,固定后的样品用梯度乙醇丙醇脱水(丙酮洗涤脱水),最后包埋在Spur环氧树脂中。在超微切片机上切下超薄切片,用2.5%(w/v)乙酸铀酰染色,随后用柠檬酸染色后固定到铜网上,最后用透射电子显微镜以80 kV的加速电压观察、拍照。
1.2.7 叶绿素荧光 参考田雨等[27]方法,采用IMAGINGPAM叶绿素荧光检测仪测定第-1、0、1、3、5和7天叶片的叶绿素荧光参数,每片叶片选取7个点,每个处理取20片独立的叶片。叶片暗处理30 min后,测定叶片的初始荧光(F0)和最大荧光(Fm),计算最大光化学效率(FmF0)/Fm,即Fv/Fm。接着打开光化光,待荧光值稳定后,测定叶片的稳态荧光(Fs),最后打开饱和脉冲光,测定光适应下的最大荧光产量(Fm'),计算实际光化学效率QY=(Fm'-Fs)/Fm'。
1.3 数据统计分析
所有试验均为3个生物学重复,利用SPSS 22.0进行单因素方差分析和t检验显著性检验以及pearson相关性分析,测定结果用Mean±SD表示,同一时间组间差异显著性通过字母标示法标示,不同字母表示差异显著(<0.05),并使用SigmaPlot 11.0作图。
2 结果
2.1 不同浓度蔗糖处理紫背天葵的效果
经过蔗糖处理后,紫背天葵在贮藏后期的呼吸强度都出现了上升。与对照对比,除了16%蔗糖处理,其他浓度的处理都先上升后下再上升,前期上升的原因可能是蔗糖为紫背天葵提供了外源碳源。其中12%的蔗糖处理后期上升最缓慢。16%的蔗糖处理使紫背天葵在前期的呼吸速率下降,后期则上升。
不同浓度蔗糖处理中,12%的蔗糖在贮藏后期保持紫背天葵水分的效果最好,但在前3 d天贮藏期间各处理间没有显著差异。与对照相比,各浓度的蔗糖处理都会使紫背天葵的细胞渗透率增加,但增加的程度并不与浓度成正相关,其中4%和16%蔗糖处理组的相对电导率增加程度最明显,可能是低浓度和高浓度的蔗糖处理使紫背天葵处于胁迫状态,诱发体内膜脂的氧化。在各浓度处理中,12%的蔗糖处理可以明显降低紫背天葵在贮藏期间的腐烂率(图1)。综上,12%蔗糖处理具有更好的保鲜作用,因此以该浓度开展下一步研究。
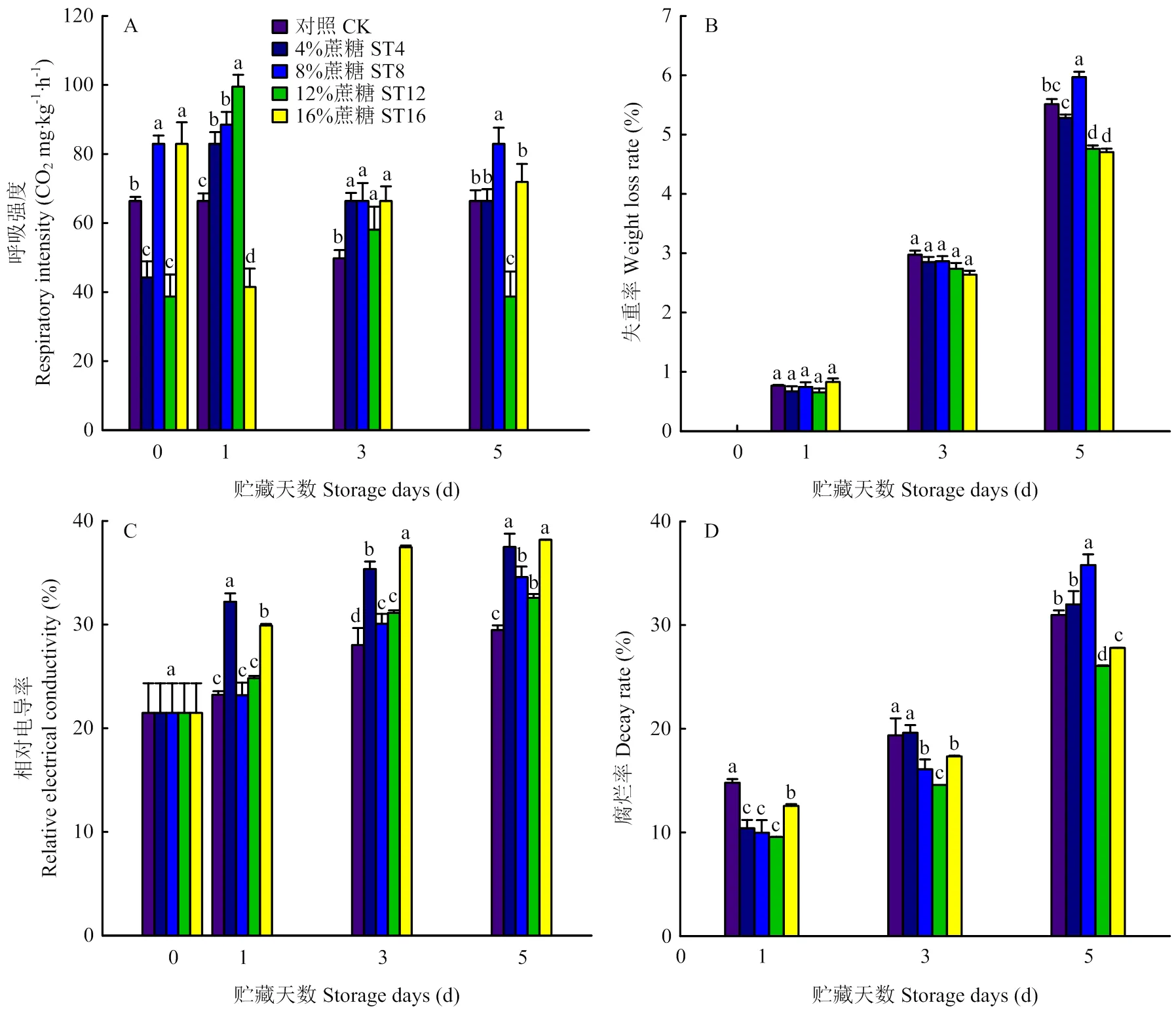
不同小写字母代表显著差异(P<0.05)。下同 Different lowercase letters indicate significant difference (P<0.05).The same as below
2.2 蔗糖处理对紫背天葵淀粉、可溶性糖、还原糖和可溶性蛋白含量的影响
蔗糖处理可显著延缓可溶性糖、淀粉和可溶性蛋白含量在贮藏期间的下降(图2)。对照组的可溶性糖含量和还原糖含量在处理当天到第1天的下降速度显著大于蔗糖处理组,表明紫背天葵在早期暗贮藏期间消耗的储备物质较多,到了第3天略有上升,可能是由于淀粉的水解产生了较多的小分子可溶性糖。在贮藏的第3天和第5天,对照组的还原糖含量显著高于蔗糖处理组,第7天时处理组的还原糖含量高于对照组。贮藏期间可溶性蛋白的变化可以反映蛋白质的降解情况,从而可衡量机体的衰老程度[29],对照组的可溶性蛋白含量在贮藏期间都低于蔗糖处理组,特别是贮藏后期,暗示对照组在贮藏期间由于碳源匮乏,加速了蛋白的分解利用。在贮藏第7天,处理组与对照组相比,淀粉含量比为1.09倍,可溶性糖含量比为1.1倍,还原糖含量比为1.8,可溶性蛋白含量比为2.2倍,因此,蔗糖处理可以显著抑制紫背天葵糖类物质和可溶性蛋白的降解。
2.3 蔗糖处理对紫背天葵蔗糖代谢的影响
2.3.1 对蔗糖合成的影响 SPS和SS-S作为蔗糖的主要合成酶,影响蔗糖的合成与代谢[30]。对照组的SPS活性在贮藏期间都高于蔗糖处理组,呈上升趋势,而处理组在贮藏期间保持较为稳定的活性(图3)。处理组与对照组的SS-S活性在贮藏前期基本不变,而到贮藏后期,处理组与对照组均上升。在贮藏前3 d,SPS活性与蔗糖含量呈显著正相关(=0.824,=0.044<0.05),SS-S活性与蔗糖含量无显著相关性(=0.258,=0.622>0.05);到了贮藏后期,SPS活性与蔗糖含量呈负相关(=-0.475,=0.341>0.05),SS-S活性与蔗糖含量也呈负相关(=-0.437,=0.387>0.05),但相关性均不显著,暗示紫背天葵蔗糖含量在贮藏前期主要由SPS正调控,在贮藏后期则由SPS和SS-S共同负调控。淀粉酶(Amylase)将淀粉水解成小分子的糖类,进而生成蔗糖的合成前体物质如UDPG和F-6-P,对照组的淀粉酶活性在贮藏后期,显著高于处理组,淀粉酶活性与蔗糖含量呈显著负相关(=-0.816,=0.038<0.05),暗示处理组的紫背天葵在吸收外源蔗糖后,可以在贮藏后期保持较稳定的蔗糖含量,从而抑制淀粉酶活性。

图2 蔗糖处理对贮藏期间紫背天葵淀粉(A)、可溶性糖(B)、还原糖(C)和可溶性蛋白(D)含量的影响

图3 蔗糖处理对紫背天葵蔗糖合成的影响
2.3.2 对蔗糖分解的影响 蔗糖的水解酶主要有SSC和AI,对碳源的转运、分配利用和糖信号转导有重要作用[31]。对照组和处理组的SSC活性在贮藏期间没有显著差异,到了贮藏后期,处理组和对照组的SSC活性稍微上升。蔗糖处理组的AI活性在贮藏第1天上升,第3天开始下降,贮藏后期活性缓慢上升;而对照组与处理组完全相反,对照组的AI活性在贮藏前期基本不变,到贮藏后期活性显著上升(图4)。葡萄糖与果糖含量在贮藏期间的变化趋势基本一致,在贮藏前3 d,果糖含量与SS-C活性呈显著正性相关(=0.852,=0.031<0.05),与AI活性无显著正相关性(=0.728,=0.101>0.05)。但在贮藏后期,果糖含量与AI活性高度相关(=0.973,=0.027<0.05),而与SS-C活性无显著相关性(=-0.494,=0.506>0.05)。暗示蔗糖的分解由SS-C和AI共同负责,两者的主导作用与贮藏时期有关。

图4 蔗糖处理对紫背天葵蔗糖分解的影响
2.4 蔗糖处理对紫背天葵叶绿体膜脂氧化和超微结构的影响
2.4.1 叶绿体膜脂氧化 MDA是膜脂氧化的产物,其含量可以评价细胞的膜脂氧化程度[32]。由图5可知,对照组和处理组的叶绿体MDA含量在贮藏期间都先上升后下降再缓慢上升,对照组叶绿体的MDA含量在贮藏期间均高于处理组,表明对照组的叶绿体在贮藏期间发生的膜脂氧化程度显著高于处理组。LOX作为膜脂氧化的关键酶,和果蔬采后衰老具有密切关系。对照组的LOX活性在贮藏期间均高于处理组,且贮藏期间的活性变化与MDA含量变化极显著相关,相关系数=0.81(<0.01),表明叶绿体的膜脂氧化主要由LOX引起。说明对照组叶绿体的膜脂氧化高于处理组,证实蔗糖处理可以抑制叶绿体LOX活性,从而降低叶绿体的膜脂氧化程度。
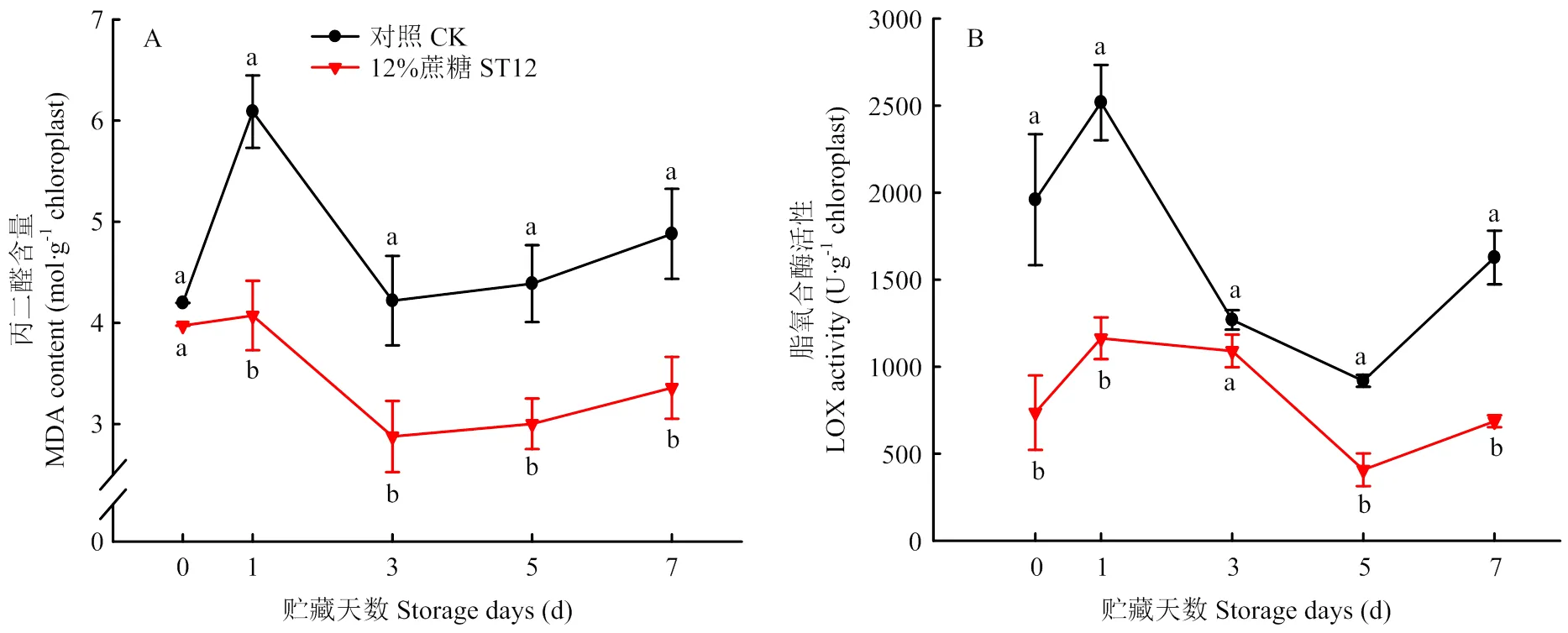
图5 紫背天葵叶绿体贮藏期间MDA(A)含量和LOX(B)活性变化
2.4.2 叶绿体超微结构 处理前,紫背天葵的细胞壁清晰可见,细胞膜厚实光滑,叶绿体呈细长状,类囊体膜清晰分明,噬饿颗粒和胞质杂质少。第3天时,对照组细胞出现了明显的质壁分离现象,基粒片层开始出现分离,胞质中杂质增加,而蔗糖处理则未出现质壁分离现象,胞质杂质增加不明显。第5天时,对照组的细胞膜出现褶皱并发生了断裂,细胞膜变薄,叶绿体的膜结构变得模糊,叶绿体形状开始由细长状变为椭圆状,胞质杂质与第3天相比变化不明显,而处理组的细胞膜未出现断裂现象,叶绿体膜结构完整,噬饿颗粒稍微增多,胞质杂质变化仍旧不明显。到贮藏第7天时,对照组的细胞膜已经完全破裂,叶绿体出现空腔并开始崩解,胞质杂质明显增多,叶绿体形状变为球状;而处理组中叶绿体未出现明显的崩解,但基粒片层发生卷曲,膜结构变薄和模糊,胞质杂质开始增多。以上证实了蔗糖处理可以延缓叶绿体结构的改变和叶绿体的崩解(图6)。
2.4.3 叶绿体功能与叶绿素荧光 实际光化学效率和最大光化学效率可以反映植物光合能力的强弱,从而表征叶绿体的能力,研究紫背天葵在贮藏期间叶片光化学效率的变化,可以反映植株在贮藏期间的衰老程度。从图7可见,蔗糖处理可以显著抑制紫背天葵在贮藏期间光合能力的下降,维持紫背天葵叶绿体的正常功能,证实蔗糖处理可以延缓紫背天葵叶绿体的衰老。紫背天葵总叶绿素含量的变化趋势与实际光化学效率变化基本一致,两者具有显著正相关(=0.911,=0.002<0.01),证实叶绿体的光化学效率变化与叶绿素降解有关。NPQ表征叶绿素分子在捕获光能后以热能形式耗散多余光能部分,可以表征叶绿素含量和光合效率。从NPQ贮藏变化图中可以看出,蔗糖处理可以显著抑制贮藏期间耗散热能的增加,保持较高的光化学效率,进而表征了叶绿体较好的生理功能。
2.4.4 叶绿体生理功能与脂氧合酶相关性分析 叶绿体实际光化学效率与淀粉、可溶性糖、还原糖、可溶性蛋白和叶绿素等物质具有显著或极显著的正相关性,而与蔗糖单个小分子物质不相关。叶绿体LOX则与实际光化学效率相反,LOX与蔗糖小分子物质显著负相关(表1)。因此,12%蔗糖处理紫背天葵可以显著维持贮藏期间淀粉、可溶性糖、还原糖、可溶性蛋白和叶绿素等物质的含量,进而维持叶绿体的生理功能,同时为紫背天葵提供外源蔗糖,在贮藏后期保持了较高的蔗糖含量,这对延缓叶绿体LOX活性的升高可能有一定的作用。
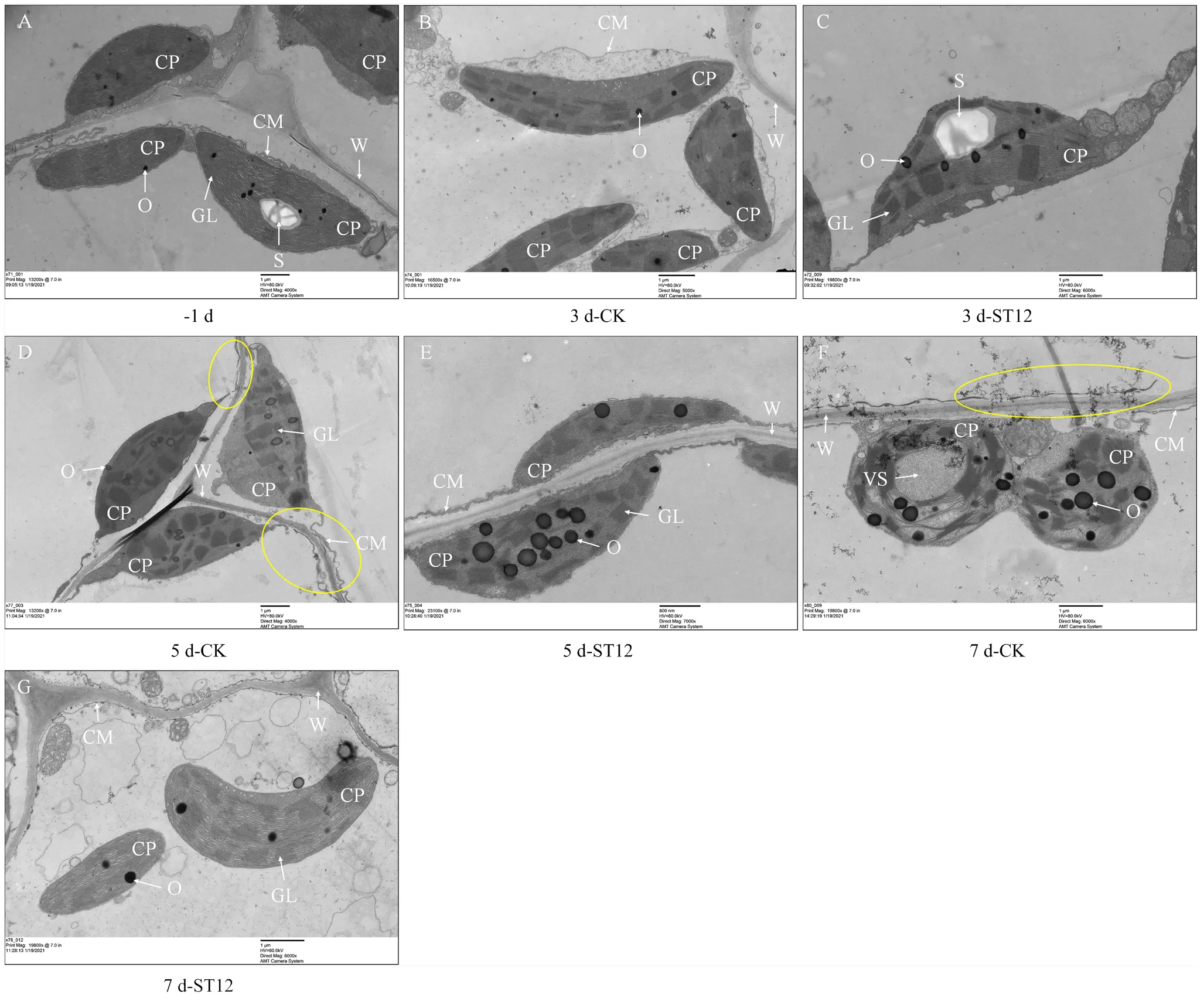
图A为-1 d的叶绿体超微结构,B、D、F分别为对照组3、5和7 d叶绿体超微结构;C、E、G分别为处理组3、5和7 d叶绿体超微结构。CP:叶绿体;CM:细胞膜;W:细胞壁;S:淀粉粒;O:噬锇颗粒;GL:基粒片层;VS:基粒片层囊泡化
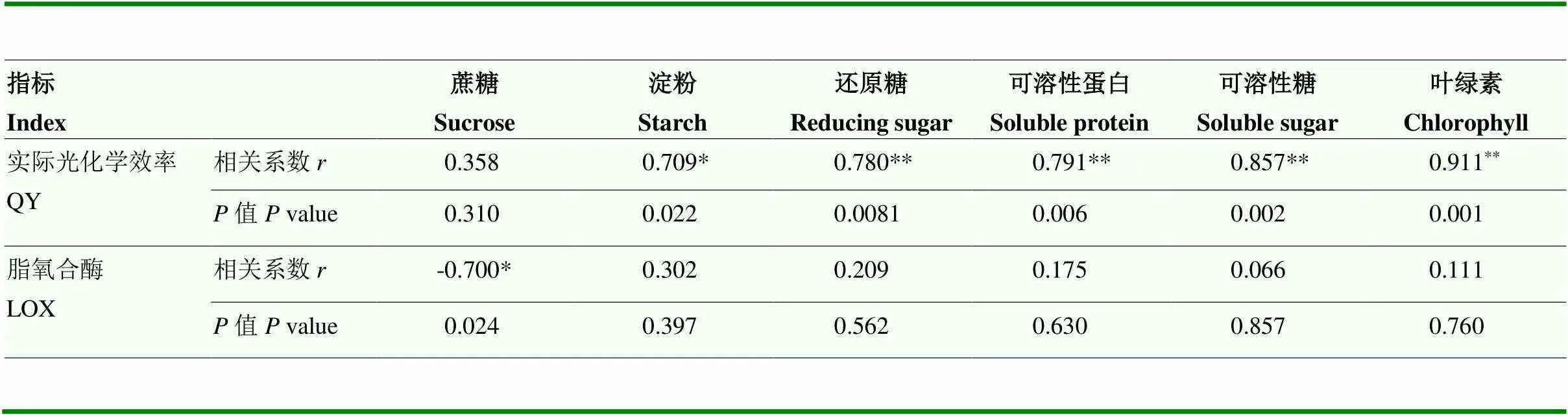
表1 紫背天葵实际光化学效率、LOX活性与相关糖类物质、可溶性蛋白和叶绿素含量的相关性
**表示具有极显著相关性(<0.01);*表示具有显著相关性(<0.05)
** represent extremely significant correlation (<0.01), * represent extremely significant correlation (<0.05)
3 讨论
在采后贮藏期间,紫背天葵采前所积累的营养物质逐渐消耗殆尽,加上叶绿体光合作用被抑制,组织细胞长期处于糖饥饿逆境中,细胞衰老的进程加快。
3.1 蔗糖延缓紫背天葵采后品质劣变
12%蔗糖处理在贮藏前期的呼吸强度高于对照,但在贮藏后期显著抑制呼吸强度的上升,特别是贮藏结束时,处理组的呼吸强度只有对照组的61%,这可能是贮藏前期蔗糖处理为紫背天葵提供了足够的能量,从而使呼吸强度上升;也可能是蔗糖参与了信号转导,让机体启动了抗逆的前期准备以适应逆境胁迫,从而在贮藏后期保持较低的呼吸强度,减少了贮藏后期紫背天葵糖类物质的消耗。在贮藏后期,处理组与对照组相比,淀粉含量、可溶性糖含量、还原糖含量、蔗糖含量和可溶性蛋白含量等保留明显高于对照组,该结果与姜丽等[33]植酸处理结果相近,特别是糖类物质,蔗糖处理的效果要优于植酸。ARAÚJO等[34]认为,植株在糖饥饿状态下,蛋白质可被降解成游离氨基酸作为糖类物质的替代物。ONO等[35]通过基质靶向荧光蛋白和荧光蛋白标记叶绿体蛋白,证实叶绿体蛋白的降解可通过一种包含小体(RCB)转运到液泡中进行,该过程主要由调控[36]。当受损的叶绿体越多,叶绿体自噬过程被激活,相应的表达水平提高,以精准地调控受损叶绿体的清除[37],加速氮素的周转利用。对照组在贮藏期间,由于糖类物质消耗过快,紫背天葵的糖饥饿加重,加上叶绿体结构受损比处理组严重,导致对照组的氮素周转利用加剧,因此,非糖物质如蛋白质和叶绿素的降解更快,从而加速紫背天葵品质劣变。蔗糖处理可显著延缓含碳和含氮物质的消耗,从而抑制了紫背天葵的衰老,但蔗糖参与碳源的分配调控机制以及碳源与氮源之间的转导调控模式还有待研究。
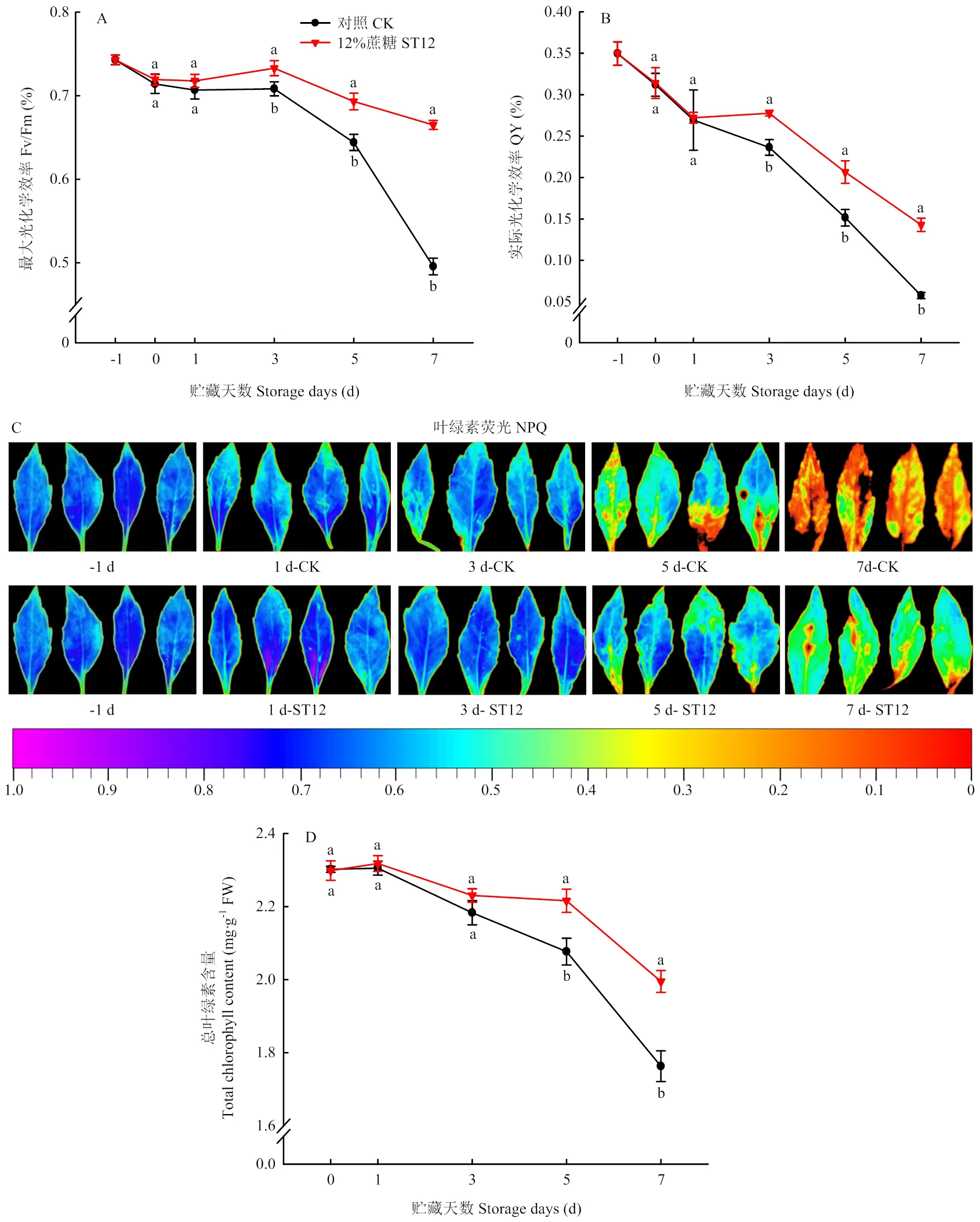
图7 蔗糖处理对紫背天葵最大光化学效率(A)和实际光化学效率QY(B)、非光化学淬灭NPQ(C)以及总叶绿素含量(D)的影响
Fig.7 The effects of sucrose treatment on the maximum photochemical efficiency (A), QY (B), the change of NPQ (C) and Chlorophyll content (D) ofduring storage
3.2 外源蔗糖处理调控蔗糖代谢
蔗糖作为大多数光合作物同化产物的主要运输和卸载形式,对植物的能量代谢具有重要影响,同时也是桥接淀粉和己糖的重要代谢枢纽[31]。本研究结果表明,贮藏前期SPS活性与蔗糖含量呈显著正相关,但在贮藏后期呈负相关,暗示紫背天葵在蔗糖充足的环境下,SPS是蔗糖合成的正向调控酶,而在蔗糖消耗殆尽时,蔗糖的合成则由SPS和SS-S共同负调控,该结果与田梦瑶等[38]的研究不完全一致。处理组在贮藏期间的蔗糖合成酶均显著低于对照组,可能是蔗糖处理为紫背天葵提供外源蔗糖,从而抑制了蔗糖合成酶的活性。BALIBREA等[39]发现胞质转化酶基因()的过表达可以调控转化酶活性的升高和延缓叶片的衰老。贮藏前期,对照组保持了较高的SPS活性和较低的AI活性,处理组则相反,暗示在蔗糖充足的情况下,上调了AI活性同时抑制了SPS活性,为抗逆做好了物质上的准备,以延缓衰老进程。而对照组在贮藏第5天的AI活性显著高于处理组,暗示对照组为了延缓衰老,在贮藏后期的逆境诱导下才上调了AI活性,这也解释了为什么贮藏前期蔗糖的分解主要与SS-C活性高度相关,而在贮藏后期与AI活性高度相关。应对糖饥饿逆境,12%蔗糖处理组和对照组对SPS与AI两种截然不同的调控,暗示SPS和AI可能是响应糖饥饿的关键酶,SS-S和SS-C可能主要负责平衡蔗糖正常的基础代谢,并非参与逆境响应的关键酶。BISWAL等[40]通过糖受体证实了蔗糖参与植株抗逆信号的转导,因此,推测蔗糖也可能参与紫背天葵糖饥饿的信号转导,但具体是调控上游基因表达还是调控SPS和AI的活性还不清楚,后续可深入研究蔗糖参与紫背天葵糖饥饿的转导模式。鉴于蔗糖处理对紫背天葵响应采后糖饥饿有积极作用,因此后续还可探究采前蔗糖处理的实际效果与可行性。
3.3 蔗糖延缓叶绿体衰老
根据表1的相关性分析,叶绿体的衰老和多种物质的消耗高度相关,暗示大量物质的消耗是引起叶绿体崩解周转的主要原因。叶绿体作为叶片氮含量最高(富含二磷酸核酮糖羧化酶和叶绿素)的细胞器[41],是细胞氮素周转利用的首选对象[42]。目前关于叶绿体的周转降解途径主要有两种,一种是通过液泡中的蛋白水解酶[43],另一种是叶绿体自身水解酶和液泡中的蛋白水解酶共同参与作用[44]。有研究证明叶绿体蛋白的降解与叶绿体数量上的减少在时空上并不同步[45],暗示叶绿体的崩解机制比较复杂。在糖饥饿逐渐加剧下,贮藏后期对照组的叶绿体崩解程度显著高于处理组,且叶绿体LOX与蔗糖具有显著负相关,暗示叶绿体的膜脂氧化可能与蔗糖的减少有关。赵晓帼等[46]与胡月等[47]研究发现蔗糖处理可以维持研究材料较高的过氧化物酶、超氧阴离子歧化酶和抗坏血酸过氧化物酶的活性,从而提高机体的抗氧化能力,说明蔗糖对降低膜脂氧化具有潜在的作用。在LOX与叶绿体实际光化学效率的相关性分析中发现,LOX与实际光化学效率并无显著的相关性,暗示叶绿体衰老并非由单个因素诱导,叶绿体的膜脂氧化可能只是其中的一个诱导因子[48]。蔗糖可通过抑制糖类物质、含氮物质的消耗与降低膜脂氧化来延缓叶绿体衰老,但蔗糖具体是如何参与调控的分子机制还有待研究。
根据以上的分析,简单绘制了蔗糖处理延缓紫背天葵采后糖饥饿的机制,如图8所示。
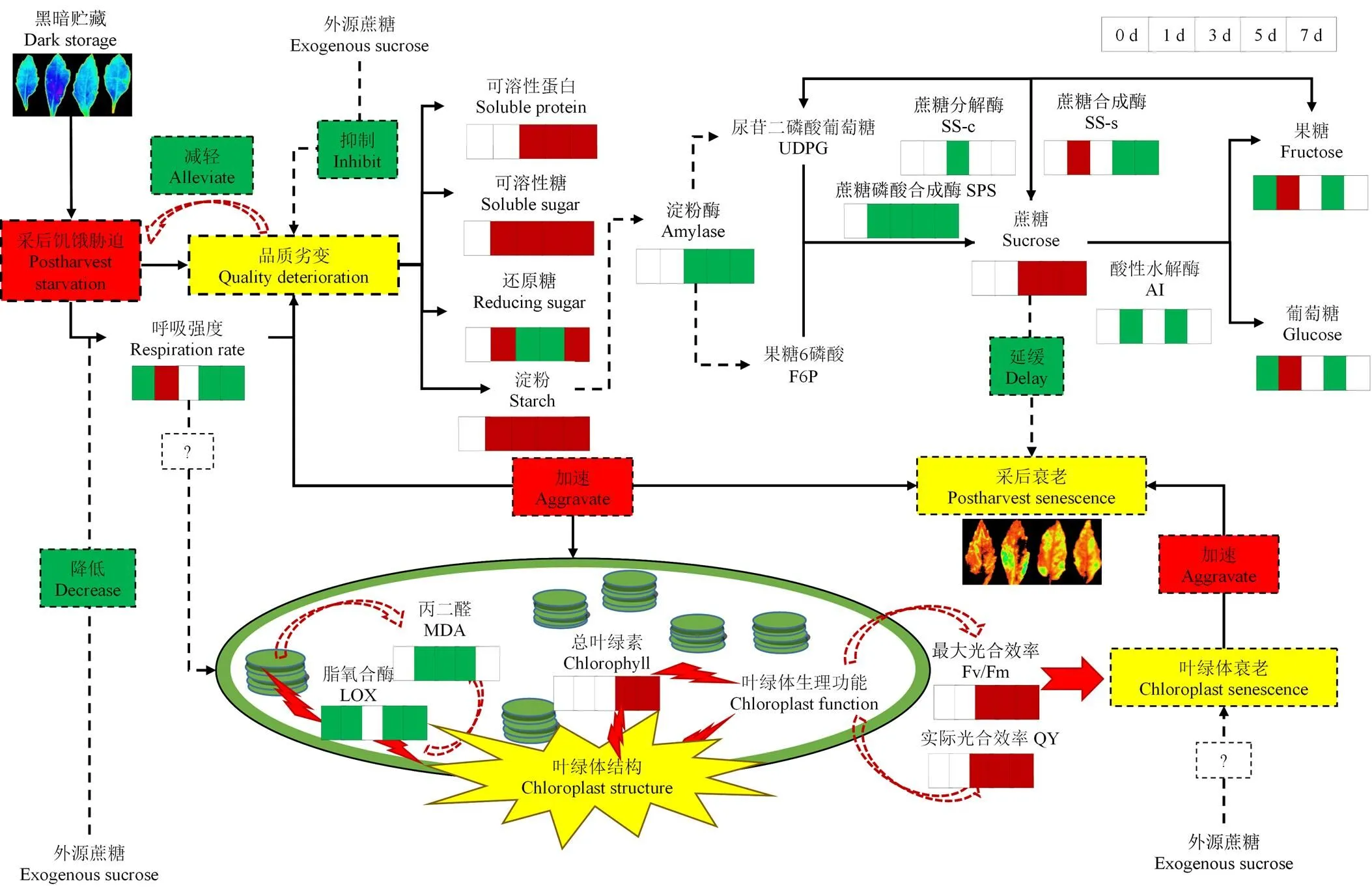
红色/绿色表示蔗糖处理组与对照组相比,酶活性或者物质含量显著高于/低于对照组,白色代表处理组与对照组无显著差异(P<0.05);虚线表示具体调控的方式或参与的形式还不确定
4 结论
蔗糖处理通过降低紫背天葵贮藏期间的呼吸强度、失重率和腐烂率,抑制蔗糖代谢,降低叶绿体膜脂氧化程度,维持叶绿体功能与结构完整性,延缓了紫背天葵采后品质的劣变和叶绿体衰老,减缓了采后糖饥饿对紫背天葵的影响。
[1] QIU X L, GUO Y X, ZHANG Q F.Chemical profile and antioxidant activity ofDC.ethanolic extract.International Journal of Food Properties, 2018, 21(1): 407-415.doi: 10.1080/10942912.2018.1424199.
[2] BUCKNER B, JANICK-BUCKNER D, GRAY J, JOHAL G S.Cell-death mechanisms in maize.Trends in Plant Science, 1998, 3(6): 218-223.doi: 10.1016/S1360-1385(98)01254-0.
[3] BLEECKER A B, PATTERSON S E.Last exit: senescence, abscission, and meristem arrest in.The Plant Cell, 1997, 9(7): 1169-1179.doi: 10.1105/tpc.9.7.1169.
[4] 施衡乐, 吴伟杰, 郜海燕, 韩延超, 陈杭君, 刘瑞玲.短波紫外线处理对紫背天葵采后贮藏品质的影响.核农学报, 2018, 32(7): 1377-1383.
SHI H L, WU W J, GAO H Y, HAN Y C, CHEN H J, LIU R L.Effect of UV-C treatment on post-harvest storage quality of.Journal of Nuclear Agricultural Sciences, 2018, 32(7): 1377-1383.(in Chinese)
[5] 张飞, 石洁, 谢意通, 姜丽.1-甲基环丙烯处理对采后紫背天葵抗氧化系统的影响.食品科学, 2022, 43(1): 164-170.doi: 10.7506/ spkx1002-6630-20201219-222.
ZHANG F, SHI J, XIE Y T, JIANG L.Effect of 1-methylcyclopropene treatment on the antioxidant system ofDC.Food Science, 2022, 43(1): 164-170.doi: 10.7506/spkx1002-6630-20201219- 222.(in Chinese)
[6] 许昕.紫背天葵铜/锌超氧化物歧化酶基因克隆和采后处理对其表达的影响[D].南京: 南京农业大学, 2017: 65.
XU X.Copper/zinc supperoxide dismutase gene cloning ofD.C and its expression after various postharvest treatments [D].Nanjing: Nanjing Agricultural University, 2017: 65.(in Chinese)
[7] JIANG L, FENG L, HOU T Y, YU Z F.Establishment of a mathematical model for treatment ofDC.by nano-packaging in combination with controlled atmosphere.Food Science, 2014, 35(16): 238-243.(in Chinese)
[8] VICKY B W, TANIA P, ELIZABETH H, EMILY B, OK L P, GIL N H, LIN J F, SHU-HSING W, JODI S, KIMITSUNE I, LEAVER C J.Comparative transcriptome analysis reveals significant differences in gene expression and signalling pathways between developmental and dark/starvation-induced senescence in.The Plant Journal: for Cell and Molecular Biology, 2005, 42(4): 567-585.
[9] BAENA-GONZÁLEZ E, ROLLAND F, THEVELEIN J M, SHEEN J.A central integrator of transcription networks in plant stress and energy signalling.Nature, 2007, 448(7156): 938-942.doi: 10.1038/ nature06069.
[10] YU S M.Cellular and genetic responses of plants to sugar Starvation1.Plant Physiology, 1999, 121(3): 687-693.doi: 10.1104/pp.121.3.687.
[11] BAENA-GONZÁLEZ E, SHEEN J.Convergent energy and stress signaling.Trends in Plant Science, 2008, 13(9): 474-482.doi: 10.1016/j.tplants.2008.06.006.
[12] MCDOWELL N, POCKMAN W T, ALLEN C D, BRESHEARS D D, COBB N, KOLB T, PLAUT J, SPERRY J, WEST A, WILLIAMS D G, YEPEZ E A.Mechanisms of plant survival and mortality during drought: why do some plants survive while others succumb to drought? The New Phytologist, 2008, 178(4): 719-739.doi: 10.1111/j.1469- 8137.2008.02436.x.
[13] IZUMI M, NAKAMURA S, LI N.Autophagic turnover of chloroplasts: Its roles and regulatory mechanisms in response to sugar starvation.Frontiers in Plant Science, 2019, 10: 280.doi: 10.3389/ fpls.2019.00280.
[14] IZUMI M, WADA S, MAKINO A, ISHIDA H.The autophagic degradation of chloroplasts via rubisco-containing bodies is specifically linked to leaf carbon status but not nitrogen status in.Plant Physiology, 2010, 154(3): 1196-1209.doi: 10.1104/pp.110.158519.
[15] IZUMI M, HIDEMA J, WADA S, KONDO E, KURUSU T, KUCHITSU K, MAKINO A, ISHIDA H.Establishment of monitoring methods for autophagy in rice reveals autophagic recycling of chloroplasts and root plastids during energy limitation.Plant Physiology, 2015, 167(4): 1307-1320.doi: 10.1104/pp.114.254078.
[16] 姚迪.光照和可溶性糖处理对青花菜保鲜效果及其机理研究[D].南京: 南京农业大学, 2013: 53.
YAO D.Effects of light and soluble sugar treatments on quality maintenance and mechanism in postharvest broccoli florets [D].Nanjing: Nanjing Agricultural University, 2013: 53.(in Chinese)
[17] 任亚梅.猕猴桃果实叶绿素代谢及生理特性研究[D].杨凌: 西北农林科技大学, 2009.
REN Y M.Study on chlorophyll metabolism and physiology characteristics of kiwifruit [D].Yangling: Northwest A & F University, 2009.(in Chinese)
[18] SITBON F, HENNION S, LITTLE C H A, SUNDBERG B.Enhanced ethylene production and peroxidase activity in IAA-overproducing transgenic tobacco plants is associated with increased lignin content and altered lignin composition.Plant Science, 1999, 141(2): 165-173.doi: 10.1016/S0168-9452(98)00236-2.
[19] 吕恩利, 陆华忠, 杨松夏, 赵俊宏, 田庆立.气调运输包装方式对荔枝保鲜品质的影响.现代食品科技, 2016, 32(4): 156-160, 93.doi:10.13982/j.mfst.1673-9078.2016.4.025.
Lü E L, LU H Z, YANG S X, ZHAO J H, TIAN Q L.Effects of packaging methods on fresh-keeping quality ofduring controlled atmosphere transport.Modern Food Science and Technology, 2016, 32(4): 156-160, 93.doi: 10.13982/j.mfst.1673-9078.2016.4.025.(in Chinese)
[20] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导.北京:中国轻工业出版社, 2017: 56-78.
CAO J K, JIANG W W, ZHAO Y M.Guidance on postharvest physiological and biochemical experiments of fruits and vegetables.Beijing: China Light Industry Press, 2017: 56-78.(in Chinese)
[21] 潘俨, 孟新涛, 车凤斌, 薛素琳, 张婷, 赵世荣, 廖康.库尔勒香梨果实发育成熟的糖代谢和呼吸代谢响应特征.中国农业科学, 2016, 49(17): 3391-3412.
PAN Y, MENG X T, CHE F B, XUE S L, ZHANG T, ZHAO S R, LIAO K.Metabolic profiles of sugar metabolism and respiratory metabolism of Korla pear (Yu) throughout fruit development and ripening.Scientia Agricultura Sinica, 2016, 49(17): 3391-3412.(in Chinese)
[22] WU Z F, TU M M, YANG X P, XU J H, YU Z F.Effect of cutting and storage temperature on sucrose and organic acids metabolism in postharvest melon fruit.Postharvest Biology and Technology, 2020, 161(C): 111081.doi: 10.1016/j.postharvbio.2019.111081.
[23] 高俊凤.植物生理学实验指导.北京:高等教育出版社, 2006: 188-191.
GAO J F.Experimental guidance of plant physiology.Beijing: Higher Education Press, 2006: 188-191.(in Chinese)
[24] AUSTIN J, WEBBER A N.Photosynthesis inmutants with reduced chloroplast number.Photosynthesis Research, 2005, 85(3): 373-384.doi: 10.1007/s11120-005-7708-x.
[25] SONG L L, YI R X, LUO H B, JIANG L, GU S M, YU Z F.Postharvest 1-methylcyclopropene application delays leaf yellowing of pak choi () by improving chloroplast antioxidant capacity and maintaining chloroplast structural integrity during storage at 20℃.Scientia Horticulturae, 2020, 270: 109466.doi: 10.1016/j.scienta.2020.109466.
[26] 吴正锋, 孙学武, 王才斌, 郑亚萍, 万书波, 刘俊华, 郑永美, 吴菊香, 冯昊, 于天一.弱光胁迫对花生功能叶片RuBP羧化酶活性及叶绿体超微结构的影响.植物生态学报, 2014, 38(7): 740-748.
WU Z F, SUN X W, WANG C B, ZHENG Y P, WAN S B, LIU J H, ZHENG Y M, WU J X, FENG H, YU T Y.Effects of low light stress on rubisco activity and the ultrastructure of chloroplast in functional leaves of peanut.Chinese Journal of Plant Ecology, 2014, 38(7): 740-748.(in Chinese)
[27] 田雨, 王旭文, 韩焕勇, 罗宏海, 王方永.施氮量对等行距密植棉花气体交换和叶绿素荧光特性的影响.新疆农业科学, 2020, 57(11): 1987-1997.
TIAN Y, WANG X W, HAN H Y, LUO H H, WANG F Y.Effects of nitrogen application rates on gas exchange and chlorophyll fluorescence parameters of cotton under wide-row spacing with high density.Xinjiang Agricultural Sciences, 2020, 57(11): 1987-1997.(in Chinese)
[28] BÜCHERT A M, CIVELLO P M, MARTÍNEZ G A.Chlorophyllase versus pheophytinase as candidates for chlorophyll dephytilation during senescence of broccoli.Journal of Plant Physiology, 2011, 168(4): 337-343.doi: 10.1016/j.jplph.2010.07.011.
[29] LESHEM Y Y.Plant senescence processes and free radicals.Free Radical Biology & Medicine, 1988, 5(1): 39-49.doi: 10.1016/0891- 5849(88)90060-3.
[30] DAIE J.Cytosolic fructose-1, 6-bisphosphatase: a key enzyme in the sucrose biosynthetic pathway.Photosynthesis Research, 1993, 38(1): 5-14.doi: 10.1007/BF00015056.
[31] KOCH K.Sucrose metabolism: regulatory mechanisms and pivotal roles in sugar sensing and plant development.Current Opinion in Plant Biology, 2004, 7(3): 235-246.doi: 10.1016/j.pbi.2004.03.014.
[32] CAMPOS P S, QUARTIN V, RAMALHO J C, NUNES M A.Electrolyte leakage and lipid degradation account for cold sensitivity in leaves ofsp plants.Journal of Plant Physiology, 2003, 160(3): 283-292.doi: 10.1078/0176-1617-00833.
[33] 姜丽, 冯莉, 侯田莹, 郁志芳.植酸处理对冷藏期间紫背天葵品质的影响.食品工业科技, 2015, 36(7): 336-341.doi: 10.13386/j.issn1002-0306.2015.07.062.
JIANG L, FENG L, HOU T Y, YU Z F.Effect of phytic acid onD.C quality during cold storage.Science and Technology of Food Industry, 2015, 36(7): 336-341.doi: 10.13386/j.issn1002-0306.2015.07.062.(in Chinese)
[34] ARAUJO W L, TOHGE T, ISHIZAKI K, LEAVER C J, FERNIE A R.Protein degradation - an alternative respiratory substrate for stressed plants.Trends in Plant Science, 2011, 16(9): 489-498.
[35] ONO Y, WADA S, IZUMI M, MAKINO A, ISHIDA H.Evidence for contribution of autophagy to rubisco degradation during leaf senescence in.Plant, Cell & Environment, 2013, 36(6): 1147-1159.doi: 10.1111/pce.12049.
[36] HIROYUKI I, KOHKI Y, MASANORI I, DANIEL R, YUICHI Y, AMANE M, YOSHINORI O, HANSON M R, TADAHIKO M.Mobilization of rubisco and stroma-localized fluorescent proteins of chloroplasts to the vacuole by an ATG gene-dependent autophagic process.Plant Physiology, 2008, 148(1): 142-55.doi: 10.1104/pp.108.122770.
[37] NAKAMURA S, IZUMI M.Regulation of chlorophagy during photoinhibition and senescence: Lessons from mitophagy.Plant and Cell Physiology, 2018, 59(6): 1135-1143.doi: 10.1093/pcp/pcy096.
[38] 田梦瑶, 周宏胜, 唐婷婷, 张映曈, 凌军, 罗淑芬, 李鹏霞.外源蔗糖处理对采后桃果皮色泽形成的影响.食品科学, 2022, 43(1): 177-183.doi: 10.7506/spkx1002-6630-20201112-135.
TIAN M Y, ZHOU H S, TANG T T, ZHANG Y T, LING J, LUO S F, LI P X.Effect of exogenous sucrose treatment on the peel coloration in postharvest peaches.Food Science, 2022, 43(1): 177-183.doi: 10.7506/spkx1002-6630-20201112-135.(in Chinese)
[39] BALIBREA LARA M E, GONZALEZ GARCIA M C, FATIMA T, EHNEss R, LEE T K, PROELS R, TANNER W, ROITSCH T.Extracellular invertase is an essential component of cytokinin- mediated delay of senescence.The Plant Cell, 2004, 16(5): 1276-1287.doi: 10.1105/tpc.018929.
[40] BISWAL B, PANDEY J K.Loss of photosynthesis signals a metabolic reprogramming to sustain sugar homeostasis during senescence of green leaves: role of cell wall hydrolases.Photosynthetica, 2018, 56(1): 404-410.doi:10.1007/s11099-018-0784-x.
[41] FELLER U, ANDERS I, MAE T.Rubiscolytics: fate of Rubisco after its enzymatic function in a cell is terminated.Journal of Experimental Botany, 2007, 59(7): 1615-1624.doi: 10.1093/jxb/erm242.
[42] TERCÉ-LAFORGUE T, MÄCK G, HIREL B.New insights towards the function of glutamate dehydrogenase revealed during source-sink transition of tobacco () plants grown under different nitrogen regimes.Physiologia Plantarum, 2004, 120(2): 220-228.doi: 10.1111/j.0031-9317.2004.0241.x.
[43] WITTENBACH V A, LIN W, HEBERT R R.Vacuolar localization of proteases and degradation of chloroplasts in mesophyll protoplasts from senescing primary wheat leaves.Plant Physiology, 1982, 69(1): 98-102.doi: 10.1104/pp.69.1.98.
[44] CHIBA A, ISHIDA H, NISHIZAWA N K, MAKINO A, MAE T.Exclusion of ribulose-1, 5-bisphosphate carboxylase/oxygenase from chloroplasts by specific bodies in naturally senescing leaves of wheat.Plant and Cell Physiology, 2003, 44(9): 914-921.doi: 10.1093/pcp/ pcg118.
[45] KRUPINSKA K.Fate and activities of plastids during leaf senescence//WISE R R, HOOBER J K.Structure and Function of Plastids.Aa Dordrecht, Netherlands: Springer, 2006: 433.
[46] 赵晓帼, 朱毅, 罗云波.外源蔗糖对萝卜幼苗品质及代谢酶活性的影响.食品科学, 2015, 36(9): 7-11.doi: 10.7506/spkx1002-6630- 201509002.
ZHAO X G, ZHU Y, LUO Y B.Effect of exogenous sucrose on quality and metabolic enzyme activities of radish sprouts.Food Science, 2015, 36(9): 7-11.doi: 10.7506/spkx1002-6630-201509002.(in Chinese)
[47] 胡月, 王鸿飞, 董栓泉, 程佑声, 许凤, 邵兴锋, 李和生.蔗糖处理对费菜黄酮含量及其抗氧化性的影响.现代食品科技, 2016, 32(1): 250-255.doi: 10.13982/j.mfst.1673-9078.2016.1.039.
HU Y, WANG H F, DONG S Q, CHENG Y S, XU F, SHAO X F, LI H S.Effect of sucrose treatment on flavonoid content and antioxidant activity ofaizoon leaves.Modern Food Science and Technology, 2016, 32(1): 250-255.doi: 10.13982/j.mfst.1673-9078.2016.1.039.(in Chinese)
[48] IZUMI M, ISHIDA H, NAKAMURA S, HIDEMA J.Entire photodamaged chloroplasts are transported to the central vacuole by autophagy.The Plant Cell, 2017, 29(2): 377-394.doi: 10.1105/tpc.16.00637.
Effects of Exogenous Sucrose on the Postharvest Quality and Chloroplast ofD.C
XIE YiTong, ZHANG Fei, SHI Jie, FENG Li, JIANG Li*
College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095
【Background】The physiological metabolism ofis active after harvest, and it is sensitive to low temperature.After harvest, it is often stored in a dark environment with slightly lower than room temperature.However, the long-term dark storage ofwill lead to sugar starvation, which affects the quality of.The dark storage also inhibits the photosynthetic process, resulting in reduced photosynthetic assimilation products and aggravated postharvest sugar starvation, and sucrose is the main form of photosynthetic product transport in plants.【Objective】The effects of exogenous sucrose treatment on postharvest quality, sucrose metabolism and chloroplast ofwere studied to explore the related mechanism of sucrose treatment on delaying postharvest senescence in this study.【Method】On the basis of screening out the optimal concentration, the contents of starch, soluble sugar, reducing sugar, soluble protein and chlorophyll induring storage were detected to study the effect of sucrose treatment on postharvest quality of.The contents of sucrose, fructose, glucose, and sucrose metabolism related enzyme activities, such as Amylase, SPS, AI, SS-s, and SS-c, were detected during storage, and then the effects of sucrose treatments on sucrose metabolism ofwas studied.The changes of chloroplast ultrastructure during storage were observed by TEM.The activity of LOX, the content of MDA, and the Fv/Fm and QY of chloroplast during storage were detected, then the effects of sucrose treatment on the physiology and function of chloroplast were studied.The effects of postharvest sucrose treatment onwere studied at biochemical and subcellular levels.【Result】The screening of sucrose concentration in the earlier study showed that 12% sucrose had the best preservation effect.Especially in the late storage period, compared with the control (distilled water treatment), the respiratory intensity, weightlessness rate, and decay rate of 12% sucrose treatment decreased by 39%, 7.8%, and 15.87%, respectively.Further study found that in the late storage, compared with the control, the treated sucrose content ratio was 1.82, starch content ratio was 1.10, soluble sugar content ratio was 1.11, soluble protein content ratio was 2.20, and chlorophyll content ratio was 1.23, indicating sucrose treatment significantly delayed the degradation of carbohydrates and nitrogenous substances.Sucrose treatment significantly inhibited the activities of SPS, AI and Amylase, indicating that sucrose treatment inhibited sucrose metabolism, thereby reducing the decomposition of sucrose and starch.In the later study on the physiological functions of chloroplasts of, it was found that at the end of storage, compared with the control, the treatedeffectively maintained the structural integrity of chloroplasts, reduced the activity of chloroplast LOX by 53.13%, and reduced the content of MDA by 33.33%.The Fv/Fm and QY were 1.35 and 1.97 times that of the control, respectively, indicating that sucrose treatment significantly delayed the senescence of chloroplasts.Further analysis showed that chloroplast function was positively correlated with starch and soluble sugar content, indicating that carbon source deficiency caused by sugar starvation could affect chloroplast function.【Conclusion】Sucrose treatment inhibited postharvest quality deterioration and chloroplast senescence ofby reducing respiratory intensity, weightlessness rate and decay rate, regulating sucrose metabolism, reducing the degree of chloroplast membrane lipid oxidation, and maintaining the integrity of chloroplast structure, thereby delaying the senescence of.
sucrose metabolism; chloroplast; sugar starvation;D.C; preservation
2021-07-09;
2021-10-09
国家自然科学基金(31301576)、江苏省高校优势学科建设工程资助项目(PAPD)
谢意通,Tel:18933567483;E-mail:2019108022@njau.edu.cn。通信作者姜丽,Tel:19951682026;E-mail:jiangli@njau.edu.cn
(责任编辑 赵伶俐)
