基于55K SNP芯片的普通小麦穗长非条件和条件QTL分析
2022-05-16唐华苹陈黄鑫李聪苟璐璐谭翠牟杨唐力为兰秀锦魏育明马建
唐华苹,陈黄鑫,李聪,苟璐璐,谭翠,牟杨,唐力为,兰秀锦,魏育明,马建*
基于55K SNP芯片的普通小麦穗长非条件和条件QTL分析
唐华苹1,陈黄鑫1,李聪1,苟璐璐1,谭翠2,牟杨1,唐力为3,兰秀锦1,魏育明1,马建1*
1四川农业大学小麦研究所,成都 611130;2四川农业大学动物营养研究所,成都 611130;3攀枝花市农林科学研究院,四川攀枝花 617061
【目的】进一步挖掘小麦穗长具有利用价值的数量遗传位点(QTL),同时深入探究穗长与其他重要农艺性状之间的遗传关系,为精细定位和分子辅助选择育种奠定基础。【方法】以20828为母本、SY95-71为父本,构建126份F7代重组自交系群体。将亲本及其重组自交系分别于2016—2017年和2017—2018年生长季种植在中国四川省成都市温江区试验基地、中国四川省崇州市试验基地、中国四川省雅安市试验基地以及孟加拉国库尔纳市试验田,调查7个不同环境下的穗长表型。利用基于小麦55K SNP芯片构建的遗传连锁图谱进行非条件QTL的定位,并分析其效应。分别以株高、穗茎长、每穗小穗数和千粒重为条件,对定位到的主效QTL进行条件QTL分析,分析穗长与它们的遗传关系。【结果】通过非条件QTL定位到13个穗长QTL,分别位于1A、1D、2B、2D、4B、6D和7A染色体,LOD值为2.79—6.19,贡献率为5.35%—12.77%。其中,定位到3个稳定遗传的主效QTL:、和,贡献率分别为6.54%—11.72%、10.16%—12.57%和5.35%—10.92%。这三个主效QTL在多环境分析中也可以检测到。进一步聚合分析表明,聚合、和增效位点的株系穗长表型显著长于聚合任意2个主效QTL或仅含单个主效QTL增效位点的株系。同时,发现对于株高、穗茎长、每穗小穗数和千粒重均没有显著影响,对于千粒重有显著影响,达到3.98%,而对于株高、穗茎长和每穗小穗数没有显著影响,对于株高和穗茎长有极显著影响,分别达到-12.28%和-22.26%,而对于每穗小穗数和千粒重没有显著影响。条件QTL分析结果表明,在QTL水平上,与株高和穗茎长无关,但受到每穗小穗数和千粒重的影响,与穗茎长、每穗小穗数和千粒重无关,但受到株高的影响,与穗茎长和千粒重无关,但受到株高和每穗小穗数的影响。【结论】定位到3个控制穗长且稳定遗传的主效QTL——、和。其中,可能为新的QTL,独立于株高和穗茎长遗传。
普通小麦;55K SNP芯片;穗长;非条件QTL;条件QTL
0 引言
【研究意义】小麦的营养物质由各种碳水化合物、蛋白质和脂肪分子组成,作为全球粮食供应的关键,小麦为人类营养来源提供了约20%的卡路里和蛋白质[1-3]。自21世纪以来,人口的不断剧增导致产量供不应求。高产、稳产逐渐成为现代小麦育种的重要目标,对其产量相关农艺性状进行遗传改良,是实现这一目标的有效途径之一[4]。小麦的穗长不仅是株型重要的组成部分,也是关键的穗部性状,与产量高度相关。因此,进一步挖掘穗长相关的数量遗传位点(QTL),研究穗长与其他农艺性状的遗传关系,有利于提高小麦现代分子育种效率。【前人研究进展】关于穗长的非条件QTL定位已有大量研究。JI等[5]利用BSE-Seq分析方法对极端混池进行基因分型,在5A染色体上初步定位到了,贡献7.88%—26.60%的表型变异。Li等[6]利用小麦55K SNP芯片鉴定和验证了2个控制穗密度和穗长的主效QTL,对株高、千粒重和粒长具有多效性效应。Zhou等[7]基于9K SNP芯片检测到9个穗长QTL,最高解释23.60%的贡献率。Liu等[8]利用全基因组关联分析在192个小麦品系和地方品种中检测到51个与穗长相关的显著SNP位点。Zhai等[9]结合SNP和SSR标记构建遗传连锁图谱,检测到30个穗长QTL。利用条件QTL解析遗传关系,可以从QTL水平更加深入解析不同关联性状之间的遗传关系[10-11]。例如,Li等[12]等通过条件QTL分析发现,确定控制穗茎长的独立于株高遗传。Zhang等[13]检测到与产量三要素相关的33个非条件QTL和59个条件QTL,可解释4.48%—34.07%的表型变异,发现可在不影响千粒重和小穗数的情况下改良穗粒数。Fan等[14]结合非条件QTL和条件QTL定位分析不同氮处理下小麦穗部性状的多效QTL区,结果表明,在缺氮条件下,和能通过积累优良等位基因维持理想的小穗育性和粒数。【本研究切入点】穗长相关的QTL较多,然而能够真正运用于生产实际的却很少[15]。与此同时,针对穗长与其他株型性状和产量性状之间的条件QTL研究也较少,其遗传关系并不清晰[16-18]。【拟解决的关键问题】本研究以小麦品系20828和SY95-71为亲本构建的128份(含亲本)重组自交系(RIL)群体为材料,利用55K SNP芯片构建遗传连锁图谱,通过非条件QTL进一步挖掘穗长稳定遗传的主效QTL,并分析其效应,同时结合条件QTL分析,分析穗长与2个株型相关性状株高和穗茎长以及2个产量相关性状每穗小穗数和千粒重之间的遗传关系,为精细定位和分子辅助选择育种奠定基础。
1 材料与方法
1.1 试验材料
试验材料为20282×SY95-71通过单籽粒传法构建的F7代RIL群体(2SY群体),包含亲本共128个株系。20828(G214-5/3/川育19//Lang 9247/50788)是由中国科学院成都生物研究所创制的一个品系,穗型较好,每穗小穗数在多年多点的表型鉴定中介于25.67—30.50,而SY95-71(Eronga 83/繁6//繁6)由四川农业大学小麦研究所创制并保存,穗型较差,每穗小穗数介于19.00—22.00[19-21]。两者均是普通小麦(图1)。

图1 2SY群体亲本和部分株系的穗长
1.2 试验设计和表型评估
在小麦成熟期,对2SY群体的亲本及其RIL分别于2017年在中国四川省成都市温江区试验基地(E1)、中国四川省崇州市试验基地(E2)和中国四川省雅安市试验基地(E3),于2018年在中国四川省成都市温江区试验基地(E4)、中国四川省崇州市试验基地(E5)、中国四川省雅安市试验基地(E6)和孟加拉国库尔纳市试验田(E7)进行多年多环境下穗长的表型鉴定。播种方法按前人描述[22]进行,每个株系种植在1.5 m宽的单行中,行间间隔0.3 m,播种密度为15粒/行,行内种子间隔0.1 m,田间管理按照当地常规生产方式进行。选取生长势一致的至少3个单株,使用直尺测量每个单株的主穗穗长(不包括芒长)。试验所用2SY群体穗长的最佳线性无偏预测值(BLUP)在课题组前期文章中已用作相关性分析,单个生态环境的数据未公布[12];而2SY群体株高[22]、穗茎长[12]、每穗小穗数[21]和千粒重[23]的BLUP来自课题组已发表的文章。
1.3 遗传图谱构建和QTL检测
试验使用Liu等[22]基于55K SNP芯片构建的高密度遗传连锁图谱。运用IciMapping 4.1(https:// www.isbreeding.net/),设置PIN=0.001、Step=1 cM、LOD≥2.5,利用完备区间作图法进行穗长的非条件QTL检测,设置PIN=0.001、Step=1 cM、LOD≥7进行穗长的多环境分析。利用中国春参考基因组2.1[24]查询前人报道的QTL物理位置,并与本试验所定位到的QTL进行比较。定位到的QTL命名遵循国际常用命名方法(https://wheat.pw.usda.gov/ggpages/wgc/98/ Intro.htm)。
使用QGAStation 2.0计算以株高、穗茎长、每穗小穗数和千粒重为条件的穗长条件表型值(SL|PH、SL|SEL、SL|SNS和SL|TGW),利用IciMapping 4.1,设置PIN=0.001、Step=1 cM、LOD≥2.5,对条件表型值的条件QTL进行分析。条件表型值(T1|T2)表示以性状T2为条件的性状T1。条件QTL分析中,以T2为条件的T1条件QTL与T1非条件QTL具有相似加性效应值和LOD值时,则认为该QTL与T2无关,而条件QTL与其非条件QTL的加性效应值和LOD值明显降低或增加时,则认为该QTL受到T2的影响。
1.4 统计分析
运用Microsoft Excel 2016计算不同环境下穗长表型的平均值和标准差。利用SAS 9.1.3的MIXED进程计算不同环境下穗长表型的BLUP。广义遗传力(2)公式2=VG/(VG+VE),其中,VG表示遗传方差,VE表示环境方差。使用IBM SPSS Statistics 27计算不同环境下穗长表型的偏度和峰度以及分析数据之间的显著性水平。使用Origin 2021绘制数据相关的频率分布图和箱线图。
2 结果
2.1 穗长的表型变异
对2SY群体穗长在不同环境中的表型数据进行评价。在E1—E7中,亲本20828的穗长平均值为11.28— 15.60 cm,亲本SY95-71的穗长平均值为7.54—9.83 cm,两者在所有环境中均呈现极显著差异(表1,<0.01)。穗长的频率分布在所有环境中呈现近似正态分布,且其偏度和峰度均趋于0,符合典型的数量性状特点(表1和图2)。同时,穗长的广义遗传力为0.63,表明穗长受遗传因素的影响大于环境因素(表1)。此外,对不同环境下穗长之间进行相关性分析,发现其Pearson相关系数为0.192—0.867,除在环境E4和E7、E5和E7之间为显著相关外(<0.01),其余均为极显著相关(表2,<0.01)。
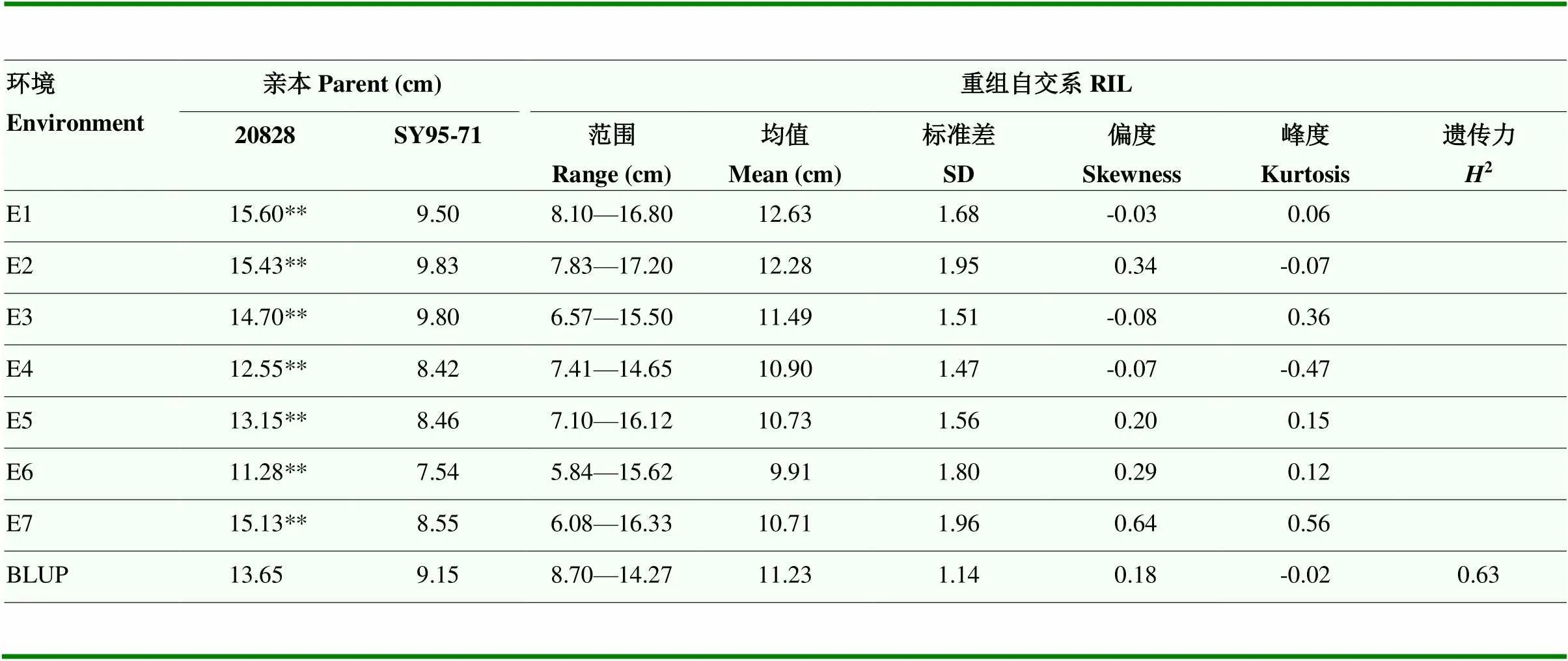
表1 2SY群体亲本及其RIL穗长表型变异
E1:2017年中国四川省成都市温江区试验基地;E2:2017年中国四川省崇州市试验基地;E3:2017年中国四川省雅安市试验基地;E4:2018年中国四川省成都市温江区试验基地;E5:2018年中国四川省崇州市试验基地;E6:2018年中国四川省雅安市试验基地;E7:2018年孟加拉国库尔纳市试验田。**:在0.01水平差异显著。下同
E1: Wenjiang experiment base, Chengdu, Sichuan Province, China in 2017; E2: Chongzhou experiment base, Sichuan Province, China in 2017; E3: Ya'an experiment base, Sichuan Province, China in 2017; E4: Wenjiang experiment base, Chengdu, Sichuan, China in 2018; E5: Chongzhou experiment base, Sichuan Province, China in 2018; E6: Ya'an experiment base, Sichuan Province, China in 2018; E7: Experiment field in Khulna, Bangladesh in 2018.**: The significant difference at 0.01 levels.The same as below
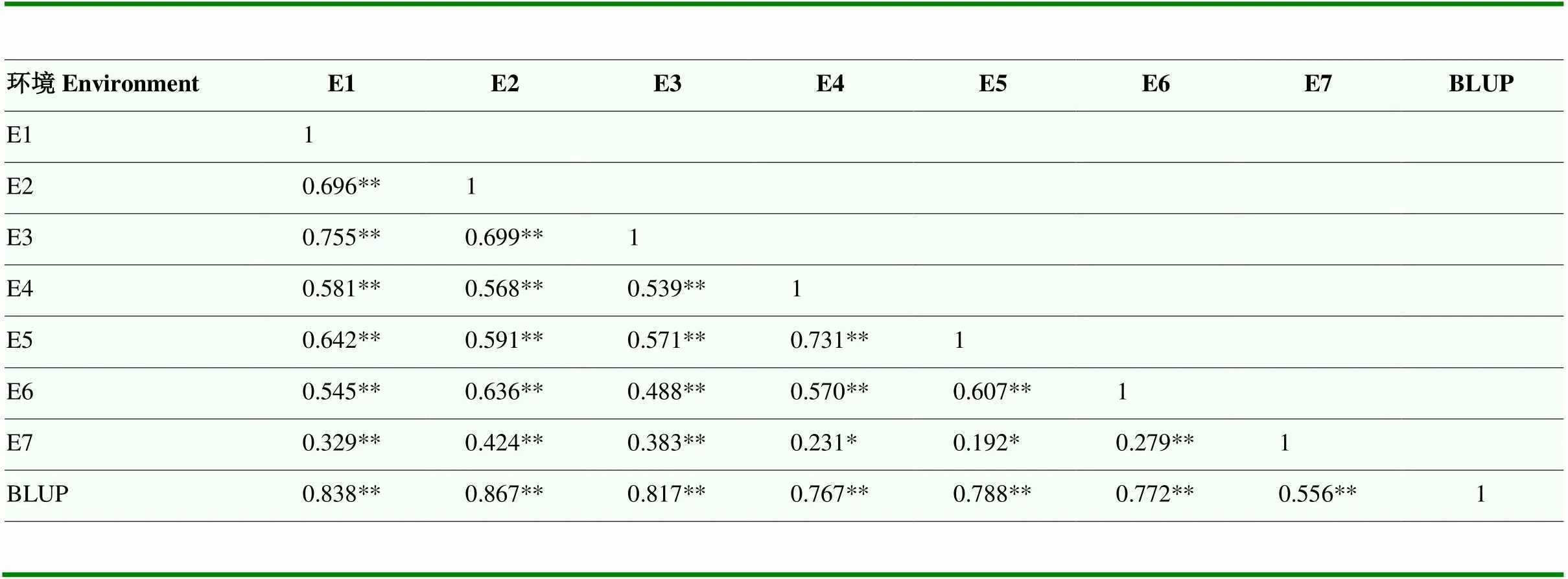
表2 2SY群体的穗长在不同环境中的相关性
*:在0.05水平差异显著 *: The significant difference at 0.05 levels
2.2 非条件QTL定位和效应分析
基于2SY群体已有的遗传连锁图谱[22],结合2年7个环境的穗长表型数据,共鉴定到13个控制穗长的非条件QTL,分布在1A、1D、2B、2D、4B、6D和7A染色体,贡献率为5.35%—12.77%(表3)。其中,可在E4、E5和BLUP中检测到,提供了6.54%—11.72%的贡献率,正效应位点来源于SY95-71;可在E1、E4和BLUP中检测到,贡献率为10.16%—12.57%,正效应等位位点来源于20828;可在E3、E4和E5中检测到,提供5.35%—10.92%的贡献率,正效应位点来源于20828。同时,、和可在多环境分析中检测到的,表明这3个QTL不易受环境影响,为稳定的主效QTL(表4)。其余10个非条件QTL仅能在单个环境中检测到,易受环境影响,贡献率为7.26%—12.77%(表3)。
E1:2017年中国四川省成都市温江区试验基地;E2:2017年中国四川省崇州市试验基地;E3:2017年中国四川省雅安市试验基地;E4:2018年中国四川省成都市温江区试验基地;E5:2018年中国四川省崇州市试验基地;E6:2018年中国四川省雅安市试验基地;E7:2018年孟加拉国库尔纳市试验田
利用主效QTL侧翼标记的基因型,将RIL分为携带和不携带目标QTL增效位点的2种类型。结合穗长数据的BLUP对其主效QTL的聚合效应进行分析(图3)。结果表明,仅携带或单个主效QTL增效位点株系的穗长显著长于不携带任何QTL增效位点的株系;携带任意2个主效QTL增效位点株系的穗长均显著长于不含任何QTL增效位点的株系;携带和或和增效位点株系的穗长显著长于仅含增效位点的株系;同时携带、和增效位点株系的穗长显著长于携带任意2个主效QTL株系或仅含单个主效QTL增效位点株系的穗长(图3)。同时,结合2SY群体株高、穗茎长、每穗小穗数和千粒重数据的BLUP,分析主效QTL对其可能存在的影响(图4)。结果发现对于株高、穗茎长、每穗小穗数和千粒重均没有显著影响。对于千粒重有显著影响(<0.05),达到3.98%,而对于株高、穗茎长和每穗小穗数没有显著影响。对于株高和穗茎长有极显著影响(<0.05),分别达到-12.28%和-22.26%,而对于每穗小穗数和千粒重没有显著影响(图4)。
2.3 条件QTL分析
分别以2个株型相关性状株高、穗茎长以及2个产量相关性状每穗小穗数和千粒重的BLUP为条件,对穗长进行条件QTL分析。通过比较穗长的BLUP在条件与非条件下QTL之间加性效应值和LOD值的变化,分析株高、穗茎长、每穗小穗数和千粒重与穗长之间的遗传关系(表5)。
在条件QTL分析中,共检测到18个控制穗长的条件QTL,分布在2B、2D、4B、6B、7A和7D染色体上,贡献率为6.07%—12.29%(表5)。和无论在条件与非条件QTL中均可检测到。其中,在以株高和穗茎长为条件下的加性效应值和LOD值与非条件下相似,而在以每穗小穗数和千粒重为条件下的加性效应值和LOD值明显下降,表明与株高和穗茎长无关,而受到每穗小穗数和千粒重的影响。在以穗茎长、每穗小穗数和千粒重为条件下的加性效应值和LOD值与非条件下相似,而在以株高为条件下时明显下降,表明与穗茎长、每穗小穗数和千粒重无关,但受到株高的影响(表5)。在非条件下的BLUP中未检测到,而在以株高和每穗小穗数为条件下能够检测到,以穗茎长和千粒重为条件下未检测到,表明其与穗茎长和千粒重无关,而受到了株高和小穗数的影响(表5)。
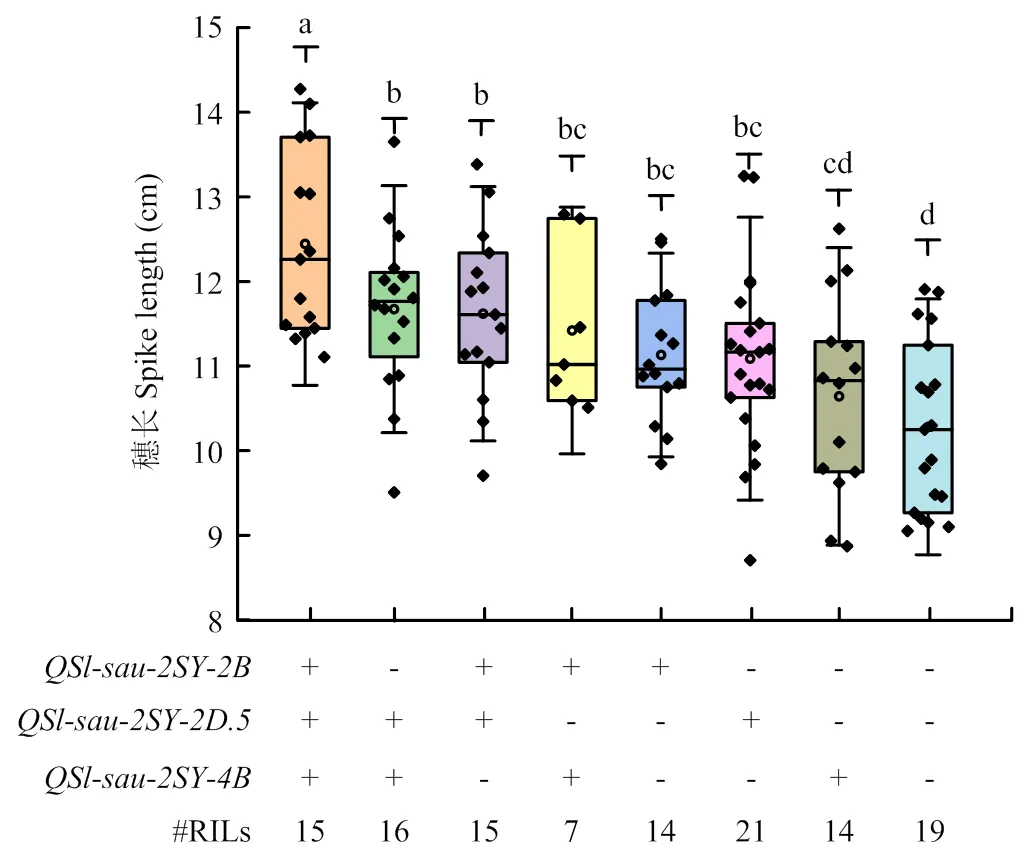
+和−:携带和不携带目标QTL增效位点的株系;#RILs:相应株系的数量;a、b、c和d代表显著性差异。下同
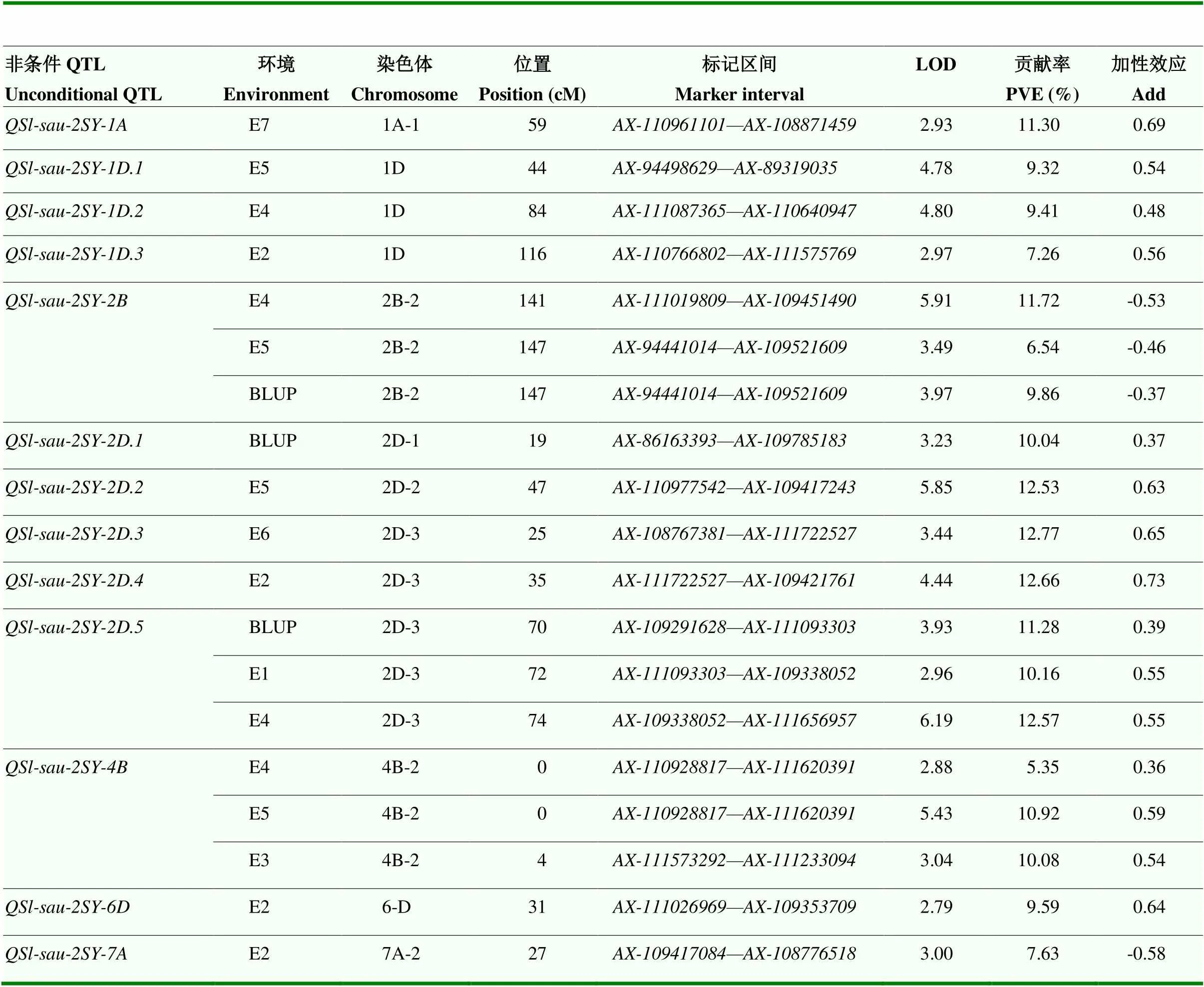
表3 2SY群体穗长的非条件QTL
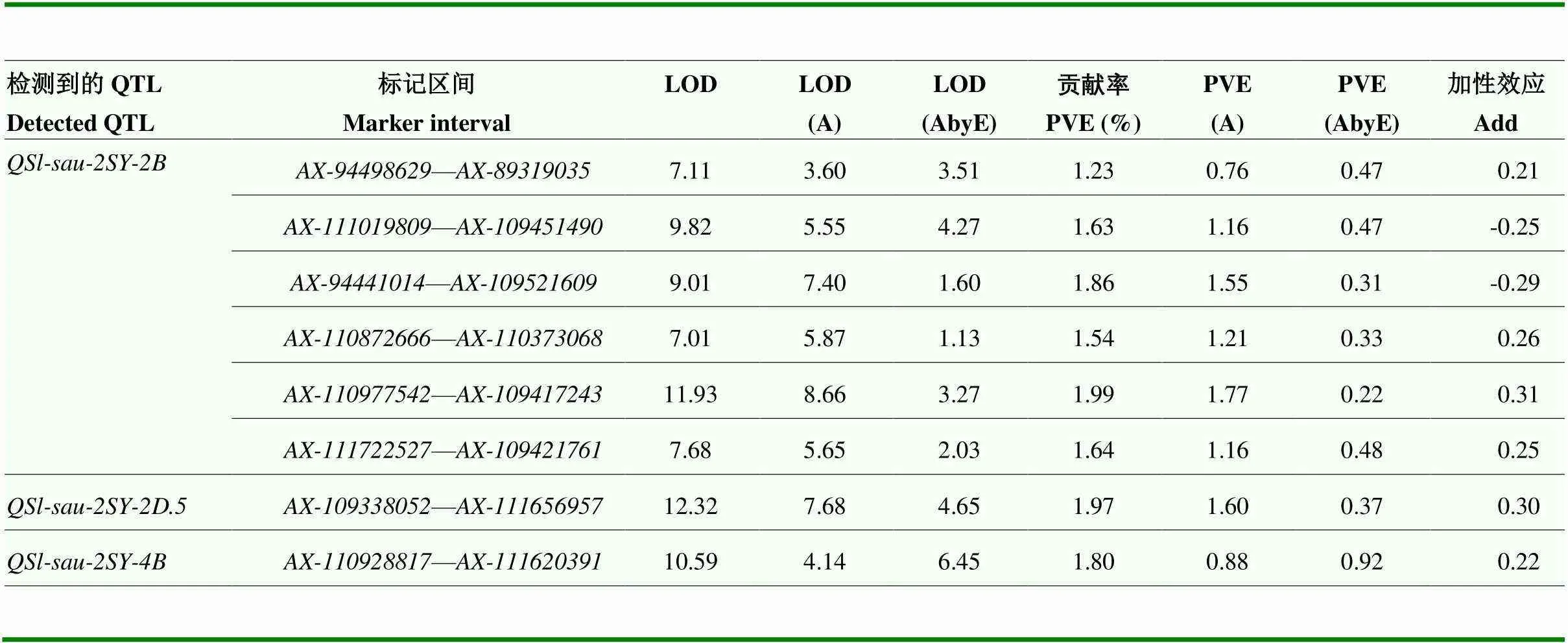
表4 2SY群体穗长的多环境QTL
LOD(A):显性和加性效应;LOD(AbyE):环境对加性和显性效应的影响;PVE(A):加性和显性效应的贡献率;PVE(AbyE):环境对加性和显性效应的贡献率
LOD(A): Dominant and additive effects; LOD(AbyE): The influence of environment on additive and dominant effects; PVE(A): Contribution of additive and dominant effects; PVE(AbyE): Contribution of environment to additive and dominant effects
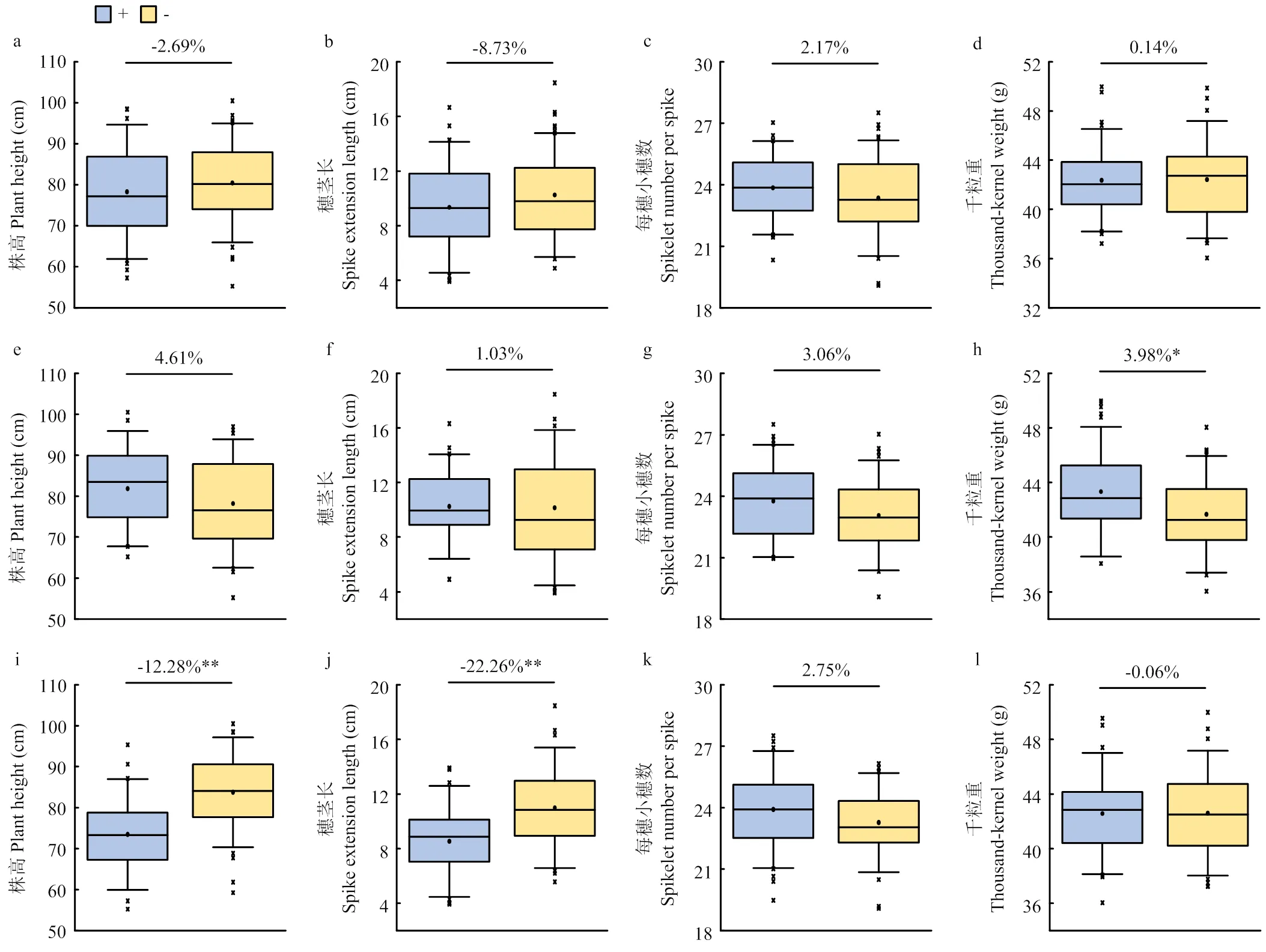
a—d:QSl-sau-2SY-2B对于株高、穗茎长、每穗小穗数和千粒重的影响,+:包含50个株系,−:包含60个株系。e—h:QSl-sau-2SY-2D.5对于株高、穗茎长、每穗小穗数和千粒重的影响,+:包含40个株系,−:包含46个株系。i—l:QSl-sau-2SY-4B对于株高、穗茎长、每穗小穗数和千粒重的影响,+:包含43个株系,−:包含61个株系。*和**:在0.05和0.01水平上差异显著
3 讨论
3.1 与前人研究的比较分析
比较本研究中穗长的主效QTL与前人研究已报道的QTL在中国春参考基因组2.1[24]上的物理位置时,发现定位于标记之间,与[25]、[26]和[8]等均无重叠部分,因此,可能是新的QTL位点。定位于标记之间,定位于标记之间,分别与李聪等[27]研究中的和物理位置有重叠的部分,且均使用共同亲本20828构建的群体,说明这些QTL极有可能是同一位点,侧面验证了其真实性和有效性。
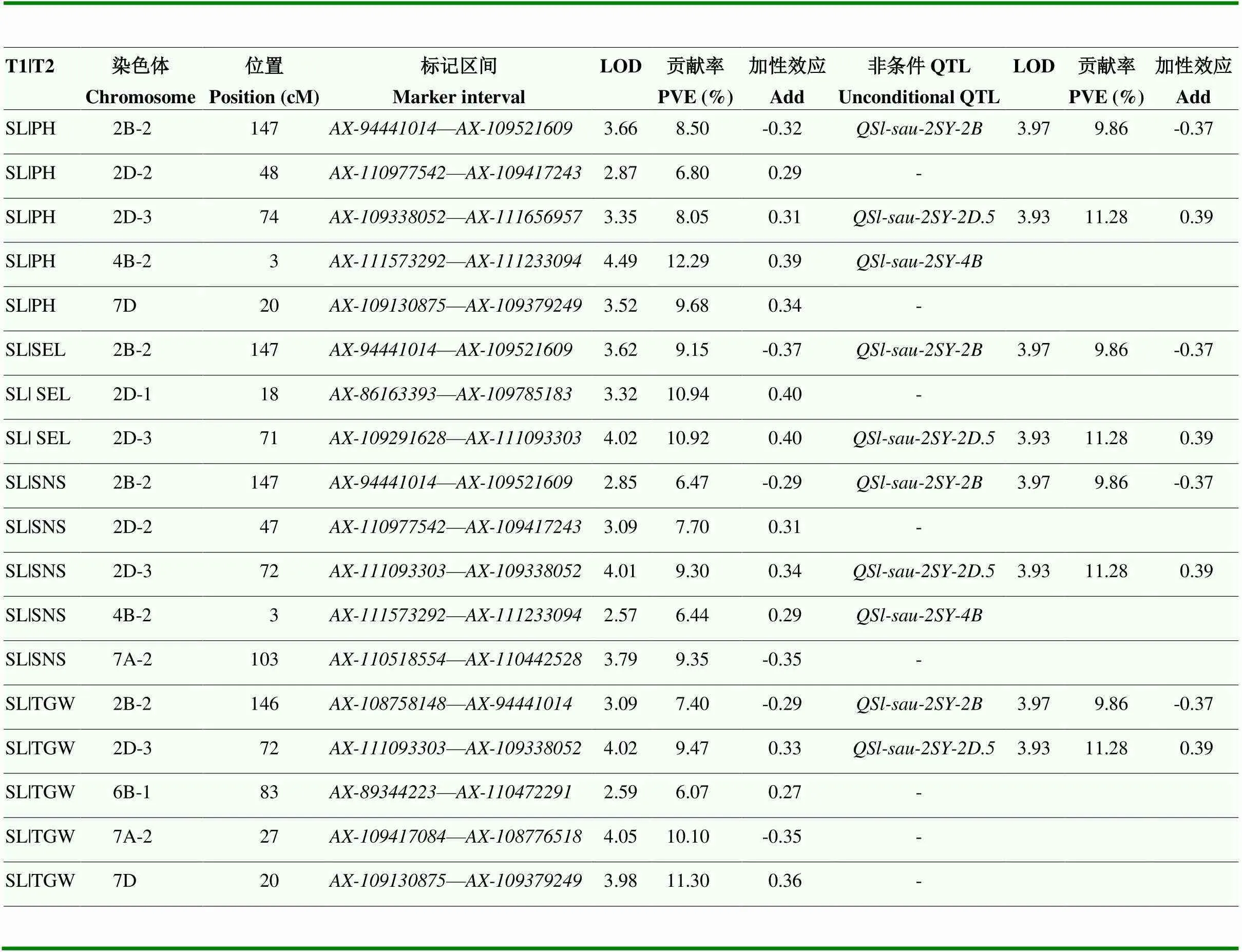
表5 2SY群体穗长的条件QTL条件
T1|T2:条件表型值;SL|PH、SL|SEL、SL|SNS和SL|TGW:以株高、穗茎长、每穗小穗数和千粒重为条件下的穗长条件表型值;-:条件QTL结果中没有相应的主效非条件QTL;非条件QTL的LOD、PVE和Add为BLUP下的结果
T1|T2: Conditional phenotype values; SL|PH, SL|SEL, SL|SNS and SL|TGW: The conditional phenotypic values of spike length under the conditions of plant height, spike extension length, spikelet number per spike and thousand-kernel weight; -: There was no corresponding major unconditional QTL in conditional QTL results; LOD, PVE and Add of unconditional QTL was calculated based on BLUP
穗长和株型、产量相关农艺性状之间有着很强的关联性,控制其相关的基因也是高度相关的,甚至由同一基因调控[28]。因此,比较与2B染色体上的[29]、与4B染色体上的[30]的物理位置,发现它们的距离非常接近,有可能为同一位点。同时,发现本研究中穗长的主效位点与株高的主效位点[22]和穗茎长的主效位点[12]存在共定位,而与每穗小穗数的主效位点[21]、千粒重的主效位点[23]没有共定位。对于这些“一因多效”的位点,还需进一步深入挖掘基因来探索其关系。
3.2 聚合育种的前景
聚合育种在聚合不同抗性基因方面的研究很多。由于生理小种的多样和环境的复杂,仅含单个抗病基因的品种抗性并不能长久维持,因此聚合多个抗病基因有利于提高品种抗病的广谱性和持久性[31-32]。相对应的,大多数QTL的遗传效应不高,被运用到分子辅助选择育种时,会出现表型提升不够显著的情况,而聚合育种是有效提高分子辅助效率的手段之一。例如,Qu等[23]利用侧翼标记基因型,分析3个粒长QTL的聚合效应,发现同时携带3个主效QTL可以显著提升表型。在本研究非条件QTL定位的3个主效穗长QTL中,仅携带1个主效QTL增效位点时的效应最大;聚合2个QTL增效位点时选择和对表型有显著提升;同时聚合、和增效位点的株系穗长表型显著长于聚合任意2个主效QTL或仅含单个主效QTL增效位点的株系(图3)。这一结果进一步说明了聚合育种可以促进穗长的遗传改良。然而,聚合多个QTL来提升表型并非基因的简单累加,基因具体如何起到作用仍需深入探究其分子机制才能揭示其原理。
3.3 穗长与其他农艺性状的遗传关系
小麦产量相关农艺性状的遗传基础非常复杂,受到众多性状的影响和调节,使用条件QTL分析方法可以从QTL水平解析性状与其构成因素之间的遗传关系[13, 33-34]。例如,Cui等[16]基于2个定位群体的条件QTL分析株高与其组成成分穗长和节间长之间的遗传关系,结果表明,在QTL水平上,穗长对株高的贡献最小,其次是第一节间长度;第二节间长度对株高的影响最大,第三节间长度和第四节间长度次之。而本研究基于穗长的条件QTL结果,分析穗长与2个株型相关性状株高、穗茎长以及2个产量相关性状每穗小穗数、千粒重之间的遗传关系。结果表明,在QTL水平上,与株高和穗茎长无关,但受到每穗小穗数和千粒重的影响。与穗茎长、每穗小穗数和千粒重无关,但受到株高的影响。与穗茎长和千粒重无关,但受到株高和每穗小穗数的影响。此外,利用穗长主效位点、和紧密连锁的侧翼标记基因型分析它们对于其他农艺性状的影响。发现对于株高、穗茎长、每穗小穗数和千粒重没有显著影响,对于千粒重有显著影响,对于株高和穗茎长有极显著影响,表明是一个单独控制穗长的QTL,可能有助于产量的提升,在影响株型的方面起着重要作用。穗长与株高、穗茎长、每穗小穗数和千粒重在QTL水平上遗传关系的揭示,结合非条件QTL的分析结果,加深了对穗长遗传基础的认识,可为未来穗长的遗传改良提供理论依据。
4 结论
定位到3个控制穗长且稳定遗传的主效QTL——、和,贡献率分别为6.54%—11.72%、10.16%—12.57%和5.35%—10.92%。其中,可能为新的QTL。聚合这3个主效QTL增效位点的株系穗长表型显著长于聚合任意2个主效QTL或仅含单个主效QTL增效位点的株系。对于株高、穗茎长、每穗小穗数和千粒重没有显著影响,对于千粒重有显著影响,对于株高和穗茎长有极显著影响。在QTL水平上,独立于株高和穗茎长遗传,独立于穗茎长、每穗小穗数和千粒重遗传,独立于穗茎长和千粒重遗传。
[1] SHIFERAW B, SMALE M, BRAUN H J, DUVEILLER E, REYNOLDS M, MURICHO G.Crops that feed the world 10.Past successes and future challenges to the role played by wheat in global food security.Food Security, 2013, 5(3): 291-317.
[2] YANG Y, KRISHNA K, DESHPANDE P, RANGANATHAN V, JAYARAMAN V, WANG T, BEI K, KRISHNAMURTHY H.High frequency of extractable nuclear autoantibodies in wheat-related disorders.Biomarker Insights, 2018, 13: 1-6.
[3] FAROOQ J, KHALIQ I, AKBAR M, PETRESCU-MAG I V, HUSSAIN M.Genetic analysis of some grain yield and its attributes at high temperature stress in wheat (L.).Ann RSCB, 2015, 19(3): 71-81.
[4] MAUREEN T N, JACOB M, HUSSEIN S, ALFRED O.Agronomic and physiological traits, and associated quantitative trait loci (QTL) affecting yield response in wheat (L.): A review.Frontiers in plant science, 2019, 10: 1428.
[5] JI G S, XU Z B, FAN X L, ZHOU Q, YU Q, LIU X F, LIAO S M, FENG B, WANG T.Identification of a major and stable QTL on chromosome 5A confers spike length in wheat (L.).Molecular Breeding, 2021, 41(9): 1-13.
[6] LI T, DENG G B, SU Y, YANG Z, TANG Y Y, WANG J H.QIU X B, PU X, LI J, LIU Z H, ZHANG H L, LIANG J J, YANG W Y, YU M Q, WEI Y M, LONG H.Identification and validation of two major QTLs for spike compactness and length in bread wheat (L.) showing pleiotropic effects on yield-related traits.Theoretical and Applied Genetics, 2021, 134: 3625-3641.
[7] ZHOU Y, CONWAY B, MILLER D, MARSHALL D, COOPER A, MURPHY P, CHAO S, BROWN-GUEDIRA G, COSTA J.Quantitative trait loci mapping for spike characteristics in hexaploid wheat.The Plant Genome, 2017, 10(2): plantgenome2016.10.0101.
[8] LIU J, XU Z B, FAN X L, ZHOU Q, CAO J, WANG F, JI G S, YANG L, FENG B, WANG T.A genome-wide association study of wheat
spike related traits in China.Frontiers in plant science, 2018, 9: 1584.
[9] ZHAI H J, FENG Z U, LI J, LIU X Y, XIAO S H, NI Z F, SUN Q X.QTL analysis of spike morphological traits and plant height in winter wheat (L.) using a high-density SNP and SSR-based linkage map.Frontiers in plant science, 2016, 7: 1617.
[10] GUO L B, XING Y Z, MEI H W, XU C G, SHI C H, WU P, LUO L J.Dissection of component QTL expression in yield formation in rice.Plant Breeding, 2005, 124(2): 127-132.
[11] CUI F, ZHAO C H, LI J, DING A M, LI X F, BAO Y G, LI J M, JI J, WANG H G.Kernel weight per spike: what contributes to it at the individual QTL level? Molecular Breeding, 2013, 31(2): 265-278.
[12] LI C, TANG H P, LUO W, ZHANG X M, MU Y, DENG M, LIU Y X, JIANG Q T, CHEN G D, WANG J R, QI P F, PU Z E, JIANG Y F, WEI Y M, ZHENG Y L, LAN X J, MA J.A novel, validated, and plant height-independent QTL for spike extension length is associated with yield-related traits in wheat.Theoretical and Applied Genetics, 2020, 133(12): 3381-3393.
[13] ZHANG H, CHEN J S, LI R Y, DENG Z Y, ZHANG K P, LIU B, TIAN J C.Conditional QTL mapping of three yield components in common wheat (L.).The Crop Journal, 2016, 4(3): 220-228.
[14] FAN X L, CUI F, JI J, ZHANG W, ZHAO X Q, LIU J J, MENG D Y, TONG Y P, WANG T, LI J M.Dissection of pleiotropic QTL regions controlling wheat spike characteristics under different nitrogen treatments using traditional and conditional QTL mapping.Frontiers in plant science, 2019, 10: 187.
[15] AGATA A, ANDO K, OTA S, KOJIMA M, TAKEBAYASHI Y, TAKEHARA S,DOI K, UEGUCHI-TANAKA M, SUZUKI T, SAKAKIBARA H, MATSUOKA M, ASHIKARI M, INUKAI Y, KITANO H, HOBO T.Diverse panicle architecture results from various combinations ofandalleles.Communications biology, 2020, 3(1): 1-17.
[16] CUI F, LI J, DING A M, ZHAO C H, WANG L, WANG X Q, LI S S, BAO Y G, LI S F, FENG D S, KONG L G, WANG H G.Conditional QTL mapping for plant height with respect to the length of the spike and internode in two mapping populations of wheat.Theoretical and Applied Genetics, 2011, 122(8): 1517-1536.
[17] YU M, MAO S L, CHEN G Y, PU Z E, WEI Y M, ZHENG Y L.QTLs for uppermost internode and spike length in two wheat RIL populations and their affect upon plant height at an individual QTL level.Euphytica, 2014, 200(1): 95-108.
[18] SU Q N, ZHANG X L, ZHANG W, ZHANG N, SONG L, LIU L Q, LIU L, XUE X, LIUG T, LIU J J, MENG D Y, ZHI L Y, JI J, ZHAO X Q, YANG C L, TONG Y P, LIU Z Y, LI J M.QTL detection for kernel size and weight in bread wheat (L.) using a high-density SNP and SSR-based linkage map.Frontiers in plant science, 2018, 9: 1484.
[19] MA J, QIN N N, CAI B, CHEN G Y, DING P Y, ZHANG H, YANG C C, HUANG L, MU Y, TANG H P, LIU Y X WANG J R, QI P F, JIANG Q T, ZHENG Y L, LIU C J, LAN X J, WEI Y M.Identification and validation of a novel major QTL for all-stage stripe rust resistance on 1BL in the winter wheat line 20828.Theoretical and Applied Genetics, 2019, 132(5): 1363-1373.
[20] 舒焕麟, 杨足君, 李光蓉.创新诱发材料SY95-71选育和利用价值研究.四川农业大学学报, 1999, 17(3): 249-253.
SHU H L, YANG Z J, LI G R.Selection and evaluation of a wheat line SY95-71 as new yellow rust spreader.Journal of Sichuan Agricultural University, 1999, 17(3): 249-253.(in Chinese)
[21] Ding P Y, Mo Z Q, Tang H P, Mu Y, Deng M, Jiang Q T, Liu Y X, Chen G D, Chen G Y, Wang J R, Li W, Qi P F, Jiang Y F, Kang H Y, Yan G J, Wei Y M, Zheng Y L, Lan X J, Ma J.A major and stable QTL for wheat spikelet number per spike was validated in different genetic backgrounds.Journal of Integrative Agriculture, 2021.doi: 10.1016/S2095-3119(20)63602-4.
[22] LIU J J, TANG H P, QU X R, LIU H, LI C, TU Y, LI S Q, HABIB A, MU Y, DAI S F, DENG M, JIANG Q T, LIU Y X, CHEN G Y, WANG J R, CHEN G D, LI W, JIANG Y F, WEI Y M, LAN X J, ZHENG Y L, MA J.A novel, major, and validated QTL for the effective tiller number located on chromosome arm 1BL in bread wheat.Plant Molecular Biology, 2020, 104(1): 173-185.
[23] QU X R, LIU J J, XIE X L, XU Q, TANG H P, MU Y, PU Z E, LI Y, MA J, GAO Y T, JIANG Q T, LIU Y X, CHEN G Y, WANG J R, QI P F, HABIB A, WEI Y M, ZHENG Y L, LAN X J, MA J.Genetic mapping and validation of loci for kernel-related traits in wheat (L.).Frontiers in Plant Science, 2021, 12: 667493.
[24] Zhu T, Wang L, Rimbert H, Rodriguez J C, Deal K R, De Oliveira R, Choulet F, Keeble-Gagnere G, Tibbits J, Rogers J, Eversole K, Appels R, Gu Y Q, Mascher M, Dvorak J, Luo M C.Optical maps refine the bread wheatcv.Chinese Spring genome assembly.The Plant Journal, 2021, 107: 303-314.
[25] PRETINI N, VANZETTI L S, TERRILE I I, DONAIRE G, González F G.Mapping QTL for spike fertility and related traits in two doubled haploid wheat (L.) populations.BMC Plant Biology, 2021, 21(1): 1-18.
[26] XU Y F, LI S S, LI L H, MA F F, FU X Y, SHI Z L, XU H X, MA P T, AN D G.QTL mapping for yield and photosynthetic related traits under different water regimes in wheat.Molecular breeding, 2017, 37(3): 34.
[27] 李聪, 马建, 刘航, 丁浦洋, 杨聪聪, 张涵.兰秀锦.基于小麦55K SNP芯片检测小麦穗长和株高性状QTL.麦类作物学报, 2019, 39(11): 1284-1292.
LI C, MA J, LIU H, DING P Y, YANG C C, ZHANG H, LAN X J.Detection of QTLs for spike length and plant height in wheat based on 55K SNP array.Journal of Triticeae Crops, 2019, 39(11): 1284-1292.(in Chinese)
[28] MWADZINGENI L, SHIMELIS H, REES D J G, TSILO T J.Genome-wide association analysis of agronomic traits in wheat under drought-stressed and non-stressed conditions.PloS one, 2017, 12(2): e0171692.
[29] ELLIS M, REBETZKE G, AZANZA F, RICHARDS R, SPIELMEYER W.Molecular mapping of gibberellin-responsive dwarfing genes in bread wheat.Theoretical and Applied Genetics, 2005, 111(3): 423-430.
[30] REBETZKE G, APPELS R, MORRISON A, RICHARDS R, MCDONALD G, ELLIS M, SPIELMEYER W, BONNETT D.Quantitative trait loci on chromosome 4B for coleoptile length and early vigour in wheat (L.).Australian Journal of Agricultural Research, 2001, 52(12): 1221-1234.
[31] 邹拓, 耿雷跃, 张薇, 张启星.水稻抗病虫基因挖掘及聚合育种研究进展.河北农业科学, 2018, 22(5): 47-67.
ZOU T, GENG L Y, ZHANG W, ZHANG Q X.Research advances on gene mining resistant to disease and insect and polymerization breeding of rice.Journal of Hebei Agricultural Sciences, 2018, 22(5): 47-67.(in Chinese)
[32] 鲁秀梅, 张宁, 陈劲枫, 钱春桃.作物基因聚合育种的研究进展.分子植物育种, 2017, 15(4): 1445-1454.
LU X M, ZHANG N, CHEN J F, QIAN C T.The research progress in crops pyramiding breeding.Molecular Plant Breeding, 2017, 15(4): 1445-1454.(in Chinese)
[33] LI Q F, ZHANG Y, LIU T T, WANG F F, LIU K, CHEN J S, TIAN J C.Genetic analysis of kernel weight and kernel size in wheat (L.) using unconditional and conditional QTL mapping.Molecular Breeding, 2015, 35(10): 1-15.
[34] LIU K Y, XU H, LIU G, GUAN P F, ZHOU X Y, PENG H R, NI Z F, SUN Q X, DU J K.QTL mapping of flag leaf-related traits in wheat (L.).Theoretical and applied genetics, 2018, 131(4): 839-849.
Unconditional and Conditional QTL Analysis of Wheat Spike Length in common wheat based on 55K SNP Array
TANG HuaPing1, CHEN HuangXin1, LI Cong1, GOU LuLu1, TAN Cui2, MU Yang1, TANG LiWei3, LAN XiuJin1, WEI YuMing1, MA Jian1*
1Triticeae Research Institute, Sichuan Agricultural University, Chengdu 611130;2Institute of Animal Nutrition, Sichuan Agricultural University, Chengdu 611130;3PanZhiHua Academy of Agricultural and Forestry Sciences, Panzhihua 617061, Sichuan
【Objective】This study is to excavate spike length (SL)-related quantitative trait loci (QTL) with potential breeding value, explore the genetic relationship between SL and other important agronomic traits in wheat, and aim at laying a foundation for fine mapping and molecular-assisted selection breeding.【Method】A total of 126 F7recombinant inbred lines (RIL) constructed by crossing 20828 and SY95-71 were used in this study.The RIL population including their parents were planted in seven different environments for phenotypic evaluation: Wenjiang, Chongzhou, Ya'an of Sichuan Province in China, and Khulna in Bangladesh during 2016-2017 and 2017-2018 growing seasons.Unconditional QTL mapping was performed using a genetic linkage map constructed using the wheat 55K SNP array, and QTLs’ effects were further analyzed.Conditional QTL analysis was performed to analyze the relationship between SL and other agronomic traits including plant height (PH), spike extension length (SEL), spikelet number per spike (SNS) and thousand-kernel weight (TKW).【Result】Thirteen QTLs controlling SL were identified using unconditional QTL mapping, and they were located on chromosomes 1A, 1D, 2B, 2D, 4B, 6D, and 7A.The LOD values ranged from 2.79 to 6.19, and the phenotypic variation rate ranged from 5.35% to 12.77%.Three stable and major QTLs (,and) were identified, and they explained 6.54% to 11.72%, 10.16% to 12.57%, and 5.35% to 10.92% of phenotypic variation rate, respectively.Furthermore, these three major QTLs could be also detected in multi-environment analysis.Moreover, aggregation analysis suggested that the SL of lines polymerizing the positive allels at these three major QTLs was significantly longer than that of those with any two ones or those carrying only one.Meanwhile, it was found thathad no significant effect on PH, SEL, SNS and TKW.had a significant effect on improving TKW (3.98%), but no significant effect on PH, SEL and SNS.had a significant effect on decreasing PH (-12.28%) and SEL (-22.26%), but no significant effect on SNS and TKW.The conditional QTL analysis showed thatwas independent of PH and SEL, whereas, affected by SNS and TKW.was independent of SEL, SNS and TKW, but affected by PH.was independent of SEL and TKW, but affected by PH and SNS.【Conclusion】In this study, three stable and major QTLs were identified for SL:,,and, among whichmay be a novel QTL independent of PH and SEL.
common wheat; 55K SNP array; spike length; unconditional QTL; conditional QTL
2021-10-20;
2021-12-16
四川省国际合作交流项目(2021YFH0083)、四川省应用基础研究计划(2021YJ0503)
唐华苹,E-mail:707952940@qq.com。陈黄鑫,E-mail:1252153393@qq.com。唐华苹和陈黄鑫为同等贡献作者。通信作者马建,E-mail:jianma@sicau.edu.cn
(责任编辑 李莉)
