重症急性胰腺炎预防与阻断急诊专家共识
2022-05-16中国医疗保健国际交流促进会急诊医学分会脓毒症预防与阻断联盟
中国医疗保健国际交流促进会急诊医学分会, 脓毒症预防与阻断联盟
执笔者:郭 喆, 关 键
急性胰腺炎(acute pancreatitis, AP)是急诊科常见的疾病,也是易导致器官功能障碍和病死率较高的疾病之一。急性胰腺炎被定义为因胰酶异常激活对胰腺自身及周围器官产生消化作用而引起的,以胰腺局部炎性反应为主要特征,甚至导致器官功能障碍的急腹症[1]。目前急性胰腺炎的诊治多遵从胰腺外科、消化内科及重症医学科的相关指南和标准,包括诊断、病情分级及临床治疗方案制定。临床上将急性胰腺炎分为轻症急性胰腺炎(mild acute pancreatitis, MAP)、中度重症急性胰腺炎(moderately severe acute pancreatitis, MSAP)和重症急性胰腺炎(severe acute pancreatitis, SAP),其分类标准是以“就诊48小时内是否存在器官功能衰竭”进行判别。不同严重程度急性胰腺炎的病死率有明显差异,早期积极有效处理对预后有明显的改善。但这种“滞后性”的诊断与分类,无法为急诊科在前期对急性胰腺炎的诊治提供帮助。基于此,经中国医疗保健国际交流促进会急诊医学分会组织急诊医学专家共同起草本共识,旨在为急诊科对急性胰腺炎的分级诊疗提供规范化指导。
本共识适用于在急诊科就诊的急性胰腺炎患者的早期处理,以及以腹痛为主诉就诊但尚未明确诊断患者的鉴别,针对急性胰腺炎的排查和评估。共识广泛参考既往各学科关于急性胰腺炎的指南、共识,并采用文献分析、专家讨论等方法,最终建议以专家组不记名评分的方法得出。
1 急性胰腺炎的流行病学
1.1急性胰腺炎的发病率与病死率
急性胰腺炎是以急性腹痛为主诉在急诊科就诊的常见病种之一,急诊科有0.3%的患者初步诊断为急性胰腺炎[2]。流行病学调查显示,美国急性胰腺炎的发病率为(13~45)/10万人[3],每年收治患者近28万人,是医院内死亡的第五大主要因素,年诊治花费超过26亿美元[4- 5]。我国2006年的一项全国多中心调查发现[6],急性胰腺炎的总病死率可达4.6%,73.9%的患者死亡发生在入院后2周内;在1743例(28.0%)被诊断为SAP 的患者中,住院病死率更高达15.6%。
随着急性胰腺炎诊疗的日趋规范,其相关病死率和平均住院时间均呈下降趋势。有文章报道,2001~2014年间急性胰腺炎的病死率在从1.68%下降到0.69%,但在65岁以上的人群中,急性胰腺炎住院病死率仍居高不下(3.4%)[7]。另外一篇关于急诊科诊治的急性胰腺炎统计发现,2006~2012年间因急性胰腺炎住院率从76.2%降至72.7%,停留时间也由5.36天减少至4.64天[8]。这说明急诊科在急性胰腺炎治疗中起到的作用越来越大。
依病理表现,急性胰腺炎被分为间质水肿型和坏死型两个类型。前者更多见,通常是MAP;后者虽然较少(5%~10%),但主要是MSAP或SAP[9]。一项回顾性多中心研究[10]发现,MAP、MSAP和SAP的占比分别为73.4%、13.5%和13.1%,但病死率分别为0.3%、3.1%、14.3%。同时急性胰腺炎也是一个复发率较高的疾病。一项纳入243 816例的研究[11-12]显示,急性胰腺炎患者30天再入院率高达16.2%,其中7.2%的患者为急性胰腺炎复发,早期识别危险因素并给予积极干预治疗可降低再次入院率。
专家推荐1:急性胰腺炎是急诊科常见的疾病之一,SAP病死率高,需要急诊科医生在首诊时即引起关注。(证据等级:高;推荐强度:强)
专家推荐2:对急性胰腺炎进行早期、规范化诊疗,可有效降低病死率和复发率。(证据等级:高;推荐强度:强)
1.2急性胰腺炎的致病因素
在不同的研究中,引起急性胰腺炎的病因占比略有不同。一篇对急诊就诊的急性胰腺炎患者的分析中,常见原因包括胆道疾病(36%)、特发性胰腺炎(16%)、药物因素(13%)和酒精滥用(11%),酒精性胰腺炎多见于男性,而胆源性胰腺炎多见于女性。其他研究的共同结论是胆结石是引起急性胰腺炎最重要的危险因素,高达40%左右[3, 13]。酗酒引起的急性胰腺炎可达30%,特别是长期大量饮酒,成为第二位致病因素[13-14]。其他原因还包括5%~10%的内镜逆行胰胆管造影(ERCP)、高甘油三酯血症(2%~5%)、药物(5%)等[13]。此外,肥胖和吸烟也是急性胰腺炎的独立危险因素。肥胖者比正常体重人群患急性胰腺炎的风险高30%,并且局部或全身并发症及死亡风险增加超过80%[15]。
1.3引发SAP的可能因素
急性胰腺炎患者中约10%~20%会进展为SAP。影响急性胰腺炎患者生存的指标包括疾病的严重程度、胰腺坏死的程度和伴随器官衰竭的情况。在大多数情况下,MAP可以自愈。但在急诊首诊时哪些患者可以发展为SAP并不明确,如何早期识别可能发展为SAP的患者是急诊医生面临的巨大挑战。判断急性胰腺炎是否发展为SAP的因素包括局部因素和全身因素。就诊时胰腺及其周围组织出现坏死迹象或有全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)均提示患者可能发展为SAP,而持续性 SIRS是导致器官衰竭和病死率升高的主要因素[16]。肥胖及中心性脂肪分布是另一个导致急性胰腺炎进展为SAP的危险因素。脂肪组织可以分泌大量脂肪因子,加重患者全身炎症反应。中心性脂肪分布患者也可以出现胰腺周围脂肪组织的液化、坏死,更容易进展为SAP[17]。众多研究还证实,高龄、共存疾病、体重指数(BMI)>30 kg/m2(亚洲患者BMI>25 kg/m2)、胸腔积液、血细胞比容(HCT)升高、尿素氮(BUN)和肌酐水平不断升高等都可能是发生SAP的前兆[18]。另有研究[19]显示,C反应蛋白(CRP)、降钙素原(PCT)、红细胞沉降率(ESR)的升高也有助于SAP的预判。
2 急性胰腺炎的表现及急诊诊断
2.1急性胰腺炎的表现
2.1.1 临床表现 急性胰腺炎的主要临床表现是腹痛,其腹痛的特征性表现见表1。但临床研究[20]表明,急性胰腺炎患者腹痛的程度及部位与病情严重程度缺乏相关性。

表1 急性胰腺炎腹痛特征
2.1.2 实验室检查 在胰腺出现炎症时,淀粉酶、脂肪酶、弹性蛋白酶和胰蛋白酶同时释放到血液中,但几种酶的清除率不同,其升高程度随采血时间的不同有所差异。血清淀粉酶通常在6~24小时升高,48小时达到峰值,3~7天下降到正常或接近正常水平[18, 20]。血清脂肪酶升高持续时间比淀粉酶长,通常4~8小时升高,24小时达到峰值,8~14天下降到正常或接近正常水平。通常认为,血清脂肪酶比血清淀粉酶对急性胰腺炎的诊断更加可靠,主要原因在于其敏感度更高和时间窗更长[20]。
2.1.3 影像学检查 CT平扫和超声是急诊科诊断急性胰腺炎的重要辅助手段。改良的CT严重度指数评分(CTSI)用于评估急性胰腺炎的严重程度[21]。国外的研究[21-23]建议入院48小时内完成超声检查,以确定是否为胆源性急性胰腺炎。由于国内多数医院超声检查可以覆盖24小时,因此目前超声是急诊科诊断急性胰腺炎最常用的影像学检查。超声检查除确定胰腺局部病变程度外,还可以帮助确定是否存在胸腔积液,这也是急性胰腺炎严重度床旁指数(BISAP)评分中的一项指标。虽然胰腺增强CT和(或)MRI检查可以精确判断胰腺坏死和渗出的范围,并判断胰腺外并发症是否存在,但多数医院急诊科无法实现实时检查。
2.2急性胰腺炎的诊断标准
根据《中国急性胰腺炎诊治指南(2021)》[24],临床上符合以下3项中的2项即可诊断为急性胰腺炎:①上腹部持续性腹痛;②血清淀粉酶和(或) 脂肪酶浓度至少高于正常上限值3倍;③腹部影像学检查结果显示符合急性胰腺炎影像学改变。
急性胰腺炎早期和晚期都可以发生并发症,包括局部并发症和全身并发症。腹部超声或CT检查可发现早期胰腺及周围的局部病变,包括急性胰周液体积聚(acute peripancreatic fluid collection, APFC)、急性坏死性积聚(acute necrotic collection, ANC)。急性胰腺炎早期全身并发症通常始于SIRS,并可以发展为多器官功能障碍综合征(multiple organs disfunction syndrome, MODS)。此外,急性胰腺炎还可能引起腹腔内高压(intraabdominal hypertension, IAH)、腹腔间隔室综合征(abdominal compartment syndrome, ACS)和胰性脑病(pancreatic encephalopathy, PE);其他全身并发症还包括既往基础共存疾病(如冠状动脉疾病或慢性肺疾病)出现病情恶化等。
2.3急性胰腺炎的分类诊断
即急性胰腺炎患者病情分级。按照最新的《中国急性胰腺炎诊治指南(2021)》,根据在48小时内是否发生器官功能衰竭及持续情况,急性胰腺炎被分为MAP、MSAP、SAP(见表 2)。

表2 中国急性胰腺炎分类诊断及预后[24]
2.4急性胰腺炎的病因诊断
不同病因引起的急性胰腺炎风险也不同,特别是有胆结石、明显高脂血症等危险因素需要尽快查明并为针对性治疗做好应对。
专家推荐3:目前急性胰腺炎的分类诊断标准不利于急性胰腺炎早期诊治决策,建议在目前分类标准中增加“疑似重症急性胰腺炎(suspicious severe acute pancreatitis, SSAP)”的诊断。(证据等级:中;推荐强度:强)
专家推荐4:完善的急性胰腺炎诊疗体系应包括急性胰腺炎的诊断、SSAP的诊断、病因诊断和并发症诊断。(证据等级:中;推荐强度:强)
2.5急性胰腺炎合并感染
虽然急性胰腺炎在中、后期常有胰腺及胰腺周围坏死合并感染的风险,早期也有部分患者合并感染发生,且通常带来较差的预后,故早期判断急性胰腺炎是否合并感染极为重要[25]。此外,胆源性急性胰腺炎可能合并有胆囊炎及胆管炎,也是急诊科必须关注的要点之一。在急诊临床实践中,急性胰腺炎合并感染的主要判断依据是临床表现及相关辅助检查,包括发热、白细胞变化、CRP升高、PCT升高等。此外,白细胞介素-6(IL-6)、血清淀粉样蛋白(SAA)和肝素结合蛋白(HBP)变化也常常提示感染出现的可能性[26-27]。研究[28]发现,急性胰腺炎患者CRP≥150 mg/L预示着合并感染的可能性,可作为预测SAP的指标之一。PCT被认为是判断急性胰腺炎合并感染最敏感的实验室指标,PCT≥2.0 ng/mL提示患者合并感染甚至有发展为脓毒症的可能性[29]。另有研究[30]认为,血清PCT诊断SAP合并感染坏死的最佳节点为≥3.0 ng/mL。CD64是新发现的能够诊断感染性疾病的重要标志物,对于预测急性胰腺炎合并感染具有较好的应用价值,敏感性及特异性高,对早期感染性疾病有诊断价值,有望成为诊断感染性疾病的新指标[31]。有研究认为,BUN>7.5 mmol/L、HCT>44%、乳酸脱氢酶(LDH)和肌酐进行性升高也是急性胰腺炎合并感染及胰腺坏死的判断指标[32]。
3 急性胰腺炎急诊评分
3.1临床评分
及时、客观、准确的评估对于急诊科医生处理急性胰腺炎患者非常重要。在病程早期准确预测急性胰腺炎的严重程度和病情走势,识别可能发展为SAP的患者,及时给予支持治疗及转诊至ICU并采取特定的干预措施,对降低急性胰腺炎的病死率和并发症发生率、改善临床预后有重大意义。目前临床常用的评分包括针对急重症患者的通用评分和针对急性胰腺炎患者的专项评分(见表3)。不同评分系统对急性胰腺炎的预后判断有相似的预测精度,但Ranson评分等需在48小时后才能评估,因此无法对入院患者进行危险分层。日本严重度评分(JSS)项目多,操作复杂,临床应用受到限制[33]。在急诊科对急性胰腺炎患者的快速评估中,应结合急诊分诊的病情分级及胰腺炎专项病情严重程度的评估。BISAP评分(见表4)因其简单和指标可及性好更加适于急诊医疗场景,被认为是实用的预测SAP的方法[34]。

表3 急性胰腺炎病情判断评分系统

表4 急性胰腺炎严重度床旁指数(BISAP评分)标准
3.2影像学评分
CTSI(见表5)是胰腺局部病变的有效评分系统,通过CT检查确定局部病变的严重程度。目前腹部超声检查尚未有量化评分用于临床。

表5 CT严重度指数(CTSI)评分标准
4 胰腺分泌、全身炎症反应与器官功能不全
4.1胰腺自体保护

4.2SIRS
在胰腺组织细胞受损时,胰腺组织中潴留的单核巨噬细胞首先被激活,合成、释放多种细胞因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)、氧自由基(oxygen free radical, OFR)等,刺激粒细胞活化,并激活毛细血管内皮细胞,启动炎症反应。在众多细胞因子中TNF-α是出现较早、生物学效应最为广泛的一种细胞因子,起核心作用[36],也是引起 SIRS及全身并发症的关键要素。过量的 TNF-α进入血液循环,刺激其他细胞因子(IL-1、IL-6、IL-8 等)的产生,引起连锁放大反应,即所谓的“瀑布样级联反应”,导致炎症因子风暴。炎症因子风暴可致广泛内皮细胞受损、毛细血管渗漏综合征、间质水肿和微循环障碍。毛细血管渗漏和间质水肿是导致全身病变急剧加重的最重要因素,患者循环血量骤然下降,因而并发难治性分布性和低血容量休克。 总之,白细胞过度激活+炎症因子级联瀑布效应,最终导致患者发生SIRS和MODS。
SIRS的诊断标准为出现以下临床表现中的2项及以上:①心率>90次/分;②体温<36 ℃或>38 ℃;③血白细胞计数(WBC)<4×109/L或>12×109/L;④呼吸频率>20次/分或动脉二氧化碳分压(PaCO2)<32 mm Hg (1 mm Hg= 0.133 kPa)。
4.3MODS
MODS被定义为在急性疾病过程中出现两个或两个以上的器官或系统同时或序贯性的功能障碍或功能衰竭,以致机体内环境的稳定必须依靠临床干预才能维持的综合征[37]。MODS是SIRS发展的结局,也是诊断SAP的必要条件。急性胰腺炎相关器官衰竭主要发生在呼吸、循环和肾脏,是急性胰腺炎最严重的全身并发症,也是SAP致死的主要原因。如果器官功能衰竭在48小时内恢复者是MSAP的特征性病程,而持续性器官衰竭,特别是≥2个器官衰竭并持续48小时以上者则是SAP的特征表现[38]。
专家推荐5:急性胰腺炎引起的自身消化及细胞因子风暴导致的SIRS是MODS和SAP的前提。(证据等级:高;推荐强度:强)
5 SAP的预防与阻断
及时发现可能导致急性胰腺炎从轻症向重症发展的因素和迹象,并及时采取措施加以预防与阻断是本共识的核心,也是急诊科医生诊治急性胰腺炎的重要任务。对于SSAP患者,通过这样的工作期望降低SAP的发生率和病死率。SSAP的筛查流程见图1。

注:NEW为英国国家早期预警评分;AP为急性胰腺炎;SSAP为疑似重症急性胰腺炎;BISAP为急性胰腺炎严重度床旁指数;MAP为轻症急性胰腺炎;CTSI为CT严重度指数
5.1高危人群筛查
常规急诊分诊可以排查可能有风险的患者,根据国家卫生健康委颁布的急诊科规范化流程标准,对英国国家早期预警评分(NEWS)高于4分的患者应该加以关注。对于NEWS≤3分的患者,还需要对可能发展为SAP的高危人群进行重点排查,包括高龄老人、肥胖(特别是 BMI≥30 kg/m2)、孕妇、有明确胆石症及既往频繁发作胆囊炎、甘油三酯≥11.1 mmol/L(1000 mg/dL)的患者。对这些患者应该加强观察和评估,及时发现SIRS和器官功能损害发生的迹象。腹围和腹压是急性胰腺炎患者病情指标之一,对腹围异常增大、腹压升高的患者也需要加以关注。
专家推荐6:可疑急性胰腺炎合并NEWS≥4分,或存在胰腺炎高危因素的患者,推荐早期排查SSAP。(证据等级:中;推荐强度:强)
5.2急性胰腺炎的相关评估
5.2.1 BISAP评分 对所有诊断急性胰腺炎患者进行BISAP评分,当评分≥3分时,应当视为SSAP。同时,采用腹部超声检查或CT平扫确定胰腺局部病变严重程度,以及对肺部病变和胸水进行评估。
5.2.2 生化及生化标志物 BUN、肌酐的异常升高,甘油三酯≥11.1 mg/L,CRP≥150 mg/L,PCT≥2.0 ng/mL,应当诊断为SSAP。
5.2.3 血气分析 血气分析是判断急性胰腺炎病情严重程度的重要指标之一。其中PaCO2、动脉血氧分压(PaO2)、乳酸、pH 等指标对急性胰腺炎严重程度的判断均有重要价值(见表 6)[39]。用氧合指数来判断急性胰腺炎患者的肺损伤常常过晚。乳酸反映患者微循环及组织灌注情况,持续高水平血乳酸(>4 mmol/L)提示患者预后不佳。血乳酸清除率比单纯的血乳酸值能更好地反映患者的预后。以达到血乳酸浓度正常(≤2 mmol/L)为标准, 第一个24小时血乳酸浓度恢复正常(≤2 mmol/L)极为关键[40]。

表6 血气分析对急性胰腺炎严重程度判断
5.2.4 动态评估 每6~8小时需重新进行 NEWS、BISAP评分,注意评分的变化趋势。
专家推荐7:存在以下任意一项可诊断为SSAP:①符合急性胰腺炎诊断,NEWS≥4分;②BISAP评分≥3分;③BMI≥30 kg/m2、异常腹围增大或腹压升高;④血清甘油三酯≥11.1 mg/L;⑤CRP≥150 mg/L和(或)PCT≥2.0 ng/mL;⑥血气评价≥Ⅱ级;⑦CTSI评分≥2分。(证据等级:中;推荐强度:一般)
6 SAP的早期干预
急性胰腺炎一经诊断,即需规范化处理。参考《中国急性胰腺炎诊治指南(2021)》的治疗原则,在早期需要关注液体支持、镇痛及营养支持,此外还需对腹内压升高、抗感染等加以关注。该指南中的“早期”为“发病至发病后2周”,已经不是急诊科意义上的早期,但我们仍然可以借鉴指南中的治疗方法。对SSAP患者应该更加积极干预,预防和阻止SAP的发生。SSAP的阻断流程见图2。
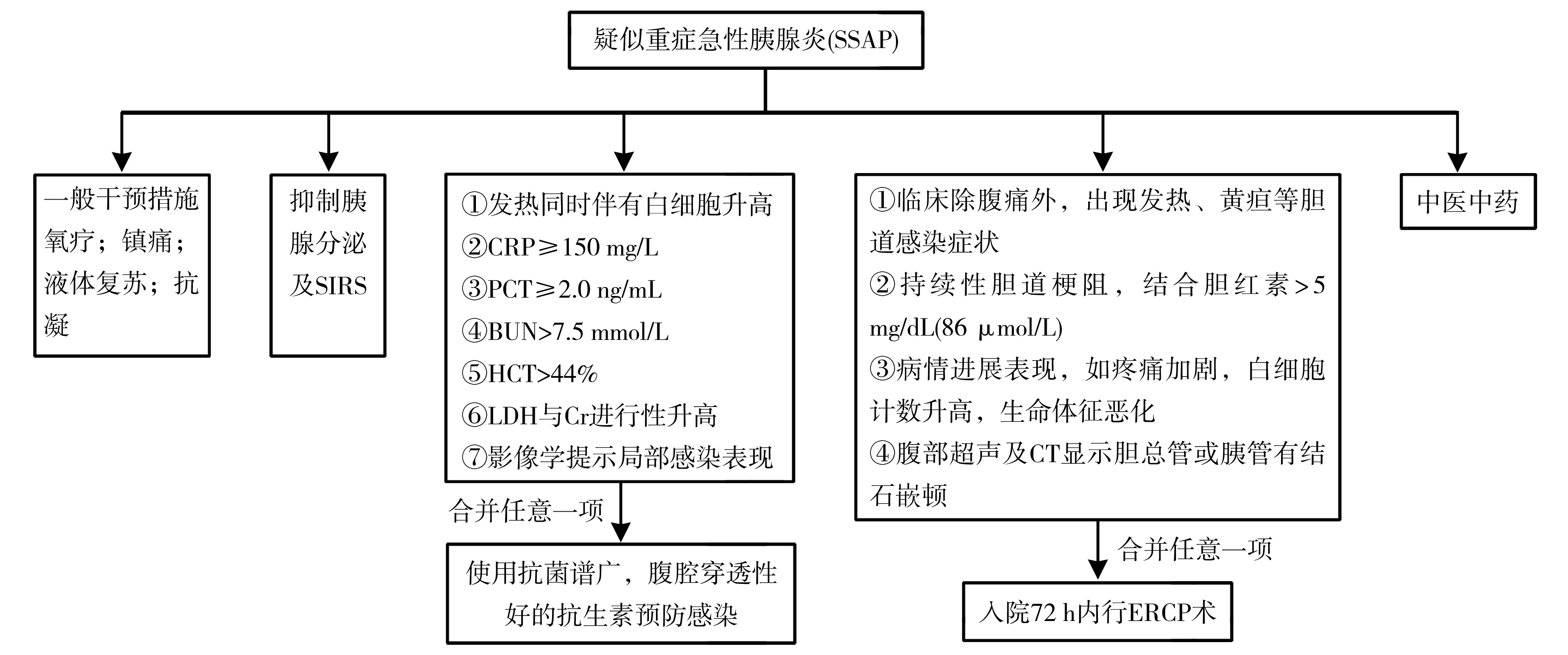
注:SIRS为全身炎症反应综合征;CRP为C反应蛋白;PCT为降钙素原;BUN为尿素氮;HCT为血细胞比容;LDH为乳酸脱氢酶;Cr为肌酐;ERCP为内镜逆行胰胆管造影
6.1一般干预措施
6.1.1 氧疗 对所有急性胰腺炎患者均需要给予氧疗。氧疗是很多重症疾病治疗的首选有效方法。急性胰腺炎早期进行氧疗,可以增加循环血流中氧的含量,减轻因为组织低灌注带来的细胞缺氧,在一定程度上保护器官功能。氧疗的方式可依患者需求采用鼻导管吸氧、面罩吸氧或高流量鼻塞及无创正压通气。
6.1.2 镇痛 胰腺炎患者可能因为炎症导致疼痛,也可因为胆道结石、感染等,以及胃肠道痉挛,甚至腹腔压力升高等造成疼痛。有些患者的疼痛是难以忍受的。镇痛对急性胰腺炎治疗是重要手段之一。急性胰腺炎疼痛性质为伤害感受性疼痛和神经病理性疼痛,一般疼痛剧烈,建议口服或静脉使用镇痛药物为非甾体类药物,也可以联合普瑞巴林或加巴喷丁口服治疗内脏神经痛。严重疼痛者还可联合中枢性镇痛药加强镇痛效果,比如曲马多口服或地佐辛静脉给药。
6.1.3 早期液体支持 在胰腺炎早期(特别是前12~24小时)液体支持治疗非常重要,可以尽早阻断由于毛细血管渗漏等导致的组织灌注下降,最大程度地减少并发症和降低病死率[41-43]。补液的种类以等张晶体液为首选,包括生理盐水、林格液,也可以应用醋酸钠林格液和碳酸钠林格液进行补液治疗。如果胰腺炎是由高钙血症引起的,应避免含钙的林格液。补液的时间和量是关键。在SSAP情况下,根据患者的血压和心率情况确定补液速度。也可以采用水负荷试验确定患者的液体缺失情况,在30分钟将20 mL/kg的液体静脉输注。通过液体支持,希望能够达到:心率<120次/min,平均动脉压(MAP)65~85 mm Hg,尿量>0.5~1.0 mL/(kg·h),HCT和BUN等指标24小时后有所下降[44-45]。
6.1.4 抗凝治疗 根据急性胰腺炎的病因不同,可能需要考虑调节凝血等手段。此外,在全身炎症反应的后期,各种炎症因子对毛细血管内皮的损伤可能很严重,加上有效血容量不足及外周毛细血管收缩,可能导致毛细血管内小血栓的形成,甚至发展为弥散内血管内凝血。及时采取肝素或低分子肝素可能会减轻毛细血管的损伤,对凝血的改善有一定帮助,同时能预防下肢静脉血栓的发生。但在临床实践中,不同病因急性胰腺炎抗凝血治疗的建议不同,参考相关共识与指南执行。
6.2抑制胰腺分泌与胰酶活性
6.2.1 生长抑素及其类似物 “胰酶消化学说”[46]是最早提出的急性胰腺炎病理损伤机制。生长抑素可以广泛抑制包括胰腺在内的器官外分泌功能,改善胰腺炎早期由于胰酶激活导致的胰腺周围局部病变。2017 年发表在《Cochrane Database》的系统综述[47],总结了84项急性胰腺炎用药相关的RCT研究,结果发现,生长抑素有利于早期MAP患者的恢复;但对于SAP,生长抑素并不能降低其病死率及并发症发生率。这提示早期使用生长抑素对防止SAP出现可能有所帮助。奥曲肽是一种人工合成的长效生长抑素类似物,可以调节胰腺分泌,也可调节炎症反应,抑制促炎细胞因子的释放。有研究[48]发现,急性胰腺炎发病48小时内静脉输注高剂量奥曲肽(50 μg/h×3 d+25 μg/h×4 d),不但可以提高血浆生长抑素浓度,阻断急性胰腺炎向重症转化,而且可以降低早期炎症因子IL-6和TNF-α水平,从而降低患者住院时间。
6.2.2 质子泵抑制剂 一方面,质子泵抑制剂能够通过抑制H+-K+-ATP酶活性导致盐酸生成减少,进而通过神经和体液分泌途径减弱胰液分泌,降低胰酶活性。另一方面,质子泵抑制剂对胃肠道黏膜的保护作用在一定程度上缓解了SAP患者的临床症状,但对于急性胰腺炎临床病程无影响[49]。因此,2015年意大利急性胰腺炎共识[50]不再推荐将质子泵抑制剂作为治疗SAP的常规手段。
6.2.3 甲磺酸加贝酯 甲磺酸加贝酯是一种合成的丝氨酸蛋白酶抑制剂,理论上可以通过抑制胰蛋白酶、弹性蛋白酶、磷脂酶A2等的激活阻止胰腺的自身消化。但有研究[51]发现,甲磺酸加贝酯在增加胰腺炎患者临床花费的同时,并未对住院病死率产生明显影响。2015年日本急性胰腺炎管理指南[23]推荐,静脉注射蛋白酶抑制剂(甲磺酸加贝塞特酯)对改善急性胰腺炎预后和并发症发生率的有效性尚未得到明确证实,需要进一步研究明确大剂量静脉注射对严重病例的疗效性。
6.3抑制SIRS
SIRS是导致急性胰腺炎全身反应和器官功能障碍的前提,早期抑制SIRS是预防与阻断SAP发生的关键措施之一。当考虑或确定SIRS发生时,应及时适量使用药物进行干预。目前临床上用于SAP免疫调控的药物包括乌司他丁、非甾体类解热镇痛抗炎药(NSAIDs)及中药制剂等。乌司他丁作为一种蛋白酶抑制剂,既可以有效地抑制胰蛋白酶和糜蛋白酶活性,也可以抑制IL-6和TNF-α的生成[52]。《中国急诊急性胰腺炎临床实践指南》推荐,一旦急性胰腺炎,即考虑使用乌司他丁30万U/d[53-54],若考虑为SAP,应提高乌司他丁的用量至60万U/d,以达到平衡炎症因子、改善预后的作用。胰腺腺泡细胞损伤后出现炎症因子大量释放。环氧合酶(COX)具有重要的促炎功能,并可以达到一定程度的止痛作用。对于ERCP引起的急性胰腺炎患者,NSAIDs可以通过抑制COX1和COX2减轻急性胰腺导致的炎症反应,避免疾病加重[55]。祖国医学在人体免疫调节及炎症调控中发挥的作用,从COVID-19治疗中得到了充分的证实。热毒宁注射液兼有抗病原体及调节免疫作用,可通过调控丝裂原活化蛋白激酶(MAPKs)、核转录因子-κB(NF-κB)通路,抑制激活蛋白-1(AP-1)、p65等核转录因子活性,调节IL-6、IL-8、IL-17、TNF-α、IL-10等细胞炎性因子表达[56-57],抑制细胞因子风暴,可保护内皮细胞,抑制毛细血管渗漏。临床实践证实,热毒宁注射液可缩短疾病治疗时间、症状缓解时间,遏制疾病重症进展,有效预防器官功能障碍。
专家推荐8:针对SSAP患者,推荐早期进行生命支持和疼痛控制,并通过中西医结合的措施抑制胰酶分泌、控制SIRS反应和保护微循环预防与阻断SAP的发生。(证据等级:高;推荐强度:强)
6.4抗感染治疗
急性胰腺炎患者普遍存在早期使用抗生素的情况,调查显示,90%在急性胰腺炎发病后3天内开始应用,其中52%使用单一抗生素,43.7%使用两种抗生素,4.3%使用三种及以上抗生素。对于MAP患者,预防性抗生素的应用并不能改善患者预后,甚至可能造成患者菌群紊乱、二重感染等。建议当有证据高度怀疑存在感染时,才考虑抗感染治疗。特别是胰腺坏死范围>50%,应予以经验性抗生素选择[50, 58]。在细菌学及药敏结果出来之前,经验性等抗生素选择应考虑覆盖需氧及厌氧的G-、G+细菌,同时还要考虑药物对胰腺屏障的穿透力。研究发现,碳青霉烯类抗生素(亚胺培南、厄他培南)及喹诺酮类药物(环丙沙星、莫西沙星)都具有很好的胰腺穿透力,并且可以覆盖大肠埃希菌、阴沟肠杆菌等胰腺炎感染常见病原体[59-60]。甲硝唑作为针对厌氧菌的药物,其胰腺屏障穿透力也很好,可以作为胰腺炎抗感染的联合用药。真菌感染是急性胰腺炎的严重并发症,常见的病原体包括白色念珠菌、热带念珠菌等。然而各国的指南均不推荐在未获得真菌感染证据前使用抗真菌药物。有下列任何一项应考虑有感染的存在:①发热同时伴有白细胞升高;②CRP≥150 mg/L;③PCT≥2.0 ng/mL;④BUN>7.5 mmol/L;⑤HCT>44%;⑥LDH与肌酐进行性升高;⑦影像学提示局部感染表现。
专家推荐9:无感染迹象的MAP,不推荐预防性使用抗生素;当出现感染迹象时,推荐使用抗菌谱广、胰腺穿透性好的抗生素。(证据等级:高;推荐强度:强)
6.5中草药治疗
急性胰腺炎属中医学“腹痛”“脾心痛”“胰瘅”等范畴[61-62]。中医认为,该病常由胆石、虫积、素体肥胖、饮食不节等因素所致,与西医的病因很一致。急性胰腺炎在急性期属实证,总体治则以“通”为用,其中危重者可表现为邪实正虚,应扶正祛邪。
6.5.1 肝郁气滞证 可见脘腹胀痛,矢气则舒,恶心或呕吐,嗳气呃逆,善太息,大便不畅,舌淡红,苔薄白或薄黄,脉弦紧或弦数;治法:疏肝解郁、理气通腑;主方:柴胡疏肝散[63]合清胰汤[64-65];推荐药物:陈皮、柴胡、川芎、香附、枳壳、白芍、甘草、生大黄等;中成药可选用柴胡舒肝丸。
6.5.2 肝胆湿热证 可见上腹胀痛拒按或腹满胁痛,胸胁苦满,发热,身目发黄,口渴,小便短黄,大便黏滞不通,舌质红,苔黄腻或薄黄,脉弦数;治法:清热祛湿、利胆通腑;主方:茵陈蒿汤[66]合龙胆泻肝汤[67];药物:茵陈、大黄(后下)、栀子、龙胆草、黄芩、山栀子、泽泻、木通、车前子、当归、生地黄、柴胡、甘草等;中成药可选用龙胆泻肝丸、胆石通胶囊、大黄利胆胶囊、茵栀黄颗粒、清胰利胆颗粒[68-69]等。
6.5.3 腑实热结证 可见腹满硬痛拒按,日晡潮热,胸脘痞塞,呕吐,口臭,小便短赤,大便干结不通,舌质红,苔黄厚腻或燥,脉洪大或滑数;治法:清热通腑,内泻热结;主方:大柴胡汤合大承气汤;药物:柴胡,枳实、半夏、黄芩、生大黄(后下)、芒硝(冲服)、白芍、栀子、连翘、桃仁、红花、厚朴、黄连;中成药可选用血必净注射液[70]、清胰利胆颗粒[68-69]等。
6.5.4 瘀毒互结证 可见腹部刺痛拒按,痛处不移,或可触及包块,发热夜甚,皮肤瘀斑,躁扰不宁,小便短涩,舌质红或有瘀斑,脉弦数或涩;治法:清热泻火,祛瘀通腑;主方:泻心汤或大黄牡丹汤合膈下逐瘀汤;药物:大黄、黄连、黄芩、当归、川芎、桃仁、红花、赤芍、延胡索、生地黄、丹参、厚朴、五灵脂、丹皮、水牛角(先煎)、芒硝(冲服);中成药可选用血必净注射液[70]、复方丹参注射液[71]、安宫牛黄丸等。
6.5.5 内闭外脱证 可见意识模糊,呼吸喘促,大汗出,肢冷,小便量少甚或无,脉微欲绝,舌质干绛,苔灰黑而燥,脉微欲绝;治法:回阳救逆、通腑逐瘀;主方:小承气汤合四逆汤;药物:生大黄(后下)、厚朴、枳实、熟附子、干姜、甘草、葛根、赤芍、红花、生晒参(另炖)、代赭石(先煎)、生牡蛎(先煎);中成药可选用参附注射液[72]等。
6.5.6 中医特色疗法 其他针对急性胰腺炎的中医疗法还包括中药保留灌肠[73]、穴位治疗[74]、中药外敷等,可以根据医院具体情况,联合中医科开展诊治。
专家推荐10:中医药可以作为预防和阻断急性胰腺炎发生、发展的重要手段。(证据等级:中;推荐强度:一般)
6.6专科会诊及干预
6.6.1 专科干预指征 对于怀疑或确诊急性胆源性胰腺炎的患者,出现下列任意一点应积极请消化科会诊,确定是否采取ERCP:①临床除腹痛外,出现发热、黄疸等胆道感染症状;②持续性胆道梗阻,结合胆红素>5 mg/dl (86 μmol/L);③病情进展表现,如疼痛加剧,白细胞计数升高,生命体征恶化;④腹部超声及CT显示胆总管或胰管有结石嵌顿。
6.6.2 ERCP+内镜乳头括约肌切开取石术(EST) ERCP已成为急性胆源性胰腺炎患者解除胆道梗阻的首选方法[75]。胆源性胰腺炎早期使用内镜超声检查,筛选出需要进行ERCP的患者进行内镜干预,能显著减少手术机会,降低并发症的发生率,缩短住院时间。导管内超声检查(IDUS)可发现胆道造影和核磁共振胆道胰管造影(MRCP)遗漏的胆管小结石或泥沙样结石。IAP/APA指南[76]指出,胆源性胰腺炎合并胆管炎的患者需24小时内急诊行ERCP。2013年ACG指南[18]和2018年AGA指南[77]一致认为,对于有急性化脓性胆管炎和(或)胆管持续性梗阻的患者,行ERCP治疗有明确指征。但现有研究结果没有得出急诊ERCP对不伴有胆管炎的急性胰腺炎患者有利的结果,因此对于无胆总管梗阻及胆管炎者,早期行ERCP是无益的。伴发胆总管结石嵌顿但无明确胆管炎的患者,推荐在入院72小时内行ERCP。
专家推荐11:推荐及时邀请专科介入治疗,特别是胆源性胰腺炎的患者。(证据等级:中;推荐强度:强)
6.7早期并发症处理
6.7.1 ACS ACS是SAP的严重并发症,是重要的死亡原因。进行胃肠减压、导泻等治疗可一定程度上降低腹内压,缓解病情进展。对于合并大量腹腔或腹膜后积液的患者,可行穿刺引流。总之,对ACS不建议早期进行开放手术减压[78]。
6.7.2 感染性胰腺坏死 急性胰腺炎早期不主张手术治疗。即使感染性胰腺坏死的患者也不主张早期手术干预。感染性胰腺坏死是急性胰腺炎后期的严重并发症,病死率可达30%左右,而早期手术患者的病死率可超过50%,延迟手术可降低患者并发症发生率和病死率[79]。因此,感染性胰腺坏死手术治疗的干预时机可延迟至发病4周后[58, 80]。无症状的胰腺假性囊肿和包裹性坏死无需外科干预;当胰腺坏死合并感染时需要手术治疗,手术应遵循延迟、引流和清创的原则。但目前关于感染性胰腺坏死延迟手术的证据均来自开腹手术数据,微创手术时机是否需要调整仍需进一步证实。感染性胰腺坏死的主要治疗措施包括经皮穿刺引流、内镜下穿刺引流、外科视频辅助清创、内镜下清创、开腹手术清创及抗菌药物使用等。目前认为,感染性胰腺坏死手术治疗策略首选“Step-up”方式,先进行穿刺引流,效果不佳的患者进行视频辅助清创、内镜下清创、开腹手术[81-82]。部分患者缺乏安全穿刺入路或评估穿刺引流效果不佳,亦可直接进行手术治疗[83]。
专家推荐12:目前感染性胰腺坏死的手术干预时机为急性胰腺炎发病后4周,手术治疗策略以“Step-up”为主。(证据等级:中;推荐强度:一般)
7 结论
急性胰腺炎患者在急诊科早期充分的评估,判断胰腺局部及全身反应的严重程度,判断合并感染及早期并发症的出现,推断发展为SAP的可能性,并通过吸氧、止痛、液体支持、抑制胰腺分泌、控制炎症反应及合理抗感染治疗等措施减少病情恶化的机会,是防止出现器官功能障碍、降低胰腺炎病死率的综合措施。此外,祖国医学也为急性胰腺炎的治疗和SAP的预防提供了多种手段,临床应当充分利用。专科处理是伴有梗阻的急性胰腺炎处理的最有效措施之一,急诊科医生需要掌握会诊指征和会诊时机,及时解除梗阻性病变,促进急性胰腺炎的恢复,防止恶化。
撰写专家(按姓氏首字母排序):丁邦晗,关键,郭喆,刘业成,司君利,魏捷,王振杰,徐珊珊,王仲,张巍巍,朱华栋,张振宇
讨论专家(按姓氏首字母排序):柴艳芬,曹钰,董士民,杜贤进,方邦江,郭树彬,龚平,吕传柱、卢中秋,陆莹,毛恩强,米玉红,倪海滨,聂时南,钱传云,司君利,田英平,王宇新,姚咏明,尹文,余涛,于学忠、曾红科,赵晓东,张国强,詹红
