不同种植模式下凤丹根际微生物群落结构和多样性分析
2022-05-16刘智张虹罗会婷王仲伟汤诗杰
刘智 张虹 罗会婷 王仲伟 汤诗杰



摘要:為探究不同种植模式下凤丹根际微生物群落结构和多样性,采用高通量测序技术对采自榉树(Zelkova serrata)下种植(ZS)、娜塔栎(Quercus nattallii)下种植(QS)、露天种植(OS)的凤丹根际以及空白土壤(CK)样品土壤细菌和真菌进行测序。结果显示,与空白土壤相比,种植凤丹提高了根际微生物群落的丰富度和多样性,不同种植模式下凤丹根际微生物群落结构有所差异。3种种植模式下细菌的优势菌门均为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)以及疣微菌门(Verrucomicrobia),但不同种植模式下每个门的相对丰度有所差异。所有样品中总共检测出12个真菌门,3种种植模式下真菌的优势菌门均为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),不同种植模式下各真菌门的相对丰度存在差异;属水平上真菌群落结构差异较大,ZS组、QS组和OS组的优势菌属分别为Exophiala、Thelephoraceae_unclassified、Ascomycota_unclassified。测定3种种植模式下凤丹的生长指标,发现林下种植的凤丹株高、叶长、叶宽均高于露天种植。林下种植模式的细菌需氧表型、革兰氏阴性表型、生物膜形成表型以及致病潜力表型高于单一种植模式。本研究从根际微生物角度分析了不同种植模式对凤丹的影响,为凤丹林下种植提供参考,为后续促生菌筛选、菌肥研制提供理论支撑。
关键词:凤丹;根际微生物;高通量测序;微生物多样性;微生物群落结构
中图分类号:S154.3文献标识码:A文章编号:1000-4440(2022)02-0502-10
Analysis on community structure and diversity in rhizosphere microorganisms of Paeonia ostii under different planting patterns
LIU Zhi ZHANG Hong LUO Hui-ting WANG Zhong-wei TANG Shi-jie
Abstract:In order to explore the rhizosphere microbial community structure and diversity of Paeonia ostii under different planting patterns, high-throughput sequencing technology was used to sequence the rhizosphere soil samples of Paeonia ostii collected from three different planting patterns, namely Zelkova serrata (ZS), Quercus nattallii (QS) and open-air planting (OS) and blank soil(CK). The results showed that compared with the blank soil, planting Paeonia ostii increased the richness and diversity of rhizosphere microbial community, and the rhizosphere microbial community structure of Paeonia ostii was different under different planting patterns. The dominant phyla of bacteria under three planting patterns were Proteobacteria, Acidobacteria, Actinobacteria and Verrucomicrobia, but the relative abundance of each phylum under different planting patterns was different. A total of 12 fungal phyla were detected in all samples. The dominant phyla of fungi under three planting modes were Ascomycota and Basidiomycota, and the relative abundance of each fungal phylum was different under different planting patterns. The fungal community structure was quite different at genus level, and the dominant genera in ZS group, QS group and OS group were Exophiala, Thelephoraceae_unclassified and Ascomycota_unclassified, respectively. The growth indices of Paeonia ostii under three planting patterns were measured, plant height, leaf length and leaf width of Paeonia ostii planted under forest were higher than those planted in open field. The aerobic phenotype, Gram-negative phenotype, forms biofilms phenotype and potentially pathogenic phenotype in cultivation pattrerns under forest were higher than those in single planting mode. In this study, the effects of different planting patterns on Paeonia ostii were analyzed from the perspective of rhizosphere microorganisms, so as to provide reference for understory planting of Paeonia ostii, and provide theoretical support for subsequent screening of probiotics and development of bacterial fertilizer.
Key words:Paeonia ostii;rhizosphere microorganisms;high-throughput sequencing;microbial diversity;microbial community structure
凤丹(Paeonia ostii)属芍药科芍药属植物,结实能力强,凤丹籽产量和出油率高。凤丹籽油富含多种不饱和脂肪酸,其干燥根皮被称为丹皮,可入药,花兼具观赏、食用和药用价值,在全国范围内得到了广泛的种植[1-4]。国家发展和改革委员会等部门于2020年印发的《关于科学利用林地资源促进木本粮油和林下经济高质量发展的意见》指出,到2025年,要新增或改造木本粮油经济林3.33×106 hm2,木本食用油年产量达2.5×106 t,林下经济年产值达1×1012 元。作为多年生灌木,凤丹抗逆性强、适应性好,可林下种植,与核桃、香椿、油茶等作物已经形成了较为成熟的套种模式。林下种植充分利用了土地资源,同时发挥了林地的林荫优势,改善了凤丹的生长环境,对提高产量、促进增收有着积极意义[5]。
根际是植物根系与土壤微生物相互作用的场所,具体指植物的根表及受根系直接影响的土壤区域,是地球上最复杂的生态系统之一[6-7]。植物的根系分泌物为根际微生物的生长提供营养物质,大约有10%的净光合固定碳通过分泌物的形式释放到根际,从而形成不同的根际微生物群落[8]。不同的根际微生物可以通过不同的方式,比如调控植物激素水平、影响植物信号的产生与传导、改善营养获取方式以及提高植物抗逆性等来影响植物的生长发育[9-11]。一些根际微生物可以通过形成生物膜来帮助植物抵抗高温和高盐胁迫[12],枯草芽孢杆菌(Bacillus subtilis)可以分泌激素类和抗菌素类物质来抵抗病原菌[13]。根际微生物群落结构受到植物类型的影响,杨潇湘等[14]比较油菜和大豆根际土壤微生物群落结构发现,两者在门水平上的优势菌群相同,但是后者富含具有生防作用的微生物,比如黄杆菌属(Flavobacterium)、鞘脂单胞菌属(Sphingomonas)、芽孢杆菌属(Bacillus)等;大豆根際具有更多的病原细菌和真菌,比如肠杆菌(Enterobacter)和炭疽菌(Colletotrichum spp.)等。除此之外,土壤环境、栽培模式、水肥条件、田间管理模式等也会影响植物根际微生物结构。例如刘振香等[15]研究发现,夏玉米田中施用有机肥可以提高土壤微生物多样性和丰富度;姜莉莉等[16]研究发现,苹果园内种植黑麦草可提高土壤中链格孢菌(Alternaria)和曲霉菌(Aspergillus)的相对丰度,种植白三叶可提高土壤赤霉菌(Gibberella)的相对丰度,而自然生草则会提高青枯菌(Ralstonia)等致病菌的相对丰度。
相比于传统土壤微生物研究方法,高通量测序技术所需样本量少、能用环境样本中直接获取的总DNA进行文库的构建,操作简单、准确度高,成为研究土壤微生物的热门手段[17-19]。前人已经研究了不同地区[20]、不同种植年限[21-22]凤丹根际微生物多样性,但对于不同种植模式下凤丹根际微生物多样性的研究还未见报道。本研究基于高通量测序技术,研究不同种植模式下凤丹根际微生物群落结构和多样性,以期为凤丹根际微生态环境研究提供理论基础,为优化油用牡丹栽培技术提供思路。
1材料与方法
1.1试验材料
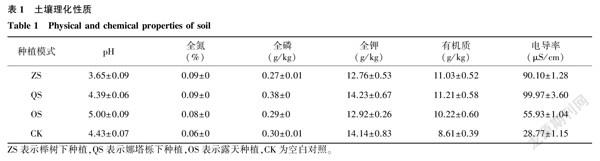
试验地位于江苏省中国科学院植物研究所试验田(南京市六合区竹镇镇,32°33′46″N,118°39′28″E),土壤类型均为黄棕壤,属亚热带季风气候。试验田内设有榉树下种植(ZS)、娜塔栎下种植(QS)以及露天种植(OS)3种模式,榉树和娜塔栎的株距×行距为4 m×6 m。3种模式下种植的凤丹均为3年生苗,株距×行距为40 cm×60 cm,种植密度约为1 hm2 42 000株,水肥管理均参照国家林业局《油用牡丹栽培技术规程》[23]进行。于2021年8月采样,每个试验区均采用五点采样法,挖出整株凤丹植株,采用抖根法采集根际。按照相同方法,在空地上采集地表10~15 cm深度的土壤作为对照组(CK),每组样品均设6个生物学重复。收集的样品装入无菌自封袋,冰盒保存,带回实验室备用。土壤理化性质见表1。
1.2凤丹生长指标测定
生长指标于2021年6月底测定,每个小区随机选取10株凤丹植株,使用卷尺(精度0.1 cm)测量株高,每1株上选取3片健康成熟顶生小叶,使用直尺(精度0.1 cm)测量叶长(叶片基部至顶端长度)和叶宽(叶片最宽处宽度),重复3次,求平均值。
1.3根际微生物基因组DNA的提取、扩增以及高通量测序
使用天根DP712试剂盒(天根生化科技有限公司产品)提取根际微生物基因组DNA,采用1%琼脂糖凝胶电泳检测其完整性,采用分光光度计检测其浓度和纯度。使用引物F:5′-CCTACGGGNGGCWGCAG-3′,R:5′-GACTACHVGGGTATCTAATCC-3′扩增细菌的16 S rDNA的V3+V4区;使用引物F:5′-GTGARTCATCGAATCTTTG-3′,R:5′-TCCTCCGCTTATTGATATGC-3′扩增真菌的ITS2区域。PCR反应体系为:Phusion Hot Start Flex 2×Master Mix 12.5 μl,1 μmol/L的正反向引物各2.5 μl,DNA模板50 ng,加ddH2O至25.0 μl。PCR反应条件为:98 ℃ 30 s;98 ℃ 10 s,54 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。
PCR产物经纯化和定量之后构建DNA文库,评估合格的测序文库(由联川生物科技有限公司提供)在Illumina NovaSeq平台上进行测序。
1.4数据处理
使用软件Cutadapt(v1.9)去除barcode标签和引物序列,使用Fqtrim(v0.94)和Vsearch(v2.3.4)分别过滤低质量序列和嵌合体,利用DADA2进行解调,得到特征(feature)序列和特征丰度表格。
对特征丰度进行归一化后,使用QIIME2计算样品的α多样性指数(Chao1指数、Observed species指数、Goods coverage指数、Shannon指数、Simpson指数)和β多样性指数。使用SILVA数据库(https://www.arb-silva.de/documentation/release138/)注释特征序列,获取分类学信息,使用Excel 2016和SPSS 26处理数据。将样本信息上传至BugBase(https://bugbase.cs.umn.edu/),预测细菌表型。使用R(VennDiagram)绘制特征分布Venn图,使用R(vegen 2.5.4)绘制PCA图,使用Origin Pro 2021绘制箱线图和群落结构图。
2结果与分析
2.1测序结果质量评估
原始数据处理后,统计高质量数据。16 S rDNA测序序列个数为1 717 754,有99.88%的序列长度在400~500 bp,有效数据与原始数据之比(Valid)均值为85.31%,其中最大值为94.01%,最小值为73.87%;所有样本的Q30均在80.00%以上,平均值为91.76%。
ITS2测序序列个数为1 969 418,有70.10%的序列长度在200~300 bp,29.18%的序列长度在300~400 bp,Vaild最小值为94.26%,Q30均在95%以上。说明,此次测序质量良好。
2.2不同种植模式下凤丹根际微生物丰富度和多样性
与传统操作分类单元(OTU)相比,DADA2算法可以对扩增子数据进行去噪、修正、去冗余,得到特征数据,数据精确度和物种分辨率大大提升。由表2可见,在16 S rDNA和ITS2测序中,ZS组的特征数最多,QS组和OS组次之,CK的特征数最少。
α多样性指数可以用来反映样本的物种丰富度和多样性。在16 S rDNA测序中,4组的Observed species指数之间无显著差异;4组的Simpson指数均为1.00。在ITS2测序中,ZS、QS、OS组的Observed species指数均高于CK; 各组间Simpson指数和Shannon指数差异不显著。
从图1可以直观地看出,每组样品共有和特有的特征数目。在16 S rDNA测序中,4组样品共有的特征数为839,ZS组、QS组、OS组、CK特有的特征数分别为:4 631、4 635、5 316和5 239;ITS2测序中,4组样品共有的特征数为124,ZS组、QS组、OS组、CK特有的特征数分别为670、562、582和378。
从以上结果可以看出,相比于空白土壤,3种种植模式均提高了凤丹根际微生物的丰富度和多样性;3种不同的种植模式中,凤丹根际细菌和真菌的丰富度和多样性也存在差异。
2.3不同种植模式下凤丹根际细菌群落结构
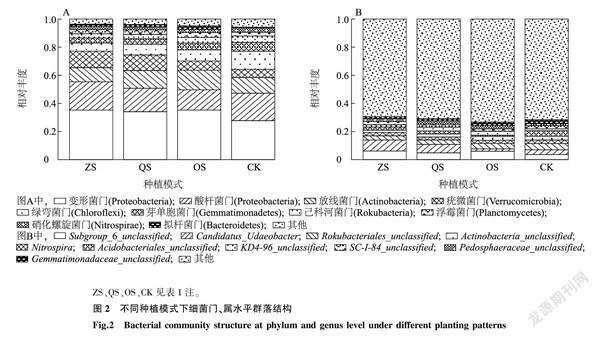
取凤丹根际细菌门水平相对丰度前10位(TOP10)绘制柱状堆叠图(图2A)。在门水平上细菌群落结构中,变形菌门(Proteobacteria)在4组中丰度最高,ZS组、QS组、OS组均高于CK;其次是酸杆菌门(Proteobacteria),在ZS组和CK中的丰度相当,均高于QS组和OS组;OS组中放线菌门(Actinobacteria)的丰度大于其他3组;疣微菌门(Verrucomicrobia)在ZS组和QS组中的丰度高于OS组和CK;拟杆菌门(Bacteroidetes)在OS组中的丰度要高于其他3组;绿弯菌门(Chloroflexi)、己科河菌门(Rokubacteria)以及硝化螺旋菌门(Nitrospirae)在CK中的丰度分别为12.9%、4.6%和3.0%,均高于在其他3组中的丰度。
图2B是属水平上凤丹根际细菌群落结构,属水平上优势菌多为现阶段未分类的细菌,在ZS组和QS组中,Candidatus_Udaeobacter的相对丰度均为最高,分别为7.80%和6.07%,其次为Subgroup_6_unclassified,相对丰度分别为6.1%和4.8%, 排在第三位的是Rokubacteriales_unclassified,相對丰度分别为3.0%和3.1%。在OS组中Subgroup_6_unclassified的相对丰度最高,之后按照相对丰度高低依次是Rokubacteriales_unclassified、KD4-96_unclassified、Actinobacteria_unclassified。在CK中,按照丰度高低依次是:Rokubacteriales_unclassified、Acidobacteriales_unclassified、Subgroup_6_unclassified、Candidatus_Udaeobacter。
由此可见,不同的种植模式对凤丹根际细菌群落结构是有一定影响的,特别是酸杆菌门、放线菌门和疣微菌门。在属水平上,Subgroup_6_unclassified、Candidatus_Udaeobacter和Rokubacteriales_unclassified在不同的种植模式下差异较大。
2.4不同种植模式下凤丹根际真菌群落结构
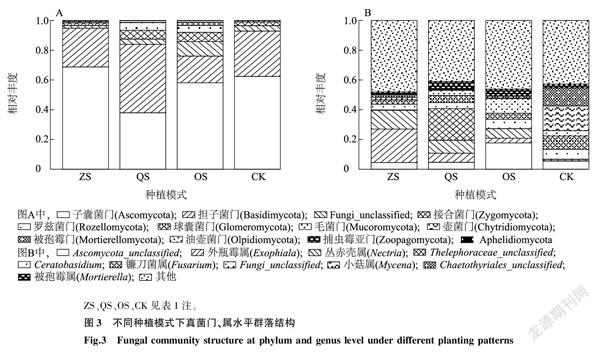
由图3A可以看出,在ZS组、OS组和CK中子囊菌门(Ascomycota)相对丰度最高,担子菌门(Basidiomycota)位居第二,而在QS组中担子菌门丰度最高。OS组中Fungi_unclassified、球囊菌门(Glomeromycota)以及接合菌门(Zygomycota)的相对丰度要高于其他3组。毛霉门(Mucoromycota)和被孢霉门(Mortierellomycota)没有出现在CK中。
由图3B可知,ZS组中相对丰度TOP3依次是外瓶霉属(Exophiala)、丛赤壳属(Nectria)、Ascomycota_unclassified,其中外瓶霉属的相对丰度达到了22.5%;QS组中Thelephoraceae_unclassified的相对丰度最高,为21.3%,其次为丛赤壳属;OS组中,Ascomycota_unclassified的丰度最高,其次为Fungi_unclassified;而在CK中,相对丰度TOP3为小菇属(Mycena)(16.6%)、Chaetothyriales_unclassified(12.2%)、镰刀菌属(Fusarium)(9.0%)。
不同种植模式下,凤丹根际真菌群落结构有着较大的差异。门水平上子囊菌门、担子菌门、Fungi_unclassified、接合菌门丰度差异较大。而在属水平上差异更明显,每组的优势属均不同。
2.5不同种植模式下凤丹根际微生物β多样性分析
对不同种植模式下凤丹根际细菌和真菌群落结构进行主成分分析,结果见图4,根据样品代表的点在PCA图中的距离,可以判断样品之间的相似度。同时PCA图给出了基于Anosim相似性分析计算出的R值,R值越接近于1,说明组间差异越大于组内差异。
从图4A可以看出,在不同种植模式下凤丹根际细菌群落PCA图中,前2个主成分的累计贡献率达到了48.58%。ZS组和QS组样品对应的点在PCA图中较为集中,且两组距离较近,说明ZS组和QS组的细菌群落组成较为相似。OS组中的大部分点与ZS组、QS组分离,CK与ZS组、QS组明显分离。结合R=0.729 5可知,不同组别之间差异较大,说明相比于CK,种植凤丹改变了根际细菌的群落结构,2種林下种植模式的细菌群落组成较为相似,且与露天种植模式存在差异。
图4B是不同种植模式下凤丹根际真菌群落PCA图,ZS组、QS组和OS组样品对应的点在PCA图中距离较近,说明3组的真菌群落结构较为相似,CK与其他3组有一定的分离,结合R=0.652 9可知,相比于CK,种植凤丹改变了根际真菌群落结构。
2.6不同种植模式下凤丹的生长状况
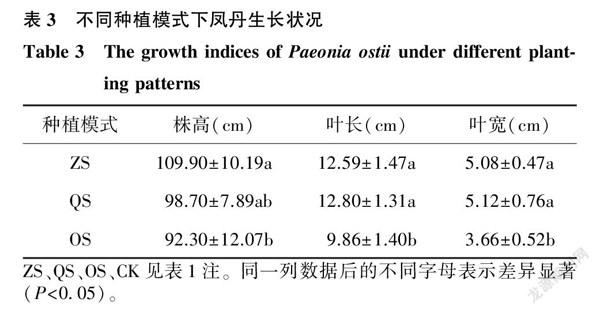
不同种植模式下凤丹的生长状况如表3所示,ZS组的株高高于QS组和OS组,其中和OS组差异显著;ZS组和QS组的叶长均显著高于OS组;ZS组和QS组的叶宽均显著高于OS组。
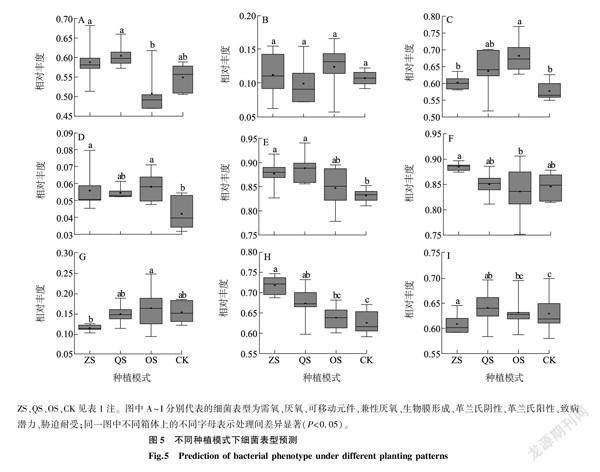
2.7不同种植模式下凤丹根际细菌表型预测
细菌表型预测结果(图5)表明,不同种植模式下凤丹根际细菌表型之间存在较大差异。ZS组和QS组的需氧表型显著高于OS组;可移动元件表型在OS组中最高,显著高于ZS组和CK,但与QS组没有显著差异;兼性厌氧表型表现为ZS组、OS组高于CK, QS组和CK没有显著差异;ZS组、QS组的生物膜形成表型要高于CK, OS组与CK无显著差异;革兰氏阴性表型在ZS组、QS组和CK中无显著差异,但ZS组显著高于OS组;革兰氏阳性表型则表现为OS组显著高于ZS组;ZS组和QS组的致病潜力显著高于CK;ZS组的胁迫耐受低于OS组和CK。厌氧表型在4组中没有显著差异。
3讨论
研究结果表明,选取合理的种植模式能增强作物根际的交互作用,优化根际微生物群落结构,对提高土壤肥力、促进作物生长发育有着积极作用[24]。轮作、套作以及连作模式下,丹参根际微生物群落结构存在一定差异,轮作和套作对改善土壤质量以及缓解丹参连作障碍有着一定的积极作用[25]。香蕉间作韭菜、假花生和覆盖稻草处理,显著提高了香蕉根际放线菌的相对丰度,但是尖孢镰刀菌(F. oxysporum)的丰度有所下降,降低了香蕉枯萎病的发生几率[26]。探究不同种植模式下草莓根际细菌和真菌群落结构,发现限根种植提高了草莓根际放线菌门、变形菌门、拟杆菌门以及子囊菌门的丰度,降低了绿弯菌门、酸杆菌门和接合菌门的丰度[27]。研究发现,凤丹与香椿、女贞间作提高了单株地上部分生物量和产量[28],凤丹-香椿套种模式在定植4年后产量高出单一种植模式51.97%,极大提高了籽粒产量[29]。
与CK相比,绿弯菌门、己科河菌门以及硝化螺旋菌门在其他处理组中的相对丰度有所降低。绿弯菌多为细胞丝状,营养方式多样,参与CO2的同化过程[30];硝化螺旋菌门可将铵态氮氧化为硝态氮,参与土壤氮循环[31]。3种种植模式下细菌的优势菌门均为放线菌门,这与张永敢[32]等的研究结果一致,但是相比于露天种植,林下种植凤丹根际细菌酸杆菌门和疣微菌门的相对丰度得到了提高,芽单胞菌门、放线菌门以及拟杆菌门有所下降。相关研究结果表明,拟杆菌门在轮作休耕模式中与土壤全钾含量呈负相关[33];而在黄花蒿连作中,随着种植年限的增加,根际芽单胞菌门和放线菌门的丰度有所降低,说明黄花蒿能选择性抑制它们的生长繁殖[34]。2种林下种植模式凤丹根际细菌群落结构和多样性也存在一定差异,相比在娜塔栎下种植凤丹,在榉树下种植凤丹提高了根际酸杆菌门的丰度,酸杆菌门细菌能够在缺氧酸性环境下生存,抗逆性强,对林地中树叶等植物残体具有降解功能[35],本研究中ZS组的pH低至3.65,也佐证了这一结论。
在所有样品中,鉴定出的真菌分别属于12个门,3种种植模式下真菌优势菌门均为子囊菌门和担子菌门,且在ZS组中子囊菌门的丰度最高。子囊菌门真菌多为腐生真菌,能分解土壤中的化合物,对土壤养分循环有着重要的作用,一定程度上可以促进作物的生长发育[36-38];担子菌门的一些真菌可以与作物共生形成菌根,增强作物抗性[39]。属水平上,ZS组丛赤壳属丰度高于其他3组,被孢霉属在QS组中丰度最高。王丽娟等[40]从鹿蹄草中分离出1株促生菌,鉴定为丛赤壳属真菌,该菌株可以显著提高鹿蹄草的根系活力,提高叶片中叶绿素a的含量、可溶性糖含量以及超氧化物歧化酶活性,从而促进鹿蹄草的生长发育。被孢霉属真菌主要腐生于土壤,部分种类可以和植物共生,对改善土壤结构有一定作用,能促进植物的生长[41]。镰刀菌属(Fusarium)和Ceratobasidium作为常见的植物病原菌,对种子的萌发及植物根茎的生长不利,可能导致作物发生枯萎病、根腐病等[42-43],而本研究发现在ZS组中这2种真菌的丰度要低于其他3组,这说明榉树下种植凤丹对抵抗病原菌有一定的作用。
BugBase是基于测序数据进行的预测分析,并不能真实反映细菌群落的全部表型,但是分析不同种植模式下凤丹根际的细菌表型,对于凤丹的种植仍有一定的理论参考价值。细菌表型预测结果显示,兼性厌氧表型在CK中最低,这可能是因为随着凤丹种植年限增加,连作土壤总孔度减少,从而影响通气性所导致的[44]。林下种植模式下需氧表型、革兰氏阴性表型、生物膜形成表型以及致病潜力表型在一定程度上高于单一种植模式,这可能跟变形菌门的丰度升高有关。变形菌门细菌在自然界中广泛存在,革兰氏阴性细菌,大多数都具有脂多糖组成的外膜,其中β-变形菌多为好氧及兼性细菌,包含很多病原菌,这与杨睿[45]研究贵州喀斯特山区花椒林根际细菌表型的結果相符,随着变形菌门丰度的升高,具有上述表型的细菌丰度也随着升高。研究结果表明,放线菌门有抗胁迫的能力[46],本研究中QS组和OS组中放线菌门的相对丰度高于其他2组,胁迫耐受表型也表现出相同的变化。细菌的表型受多种因素影响,在凤丹的种植中,不同模式下土壤理化性质存在差异,环境异质性大,微生物通过表型的适应性调整,以应对环境的改变[47]。
对果实生长期凤丹的部分生长指标进行测定,发现套种在榉树下的凤丹植株生长状态最佳,其株高显著高于其他2组,这可能和子囊菌门、酸杆菌门中一些有益菌的丰度增加有关。
综上,林下种植凤丹提高了根际微生物多样性,不同种植模式下凤丹根际微生物群落结构存在较大差异,榉树下套种凤丹提高了酸杆菌门、子囊菌门、丛赤壳属等有益菌的丰度,减少了镰刀菌属和Ceratobasidium等致病菌的丰度。测量生长指标发现榉树下种植的凤丹长势最好,由此推断,榉树下种植凤丹有助于植株的生长发育。我们今后还将从土壤代谢组学、籽粒产量以及凤丹药用成分等角度继续探索不同种植模式对凤丹的影响,以期为凤丹高效栽培技术以及林农复合经营提供新思路。
参考文献:
[1]张姗姗,赵凡,魏小豹,等. 凤丹和紫斑牡丹6个产地种子脂肪酸组分的比较[J]. 中国粮油学报, 2021, 36(3): 84-90.
[2]谢一青,吴庆锥,余孟杨,等. 凤丹南移福建的适应性分析[J]. 热带作物学报, 2021,42(2): 592-598.
[3]王仲伟,王欢利,张文献,等. 江苏油用牡丹的发展思考[J]. 江苏林业科技, 2016, 43(6): 53-55.
[4]裴姿琛,胡永宏,刘泽,等. 新型木本油料作物——油用牡丹的开发和利用[J]. 林业与生态科学, 2018, 33(4): 358-363.
[5]王勇,何舒,熊冰杰,等. 不同栽培模式对人参根际土壤微生物多样性的影响研究[J]. 中草药, 2021, 52(17): 5303-5310.
[6]刘王锁,李海泉,何毅,等. 根际微生物对植物与土壤交互调控的研究进展[J]. 中国土壤与肥料, 2020(5): 318-327.
[7]KHAN N, ALI S, SHAHID M , et al. Insights into the interactions among roots, rhizosphere, and rhizobacteria for improving plant growth and tolerance to abiotic stresses: a review[J]. Cells,2021,10(6): 1551
[8]SONG Y, LI X, YAO S, et al. Correlations between soil metabolomics and bacterial community structures in the pepper rhizosphere under plastic greenhouse cultivation[J]. Science of the Total Environment, 2020, 728: 138439.
[9]KANG S, KHAN A L, WAQAS M, et al. Plant growth-promoting rhizobacteria reduce adverse effects of salinity and osmotic stress by regulating phytohormones and antioxidants in Cucumis sativus[J]. Journal of Plant Interactions, 2014, 9(1): 673-682.
[10]YUAN J, ZHAO J, WEN T, et al. Root exudates drive the soil-borne legacy of aboveground pathogen infection[J]. Biomed Central, 2018, 6(1): 156.
[11]BAL H, NAYAK L,DAS S, et al. Isolation of ACC deaminase producing PGPR from rice rhizosphere and evaluating their plant growth promoting activity under salt stress[J]. Plant Soil,2013, 366: 93-105.
[12]KIM Y C, LEVEAU J, MCSPADDEN GARDENER B B, et al. The multifactorial basis for plant health promotion by plant-associated bacteria[J]. Applied and Environmental Microbiology, 2011, 77(5): 1548-1555.
[13]KASIM W A, GAAFAR R M, ABOU-ALI R M, et al. Effect of biofilm forming plant growth promoting rhizobacteria on salinity tolerance in barley[J]. Annals of Agricultural Sciences, 2016,61(2):217-227.
[14]杨潇湘,张蕾,黄小琴,等. 基于高通量测序分析大豆和油菜根际微生物群落结构的差异[J]. 应用生态学报, 2019, 30(7): 2345-2351.
[15]刘振香,刘鹏,贾绪存,等. 不同水肥处理对夏玉米田土壤微生物特性的影响[J]. 应用生态学报, 2015, 26(1): 113-121.
[16]姜莉莉,宫庆涛,武海斌,等. 不同生草处理对苹果园土壤微生物群落的影响[J]. 应用生态学报, 2019, 30(10): 3482-3490.
[17]艾铄,张丽杰,肖芃颖,等. 高通量测序技术在环境微生物领域的应用与进展[J]. 重庆理工大学学报(自然科学), 2018, 32(9): 111-121.
[18]王林,李冰,朱健. 高通量测序技术在人工湿地微生物多样性研究中的研究进展[J]. 中国农学通报, 2016, 32(5): 10-15.
[19]牛世全,龙洋,李海云,等. 应用IlluminaMiSeq高通量测序技术分析河西走廊地区盐碱土壤微生物多样性[J]. 微生物学通报, 2017, 44(9): 2067-2078.
[20]尹原森,马国胜,曹春燕,等. 不同地区凤丹根际土壤微生物功能多样性分析[J]. 分子植物育种, 2021, 19(20):6918-6926.
[21]郭丽丽,尹伟伦,郭大龙,等. 油用凤丹牡丹不同种植时间根际细菌群落多样性变化[J]. 林业科学, 2017, 53(11): 131-141.
[22]李昱莹,刘曙光,廉小芳,等. 油用牡丹凤丹不同种植年限根际真菌群落多样性变化研究[J]. 基因组学与应用生物学, 2020, 39(4): 1672-1685.
[23]全国花卉标准化技术委员会. 油用牡丹栽培技术规程: LY/T 2958-2018[S]. 北京: 国家林业局,2018.
[24]章家恩,高爱霞,徐华勤,等. 玉米/花生间作对土壤微生物和土壤养分状况的影响[J]. 应用生态学报, 2009, 20(7): 1597-1602.
[25]王悦,杨贝贝,王浩,等. 不同种植模式下丹参根际土壤微生物群落结构变化[J]. 生态学报, 2019, 39(13): 4832-4843.
[26]王丽霞,井涛,殷晓敏,等. 不同种植模式对香蕉根区土壤养分及可培养微生物数量的影响[J]. 中国南方果树, 2020, 49(4): 80-86.
[27]陈泽斌,陈敏,阮亚男,等. 不同种植模式草莓根际细菌和真菌群落结构的变化[J]. 昆明学院学报, 2019, 41(6): 52-56.
[28]李娟. 油用牡丹与经济林木立体栽培模式研究[D]. 郑州: 郑州大学, 2019.
[29]王国霞,罗青,杨玉珍,等. 立体栽培模式对油用牡丹生长和产量的影响[J]. 贵州农业科学, 2018, 46(12): 100-103.
[30]鲜文东,张潇橦,李文均. 绿弯菌的研究现状及展望[J]. 微生物学报, 2020,60(9):1801-1820.
[31]刘芯竹. 覆盖经营对毛竹林土壤理化性质和细菌群落多样性影响[D]. 杭州:浙江农林大学, 2021.
[32]張永敢,赵娟,张玉洁,等. 药用植物凤丹(Paeonia suffruticosa)根际土壤细菌群落16S rRNA基因的ARDRA分析[J]. 生态学报, 2016, 36(17): 5564-5574.
[33]南丽丽,郭全恩,谭杰辉,等. 轮作休耕模式对土壤细菌群落的影响[J]. 干旱地区农业研究, 2020, 38(6): 128-134.
[34]李倩,袁玲,杨水平,等. 连作对黄花蒿生长及土壤细菌群落结构的影响[J]. 中国中药杂志, 2016, 41(10): 1803-1810.
[35]杨安娜,陆云峰,张俊红,等. 杉木人工林土壤养分及酸杆菌群落结构变化[J]. 林业科学, 2019, 55(1): 119-127.
[36]刘婷,肖仲久,李小霞,等. 高通量测序技术分析茅台酿酒高粱根际真菌群落特征[J]. 内蒙古农业大学学报(自然科学版), 2021,43(1): 48-52.
[37]马继琼,孙一丁,杨奕,等.不同叶稻瘟抗性水稻品种对根际真菌的影响[J]. 江苏农业科学,2021,49(12):75-80.
[38]刘震,徐玉鹏,王秀领,等.黑龙港苜蓿根际土壤真菌群落结构及多样性分析[J]. 江苏农业科学,2021,49(10):197-201.
[39]薛晓敏,王来平,韩雪平,等. 不同树盘覆盖对矮砧苹果园土壤微生物群落结构和多样性的影响[J]. 生态学报, 2021,41(4): 1528-1536.
[40]王丽娟,王威威,吕雪,等. 鹿蹄草内生真菌的分离鉴定及其对鹿蹄草的生理效应[J]. 东北农业大学学报, 2013, 44(8): 87-93.
[41]MICHAL J J, ANATOLI L, ALEXANDRA F, et al. The beneficial root-colonizing fungus Mortierella hyalina promotes the aerial growth of Arabidopsis and activates calcium-dependent responses which restrict Alternaria brassicae-induced disease development in roots.[J]. Molecular Plant-microbe Interactions, MPMI, 2018, 32(3): 351-363.
[42]张向民. 镰刀菌属分类学研究历史与现状[J]. 菌物研究, 2005(2): 63-66.
[43]唐涛,王帆帆,郭杰,等. 12种生物源杀菌剂对白术根腐病的防效[J]. 植物保护, 2021, 47(3): 288-293.
[44]耿贵,杨瑞瑞,於丽华,等. 作物连作障碍研究进展[J]. 中国农学通报, 2019, 35(10): 36-42.
[45]杨睿. 贵州喀斯特山区花椒林根际土壤微生物群落结构及功能研究[D]. 贵州:贵州师范大学, 2021.
[46]杨睿,李娟,龙健,等. 贵州喀斯特山区不同种植年限花椒根际土壤细菌群落结构特征研究[J]. 生态环境学报, 2021, 30(1): 81-91.
[47]赵鹏宇,白雪,燕平梅,等. 华北落叶松林土壤细菌群落结构与表型的环境异质性响应[J]. 林业科学, 2021, 57(7): 101-110.
(责任编辑:陈海霞)
收稿日期:2021-12-16
基金项目:江苏省农业科技自主创新基金项目[CX(19)3066] ;江苏现代农业产业技术体系建设项目[JATS(2021)507]
作者简介:刘智(1996-),男,陕西汉中人,硕士研究生,主要从事油用牡丹根际微生物研究。(E-mail)liuzhi2021702@163.com
通讯作者:王仲伟,(E-mail)w0414115@Sina.cn;汤诗杰,(E-mail)tangshijie69@aliyun.com
