溶血性曼氏杆菌重要抗原的免疫原性分析
2022-05-16陆奕彤李垚杨发龙
陆奕彤 李垚 杨发龙






摘要:旨在通过分析溶血性曼氏杆菌重要抗原的免疫原性,为疫苗和诊断试剂研制提供依据。在生物信息学分析的基础上,构建溶血性曼氏杆菌lktA、ompA、plpE、plpF、ompP2和gs60基因的原核重组表达载体,并将其转化至大肠杆菌BL21(DE3)中进行表达,获得重组蛋白质。随后用被抗溶血性曼氏杆菌感染的绵羊血清进行Western-blot和酶联免疫吸附测定(ELISA),评价各蛋白质的免疫原性并筛选优势免疫原;用各重组蛋白质免疫小鼠,评价免疫小鼠后诱导其产生的抗体水平,以评价各重组蛋白质作为重组疫苗的潜在价值。Western-blot和ELISA检测结果表明,各重组蛋白质均具有良好的免疫原性,其中rLktA、rOmpA、rGs60与感染的绵羊血清结合能力最强,为优势免疫原;各重组蛋白质免疫小鼠后均能诱导其產生体液免疫应答,其中rOmpA、rPlpE和rPlpF免疫小鼠后诱导其产生的抗体在免疫后35 d仍能与全菌蛋白质结合。研究结果为溶血性曼氏杆菌感染血清学诊断试剂的开发和新型疫苗的研制提供了重要的试验数据。
关键词:溶血性曼氏杆菌;重要抗原;免疫原性
中图分类号:S852.61+2文献标识码:A文章编号:1000-4440(2022)02-0446-07
Immunogenicity analysis of major antigens of Mannheimia haemolytica
LU Yi-tong,LI Yao,YANG Fa-long
Abstract:The purpose of this study is to compare and analyze the immunogenicity of major antigens of Mannheimia haemolytica, and to provide a basis for the development of vaccines and diagnostic reagents. Based on bioinformatics analysis, prokaryotic expression vectors of lktA, ompA, plpE, plpF, ompP2 and gs60 genes were constructed and transformed into Escherichia coli BL21(DE3), and recombinant proteins were expressed and purified. Subsequently, Western-blot and enzyme-linked immunosorbent assay (ELISA) were performed by using sheep anti-Mannheimia haemolytica serum to evaluate the immunogenicity of each protein, and to screen the dominant immunogens. Meanwhile, mice were immunized with each recombinant protein, and the antibody levels were tested to evaluate potential value of each protein as a recombinant vaccine. The results demonstrated that all tested proteins were good immunogens, while rLktA, rOmpA and rGs60 showed the strongest binding ability to infected sheep serum, suggesting that they were the dominant immunogens of Mannheimia haemolytica. All recombinant proteins could induce humoral immune response in mice, while rOmpA, rPlpE and rPlpF could induce high titer antibody after 35 days post immunization. These results provide important data for developing serological diagnostic tools and new vaccines.
Key words:Mannheimia haemolytica;important antigen;immunogenicity
溶血性曼氏杆菌(Mannheimia haemolytica)属于巴氏杆菌科曼氏杆菌属,是一种革兰氏阴性兼性厌氧球杆菌。其作为一种条件致病菌,溶血性曼氏杆菌常存在于牛、羊等反刍动物上呼吸道中。当动物受到一些应激因素(如天气骤变、长途运输或病毒、支原体感染等)影响,造成机体免疫能力下降时,溶血性曼氏杆菌便可入侵动物肺部,引起动物发生严重的肺炎[1-2]。溶血性曼氏杆菌是公认的引起牛呼吸道综合征(Bovine respiratory disease complex,BRDC)的主要病原[3]。近年来,越来越多的研究发现,溶血性曼氏杆菌同样是导致绵羊和山羊等小反刍动物发生呼吸道疾病的重要病原[4],还可以导致羔羊败血症和母羊乳房炎的发生[5-6]。
目前,中国还缺乏针对溶血性曼氏杆菌的使用广泛且安全有效的商品化疫苗,同时也没有特异、敏感的血清学诊断试剂,而国外使用的商品化疫苗仅能提供部分免疫保护[7]。因此,有必要对溶血性曼氏杆菌的病原特征及其重要的免疫原进行深入研究,从而有助于溶血性曼氏杆菌新型疫苗和血清学诊断试剂的研制。
国内外研究者已经在溶血性曼氏杆菌免疫原方面进行了一些相关研究,发现白细胞毒素(LKT)及OmpA、PlpE等多个外膜蛋白质等均具有良好的免疫原性,可诱导机体产生一定的免疫保护作用[8-10]。然而,虽然上述研究对一些潜在的诊断抗原和疫苗的候选蛋白质进行了评价,但对于其中哪些可以作为优势免疫原诱导机体产生高水平免疫应答尚不清楚。此外,相关研究多以牛源菌株为对象,分析其感染牛后诱导牛产生的免疫应答情况,而对溶血性曼氏杆菌感染羊后诱导羊产生的免疫应答情况的报道甚少。
本研究分析比较了溶血性曼氏杆菌感染羊后LktA、OmpA、PlpE、PlpF、OmpP2、Gs60等6个重要免疫原在羊体内诱导产生的抗体水平以及这些免疫原的重组蛋白质在小鼠体内诱导产生的免疫应答水平,从而为血清学诊断试剂的开发和新型疫苗的研制提供有用的试验数据。
1材料与方法
1.1菌株、载体及血清
溶血性曼氏杆菌临床分离株S4由笔者所在实验室(西南民族大学青藏高原动物遗传资源保护与利用教育部重点实验室)分离鉴定和保存;pET-28α(+)载体为Novagen公司产品;大肠杆菌E.coil DH5α、BL21(DE3)感受态细胞为天根生化科技(北京)有限公司产品;35份溶血性曼氏杆菌感染绵羊血清及3份阴性血清由笔者所在实验室收集并保存。
1.2主要试剂
氨苄青霉素、卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)购自美国Sigma公司;金牌Mix(green)Golden Star T6 Super PCR Mix(1.1×)购自北京擎科信业生物公司;核酸相对分子质量标准DNA marker、蛋白质相对分子质量标准品、限制性内切酶Bam HⅠ、XhoⅠ与T4 DNA连接酶购自日本TaKaRa公司;Gel Extraction Kit、Plasmid Miniprep Kit、Cycle Pue Kit购自美国Omega公司;镍金属螯合亲和[组氨酸(His)标签蛋白]蛋白质纯化柱购自常州天地人和生物科技有限公司;27 mm透析袋(相对分子质量:35 000)购自广州赛国生物科技有限公司;辣根过氧化物酶(HRP)标记驴抗绵羊、HRP标记山羊抗鼠、SuperLumia ECL HPR Substrate Kit购自美国Abbkine公司;磷酸缓冲盐溶液(PBS)、酶标抗体稀释液、血清稀释液、3,3′,5,5′-四甲基联苯胺(TMB)显色液、终止液购自武汉博士德生物工程有限公司;二喹啉甲酸(BCA)蛋白质定量试剂购自江苏凯基生物技术股份有限公司;酶标板购自Corning公司。
1.3引物设计
为制备原核表达重组蛋白质,对ompA、plpE、plpF、ompP2、gs60基因全长编码序列(CDS)进行克隆;对于lktA基因,对其2 019~2 819位核苷酸编码序列进行截短表达。PCR扩增引物用Primer Premier 5軟件设计,由生工生物工程(上海)股份有限公司合成,引物具体信息见表1。
1.4PCR扩增
采用常规酚-三氯甲烷法从溶血性曼氏杆菌S4株中提取总DNA作为模板,利用表1中的引物对各基因片段进行PCR扩增。反应总体系为20 μl,包括Mix(green)Golden Star T6 Super PCR Mix(1.1×)(5 U/μl)10 μl,上游引物、下游引物各1 μl,DNA模板2 μl,去离子水6 μl。反应条件:95 ℃预变性 5 min;94 ℃变性30 s,退火30 s(lktA、ompA、plpF、plpE、ompP2、gs60基因对应的退火温度分别为60.0 ℃、58.0℃、63.0 ℃、57.7 ℃、57.8 ℃、55.9 ℃);72.0 ℃延伸(其中gs60基因延伸1 min 30 s,其他基因均延伸40 s),共35个循环;72.0 ℃延伸10 min,16 ℃结束反应。PCR产物用1.5%琼脂糖凝胶电泳进行检测。
1.5原核表达载体的构建
利用Gel Extraction Kit对上述各PCR产物进行回收纯化。随后用限制性内切酶Bam HⅠ、Xho Ⅰ对pET-28a(+)载体及纯化的目的片段进行双酶切。利用Cycle Pue Kit纯化酶切产物,采用T4 DNA连接酶进行连接反应。将连接产物转化至DH5α感受态细胞中,然后将重组质粒DH5α工程菌涂布于含有卡那霉素(50 μg/ml)的LB琼脂选择培养基上。第2 d挑取疑似阳性菌落,利用质粒提取试剂盒Plasmid Miniprep Kit对其进行质粒提取,随后进行PCR鉴定和Bam HⅠ、XhoⅠ双酶切鉴定,将鉴定为阳性的样本送至生工生物工程(上海)股份有限公司进行测序确认。
1.6重组蛋白质的诱导表达和可溶性分析
将pET-28a(+)-X转化至Escherichia coli BL21(DE3)感受态细胞中,获得表达工程菌,将表达工程菌菌种按1∶100的体积比接入100 ml LB液体培养基(卡那霉素质量浓度为50 μg/ml)中,将终浓度为1 mmol/L的IPTG于37 ℃诱导表达9 h,然后取2 ml菌液,于8 000 r/min、4 ℃离心15 min,收集菌体,经pH值为7.4的PBS重悬,与等体积的2×SDS-聚丙烯酰胺凝胶电泳(PAGE)上样缓冲液混合,加热煮沸5 min,通过含量为12%的分离胶进行SDS-PAGE检测。
将检测正确的样本在冰水浴中通过超声波破碎仪于400 W破碎20 min(超声2 s+暂停6 s为1个循环),破碎后于12 000 r/min、4 ℃离心15 min,分别收集沉淀、上清。取少许沉淀,经pH值为7.4的PBS重悬,然后将沉淀、上清均用含量为12%的分离胶进行SDS-PAGE,对重组蛋白质进行可溶性分析。
1.7重组蛋白质的纯化
将上述诱导表达后的菌液于8 000 r/min、4 ℃离心15 min,收集菌体并用PBS重悬,在冰浴中进行超声破碎(400 W,20 min)。破碎后于12 000 r/min、4 ℃离心15 min,弃去上清,收集沉淀,将沉淀用破碎Buffer(Binding Buffer)溶解,在冰浴中进行二次超声破碎,于400 W破碎20 min(超声2 s+暂停 6 s为1个循环),破碎后于12 000 r/min、4 ℃离心20 min,收集上清液,进行镍琼脂糖亲和层析纯化。最后将制备好的各组分蛋白质置于-80 ℃冰箱中保存。
1.8优势免疫原的筛选
为评价溶血性曼氏杆菌感染羊后蛋白质rOmpA、rPlpE、rPlpF、rOmpP2、rGs60诱导免疫应答的能力,筛选能够与感染动物血清抗体高效结合的优势免疫原,以上述纯化的各重组蛋白质作为包被抗原,分别以临床感染绵羊阳性血清、阴性血清作为一抗,进行间接酶联免疫吸附剂测定(ELISA)。主要过程如下:每孔用100 μl、5 μg/ml重组蛋白质包被酶标板,用PBST(500 ml PBS+25 μl Tween-20)洗涤3次后再用5%(质量体积比)脱脂奶粉在37 ℃作用2 h进行封闭,洗涤3次后加入100 μl按1∶200稀释的临床感染动物血清或阴性血清,在37 ℃孵育1 h,洗涤5次后加入100 μl按1∶6 000稀释的辣根过氧化物酶(HRP)标记驴抗绵羊免疫球蛋白(IgG),37 ℃孵育45 min,洗涤5次后加入100 μl底物3,3′,5,5′-四甲基联苯胺(TMB),室温下显色10 min,加入100 μl终止液,并在酶标仪上读取OD450。
1.9重组蛋白质的免疫原性分析
将40 μg重组蛋白质与ISA 201佐剂按等体积混合进行乳化,分别免疫6只6~8周龄的雌性BALB/c小鼠,并设PBS对照组。首次免疫14 d后用相同剂量进行二次免疫,并分别于首次免疫后0 d、7 d、14 d、21 d、28 d、35 d采集小鼠血清。以各重组蛋白质作为包被抗原(1孔50 ng),以按1∶50比例稀释的小鼠血清为一抗进行间接ELISA检测,从而评价各重组蛋白质诱导产生的抗体水平(用OD450表示)。
2结果与分析
2.1溶血性曼氏杆菌重要抗原编码基因的PCR扩增
为了构建重要抗原编码基因的原核表达载体,利用表1中的引物对各基因片段进行PCR扩增,结果均获得与预期大小一致的条带,详见图1。
2.2原核表达载体的构建及鉴定结果
对目的片段和pET-28a(+)载体进行双酶切后,将酶切所得基因分别与pET-28a(+)连接,并用连接后的载体分别转化DH5α感受态细胞,再用含有卡那霉素的LB琼脂平板筛选疑似阳性菌落,培养后提取质粒,对质粒进行特异性PCR鉴定,且使用Bam HⅠ和XhoⅠ對质粒进行双酶切鉴定。结果表明,除了在相应位置出现与预期相符的目的条带外,还在5 800 bp左右处出现了条带。此外,测序结果显示,6个质粒均为阳性质粒,表明本研究成功构建了6个重组原核表达载体。
2.3重组蛋白质的诱导表达和可溶性分析
将诱导的菌液离心,用PBS重悬沉淀并洗涤沉淀后在冰水浴中进行超声破碎,破碎完成后,离心分离上清液和沉淀,分别使用上清液、沉淀进行SDS-PAGE。可溶性分析检测结果显示,6个重组蛋白质破碎后的上清液中均没有出现条带,而沉淀中出现与预期相符的目的条带(图2),说明6个重组蛋白质都以包涵体的形式表达。
2.4重组蛋白质的纯化
将菌体经过第1次PBS重悬破碎洗涤后,留下的沉淀再用含有8 mol/L尿素的Buffer Ⅱ 溶解破碎,将离心后留下的上清液过镍柱,进行镍柱亲和层析纯化。在洗杂和洗脱过程中,使用具有不同咪唑浓度(20 mmol/L、50 mmol/L和500 mmol/L)的Wash Buffer进行梯度洗脱,对收集到的蛋白质进行SDS-PAGE检测。由图3可以看出,各基因对应的重组蛋白质经电泳后均有单一且符合预期大小的目的条带,表示重组蛋白质的纯化效果良好。对纯化结果良好的蛋白质组分进行透析复性、浓缩及二喹啉甲酸(BCA)试剂盒蛋白质浓度检测,以便进行进一步的研究。
2.5优势免疫原的筛选结果
使用按上述步骤制备的纯化重组蛋白质作为包被抗原,以临床感染动物血清及阴性血清作为一抗,进行间接ELISA检测,其目的是为了能够筛选与感染动物血清高效结合的优势免疫原。由图4可以看出,溶血性曼氏杆菌感染羊后,本研究选择的6种免疫原蛋白质在绵羊体内产生的6种抗体水平存在明显差异,可见不同重组蛋白质与感染血清的结合能力也有差异,按OD值从高到低排序为 rOmpA、rLktA、rGs60、rPlpE、rOmpP2、rPlpF。由此可见,rOmpA、rLktA和rGS60是进行溶血性曼氏杆菌血清学诊断试剂开发的良好候选蛋白质。
2.6重组蛋白质疫苗诱导小鼠产生的抗体水平
为了评价制备的重组蛋白质作为亚单位疫苗候选蛋白质的潜力,将具有相同蛋白质剂量(40 μg)并且经无菌检验及物理性状检验的重组蛋白质疫苗分组后经皮下注射免疫小鼠,以免疫后不同时间的小鼠血清作为一抗,以纯化的重组蛋白质作为包被抗原,进行间接ELISA检测,以评价重组蛋白质免疫小鼠后能否使小鼠产生特异性抗体、抗体水平的变化及抗体的持续时间。由图5可以看出,6个重组蛋白质均能使小鼠产生免疫应答,其中rLktA、rOmpA、rPlpE、rPlpF、rGs60经过2次免疫后,抗体水平不断上升,并持续至试验首免后35 d仍未下降。其中,rOmpA产生的抗体水平较高;rOmpP2产生的抗体水平较低,并且持续时间较短,在首免后28 d开始下降。由此可见,除rOmpP2外,其他重组蛋白质均具有作为亚单位疫苗候选蛋白质的潜力。
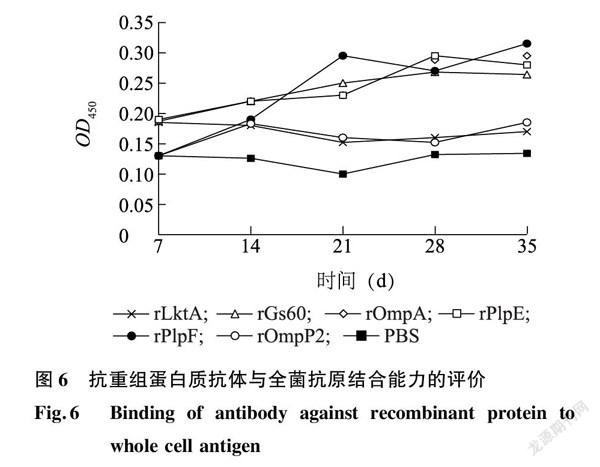
2.7抗重组蛋白质抗体与溶血性曼氏杆菌全菌蛋白质结合能力的评价
为了评价各重组蛋白质免疫后产生的抗体能否与溶血性曼氏杆菌的菌体结合,从而具有潜在的免疫保护作用,以各重组蛋白质免疫小鼠后的血清作为一抗、以制备的溶血性曼氏杆菌全菌蛋白质作为包被抗原进行ELISA检测。由图6可以看出,rOmpA、rPlpE、rPlpF免疫后诱导产生的抗体能与溶血性曼氏杆菌的全菌蛋白质高效结合,抗体水平明显高于阴性对照,并且在免疫后35 d仍能与全菌蛋白质结合。由此可见,rOmpA、rPlpE、rPlpF可能具有潜在的免疫保护作用。
3讨论
溶血性曼氏杆菌作为引起牛、羊等反刍动物呼吸道疾病的重要病原,给国内外养殖业造成了巨大的经济损失[11-13],仅在北美地区,每年给肉牛养殖业造成的经济损失就高达数十亿美元[14],因此对该病进行有效控制尤为紧迫。开发敏感的诊断工具和高效的疫苗是对该病进行防控的重要措施[15],目前国外使用的商品化疫苗仅能提供部分免疫保护[7]。因此,为了更好地对该病进行防控,有必要对溶血性曼氏杆菌的免疫原分子进行更全面的认识,国内外学者已进行了一些相关研究。例如,2010年Ayalew等[16,9]通过免疫蛋白质组学分析证实了55种可能具有免疫原性的溶血性曼氏杆菌的外膜蛋白质,包括OmpA、OmpP2、LktA、PlpE等。其中,脂蛋白PlpE是最早发现于溶血性曼氏杆菌中的一种脂蛋白,Yalew等[17]通过对PlpE的研究发现,重组PlpE免疫牛后可诱导牛产生良好的免疫应答,随后他们用重组溶血性曼氏杆菌OmpA对牛进行免疫,用补体介导的方式刺激机体产生了高抗体反应[8]。Omaleki等[18]后来将PlpE与LktA进行融合表达,结果表明,融合表达后免疫小鼠能够使其产生良好的保护效果。为了进一步评价溶血性曼氏杆菌中各重要功能蛋白质在感染动物后的免疫原性,并筛选适合的免疫原蛋白质,后续进行血清学诊断方法的研究和新型疫苗的研制。本研究从绵羊源溶血性曼氏杆菌中对lktA、ompA、plpE、plpF、ompP2、gs60等6个基因进行了克隆和原核表达,随后评价了各蛋白质的免疫原性及重组蛋白质诱导机体产生的免疫应答水平。
建立血清学检测方法的关键是所采用的抗原能否与大多数临床感染血清反应,并且能够高效结合。为了筛选溶血性曼氏杆菌中适合作为诊断抗原的优势免疫原蛋白质,本研究采用间接ELISA方法分析比较了6种免疫原与35份临床感染阳性血清和3份阴性血清的结合反应能力,结果发现,虽然所有6种蛋白质均能不同程度地与临床感染血清结合,但各自的结合能力有差别。其中rOmpA、rLktA、rGs60可与绝大多数感染动物血清反应,且具有很强的结合能力,说明它们是优势免疫原,可以作为溶血性曼氏杆菌血清学诊断试剂开发的良好候选蛋白质。但是,各蛋白质作为诊断抗原的特异性还需要进行进一步的验证。
开发新型亚单位疫苗是溶血性曼氏杆菌疫苗研发的重要方向。作为疫苗候选蛋白质,必须在免疫后能诱导机体产生强烈和持续的免疫应答。本研究采用制备的6种重组蛋白质免疫小鼠,发现所有重组蛋白质均可以诱导机体产生较高水平的体液抗体。其中,rLktA、rOmpA、rPlpE、rPlpF、rGs60免疫后产生的抗体水平高,且在试验结束时(免疫后35 d)仍可保持较高水平,说明上述5种重组蛋白质,特别是rOmpA具有作为亚单位疫苗候选蛋白质的潜力。
本研究在优势免疫原筛选评价中rLktA能够检测出更多的阳性血清,是作为血清学诊断试剂开发的良好候选蛋白质。然而,采用rLktA免疫小鼠后产生的特异性抗体与溶血性曼氏杆菌全菌蛋白质的结合能力较弱,可能是由于白细胞毒素(LKT)在溶血性曼氏杆菌生长的对数期分泌于培养液的上清液中[19],作为释放于胞外的毒素蛋白质,在全菌蛋白质中其成分含量很低。因此,作为溶血性曼氏杆菌最为重要的毒力因子,在开发新型亚单位疫苗时,将OmpA、PlpE与LKT进行融合表达将是重要的策略之一。
本研究对6个重要的溶血性曼氏杆菌免疫原蛋白质的免疫原性及其重組蛋白质诱导的体液免疫应答水平进行了比较分析,为进一步将这些蛋白质作为抗原开发血清学诊断试剂和新型疫苗提供了重要的参考依据。
参考文献:
[1]SRIKUMARAN S, KELLING C L, AMBAGALA A. Immune evasion by pathogens of bovine respiratory disease complex[J]. Anim Health Res Rev, 2007, 8(2):215-229.
[2]朱利霞,王洪彬,赵希艳,等.牛细菌性呼吸道疾病研究进展[J]. 黑龙江畜牧兽医, 2019(14):63-66.
[3]ANGEN , QUIRIE M, DONACHIE W, et al. Investigations on the species specificity of Mannheimia (Pasteurella) haemolytica serotyping[J]. Veterinary Microbiology, 1999, 65(4):283-290.
[4]马增军,颛锡良,芮萍,等. 羊溶血性曼氏杆菌主要生物学特性测定[J]. 黑龙江畜牧兽医, 2005(7):39-40.
[5]李娟,刘阳,彭欠欠,等. 羊溶血性曼氏杆菌的分离与鉴定[J]. 黑龙江畜牧兽医, 2013(20): 96-97.
[6]马冰杰. 羊乳腺炎的发生与诊治[J]. 黑龙江动物繁殖, 2016, 24(3):49-50.
[7]周金玲. 牛溶血性曼氏杆菌小鼠感染模型建立及灭活疫苗免疫原性研究[D]. 大庆:黑龙江八一农垦大学, 2018.
[8]AYALEW S, SHRESTHA B, MONTELONGO M, et al. Immunogenicity of Mannheimia haemolytica recombinant outer membrane proteins serotype 1-specific antigen, OmpA, OmpP2 and OmpD15[J]. Clinical and Vaccine Immunology, 2011, 18(12):2067-2074.
[9]AYALEW S, COMFER A W, BLACKWOOD E R. Characterization of immunodominant and potentially protective epitopes of Mannheimia haemolytica serotype 1 outer membrane lipoprotein PlpE[J]. Infection and Immunity, 2004, 72(12):7265-7274.
[10]BATRA S A, SHANTNALINGAM S, DONOFRIO G, et al. A chimeric protein comprising the immunogenic domains of Mannheimia haemolytica leukotoxin and outer membrane protein PlpE induces antibodies against leukotoxin and PlpE[J]. Veterinary Immunology and Immunopathology, 2016, 175:36-41.
[11]冯旭飞,刀筱芳,杨发龙,等. 绵羊肺脏中溶血性曼氏杆菌的分离鉴定及其药物敏感性分析[J]. 中国畜牧兽医, 2014, 41(8): 224-228.
[12]KUMAR J, DIXIT S K, KUMAR R. Rapid detection of Mannheimia haemolytica in lung tissues of sheep and from bacterial culture[J]. Veterinary World, 2015, 8(9):1073-1077.
[13]FERANNDEZ S, GALAPERO J, GMEZ L, et al. Mannheimia haemolytica and Bibersteinia trehalosi serotypes isolated from merino breed lambs in extremadura (southwestern Spain)[J]. Indian Journal of Microbiology, 2016, 56(4):513-515.
[14]NOYES N R, BENEDICT K M, GOW S P, et al. Mannheimia haemolytica in feedlot cattle: prevalence of recovery and associations with antimicrobial use, resistance, and health outcomes[J]. Journal of Veternary Internal Medicine, 2015, 29(2): 705-713.
[15]董捷. 淺谈溶血性曼氏杆菌研究进展[J]. 广西畜牧兽医, 2020, 180(1):45-46.
[16]AYALEW S, CONFER A W, HARTSON S D, et al. Immunoproteomic analyses of outer membrane proteins of Mannheimia haemolytica and identification of potential vaccine candidates[J]. Proteomics, 2010, 10(11):2151-2164.
[17]YALEW S, CONFER A W, PAYTON M E, et al. Mannheimia haemolytica chimeric protein vaccine composed of the major surface-exposed epitope of outer membrane lipoprotein PlpE and the neutralizing epitope of leukotoxin[J]. Vaccine, 2008, 26(38):4955-4961.
[18]OMALEKI L, BROWNING G F, BARBER S R, et al. Sequence diversity, cytotoxicity and antigenic similarities of the leukotoxin of isolates of Mannheimia species from mastitis in domestic sheep[J]. Vet Microbiol, 2014, 174(1/2): 172-179.
[19]SHEWEN P E, WILKIE B N. Cytotoxin of Pasteurella haemolytica acting on bovine leukocytes[J]. Infection and Immunity,1982, 35(1):91-94.
(责任编辑:徐艳)
收稿日期:2021-09-06
基金项目:四川省重点研发项目(2021YFN0008);西南民族大学研究生创新项目(CX2020SZ57)
作者简介:陆奕彤(1996-),女,辽宁锦州人,硕士研究生,研究方向为动物病原生物学。(E-mail)981489868@qq.com
通讯作者:杨发龙,(E-mail)yang.falong@swun.edu.cn
