整合素αvβ1在猪流行性腹泻病毒(PEDV)侵染Vero细胞过程中的作用
2022-05-16原冬伟王一栾广宇张旭
原冬伟 王一 栾广宇 张旭







摘要:为明确整合素αvβ1在猪流行性腹泻病毒(PEDV)侵染过程中的作用,通过对整合素αvβ1在Vero细胞表面的过表达和抑制反应,检测PEDV在侵染过程中的病毒载量和蛋白质表达量的变化。结果显示,Vero细胞表面整合素αvβ1的过表达使病毒载量和蛋白质表达量升高,Vero细胞表面整合素αvβ1基因的沉默使病毒载量和蛋白质表达量显著降低。整合素αvβ1可促进PEDV侵染Vero细胞。
关键词:整合素αvβ1;PEDV;侵染;Vero细胞
中图分类号:S858.282.65+9.6文献标识码:A文章编号:1000-4440(2022)02-0422-07
Role of integrin αvβ1 for porcine epidemic diarrhea virus (PEDV) infection in Vero cells
YUAN Dong-wei,WANG Yi,LUAN Guang-yu,ZHANG Xu
Abstract:In this study, we detected the viral load and protein expression of porcine epidemic diarrhea virus (PEDV) after overexpression and inhibition of integrin αvβ1 on the surface of Vero cells, and then cleared the role of integrin αvβ1 in the PEDV infection process. The results showed that the viral load and protein expression were significantly increased in the Vero cells which overexpressed integrin αvβ1, and the viral load and protein expression were significantly reduced in the Vero cells with silent integrin αvβ1 gene. Integrin αvβ1 promotes PEDV to infect Vero cells.
Key words:integrin αvβ1;porcine epidemic diarrhea virus (PEDV);infection;Vero cells
江蘇农业学报2022年第38卷第2期
原冬伟等:整合素αvβ1在猪流行性腹泻病毒(PEDV)侵染Vero细胞过程中的作用
猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)是猪流行性腹泻病(Porcine epidemicdiarrhea, PED)的病原,易感群体涉及不同年龄和不同品系猪,尤其以引起哺乳仔猪出现水样腹泻、呕吐、脱水甚至死亡为主要特征[1]。PED是有季节变化且有地方流行趋势的猪消化道传染性疾病,上世纪70年代初期在英格兰被发现,目前已传播至全球36个国家,遍布欧洲、亚洲、美洲,已经成为制约养猪业发展的重要肠道传染病,给养猪业造成巨大的经济损失[2]。
PEDV为具有囊膜结构的RNA冠状病毒,是尼多病毒目(Nidovirales)下冠状病毒科(Coronaviridae)成员,基因组大小约为28 kb,由5′和3′非翻译区(UTR)以及7个开放阅读框组成,编码4个结构蛋白及3个非结构蛋白,排列顺序为5′UTR-ORF1a-ORF1b-纤突糖蛋白基因(S)-ORF3-小包膜蛋白基因(E)-膜糖蛋白基因(M)-核衣壳蛋白基因(N)-3′UTR[3]。PEDV感染宿主细胞的过程十分复杂,主要通过病毒表面纤突糖蛋白与宿主细胞表面膜蛋白及碳水化合物分子的结合,促进病毒感染[4]。猪氨基肽酶N(pAPN)曾被报道是PEDV的细胞受体参与病毒感染,开启了PEDV侵入机理的深入研究[5-9]。然而,在后续试验中证实,在表达pAPN的猪睾丸细胞(ST)中并不能形成PEDV的感染,而对PEDV易感的非洲绿猴肾细胞(Vero细胞)又不依赖于氨基肽酶N的表达[10-13]。因此,pAPN不是PEDV感染宿主细胞必须存在的蛋白质,作为病毒感染宿主细胞受体的理论尚未完全确证,正处在探索阶段,PEDV的侵入机制仍不清楚。另外,大量研究结果显示,病毒感染宿主细胞并非依赖一种受体,大多病毒都可利用多种受体蛋白质,包括冠状病毒成员在内许多囊膜病毒,存在多个细胞感染受体或细胞感染相关蛋白质。在PEDV同科的病毒中,猪传染性胃肠炎病毒、SARS冠状病毒、人冠状病毒229E、鼠冠状病毒和禽传染性支气管炎病毒都存在多个细胞感染受体的情况[14-17]。
整合素(Integrin)是一种异源二聚体跨膜蛋白质,广泛分布于大多数哺乳动物细胞表面,可以作为多种病毒(如:人类疱疹病毒、猪瘟病毒、腺病毒、口蹄疫病毒、轮状病毒、狂犬病毒等)感染受体或辅助受体,促进病毒感染宿主细胞[18]。本实验室前期研究结果显示,整合素αvβ3能增强PEDV对非敏感细胞CHO的黏附,在PEDV感染后表达水平明显上调;整合素αvβ3增强了PEDV在Vero细胞和IECs中的复制[19-20]。有研究者报道,细胞表面蛋白整合素αvβ1在多种病毒侵染细胞过程中具有促进作用[21-23],而且其与整合素αvβ3为同家族成员,可识别PEDV S蛋白RLD配体识别序列。那么,整合素αvβ1是否也与PEDV感染相关呢?本研究通过对整合素αvβ1在Vero细胞表面的过表达和抑制反应,探索整合素αvβ1在PEDV侵染Vero细胞过程中的作用,为PEDV侵入宿主细胞机制的研究和预防策略的设计奠定基础并指出新的研究方向。
1材料与方法
1.1材料
PEDV标准毒株CV777(GenBank accession no. AF353511.1)、HA标记的真核质粒(pCAGGS-HA)、表达整合素αv的真核质粒(pCAGGS-αv)、表达整合素β1的真核质粒(pCAGGS-β1)均为前期实验制备并保存,整合素αv、整合素β1、PEDV N蛋白抗体也为本实验室制备和保存,非洲绿猴肾细胞(Vero)由中国农业科学院哈尔滨兽医研究所馈赠。
1.2试剂
本试验所用到的主要试剂见表1。
1.3siRNA设计与合成
参考GenBank中非洲绿猴整合素αv及整合素β1序列,由上海吉玛制药技术有限公司合成干扰序列siRNA-miαv、siRNA-miβ1、siRNA-NC。siRNA-miαv序列用siRNA A、siRNA B、siRNA C表示,siRNA-miβ1序列用siRNA 1、siRNA 2、siRNA 3表示,siRNA-NC为试验阴性对照。siRNA序列见表2。
1.4细胞培养和转染
常规方法复苏Vero细胞后用含胎牛血清的DMEM细胞培养基,于37 ℃、5% CO2恒温环境下培养及传代。转染前1 d,将传代Vero细胞接种于6孔板,次日细胞生长至70%~80%融合度时进行转染。按Attractene Transfection Reagent(Qiagen)转染说明书进行转染。分别加入待转染真核重组质粒或siRNA序列(100 mg/L)。转染结束后在37 ℃、5% CO2恒温环境下继续培养,间隔6 h后换含胎牛血清的DMEM细胞培养液继续培养24~48 h收取样品。每组试验都加设对照。
1.5RNA提取及cDNA合成
RNA样品提取严格遵照病毒RNA提取试剂盒所述步骤执行,获得样品RNA经测定浓度后用于反转录或-40 ℃保存。样品RNA反转录制备cDNA,反应体系参照试剂盒说明书。制备的cDNA于-40 ℃保存备用。
1.6实时荧光定量PCR
针对GenBank中整合素αv、整合素β1、PEDV ORF3序列及β-actin序列信息,设计荧光定量PCR引物(表3),引物由哈尔滨睿博兴科生物技术有限公司合成。按SYBR Green实时荧光定量PCR检测试剂盒提供的反应体系,分别添加上、下游引物。配制好的反应液在避光、低温条件下混匀、分装、离心后,放置于ABI QuantStudio 3 RT-qPCR检测仪中。反应程序为:95 ℃ 3 min;95 ℃ 30 s,55~60 ℃(根据引物Tm值选择退火温度)30 s,72 ℃ 30 s,40个循环。检测完成后,读取Ct值,并对数据进行分析。
1.7免疫印迹分析
首先将完成转染试验的各组Vero细胞按试验要求回收,分别加入RIPA细胞裂解液,在冰浴中裂解30 min,提取细胞中总蛋白质。用BCA法测定蛋白质浓度后加入上样缓冲液,沸水中加热使蛋白质变性,然后取等量蛋白质样品进行SDS凝胶电泳。蛋白质凝胶电转仪上转印至PVDF膜上,PBS清洗后用5%脱脂乳室温下封闭2 h,分别加入一抗(整合素αv、整合素β1、PEDV N蛋白抗体)、二抗(HRP标记的抗兔、抗鼠IgG),37 ℃孵育2 h。最后加入ECL显色成像,使用凝胶成像系统拍照。以GAPDH為内参,利用Image J图像分析软件测定蛋白质条带灰度值,计算并比较各试验组细胞样品中所含蛋白质相对表达水平。
1.8数据分析
使用SPSS 21.0软件,计量数值均以平均值±标准差表示,两组数据间比较采用t检验,多组间差异比较采用单因素方差分析,两两组间差异比较采用SNK q检验,各试验独立重复3次,以P<0.05、P<0.01表示差异有统计学意义。
2结果
2.1整合素αvβ1在Vero细胞中的过表达
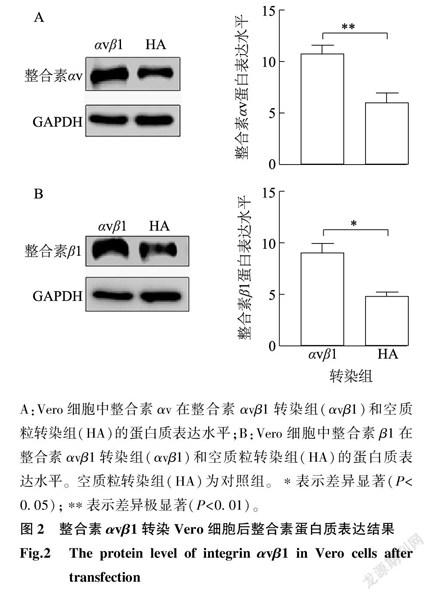
为明确整合素αvβ1对PEDV侵染Vero细胞的影响,我们将质粒pCAGGS-αv、pCAGGS-β1利用细胞转染的方法共转染在Vero细胞中,同时转染空质粒pCAGGS-HA作为对照组。然后利用荧光定量PCR方法和Western blot技术对Vero细胞表面整合素αvβ1的表达情况进行检测。结果显示,整合素αvβ1转染组与对照组相比较,整合素αv和整合素β1 mRNA表达水平均极显著升高(图1);整合素αvβ1转染组蛋白质表达结果与整合素αv和整合素β1 mRNA表达水平一致,在整合素αvβ1转染组蛋白质表达增强,灰度分析结果显示蛋白质表达水平与对照组差异显著或极显著(图2)。所得结果表明整合素αvβ1在Vero细胞中过表达成功。
2.2过表达整合素αvβ1对PEDV侵染vero细胞的影响
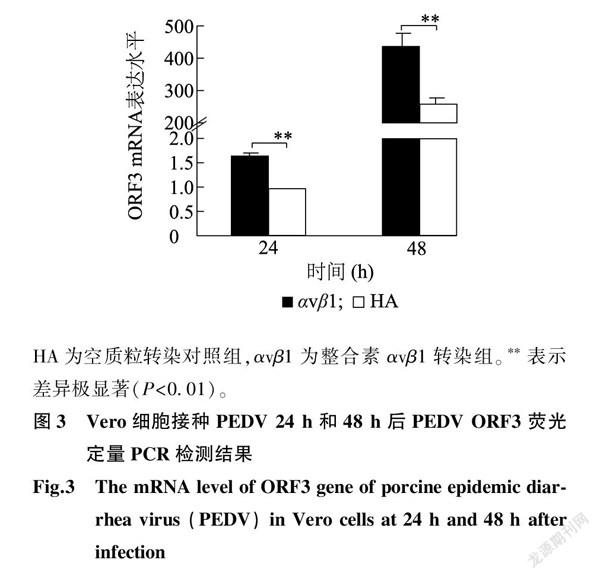
将共转染整合素αvβ1的Vero细胞接种PEDV,37 ℃孵育6 h后洗涤更换培养基,37 ℃、5%CO2下继续培养,分别于接种后24 h和48 h收取样品,荧光定量PCR检测PEDV ORF3 mRNA表达水平,Western blot技术检测PEDV N蛋白质表达水平。试验过程中将HA标记的转染组设为试验对照。结果显示,在病毒感染24 h和48 h后,试验组PEDV ORF3 mRNA表达水平极显著升高(图3)。Western blot技术检测结果显示,在病毒感染24 h和48 h后,试验组蛋白质表达条带明显增强,灰度分析结果显示试验组PEDV N蛋白质表达水平随感染时间延长而升高且与对照组相比呈显著差异(图4)。所得结果表明,整合素αvβ1的过表达能够促进PEDV侵染,使PEDV在Vero细胞内的含量明显增加。
2.3siRNA转染对整合素αvβ1在Vero细胞中表达的影响
分别将整合素αv和整合素β1的特异性siRNA及阴性对照转染至Vero细胞,利用荧光定量PCR 和 Western blot技术检测siRNA干扰效果。整合素αv和整合素β1 mRNA表达水平检测结果(图5)显示,与siRNA-NC对照组相比,靶向αv的siRNA A、siRNA B、siRNA C组整合素αv的mRNA水平极显著下降,靶向β1的siRNA 1、siRNA 2、siRNA 3组整合素β1的mRNA水平极显著下降。整合素αv和整合素β1蛋白质表达水平检测结果(图6)显示,与siRNA-NC对照组相比,靶向αv的siRNA A、siRNA B、siRNA C组整合素αv蛋白质水平均显著降低,靶向整合素β1的siRNA 1、siRNA 2、siRNA 3组β1蛋白质水平均极显著降低。以上结果表明本研究所设计的siRNA对整合素αv和整合素β1在Vero细胞表面的干扰效果明显。
2.4整合素αvβ1 siRNA干扰后对PEDV侵染vero细胞的影响
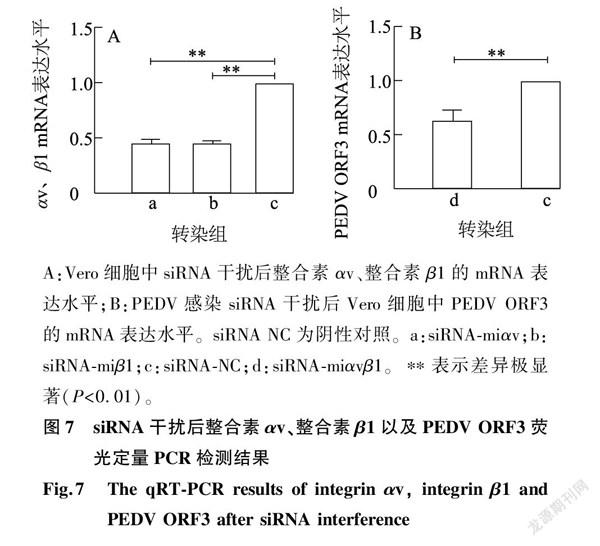
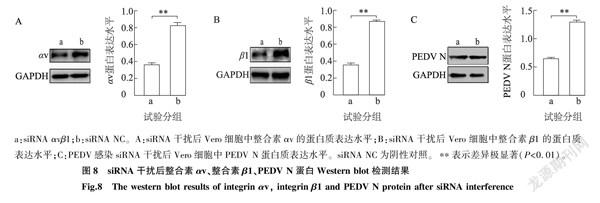
为确定降低细胞表面整合素αvβ1的表达对PEDV侵染Vero细胞的影响,利用干扰效果较好的siRNA分别下调Vero细胞表面的整合素αv和整合素β1的表达,然后感染PEDV,通过荧光定量PCR检测PEDV感染的Vero细胞整合素αv、整合素β1以及PEDV感染后PEDV ORF3基因mRNA水平,Western blot技术检测siRNA干扰后感染PEDV的Vero细胞中整合素αv、整合素β1以及PEDV感染后PEDV N蛋白质表达水平。荧光定量PCR检测结果(图7)显示,与siRNA NC对照组相比,试验组整合素αv、整合素β1以及病毒感染后PEDV ORF3基因mRNA表达水平均降低且差异极显著。Western blot技术检测结果(图8)显示,siRNA干扰试验组整合素αv、整合素β1以及病毒感染后PEDV N蛋白质表达水平与siRNA NC对照组相比较均明显降低且差异极显著。上述结果表明,整合素αvβ1被干扰表达后可降低PEDV对Vero细胞的侵染。
3讨论
PED是PEDV感染后引起的一种猪急性、流行性消化道传染病。PEDV靶向感染小肠绒毛上皮细胞,造成小肠绒毛萎缩、上皮细胞变性坏死脱落,肠黏膜充血、肿胀,吸收不良和严重腹泻。自2010年10月PED在中国大面积暴发以来,2013年以后美国、加拿大、墨西哥等北美国家,韩国、日本等亚洲国家及中国台湾地区也相继暴发PED,目前已经席卷亚洲、欧洲、美洲的大部分地区,给世界主要生猪养殖地区和国家带来严重的经济损失[1]。
阐明PEDV侵染宿主细胞的机制是预防PED发生的重要基础性研究。PEDV感染宿主细胞的过程十分复杂,主要通过病毒表面纤突糖蛋白与宿主细胞表面膜蛋白及碳水化合物分子的结合,促进病毒感染[4]。pAPN曾被报道是PEDV感染宿主细胞的受体并开展了大量病毒侵入机制的研究,但随后pAPN又被证实只是一种与病毒感染相关的宿主蛋白质[9]。目前认为病毒感染并非依赖一种受体蛋白质,而是利用位于细胞表面的多个受体蛋白质,才能完成病毒感染过程。整合素是一种广泛分布于哺乳动物细胞表面的黏附分子,在多种病毒感染宿主细胞的过程中都起到促进或辅助作用,如:整合素α2β1与艾柯病毒1(EV1)的感染有关[24],整合素α5β1、αvβ3、αvβ6都可在FMDV感染过程中起到促进作用[25],整合素αvβ3可促进日本脑炎病毒(JEV)的感染[26]。整合素β1可以与α亚基结合,广泛分布于许多哺乳动物细胞中,介导病毒感染细胞[18, 27]。本实验室前期研究发现,PEDV感染Vero细胞差异表达蛋白质筛选结果显示整合素αvβ1和整合素αvβ3与病毒感染有关,且与整合素αvβ1同源的整合素αvβ3已被证明可促进PEDV感染细胞[19- 20]。整合素αvβ1在PEDV主要侵染的仔猪小肠绒毛上皮细胞中存在[23],同时在PEDV高度敏感的Vero细胞中也存在。本研究在Vero细胞上通过过表达和抑制整合素αvβ1的表达来阐明PEDV在侵染Vero细胞过程中所受整合素αvβ1的影响。试验结果显示,在Vero细胞中过表达αvβ1后,PEDV的mRNA和蛋白质表达水平均出现显著上调,证明整合素αvβ1能够促进PEDV侵染细胞,使PEDV在Vero细胞内的含量明显增加。RNA干扰技术(RNAi)是一种基因沉默技术,是通过导入与内源性mRNA同源的双链RNA,来诱发同源靶mRNA高效、特异性地降解,从而导致靶基因沉默且表达下降的现象[28-29]。本研究通过siRNA干扰试验反向验证整合素αvβ1与PEDV侵染细胞的关系。由于RNAi技术存在不同位点效应,相应的序列抑制mRNA降解效率会有差异,甚至有些序列根本起不到抑制的作用。因此本研究分别設计3个整合素αv与整合素β1基因的siRNA序列,通过检测转染后Vero细胞各基因蛋白质及核酸水平的变化,筛选出最佳siRNA序列。利用最佳siRNA沉默Vero细胞表面整合素αvβ1,结果显示在被干扰的Vero细胞感染PEDV 48 h后,PEDV的mRNA和蛋白质表达水平均出现显著下调,说明整合素αvβ1的干扰可降低PEDV对Vero细胞的侵染。综上所述,整合素αvβ1能够促进PEDV侵染Vero细胞,由于整合素αvβ1是位于细胞表面的蛋白质,因此整合素αvβ1是否可能作为一种受体蛋白与PEDV的S蛋白相结合,在病毒的黏附、内化过程中起到促进作用有待继续研究。本研究所获结果为PEDV侵入机制的解析和抗病毒策略设计提供了新的研究方向和理论基础。
参考文献:
[1]李公美,李茂辉,钱爱东,等. 猪流行性腹泻病毒新型检测方法的研究进展[J]. 中国兽医学报, 2020, 40(3): 650-653,664.
[2]WOOD E N. An apparently new syndrome of porcine epidemic diarrhoea [J]. The Veterinary Record, 1977, 100(12): 243-244.
[3]LEE C. Porcine epidemic diarrhea virus: An emerging and re-emerging epizootic swine virus [J]. Virol J, 2015, 12: 193.
[4]SANDRINE B, MILLET J K, LICITRA B N, et al. Mechanisms of coronavirus cell entry mediated by the viral spike protein [J]. Viruses, 2012, 4(6): 1011-1033.
[5]OH J S, SONG D S, PARK B K. Identification of a putative cellular receptor 150 kDa polypeptide for porcine epidemic diarrhea virus in porcine enterocytes [J]. J Vet Sci, 2003, 4(3): 269-275.
[6]LI B X, GE J W, LI Y J. Porcine aminopeptidase N is a functional receptor for the PEDV coronavirus [J]. Virology, 2007, 365(1): 166-172.
[7]CONG Y, LI X, BAI Y, et al. Porcine aminopeptidase N mediated polarized infection by porcine epidemic diarrhea virus in target cells [J]. Virology, 2015, 478: 1-8.
[8]PARK J E, PARK E S, YU J E, et al. Development of transgenic mouse model expressing porcine aminopeptidase N and its susceptibility to porcine epidemic diarrhea virus [J]. Virus Res, 2015, 197: 108-115.
[9]李公美,幺乃全,李茂輝,等. 猪氨基肽酶对PEDV感染作用的研究进展[J]. 中国兽医科学, 2020, 50(11): 1421-1427.
[10]SHIRATO K, MAEJIMA M, ISLAM M T, et al. Porcine aminopeptidase N is not a cellular receptor of porcine epidemic diarrhea virus, but promotes its infectivity via aminopeptidase activity [J]. J Gen Virol, 2016, 97(10): 2528-2539.
[11]WHITWORTH K M, ROWLAND R R R, PETROVAN V, et al. Resistance to coronavirus infection in amino peptidase N-deficient pigs [J]. Transgenic Res, 2019, 28(1): 21-32.
[12]LI W, LUO R, HE Q, et al. Aminopeptidase N is not required for porcine epidemic diarrhea virus cell entry [J]. Virus Res, 2017,5(2): 6-13.
[13]LUO L, WANG S, ZHU L, et al. Aminopeptidase N-null neonatal piglets are protected from transmissible gastroenteritis virus but not porcine epidemic diarrhea virus [J]. Sci Rep, 2019, 9(1): 13186.
[14]CHRISTEL S, HERRLER G. Sialic acids as receptor determinants for coronaviruses[J]. Glycoconjugate Journal, 2006, 23(1/2): 51-58.
[15]KUBA K, IMAI Y, OHTO N T, et al. Trilogy of ACE2: A peptidase in the renin-angiotensin system, a SARS receptor, and a partner for amino acid transporters[J]. Pharmacology & Therapeutics, 2010, 128(1): 119-128.
[16]JEFFERS S A, HEMMILA E M, HOLMES K V. Human coronavirus 229E can use CD209L (L-SIGN) to enter cells [J]. Advances in Experimental Medicine & Biology, 2006, 581: 265-269.
[17]MADU I G, CHU V C, LEE H, et al. Heparan sulfate is a selective attachment factor for the avian coronavirus infectious bronchitis virus Beaudette[J].Avian Diseases, 2007, 51(1): 45-51.
[18]张俊磊. 整合素在病毒感染宿主细胞过程中的作用[J]. 第三军医大学学报, 2004, 26(2): 176-178.
[19]高晶. 猪整合素αvβ3真核表达载体构建及介导PEDV感染作用的初步验证[D]. 大庆:黑龙江八一农垦大学, 2016.
[20]LI C, SU M, YIN B, et al. Integrin αvβ3 enhances replication of porcine epidemic diarrhea virus on Vero E6 and porcine intestinal epithelial cells [J]. Vet Microbiol, 2019, 237: 108400.
[21]YUN B L, GUAN X L, LIU Y Z, et al. Integrin αvβ1 modulation affects subtype B avian metapneumovirus fusion protein-mediated cell-cell fusion and virus infection [J]. J Biol Chem, 2016, 291(28): 14815-14825.
[22]SHUAI L, WANG J, ZHAO D, et al. Integrin β1 promotes peripheral entry by rabies virus [J]. J Virol, 2020, 94(2): e01819.
[23]DORNER M, ZUCOL F, ALESSI D, et al. β1 integrin expression increases susceptibility of memory B cells to Epstein-Barr virus infection [J]. J Virol, 2010, 84(13): 6667-6677.
[24]XING L, HUHTALA M, PIETIAINEN V, et al. Structural and functional analysis of integrin alpha2I domain interaction with echovirus 1 [J]. J Biol Chem, 2004, 279(12): 11632-11638.
[25]NEFF S, SA-CARVALHO D, RIEDER E, et al. Foot-and-mouth disease virus virulent for cattle utilizes the integrin alpha(v)beta3 as its receptor [J]. J Virol, 1998, 72(5): 3587-3594.
[26]FAN W, QIAN P, WANG D, et al. Integrin αvβ3 promotes infection by Japanese encephalitis virus [J]. Res Vet Sci, 2017, 111: 67-74.
[27]ASKARI J A, BUCKLEY P A, MOULD A P, et al. Linking integrin conformation to function [J]. J Cell Sci, 2009, 122(2): 165-170.
[28]李方華,侯玲玲,苏晓华,等. RNA干扰的研究进展及应用[J]. 生物技术通讯, 2010, 21(5): 740-745.
[29]王龙涛,葛晨霞,王丹,等. 靶向TGEV S基因的外源性microRNA对TGEV增殖效果的抑制[J]. 中国兽医学报, 2016, 36(2): 196-199.
(责任编辑:张震林)
收稿日期:2021-09-16
基金项目:黑龙江省自然科学基金项目(C2018049);黑龙江八一农垦大学引进人才科研启动计划资助项目(XYB2014-11);黑龙江八一农垦大学三横三纵支持计划资助项目(ZRCPY201907)
作者简介:原冬伟(1980-),男,吉林吉林人,博士,讲师,主要从事动物传染病机制及诊断方法研究。(E-mail)yuandongwei@163.com
