基于合成受体的食品污染物生物检测进展
2022-05-14胥欣欣匡华
胥欣欣,匡华
(1 江南大学食品科学技术国家重点实验室,江苏 无锡 214122; 2 江南大学食品学院,生物界面与生物检测研究所,江苏 无锡 214122)
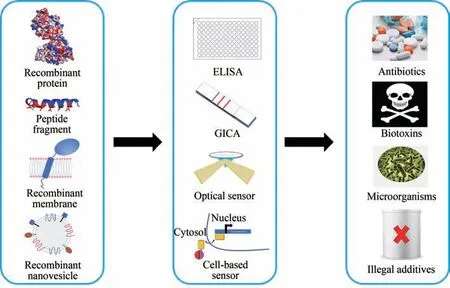
食品安全是世界性问题。随着经济全球化的日益发展,食品安全已成为关乎人类健康的全球性挑战。食品安全问题对国家的政治稳定、经济建设、社会发展等都具有重要的影响。民以食为天,我国为保证食品安全,保障公众身体健康和生命安全,制定了《中华人民共和国食品安全法》。现行国家食品安全标准中明确规定了食品、食品添加剂、食品相关产品中的致病性微生物、农药残留、兽药残留、生物毒素、重金属等污染物质以及其他危害人体健康物质的限量要求。对食源性疾病、食品污染以及食品中的有害因素进行监测,是食品安全风险监测和评估的重要环节之一。
目前,已经有多种成熟的检测技术被广泛应用于食品安全检测,如高效液相色谱(HPLC)、气相色谱(GC)、高效液相色谱-质谱(HPLC-MS)、气 相 色 谱- 质 谱(GC-MS) 和 核 磁 共 振(NMR)[1-2]。这些仪器分析技术有普遍的局限性,如检测时间长,依赖专业的样品处理技术和昂贵的仪器等,限制了它们的应用。ELISA(enzyme linked immunosorbent assay)、胶体金免疫色谱(gold immunochromatographic assay,GICA)、电化学生物传感器等相对低成本、便携且易于操作,在食品分析领域展现出巨大的潜力[3-8]。还有基于分子印迹聚合物(molecular imprinted polymer,MIP)的传感器,利用MIP可以模仿抗体、酶和其他生物分子的特异性和选择性的优势,能够实现污染物的识别、富集和分离[9-11]。
除了上述几种检测手段,基于受体-配体相互作用的受体结合测定技术(receptor-binding assay,RBA)也是筛查分析食品安全相关毒害物质的有效工具和研究热点[7,12-14]。所谓受体,是指细胞膜或细胞内的一些能与生物活性分子(如药物、毒素、神经递质、激素和抗体等,统称配体)相互作用的生物大分子。和抗体-抗原一样,受体-配体反应具有高亲和力、高特异性和高饱和。受体只能与相应的活性物质结合,因此受体技术在食品安全检测方面同样具有准确性。
本文将概述应用于食品检测的受体种类,以及制备受体的常用表达方式,列举已经开发用于食品检测的具体受体,例如针对抗生素类药物,生物毒素等。本文也将分析受体在食品安全检测中的优势和潜在局限性,同时展望受体在食品安全检测中的应用前景和未来研究方向。
1 受体的概述
广义上来说,受体的涵盖范围很广。只要能和目标物特异性结合的物质(如核酸、多肽、蛋白质等化合物),都可以被称为受体。本文所述受体主要聚焦于受体蛋白,是来自于生物体或细胞的生物大分子。
1.1 受体与配体
受体和配体之间有3个相互关联的功能:①识别和结合,即两者以高亲和力、高特异性识别并结合结构互补区域;②转导信号,即受体-配体的相互作用会激活级联反应,将细胞外的信号传递到效应器,比如酶、离子通道等,使它们的活性或构象发生相应的变化;③产生相应的生物效应,及引起细胞功能变化。另外,如果受体结合的是拮抗剂,那么就会阻断某个生物效应。从受体-配体的结合角度看,受体具有四大特征:立体选择性、饱和性、可逆性、高亲和力[15]。本文着重介绍:基于受体-配体的特异性识别和结合,可以开发类似基于抗体-抗原反应的检测装置;基于受体-配体结合后产生的信号转导,可以开发细胞传感器,用于检测目标物。
1.2 受体的分类
根据不同的细胞定位,可将受体分为三大类[15]:①外膜受体,包括神经递质、绝大多数激素、生长因子、神经营养因子、免疫活性物质以及感觉刺激物等的受体;②内膜受体,即细胞器膜受体,如三磷酸肌醇受体等;③细胞浆膜内的受体,包括类固醇激素和一些脂溶性激素等的受体,这类受体都是在胞质中与配体结合,再移位至细胞核,激活相应基因的转录而发挥作用。由于它们最终与核内的DNA相互作用,故又被称为核受体。
2 受体蛋白的制备
2.1 表达系统的概述
随着分子生物相关学科的快速发展,越来越多的重组蛋白生产系统已经被开发出来。从最简单的细菌到高等的转基因动物,它们都可以作为表达宿主。目前,世界上已开发完善且得到广泛认可的重组蛋白表达体系主要包括:大肠杆菌表达系统、酵母表达系统、昆虫表达系统和哺乳动物表达系统(图1),这些表达系统具有不同的优劣势(表1)。

表1 4种表达系统的比较Tab.1 Comparison of 4 expression systems

图1 不同的重组蛋白表达系统Fig.1 Different expression systems for recombinant proteins production
2.1.1 原核表达系统
最常用的原核蛋白表达系统是大肠杆菌E.coli表达系统。大肠杆菌遗传背景清晰、易培养、基因工程操作简单,而且繁殖速度快、成本低,商品化表达载体种类齐全,最重要的是外源蛋白表达水平高。缺点是重组表达的蛋白易形成包含体,蛋白复性后易损失活性。在重组蛋白的N 端融合一个信号肽,将蛋白质定位到大肠杆菌的周质空间,通过周质空间的分子伴侣协助蛋白质正确折叠和二硫键形成,一定程度上可以稳定蛋白。就本身来源于原核细胞的受体蛋白来说,用大肠杆菌系统表达是最佳的选择,比如β-内酰胺类抗生素受体[16]。
2.1.2 酵母表达系统
酵母细胞在明确定义的培养基中能够快速生长,不需要动物源性生长因子的参与,并且可以分泌大量重组蛋白。酵母细胞相对于大肠杆菌表达系统的主要优点在于:无内毒素、完整的真核蛋白合成途径和重组蛋白的分泌能力;另外,在酵母细胞中的蛋白质能够正确折叠并进行翻译后修饰,可以用于糖蛋白的表达。因此,当高等生物来源的受体蛋白难以在细菌中表达时,酵母表达系统不失为一个良好的选择。与哺乳动物细胞系统相比,酵母细胞的蛋白质生产往往更快、更便宜。然而,酵母毕竟是低等的真核生物,其N-糖基化模式单一,可能无法保证重组受体的天然活性,这也是酵母表达系统的主要缺点。
2.1.3 哺乳动物表达系统
对于高等动物来源的重组蛋白,哺乳动物细胞表达系统是首选。因为哺乳动物细胞的糖基化修饰完整,表达的蛋白折叠正确、活性高,最接近天然蛋白。长期以来,人胚胎肾细胞HEK293被认为是瞬时表达重组蛋白的最佳宿主。如今,随着培养基成分的优化和宿主细胞的工程改造,用悬浮驯化的中国仓鼠卵巢细胞CHO-K1作为瞬时转染的宿主细胞,能够进一步提高重组蛋白的产量。值得注意的是,细胞培养需要昂贵的培养基和严格的培养条件,而且细胞株构建和发酵周期长,因此成本较高。
2.1.4 昆虫表达系统
昆虫细胞表达系统也属于真核细胞表达系统,是介于酵母和哺乳动物细胞表达系统之间的存在。昆虫细胞表达系统的优势如下:生长迅速,蛋白表达量高,易规模化;具有糖基化等翻译后修饰系统;蛋白质的正确折叠,使重组蛋白更加接近天然结构;重组蛋白的可控性定位(核膜或分泌至胞外);普适性,能表达绝大多数物种来源的蛋白。
2.1.5 无细胞翻译系统
无细胞翻译是一种不依赖于活细胞,在体外实现基因转录和翻译过程的蛋白质合成系统(图2)。该体系的组成主要包括细胞(微生物、动物或植物)裂解液中所含有的蛋白合成所需的必要元件、外源添加核苷酸、tRNA、能量物质等元素和含目的基因的质粒。目前,基于大肠杆菌裂解物的无细胞系统最为常用[17]。此外,真核细胞(小麦胚芽、昆虫、酵母等)裂解物也可以用于无细胞系统[18-19]。无细胞翻译系统能够规避蛋白生产对细胞生长的影响,适用于膜蛋白的表达和具有细胞毒性蛋白的表达,以及非天然氨基酸的嵌入。相比其他成熟的表达系统,无细胞翻译在大规模生产方面尚有不足,特别是真核无细胞系统,细胞培养的成本较高。
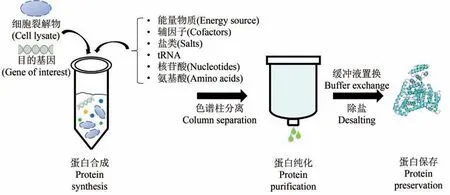
图2 基于无细胞翻译系统的蛋白制备Fig.2 Protein preparation based on cell-free translation system.
2.2 受体蛋白的表达
对于可溶性的受体蛋白,尤其是来源于细菌的受体,比如磺胺类抗生素受体蛋白[20],大肠杆菌是最佳的表达宿主,只需要质粒构建、感受态转化、诱导表达、亲和色谱纯化和离子交换纯化的流程即可获得较纯的重组蛋白。对于简单跨膜蛋白,比如β-内酰胺抗生素受体[21-22],可以通过去除跨膜域的方式来提高受体蛋白的可溶性,提高其表达量,同时保证其对配体亲和力的完整性。对于多跨膜域的膜蛋白,比如真核来源的β-兴奋剂受体,往往需要用哺乳动物细胞[23]和昆虫细胞[24]这类真核细胞或无细胞翻译体系[25]来进行表达。具有磷脂双分子层的细胞膜或其他膜类结构可以作为膜蛋白的载体,使受体蛋白无需被分离纯化,这种膜和受体的复合体能够保持受体的天然结合功能[26-27]。
2.3 受体蛋白的改造
随着分子生物学相关技术的日益发展,人们的研究范围不仅限于对蛋白质的功能和结构解析,还拓展到了对具有生物(催化)活性的蛋白质的理性设计和改造等领域。基于此类基础理论研究和技术支撑,合理改造受体蛋白,以提高其亲和性、特异性等物化性质,将是合成受体生物应用的重要发展方向之一。
2.3.1 受体蛋白的定点突变
定点突变技术是分子生物学中研究蛋白质结构和功能特性的宝贵工具[28]。定点突变的设计往往需要与计算机科学(同源建模、分子对接、动力学模拟等)相结合,是有目的地对某一个或某几个氨基酸进行理性改变。通过基于定点突变的蛋白质合理改造,可以提高蛋白的催化活性或热稳定性等[29]。就基于合成受体的生物检测而言,Ning 等[30]通过同源建模构建了地衣芽孢杆菌ATCC14580 的BlaR-CTD 的三维结构,同时与40 种β-内酰胺抗生素进行分子对接,系统分析活性口袋附近的关键氨基酸并合理设计定点突变,同时插入二硫键和盐桥,最终异源表达了23 种突变受体蛋白。经活性和稳定性测试,其中3种突变体对多种β-内酰胺抗生素具有更高的亲和力,而I188K/S19C/G24C突变体的稳定性最好。这一研究表明,受体蛋白BlaR-CTD 的结构变化会引起其亲和力和稳定性的改变,为受体蛋白的理性设计研究提供了思路。Wang等[31]也利用了类似方式,对四环素类抗生素受体蛋白TetR 进行了P105F 和P105Y点突变改造。利用免疫分析方法检测四环素时,这两种突变受体比野生型的亲和力和灵敏度更高。
2.3.2 受体蛋白的定向进化
自然界存在“适者生存”的筛选法则,而在实验室中,科学家们人为设定筛选条件,模拟蛋白质的发展进化过程,短时间内获得性能优良的蛋白,即蛋白定向进化。最近,研究人员设计构建了人工受体蛋白文库,利用核糖体展示技术在大肠杆菌裂解液系统中进行体外转录和翻译。经过多轮淘选,从随机文库中获得的3种突变体蛋白对百草枯具有高亲和力和检测灵敏度[32]。该研究中的受体蛋白设计和定向进化筛选过程理论上也适用于其他类型的受体蛋白,具有一定的借鉴参考价值。2018 年诺贝尔化学奖对“定向进化”和“噬菌体展示”的概念给予了肯定,认可该研究在酶和抗体改造方面的重大贡献[33]。就合成受体的生物检测应用而言,为了获得高特异、高亲和、高灵敏的受体蛋白,对受体的定向进化改造是大势所趋。
3 受体在食品安全检测中的应用
3.1 抗生素残留
抗生素是一种抑制或杀死细菌的化学物质,是由微生物或高等动植物在生活过程中产生的一类次级代谢产物。得益于其有效的抑菌作用,抗生素被广泛应用于畜牧业和水产养殖业中。然而,抗生素的滥用使其在食品中残留超标的案例屡见不鲜。对抗生素残留进行快速、灵敏检测,是保障食品安全的重要环节。受体只能与对应的活性分子相结合,因此受体技术在检测抗生素方面具有更高的准确性[7]。近些年,基于受体的抗生素筛查分析技术已成为一个研究热点,应用于检测β-内酰胺、磺胺、四环素等抗生素残留(表2)。

表2 基于受体的抗生素筛查分析方法Tab.2 Receptor-based antibiotic screening and analysis method
3.1.1β-内酰胺的检测
β-内酰胺类抗生素是化学结构中具有β-内酰胺环的一大类抗生素,包括青霉素类、头孢菌素类、单环β-内酰胺类和碳青霉烯类。β-内酰胺环具有不稳定性,在抗体制备过程中容易降解,因此难以获得针对完整β-内酰胺类抗生素的抗体。β-内酰胺类抗生素的受体是其抗体的绝佳代替物,人们已经开发了多种基于受体的检测方法。
针对肺炎链球菌来源的青霉素结合蛋白PBP2x,Zeng 等[21]通过截短N 端的跨膜域,提高PBP2x的可溶性,在大肠杆菌中重组表达受体蛋白PBP2x*。基于PBP2x*建立微孔板检测方法,45 min 可检测42 个牛奶样品的16 种β-内酰胺类抗生素,其中15种的检测限低于欧盟最大限量规定。该课题组进一步研究发现,青霉素结合蛋白3的可溶性部分(sPBP3*)对β-内酰胺类抗生素的亲和力更高,可应用于检测牛奶中的11 种青霉素和16 种头孢菌素[34]。Lamar 等[35]基于PBP2x*开发了微孔板检测法,通过使用HRP 标记的地高辛抗体Fab 片段检测DIG-AMP/PBP2x*复合物,建立标准曲线可检测牛奶、肉汁、鸡蛋和蜂蜜中的β-内酰胺。Peng等[22]在大肠杆菌BL21(DE3)中重组表达了地衣芽孢杆菌BlaR 的C 端活性域(BlaRCTD),作为β-内酰胺受体蛋白,建立ELISA 方法用于检测牛奶、牛肉和鸡肉3种不同基质中的β-内酰胺类抗生素,可以同时检测15 种β-内酰胺,其中11 种的检出限低于欧盟规定的最大残留限量。Yuan 课题组[16,30]通过同源建模和分子对接技术,设计了23种BlaR-CTD突变蛋白,筛选获得高稳定性、高亲和力的I188K/S19C/G24C 突变受体,建立了酶联受体检测方法可检测13 种食物样品中的40 种β-内酰胺。Li 等[36]利用I188K/S19C/G24C 的BlaR-CTD 突变受体,结合胶体金免疫色谱(GICA)技术,可以在10 min 内实现对牛奶和鸡肉样品中21种β-内酰胺的快速检测。
最近,Fan 等[37]基于四环素抗体和青霉素结合蛋白PBP-6,构建表面增强拉曼散射(SERS)的免疫传感器,实现了四环素和青霉素的联合检测,其中对青霉素的检测限可达0.010 ng/mL,IC50值为1.77 ng/mL,是目前最灵敏的生物分析方法。
3.1.2 磺胺类抗生素的检测
磺胺类药是一类具有广谱抗菌活性的合成抗生素,在兽医医学中被广泛用于预防和治疗传染病。就磺胺类药而言,基于受体的检测方法很少。二氢叶酸合成酶(DHPS)是磺酰胺类的受体之一,该受体是叶酸辅酶因子合成过程中的关键酶。抗微生物试剂(如磺胺和氨苯砜)是对氨基苯甲酸(PABA)的竞争抑制剂,通过竞争结合DHPS,影响二氢叶酸的合成,最终抑制细菌的生长。
Liang 等[20]在大肠杆菌中表达肺炎链球菌来源的DHPS,用于开发新型微孔板检测法以检测磺胺类药。该方法是基于磺胺类药和HRP 标记的磺胺类衍生物之间的竞争作用,在最佳条件下,对9 种磺胺类药和PABA 的检测限可达100 ng/mL 以下;对于28 种不同磺胺类药,IC50值在426~50 000 ng/mL 之间。该检测方法虽然灵敏度不够高,但是具有很强的独创性,为检测磺胺类药物提供了新的思路。在后续工作中,该团队合成的DHPS-DHPPP(二氢蝶呤焦磷酸)二元复合物,对磺胺类药具有更高的亲和力,继而开发了荧光偏振测定法(FPA)和生物传感器,可检测牛奶样品中29 种磺胺类药,IC50值小于100 ng/mL[38-39]。基于DHPS-DHPPP 复合物的生物传感器同样可以检测不同基质中的磺胺类药,以磺胺甲嘧啶(SMZ)为例,其在鸡肉、猪肉、鸡蛋和蜂蜜中的检出限分别为17.82 μg/kg、20.55 μg/kg、23.22 μg/kg和5.57 μg/kg[40]。
3.1.3 四环素药物检测
四环素药物(TC)是一类广谱抗菌药物,在人类和动物中广泛用于治疗细菌性疾病。在自然界中,某些抗TC 的细菌具有特殊Tet 阻遏蛋白(TetR),可以特异性结合TC 并将其转移出细菌[49-50]。
在含有四环素的条件下,TetR 会与同源操纵子tetO 解离,这种解离效应和四环素浓度之间存在剂量关系。21 世纪初,瑞士的科研人员利用该原理,在微孔板或PVDF 膜上固定tetO,用mouse anti-His 和anti-mouse IgG-HRP 间接法检测His 标记的TetR,实现对四环素的定量。在牛奶和牛血清基质中微孔板法的检测限是0.1~7.2 ng/mL[41];在牛奶、肉末、牛血清基质中试纸条法的线性范围是5~10 ng/mL[42]。Wang等[43]将TetR视为四环素的受体,在大肠杆菌Rosetta-gami(DE3)中表达TetR 受体蛋白,通过分子对接技术探究其对四环素的识别机理,最终建立了基于TetR 的化学发光免疫分析方法,可用于测定牛奶中的5种四环素药物,检测限为5~16 pg/mL,空白牛奶样品中的添加回收率在71.7%~95.8%之间。同年,作者通过定向进化获得TetR 蛋白结合口袋的关键氨基酸Pro105的两种突变体,能够同时识别9种四环素药物。与野生型TetR相比,它们具有更高的亲和力和灵敏度。基于最优突变体开发的竞争性荧光免疫测定法,可以检测鸡蛋样品中的9种四环素药物,IC50值在3.1~17.2 ng/mL,检测限在0.3~5.8 ng/mL[31]。Meyer 等[44]建立了基于TetR-tetO 的可再生化学发光受体测定法,适用于检测环境和食品样品中四环素。虽然该研究仅针对加标自来水,且检测限仅为0.1 μg/L,不过可回收、可再生性是它的一个亮点和特色。
3.1.4 大环内酯类检测
大环内酯类抗生素是一类分子结构中具有12~16 碳内酯环的抗菌药物。Weber 等[45]以哺乳动物细胞为模型,在细胞内构建基于大环内酯类调控蛋白MphR(A)及其操纵子ETR 的调控系统,通过调控表达分泌型碱性磷酸酶作为标志物,检测大环内酯类抗生素。Möhrle 等[46]采用类似的方式构建微生物传感器,以荧光素酶基因表达产物作为检测信号。Weber 等[41]基于MphR(A)和ETR 建立了类似ELISA 的微孔板法,可检测红霉素、竹桃霉素、克拉霉素、罗红霉素、阿奇霉素,检测限分别为1.7 ng/mL、26 ng/mL、63 ng/mL、605 ng/mL、5000 ng/mL。Cheng 等[47-48]在前人的研究基础上,对大环内酯类抗生素调控蛋白MphR(A)、MphR(E)与不同操纵子DNA 的组合进行优化,最终以MphR(A)和A-DNA为基础,采用蛋白和抗生素药物分步反应的方式,建立了检测原奶中红霉素残留的类ELISA 系统,CCα 值为43.28 ng/mL, CCβ 值 为46.44 ng/mL。 然 而,MphR(A)仅对红霉素具有高亲和力,限制了此类方法的实用性,若要作为实际应用产品,仍需要进一步深入研究。
3.2 农药残留
百草枯(PQ)是一种水溶性的季铵盐除草剂,长期以来在农业、园林业等领域被广泛使用。胆素结合蛋白(bilin-binding protein,BBP)是一种脂质运载蛋白,Li 等[32]利用核糖体展示技术,经数轮筛选,获得并鉴定3 个BBP 变体,对PQ 复合物具有高亲和力,IC50值低至14.039 ng/mL±0.970 ng/mL,检测限达到0.083 ng/mL±0.011 ng/mL。BBP 作为一种稳定的半抗原的受体蛋白,有潜力成为重组抗体片段的替代品,在生物分析领域具有较高的应用价值。
3.3 非法添加剂
3.3.1 β兴奋剂的受体
β 兴奋剂,即β-肾上腺素受体激动剂,是一类体能增强药物,会被一些运动员违规滥用。Bovee等[51]基于放射性标记的β 兴奋剂和可溶性的受体建立了β 兴奋剂的发光检测方法。在无β 兴奋剂的条件下,放射性标记的β 兴奋剂仍然与受体结合,通过计数测量发光强度;在含有β兴奋剂药物的条件下,药物竞争结合受体并取代放射性标记的β兴奋剂,发光强度减弱。该方法可实际检出真实的阳性样本。
在牲畜养殖业,β 兴奋剂被用于促进家畜动物的生长。β 兴奋剂在我国是被严禁使用的。β 兴奋剂包含多种不同的药物,因此基于β兴奋剂受体结合的检测方法具有一定的广谱性优势。Wang 等[23]利用人胚胎肾细胞HEK293 表达重组β 兴奋剂受体蛋白β2-AR,开发了一种基于β2-AR的酶联受体测定法(ELRA)。该方法类似竞争法ELISA,可用于猪尿中克伦特罗、沙丁胺醇和莱克多巴胺的快速高通量检测,对应的IC50值分别为34 μg/L、53 μg/L 和63 μg/L。在后续工作中,该作者所在课题组利用无细胞翻译系统[25]和SF9 昆虫细胞表达系统[24]表达了β2-AR 并建立ELRA。用无细胞翻译系统可提高β2-AR 的表达量至1.1 mg/mL,但对β 兴奋剂的检测灵敏度会有所下降,针对克伦特罗、沙丁胺醇和莱克多巴胺的IC50值分别为45.99 μg/L、60.38 μg/L 和78.02 μg/L。β2-AR 在昆虫细胞表达系统中的表达量更高, 可达1.23 mg/mL,ELRA 检测方法对3种β兴奋剂的IC50值分别为28.36 μg/L、50.70 μg/L、59.57 μg/L,呈现出更好的检测性能。Cheng 等[52]利用SF9 细胞表达了叙利亚仓鼠肺来源的β2-AR并建立ELRA方法,针对莱克多巴胺的检测限为5.20 μg/L,IC50值为30.38 μg/L。值得一提,重组受体β2-AR 也可以通过大肠杆菌E.coli[53]、酿酒酵母[54]和其他哺乳动物细胞[55]等体系表达,不过能否适用于β 兴奋剂的检测仍有待进一步研究。理论上来说,哺乳动物细胞中表达的受体蛋白在结构上与天然受体最为接近,也最具有应用前景。基于受体的非法添加剂筛查分析方法见表3。

表3 基于受体的非法添加剂筛查分析方法Tab.3 Receptor-based screening and analysis method of illegal additives
3.3.2 磷酸二酯酶PDE5抑制剂
磷酸二酯酶PDE5 抑制剂是一类用于治疗勃起功能障碍的药物,市场上用于增强性功能的膳食补充剂产品经常掺入PDE5 抑制剂,对人体健康造成影响。Santillo 等[56]基于PDE5 抑制剂对PDE5活性的抑制作用,开发了一种荧光检测方法来快速检测掺假产品中的PDE5 抑制剂。在不含基质的溶液中,可以灵敏检测9 种PDE5 抑制剂,IC50值在0.4~4.0 ng/mL 之间。在空白基质加标1 mg/g 的浓度下,成功检测到所有9种掺假物。该方法可在15 min内同时分析40多个样品。
3.4 真菌毒素
真菌毒素是由丝状真菌产生的有毒次生代谢物或有机化合物。目前人们已经发现超过300种真菌毒素,其中较为常见且危害较大的霉菌毒素包括黄曲霉毒素、赭曲霉毒素、单端孢霉烯、伏马毒素、玉米赤霉烯酮、展青霉素、橘霉素和交链孢霉毒素等,它们主要产自于镰刀菌、曲霉菌、青霉菌和交链孢霉菌等不同菌属[57-59]。目前,基于天然受体的真菌毒素检测方法鲜有报道,只有少量基于多肽片段的真菌毒素识别研究,而且设计具有高亲和力的新型多肽受体仍具有挑战性[60-61]。
Bazin 等[62]固相合成来自氧化还原蛋白的不同多肽片段,通过HPLC评估多肽结合赭曲霉毒素OTA 的能力,筛选获得OTA 结合肽NFO4 并建立竞争性ELISA,可用于检测红葡萄酒基质中的OTA,检测限可达2 μg/L。该课题组以OTA 结合肽NFO4为基础,对检测体系进行了更加深入的研究,将NFO4 分别和三维多孔壳聚糖载体[63]和电流传感器[64]联合使用,能够稍微提高对OTA 的检测灵敏度。Heurich等[65]通过计算模型设计,从多肽文库中筛选出两个与OTA 有亲和力的肽段:八肽和十三肽。虽然这两种多肽在体外均能与OTA结合,但是该研究并未以此建立OTA 的竞争性检测方法。
除了多肽受体外,还有基于分子印迹蛋白的玉米赤霉烯酮(ZEN)[66]和黄曲霉毒素(AFB1)[67]检测方法,可用于真实样品中真菌毒素的检测。
3.5 海洋生物毒素
海洋生物毒素是由微观藻类产生的天然化学物质,可以在贝壳类和鱼类等水生生物中蓄积。人类位于食物链顶端,误食海洋生物毒素污染的水产品会对人类的生命健康造成极大的威胁[68-69]。
3.5.1 环亚胺类毒素检测
环亚胺类毒素是鞭毛藻来源的神经毒素,它们是烟碱乙酰胆碱受体(nAChR)的有效拮抗剂。利用富含烟碱乙酰胆碱受体的电鳐细胞膜和荧光标记的α-金环蛇毒素,Vilariño等[70]建立了荧光偏振定量检测方法,原理是检测物中的环亚胺抑制了金环蛇毒素与nAChR 的相互作用,产生荧光偏振变化。该方法可用于检测贻贝提取物中裸草胺-A 和13-去甲基螺旋内酯C,检测范围分别是50~2000 μg/kg 和70~700 μg/kg。该方法对检测蛤蚌、牡蛎、扇贝基质中裸草胺-A 和13-去甲基螺旋内酯C 具有普适性[71],而且适用于检测13,19-去二甲基螺旋内酯C,定量范围为40~200 μg/kg[72]。在前人的基础上,Otero等[73]用荧光素衍生物直接标记nAChR,开发了螺环内酯的荧光偏振直接测定法,从间接识别到直接识别的转变使得检测灵敏度和速度都显著提高。
基于相同的传感特性,具有不同检测技术的固相受体结合检测方法已经被开发出来[74-77]。原理类似竞争抑制ELISA,比如待测物中环亚胺与固相上的毒素竞争结合其受体,再用受体的一抗、HRP-二抗检测受体的量,从而计算目标物的含量。Aráoz 等[75]基于环亚胺类毒素对α-金环蛇毒素与nAChR 结合的竞争性抑制,开发了受体结合微孔板测定法,能够检测贝类样品中的环亚胺类毒素。该方法具有高灵敏度和可重复性,但是选择性较低,需结合质谱分析才能确认毒素类型。Rodríguez 遵循类似的原理,利用微球/流式细胞仪系统开发了基于受体的螺内酯检测方法,所用的受体分别是石纹电鳐来源的nAChR 和静水椎实螺来源的乙酰胆碱结合蛋白(AChBP)。通过将nAChR 或AChBP 固定在羧化微球表面上,用环亚胺与α-金环蛇毒素竞争结合受体蛋白的方式来进行荧光定量检测。经简单样品前处理,该方法可以灵敏检测贻贝、扇贝和蛤蚌中13-去甲基螺旋内酯C,检测范围为10~6000 μg/kg[76]。
3.5.2 其他海洋生物毒素
软骨藻酸是一种兴奋性神经递质谷氨酸酯的类似物。Van Dolah 等[26]开发了一种受体测定法,即在SF9 昆虫细胞膜上表达了谷氨酸受体GLUR6,利用竞争法检测软骨藻酸。由于GLUR6 同样能够识别谷氨酸,所以检测样品必须经过去谷氨酸处理,使得该方法具有一定的局限性。Van Dolah 和来自6 个不同国家的9 所实验室合作,开展了一项针对麻痹性贝类毒素的受体结合测定研究。该研究基于提取物与3H 标记的蛤蚌毒素(3H-saxitoxin)竞争结合大鼠脑膜的钠离子通道,3H-saxitoxin 结合数量的减少与海鲜中存在的贝类毒素量成比例[78]。
海葵毒素(PLT)是一种高毒性非肽类海洋天然产物,具有复杂的化学结构,其作用靶点是Na+,K+-ATPase 酶。Alfonso 等[79]结合荧光偏振开发了一种基于Na+,K+-ATPase和海葵毒素相互作用的检测方法,用荧光偏振度来量化海葵毒素浓度。该方法可以检测贻贝样品和鞭毛藻培养物中海葵毒素,定量限为10 nmol/L,检出限为2 nmol/L。随后,该团队还开发了基于Na+,K+-ATPase的表面等离子体共振生物传感器,对海葵毒素的检出限为3.73 pg,定量限为11.20 pg[80]。
3.6 生物性污染
食源性致病菌是导致食品安全问题的重要来源,检测食品中存在的食源性致病菌对于预防传染病的传播至关重要。利用感官受体蛋白构建电子鼻、舌,可以用于食品质量和安全评估[81]。
受真菌污染的谷物中会产生1-辛烯-3-醇,可以被特定人类嗅觉受体(OR)所识别。Ahn 等[27]利用人胚胎肾细胞HEK293 生产含OR 的纳米囊泡,并将囊泡整合到单壁碳纳米管场效应晶体管(swCNT-FET)中,构建了对特定气味的感知和信号放大系统。该系统对1-辛烯-3-醇具有高选择性,因此可以有效用于谷物中真菌污染的实时测量,检测灵敏度可达1 fmol/L。遵循类似的手法,Son等[82]利用两种人类嗅觉受体OR51S1 和OR3A4,分别用以识别细菌产生的土臭素(GSM)和2-甲基异冰片醇(MIB),结合swCNT-FET 放大信号,所构建的电子鼻可以实现对自来水、瓶装水和河水中细菌的检测,灵敏度低至10 ng/L。Sankaran等[8]利用来自果蝇增香剂结合蛋白LUSH 的多肽片段作为感知材料,开发了石英微天平(QCM)传感器,以检测指示包装牛肉中沙门氏菌污染所产生的挥发性有机化合物,如3-甲基-1-丁醇和1-己醇。
RAW264.7 免疫细胞表面富含受体蛋白比如TLR,能够识别病原体相关分子模型(PAMP)。细胞被细菌污染后,最终会激活细胞因子的表达,比如TNF-α。基于这一原理,Seo等[83]以RAW264.7细胞为感知元件,用双抗体夹心的传感器检测TNF-α,形成检测信号,可以应用于实时检测牛奶样品中的志贺氏菌、金黄色葡萄球菌和单核细胞增生李斯特氏菌等致病细菌。不过,该传感器的信号传导易受培养基的搅动程度和体积影响,这势必会影响在实际应用中的推广。再者,这种传感器虽然基于受体-配体结合的原理,但是其检测信号本质上是经由复杂通路激活产生的,在稳定性上可能会有所欠缺。
3.7 瑞鲍迪苷A
瑞鲍迪苷A(Reb-A)是一种甜菊醇糖苷,是可以从菊科甜菊中提取的天然甜味剂。Reb-A在高温条件下具有良好的稳定性,因此在食品中被广泛使用。Arodola等[84]通过同源性建模、分子对接和分子动力学模拟等计算机辅助技术,阐明了Reb‑A 和人类甜味受体T1R2 单体之间的相互作用关系,构建了基于T1R2-Reb-A 复合物、氧化锌纳米颗粒(ZnO-NPs)和氧化石墨烯(GO)的电化学传感器,用于检测Reb-A,遗憾的是该方法没有落实到真实样品的检测。另外,该作者所在团队[85]还开发了一种新型的细胞色素C 修饰的纳米复合电化学生物传感器,用于测定不同食品样品中的Reb-A。虽然目前还没有关于甜菊糖苷对健康危害的报道,但考虑到此类甜味剂在食品工业中的广泛使用,上述检测方法可能在未来有一定的应用前景。
4 受体用于食品安全检测的优缺点
传统抗体的制备都要经由动物免疫,不仅周期长,而且需要熟练的操作技艺。另外,对于本身带有毒性的待测物,动物经免疫后易死亡,获得特异性抗体难度较大。受体的制备主要通过在细胞中重组表达产生的,相对制备周期短、效率高。此外,受体还具有检测优势,受体最重要和独特的特征是特异性,受体可以与特定药物类别中许多药物组合,无论其结构相似性如何。遇到同一类别的多种药物的混合物并不少见,对应某一类非法添加物,受体的另一个优点得以呈现,即受体测定方法能够对包含多种药物的混合物产生单一的信号响应。受体在这类混合物的检测中往往能发挥重大作用。对于一些高毒素分子和低免疫原性的分子,往往无法通过制备单克隆抗体的方式检测,受体检测是绝佳的选择。和基于抗体的检测方法类似,受体同样可以和多种标记技术串联使用,从而获得更高的检测灵敏度。
常规的单克隆抗体,往往需要经过多次免疫和筛选的过程,以不断完善抗体的高亲和力进化。相比之下,天然的受体蛋白与配体的亲和力相对固定。随着检测要求的不断提高,其性能可能难以达标。另外,相比抗体,蛋白的稳定性较差是酶标受体的缺点之一。受体对药物分子的识别通常具有广谱性,对于一类化合物中某种特定药物的高特异性检测,恐怕很难满足。再者,一些受体蛋白,特别是含有多个跨膜域的膜蛋白,由于其本身性质,在不同的蛋白表达系统中表达量都不会太高,不易制备,或者制备所得受体物质活性会有所损失,导致特异性减弱。要想真正将此类受体应用于食品检测,这是必须要改进的一个方面。
5 展望
21 世纪是生物技术学科飞速发展的时代,分子生物学和合成生物学技术和理论的不断革新,进一步推动受体结合测定技术的进步。目前,基于受体蛋白的受体结合测定技术已经成为食品安全检测的有效手段,可应用于检测食品中抗生素、农药、生物毒素、病原菌、非法添加物等多种危害物质残留,展现出不俗的未来发展前景和一定的市场应用潜力。究其原因,是不断的生物进化或人为进化过程使受体蛋白对配体(如危害物质)具有高亲和力和特异性,从而成为配体的“天然靶标”。特别是当受体蛋白能够识别某一类物质的共有位点或被某一类物质的共有位点抑制活性时,那么就可以利用受体蛋白实现对此类物质的广谱性检测。比如,基于β-内酰胺受体蛋白的检测技术发展较为成熟,已有多款检测试剂盒(试纸条)类产品实现商品化,用于β-内酰胺类抗生素的快速、灵敏检测。
不过,许多基于受体蛋白的检测方法仍处于实验室研究阶段,亟待解决的瓶颈问题主要包括受体蛋白的稳定性、特异性或广谱性等。随着分子克隆和基因工程等生物技术的快速发展,“定向进化”和“噬菌体展示”的概念已逐渐被人们所认可且熟知。研究人员通过对酶的定向改造,可以使其拥有更高的活性和稳定性[86]、更多的选择性和功能性[87-88]。噬菌体展示技术是目前最高效的高通量筛选手段之一,能够实现基因型(DNA 序列)和表型(高亲和力、高特异性)的完美对接,适用于筛选优质的结合蛋白或抗体[33]。对于正在开展检测应用研究的受体蛋白来说,这些技术的合理利用是解决上述瓶颈的关键。利用同源建模、分子对接和动力学模拟,预测受体蛋白识别和结合配体的活性位点。针对相关位点设计随机突变引物,结合PCR 扩增技术构建受体蛋白噬菌体展示文库。通过对受体蛋白的定向进化设计,改变其特异性或提高其亲和力、稳定性,从而扩展其在食品检测中的应用将是未来的研究热点。另一方面,对危害物质的检测可以借助能够被危害物质抑制的酶,或者能够代谢危害物质的酶,又或者能够识别、转运危害物质的酶。这些酶都是能和危害物质相互作用的蛋白,均可视为危害物质的潜在“受体蛋白”。因此,将来开发此类受体蛋白并运用于食品安全检测也具有不错的研究前景。
通过多学科交叉研究的方式,开发更廉价的检测设备,实现受体信号的转换和放大;针对不同类型受体蛋白,优化不同底盘生物中的表达条件,实现受体蛋白的量产化,从而降低受体检测应用的价格;一些难以制备抗体的小分子毒害物质,可以尝试使用其天然的受体或定向筛选非天然受体,比如分子印迹蛋白质、多肽片段等。以上都是未来值得研究的方向。
