基于生物正交反应的病毒功能化及其生物医学应用
2022-05-14黄利利张韩王伟伟谢海燕
黄利利,张韩,王伟伟,谢海燕,
(1 北京理工大学医工融合研究院,北京 100081; 2 北京理工大学生命学院,北京 100081)

病毒是一类个体微小,结构简单的非细胞型生物。病毒大小为纳米级,形态呈单分散,不同类型的病毒具有特定的空间结构,对pH 值、温度和溶剂的变化相对稳定,可大量复制[1-5]。这些独特的性能使得病毒被广泛研究,并应用于生物医学的多个领域[6-8]。而在这之前需要根据病毒的实际使用需求对其进行修饰,赋予其新的性质和功能。从结构组成来讲,病毒是由核酸(DNA 或RNA)和蛋白质构成的核酸-蛋白复合体,而对于包膜病毒而言,在其核衣壳之外还包裹了一层由特殊蛋白、类脂、多糖组成的脂质包膜。因此,组成病毒的核酸、蛋白质、脂类、多糖四类生物大分子均可作为病毒修饰的分子靶标。因此,建立普适、高效并且可在复杂环境下高选择性地修饰生物大分子的技术和方法,不但对生物复杂体系中探索生物大分子的信息与功能具有重要意义,而且对病毒相关的生物医学研究具有重要的推动作用。
生物正交反应是指一类能够在不干扰生物体自身生化反应的条件下,在活体、组织或细胞中进行的化学反应。理想的生物正交反应具有以下特点:反应可在生理条件下进行,反应速度快,且具有高度的反应特异性和选择性,生成的产物结构稳定,生物相容性好。2000 年,Bertozzi 课题组开发出了叠氮基团与膦(如三苯基膦)或亚磷酸酯反应,并将其用于细胞表面糖分子的化学修饰。该反应对生命科学研究产生了革命性的影响,自此开启了生物正交反应的研究热潮[9]。到目前为止,已有十余种生物正交反应被发现或者开发并用于病毒、菌类、细胞、组织的功能化改造[10]。迄今为止,研究人员已经开发出了多种生物正交反应,其中常用于生物大分子功能化改造的生物正交反应主要包括:①醛或酮与胺类化合物的缩合反应;②施陶丁格反应;③叠氮-炔基环加成反应;④逆电子效应的狄尔斯-阿尔德反应[11-12]。
1 生物正交反应及其对生物大分子的功能化
1.1 醛或酮与胺类化合物的缩合反应
含羰基的化合物(如醛或酮)可与胺类化合物发生缩合反应,形成结构相对稳定的肟键或腙键(图1)[13]。而且,研究者发现胺、硫醇等亲核试剂也可以与含羰基的化合物反应,生成的产物在水溶液中均能保持稳定[14]。因此,在20 世纪后期,该类反应被逐渐应用于溶液中蛋白质、脂类或聚糖等生物大分子的修饰[15-18]。但是这类反应要求被修饰的生物大分子纯度较高,主要原因是由于生物体系内部的葡萄糖、丙酮酸等内源性分子同样含羰基基团,可与上述亲核试剂发生竞争反应,导致对目标生物分子的选择性和特异性不够高。因此,将含羰基的化合物与胺类化合物的缩合反应用于病毒功能化改造之前,需要先对病毒进行分离纯化[19]。为此化学家们开始尝试将一些独特的活性官能团引入生物体系,以克服生物正交反应在病毒功能化改造中的局限性。
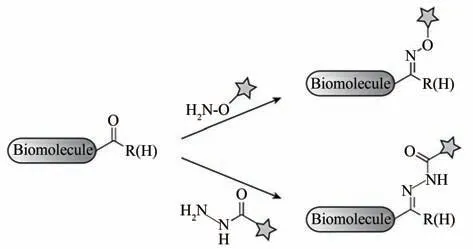
图1 基于醛或酮类的生物正交反应[13]醛和酮可以与胺类化合物[氨基氧化合物(上)、酰肼化合物(下)]发生缩合反应形成稳定的肟键或腙键Fig.1 Bioorthogonal reactions based on aldehydes or ketones[13][Aldehydes or ketones can condense with aminooxy compounds(top)or hydrazide compounds(bottom)to form stable oxime or hydrazine linkages,respectively]
1.2 施陶丁格反应
施陶丁格反应是通过叠氮化合物与膦(如三苯基膦)或亚磷酸酯反应得到亚胺基膦烷中间体,并进一步水解得到分子内酰胺基氧化膦(如三苯基氧膦)的一类生物正交偶联反应。2000 年,Bertozzi 团队[13]改进了施陶丁格反应,将反应过程中的氧化膦排出,使得叠氮化合物与膦反应生成天然的酰胺键,该反应被称为无痕施陶丁格连接反应(图2)。反应中的膦类化合物与叠氮化合物在生物体系中是完全不存在的,因此对生物体系中生物大分子功能化具有高度的特异性。这也是第一个基于非生物体系化学基团的生物正交反应[9,19-20]。更重要的是,二者对目标生物大分子的结构和功能的影响非常小,可在活细胞或活体中进行生物大分子的原位功能化改造[21-23]。此后,许多研究小组开始将叠氮基团作为生物大分子功能化的报告基团[24-26]。因此,理论上该反应不但可用于分离纯化后的病毒修饰,而且可用于细胞或活体内病毒的原位标记。然而,施陶丁格反应在生物大分子功能化方面仍存在一定的局限性。其反应速率很低[典型的二级反应速率常数为k=0.0020 L(/mol·s)], 需 要 高 浓 度 的 三 苯 基 膦(>250 mmol/L)才能促进反应的进行[9,19-20]。因此,化学家们对发展更快的基于叠氮基团的生物正交反应产生了极大的兴趣。

图2 生物大分子与配体通过无痕施陶丁格反应偶联[13][通过膦(1)与叠氮基团自发的反应生成亚胺磷烷(2),进一步发生结构重排(3),之后水解得到酰胺键偶联产物(4)和氧化膦副产物]Fig.2 Biomacromolecules coupling with ligands by the trace‐less Staudinger ligation reaction[13].[The phosphine-modified biomacromolecule(1)could react with the azide-linked ligand by the Staudinger ligation reaction to yield imino‐phosphorane(2),which rearranges to produce the intermediate(3)for hydrolysis to generate the coupling product(4)and a phosphine oxide by-product.]
1.3 叠氮-炔基环加成反应
叠氮-炔基环加成反应是指含叠氮基团的化合物作为1,3-偶极子与炔烃发生[3+2]环加成反应(图3)[13]。在一价铜离子的作用下,叠氮基团与炔基的反应速率可达到(65±10)L/(mol·min),该反应被称为Cu(Ⅰ)催化的叠氮-炔基环加成(copper catalyzed azide-alkyne cycloaddition,CuAAC)反应,反应生成稳定的三氮唑产物[27-28]。另外,研究者通过使用特定的铜离子配体,使得叠氮-炔基环加成反应的反应速率得到不同程度提升[29-30],基于该反应极高的产率和优异的官能团选择性,越来越多的生物学家将其应用于生物系统中蛋白质、糖类等生物大分子的功能化改造[31-32]。但是,Cu(Ⅰ)催化剂的潜在细胞毒性阻碍了CuAAC 反应在生物大分子功能化方面的广泛使用。由于对病毒组成成分进行功能化的过程中无法保证病毒活性,该反应更多地被用于病毒检测和相关药物的研发,而无法用于活病毒标记与示踪。为了消除Cu(Ⅰ)催化剂的毒副作用,化学家们一方面侧重于开发铜离子螯合配体,通过稳定一价铜离子来降低其毒副作用[30,33-35];另一方面,致力于开发无需铜离子催化的生物正交反应。直到2004 年,Bertozzi 课题组[36]报道了一种可利用环状炔烃的张力推进作用触发叠氮-炔基之间的环加成反应,该反应被称为张力促进的叠氮-炔基环加成(strain promoted azide-alkyne cycloaddition,SPAAC)反应,也被称为“无铜点击化学”反应。该反应不但保留了叠氮基团与炔基的反应特异性,而且避免了因铜离子参与而产生的生物毒性。然而,与CuAAC 相比,其反应效率较低。例如,环辛炔与叠氮化合物的二级反应速率常数k=0.0024 L/(mol·s),与施陶丁格反应相当。为此,研究人员开发出了一系列环辛炔衍生物,使得反应速率得到不同程度的提升[37-40]。目前该反应已经被广泛应用于病毒、菌类、细胞、活体等不同生物体系中生物大分子的功能化改造[41-45],是目前为止进行生物大分子功能化中最常用的生物正交反应类型之一。
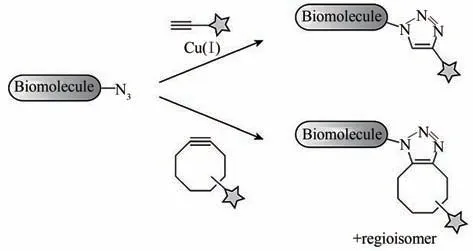
图3 叠氮基团与炔基发生环加成反应,生成三氮唑产物[13][Cu(Ⅰ)催化的叠氮-炔基环加成反应(上)和张力推进的叠氮-炔基环加成反应(下)]Fig.3 Bioorthogonal cycloadditions of azides and alkynes to form triazoles[13][Terminal alkynes are activated by Cu(Ⅰ)to undergo cycloaddition with azides(top).Cyclooctynes react with azides through a strain-promoted cycloaddition(bottom).]
1.4 逆电子需求的狄尔斯-阿尔德反应
带有供电子基团的亲双烯体与带有吸电子基团的双烯体之间可自发地发生快速高效的双烯加成反应[46]。其中最典型的反应方式就是四嗪和反式环辛烯之间的逆电子需求的[4+2]狄尔斯-阿尔德环加成(inverse electron-demand Diels-Alder,IEDDA)反应[47-48]。二者的反应速度非常快,二级反应速率常数为(2000±400)L/(mol·s),因而可在低浓度下实现目标生物分子的功能化[47,49]。该反应无需催化剂,且反应具有高度的区域选择性和立体选择性。目前该反应也已被用于活体、细胞、细菌、病毒的体外或体内生物大分子功能化改造与荧光标记[50-53]。值得注意的是,四嗪分子上连接的吸电子基团,或者提高亲双烯体的给电子能力,均可以有效地提高IEDDA反应的反应速率,然而过强的吸电子取代基会加快四嗪分子在体内的降解速度,而亲双烯体的环张力、取代基构象等因素同样对IEDDA 反应的反应速率具有重要影响。因此,在实际应用中需要考虑多方面的影响因素,寻找最佳平衡点。
2 生物正交反应对病毒组成成分的功能化
利用生物正交反应进行病毒功能化改造,首先需要将特定的生物正交反应基团(如醛基、叠氮、烯烃等)引入目标生物分子中,然后利用生物正交反应将含有互补官能团的功能元件(如抗体、寡核苷酸、多肽、蛋白质、碳水化合物,荧光探针、药物等)引入目标分子,进而实现病毒的蛋白质、聚糖、脂质、核酸不同组分的功能化改造。方法稳健、通用,而且在胞外或胞内均可进行高效、特异的反应,是进行目标病毒组分功能化中非常重要的工具[54-55]。
2.1 蛋白质
蛋白质是病毒衣壳蛋白和包膜蛋白的重要组成成分,而氨基酸是蛋白质的基本组成单元,氨基酸具有几个可直接进行修饰的基团,包括赖氨酸的伯氨基、半胱氨酸的巯基、天冬氨酸和谷氨酸的羧基、酪氨酸的酚羟基,以及组氨酸的咪唑基。因此,可通过化学修饰或生物偶联的方式直接将生物正交基团引入上述天然氨基酸,以实现目标蛋白的修饰。目前,叠氮或炔烃基团已被成功引入多种病毒的蛋白组分中[56-59]。例如,Steinmetz 等[56]将炔基修饰的富勒烯衍生物通过CuAAC 反应连接到叠氮修饰的豇豆花叶病毒和噬菌体Qβ 病毒样颗粒表面,不但解决了富勒烯水溶性问题,而且可实现富勒烯在病毒表面的高效负载,这对于开发具有光激活性能的新型肿瘤诊疗试剂具有重要推动作用。另外,研究表明与N-羟基琥珀酰亚胺和马来酰亚胺等直接的化学修饰相比,利用CuAAC 反应进行病毒功能化改造的速度更快,而且具有更高的选择性和特异性[55]。Steinmetz 课题组[58]也证实,将炔基修饰到马铃薯X型杆状病毒蛋白表面,可通过生物正交反应实现生物素、荧光探针、PEG 等多种功能基团与病毒的偶联,进而赋予病毒生物成像、肿瘤靶向等功能。本课题组利用叠氮修饰的PEG4-NHS 与痘苗病毒(vaccinia virus,VACV)表面的氨基发生反应,产生叠氮基团修饰的VACV,进而与环炔修饰的量子点通过SPAAC 反应偶联,修饰后的VACV仍具有良好的生物活性,能感染宿主细胞,而且病毒表面的量子点仍保持初始的荧光性能,可用于病毒感染过程的动态示踪[59]。
除了叠氮-炔基的环加成反应外,基于醛或酮与胺类化合物的缩合反应也被广泛用于病毒蛋白的功能化。研究者分别将醛基或酮基官能团引入病毒衣壳蛋白或包膜蛋白表面,并通过缩合反应,将其与羟基胺、酰肼和烷氧胺类修饰的功能分子偶联,成功构建出多种以病毒为载体的生物成像系统和药物递送系统[60-65]。例如,Hooker 等[60]构建了基于噬菌体MS2 的纳米级磁共振成像系统。作者首先将NHS 修饰的醛基官能团与病毒衣壳表面赖氨酸残基的氨基反应,实现病毒衣壳内表面的醛基修饰,随后通过肟缩合反应,与对苯二胺配体修饰的Gd3+络合物偶联;该策略不但提高了磁成像造影剂——Gd3+络合物的水溶性和稳定性,而且所构建的成像系统具有更高的弛豫性,为生物医学研究领域提供了性能优良的成像探针[60]。另外,也有研究者利用磷酸吡哆醛修饰蛋白质或多肽的N 端氨基,进而通过转氨作用将羰基引入目标蛋白,从而为蛋白质的功能化提供作用靶点[63-64]。为了进一步提高缩合反应对蛋白质的功能化效率,Dirksen等[61]利用苯胺作为催化剂,将芳香醛引入未保护的氨基酸,使其能够在室温条件下与胺的亲和试剂反应得到腙和肟缀合物,进而实现荧光探针对目标蛋白或多肽的功能化。结果发现,该反应高效、快速、选择性强,反应速率常数为101~103L/(mol·s),超过了CuAAC 等常规的生物正交反应,表明该反应能够在低浓度和中性pH 下实现目标多肽和蛋白质的高效标记。Kovacs 等[65]将两种不同的生物正交反应策略分别用于MS2 病毒样纳米不同组分的功能化改造,实现了荧光染料在病毒内部装载,以及靶向配体——核黄素与病毒衣壳外表面偶联,进而成功构建出具有肿瘤靶向性的病毒载体成像系统。
通过直接对天然氨基酸进行化学修饰,进而偶联生物正交基团的病毒功能化改造策略,操作简便、经济、省时,但也存在一些不足。比如:无法准确控制生物正交基团在目标病毒组分上的数目和分布,偶联的功能分子极易占据病毒的表面识别位点,影响病毒自身的生物学功能[66-67]。因此,功能化的病毒主要被用于抗病毒药物或疫苗的开发,以及以病毒为载体的递送系统构建等,若将其用于病毒标记和示踪,则需要对病毒表面偶联物的剂量和偶联部位进行严格控制。为了使功能化后的病毒仍具有良好识别并感染宿主细胞的能力,科学家们开发出多种向目标生物大分子中引入特定生物正交反应基团的方法,主要包括基于残基定位法的非天然氨基酸引入技术和基于基因编码的非天然氨基酸定点引入技术[68-70]。
基于残基定位法的非天然氨基酸引入技术,是将生物正交基团修饰的氨基酸作为天然氨基酸的结构类似物,通过蛋白质自然的生物合成与代谢嵌入途径实现目标蛋白的功能化。这种蛋白质功能化策略具有良好的生物相容性,一般不会对目标蛋白的结构和功能产生影响,而且无需额外加入氨酰-tRNA合成酶。目前,带有叠氮、炔基或羰基等小分子官能团的氨基酸已经通过上述策略成功实现多种病毒蛋白的功能化[71-72]。例如,Carvalho 等[71]利用生物正交反应实现流感病毒样颗粒包膜蛋白荧光标记的策略(图4)。首先,作者将叠氮高丙氨酸(AHA)加入培养基中,利用杆状病毒表达系统对A 型流感病毒包膜蛋白——血凝素进行高效表达的过程中,实现血凝素的叠氮基衍生,该过程不影响血凝素蛋白的折叠和生物学功能,构建的流感病毒样颗粒的包膜表面带有叠氮基团,可利用环炔修饰的荧光探针,通过SPAAC 反应,实现病毒样颗粒的荧光标记[71]。Strable 等[72]分别将带有炔基或叠氮基的甲硫氨酸类似物用于乙型肝炎病毒或噬菌体Qβ 衣壳蛋白的修饰,结果发现所构建的病毒样颗粒中,生物正交基团的嵌入率超过95%。表明上述甲硫氨酸类似物具有良好的生物相容性,可实现病毒蛋白的高效、高选择性修饰,为荧光探针、靶向分子等功能基团对病毒的功能化改造提供了有利条件。

图4 流感病毒样颗粒包膜蛋白的体内位点特异性标记[71]将叠氮基团修饰的非天然氨基酸——AHA添加到培养基中,在细胞中后续血凝素蛋白扩增的过程中,将AHA引入新生的血凝素蛋白(Hemagglutinin,HA)中,带有叠氮基团的血凝素蛋白被融合到细胞分泌的囊泡表面,进而可利用环炔修饰的Alexa 488通过张力促进的叠氮-炔基环加成反应,实现囊泡表面血凝素蛋白的位点特异性标记,构建成可发荧光的流感病毒样颗粒Fig.4 Site-specific in vivo labeling of enveloped influenza VLPs[71]During intracellular protein synthesis,the AHA is incorporated into the nascent HA proteins.The modified HA is further incorporated into the vesicles’envelope that can secret from the cells,carrying the chemical modification.Addition of the Alexa 488-cyclooctyne reagent allows the site-specific modification of HA by strain-promoted alkyne-azide cycloaddition(SPAAC)
基于基因编码的非天然氨基酸定点引入技术,是将带有环状烯烃或炔烃等大分子生物正交反应官能团的非天然氨基酸,以基因编码的方式引入目标蛋白的特定部位,从而实现蛋白功能化修饰的目的[73]。2000 年,Schultz 课题组[74]将非天然氨基酸编码到对应的琥珀密码子或四碱基密码子上;同时,将可特异识别非天然氨基酸的外源氨酰-tRNA合成酶也引入细胞内,进而在蛋白质翻译过程中将该氨基酸插入延长的肽链中,成功实现了目标蛋白的位点特异性修饰。研究者将该技术与生物正交偶联反应结合,成功实现了病毒蛋白的位点特异性修饰。例如,Carrico 等[75]将侧链上含苯丙氨酸官能团的非天然氨基酸利用终止密码子引入病毒的衣壳蛋白上,进而通过生物正交反应成功地将多肽偶联在病毒的特定部位,提高了病毒的肿瘤靶向性。目前该技术已被用于多种功能分子对噬菌体MS2、肝炎病毒、HIV 病毒等的功能化改造,拓宽了病毒在生物医学领域的应用范畴[76-79]。
2.2 糖类
糖基是包膜病毒糖蛋白的重要组成成分,同样可作为病毒功能化的靶点。糖类分子上的醛基和酮基可直接与胺类化合物发生缩合反应。另外,也可将生物正交基团引入糖类分子的羟基,实现目标糖类分子的修饰[80-81]。然而,由于病毒糖蛋白在其感染宿主细胞的多个阶段,例如吸附、入胞、组装、出芽等过程中起着至关重要的作用,因此,若希望功能化后的病毒仍保持良好的感染力,则需要对生物正交基团的引入数量和引入位点进行严格控制。因此常用的功能化策略是将带有叠氮、硫醇、酮等生物正交基团的甘露胺、半乳糖胺、葡萄糖胺等寡糖或单糖分子作为天然糖分子类似物,并通过自然的糖代谢机制将该糖分子类似物引入目标糖蛋白中,之后通过生物正交反应与带有互补官能团的功能分子偶联,实现糖蛋白的功能化[82-83]。例如,人类腺病毒(Ad5)在纤维蛋白的第109 位丝氨酸残基上有一个乙酰葡萄糖(O-GlcNAc)残基。因此,Banerjee 等[84]将叠氮基团修饰的葡萄糖通过糖代谢引入腺病毒纤维蛋白中,进而利用CuAAC 反应,将肿瘤靶向元件——叶酸小分子偶联在病毒颗粒表面,从而增强腺病毒对乳腺癌细胞的靶向性。Zhao 等[85]分别利用叠氮基团修饰的N-乙酰甘露糖胺和半乳糖胺通过糖代谢嵌入麻疹病毒的包膜糖蛋白,并通过SPAAC 反应与炔烃修饰的荧光探针偶联(图5)。研究表明,上述标记策略不影响病毒的结构和功能,可用于病毒的动态可视化成像,为包膜的代谢标记奠定了基础[84-86]。另外,基于病毒蛋白质的修饰策略同样可用于病毒糖蛋白的功能化。例如,Fernandez等[87]利用基因工程改造技术,将环炔修饰的非天然氨基酸定点引入HIV-1包膜糖蛋白复合物中,进而通过四嗪与环炔间的IEDDA 反应对HIV-1 包膜糖蛋白荧光标记,并用于对宿主细胞感染过程的动态可视化成像。

图5 利用叠氮化的糖通过宿主细胞膜蛋白的糖基化过程实现对包膜麻疹病毒糖蛋白的修饰[85]Fig.5 Modification of an enveloped measles virus can be achieved by the metabolic incorporation of azido sugars into the host cells through the protein glycosylation process[85]
2.3 脂类
与病毒表面糖蛋白不同,修饰病毒包膜脂质分子对病毒的生物学性能影响相对较小。因此,对其进行功能化修饰可更好地保持病毒的结构和功能的完整性。最初,研究者开发了一系列带有生物正交官能团的脂类分子类似物或其前体分子类似物,如磷脂类、固醇类、鞘脂类,并通过直接插膜或脂代谢的方式实现细胞膜脂类的功能化[88-90]。例如,Salic 课题组[88]设计合成了胆碱的结构类似物——丙炔胆碱,并将其加入不含胆碱的细胞培养液中与NIH 3T3 细胞共孵育,进而通过细胞内磷脂酰胆碱的生物合成和代谢嵌合机制,成功将丙炔基修饰在细胞膜磷脂上,并利用叠氮基团修饰的荧光探针实现细胞膜的标记。由于包膜病毒感染宿主细胞的过程中,组装好的子代病毒颗粒会以出芽方式从细胞中释放,并将宿主细胞膜转变成自身的包膜。因此,许多研究小组利用这一策略成功地将叠氮基团引入到目标病毒包膜中,并证实这种修饰方法可以有效保持病毒的生物活性[91-92]。例如,本课题组首先通过胆碱磷脂的“生物合成”与“自然嵌合”,实现了宿主细胞膜上胆碱磷脂的叠氮基衍生,接着进行病毒的感染复制,利用包膜病毒复制组装时需要从宿主细胞膜中获取磷脂成分以形成自身包膜的特性,在病毒的复制组装过程中实现了病毒包膜的叠氮基衍生,进而加入环炔基修饰的荧光探针,通过SPAAC 反应实现了病毒包膜的标记(图6)[91]。
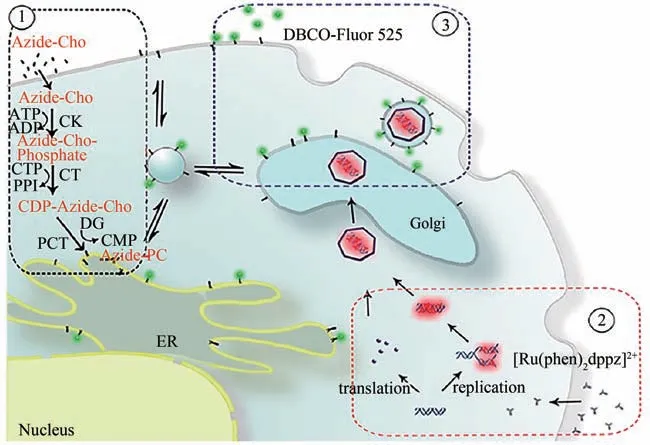
图6 宿主细胞内的病毒包膜与核酸的双荧光标记[91][叠氮化物胆碱(Azide-Cho)和[Ru(phen)2(dppz)]2+存在下,利用VACV感染宿主细胞。首先Azide-Cho利用宿主细胞中磷脂的生物合成途径掺入细胞膜中(①);然后在VACV感染细胞2 h后,加入[Ru(phen)2(dppz)]2+,使其能通过病毒导致细胞病理效应进入细胞,并嵌入病毒核酸中(②);在病毒感染24 h后,将DBCO-Fluor 525荧光探针加入培养基中,用于VACV包膜的标记(③);继续感染24 h后,双标记的病毒粒子被组装并释放]Fig.6 Dual-fluorescent labeling of the viral envelope and nucleic acid in host cells[91][The vaccinia virus(VACV)propagates in the presence of both azide-Cho and[Ru(phen)2(dppz)]2+in the host cell.The biosynthesis and incorporation of azide-Cho-containing phospholipids in the host cells are carried out at first(①);then the cells are infected with VACV,and the[Ru(phen)2(dppz)]2+is added into the medium at 2 h after the infection,which could enter the cells through the permeable cytomembrane due to the cytopathogenic effect of the virus to label the nucleic acid of the virions(②);at 24 h after the infection,DBCO-Fluor 525 is added into the medium to label the envelope of the VACV(③);after another 24 h with the infection,the dual-labeled virions are finally assembled and released.]
2.4 核酸
病毒核酸分为RNA 和DNA 两种类型。分别由四种不同的核苷酸/脱氧核苷酸组成,而这也是进行病毒核酸功能化改造的分子靶标。目前科学家已经合成多种功能化核苷酸/脱氧核苷酸分子,并通过生物正交反应实现核酸的功能化[93-98]。例如,Carell 和他的同事合成了炔基修饰的核苷酸用于DNA 的合成后标记[97]。Salic 等[98]分别合成了炔基修饰的脱氧尿苷、烯基修饰的脱氧尿苷和炔基修饰的尿苷,并作为核苷酸衍生物通过生物合成及代谢嵌入途径分别引入DNA 或RNA 中,之后利用功能化荧光探针通过生物正交反应,实现DNA或RNA 的荧光标记。Wang 等[95]将炔基修饰的核苷类似物用于病毒DNA 修饰,进而通过叠氮修饰的荧光探针实现病毒在细胞内的原位标记。而且作者比较了炔基修饰的不同核苷类似物(炔基脱氧尿苷、炔基脱氧胞苷、炔基脱氧腺苷)分别对单纯疱疹病毒、腺病毒和痘苗病毒的毒性和修饰效率。研究结果为基于核苷类似物和生物正交反应的病毒核酸标记技术提供了重要信息。本课题组[99]基于上述标记策略,发展了一种普适性更强的病毒多组分标记方法,首先分别合成了带有叠氮基团的氨基酸以及带有乙烯基团的脱氧核苷酸,并通过宿主细胞内蛋白质和核酸的生物合成途径,分别实现了病毒蛋白的叠氮基和核酸的乙烯基衍生,进而将SPAAC与IEDDA 两种生物正交反应偶合于同一个细胞中发生,实现了病毒蛋白与核酸的双重标记。该方法可应用于所有包膜病毒和衣壳病毒,具有很强的普适性(图7)。
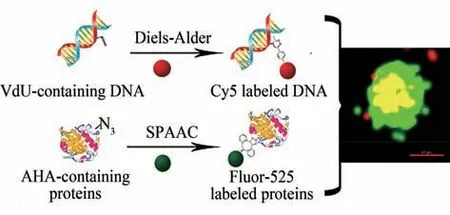
图7 宿主细胞内的病毒蛋白与核酸的双荧光标记[99](叠氮基衍生的病毒蛋白可通过SPAAC反应与环炔修饰荧光探针偶联;乙烯基衍生的病毒核酸可通过IEDDA反应与四嗪修饰荧光探针偶联)Fig.7 Dual-fluorescent labeling of viral protein and nucleic acid in host cells[99](AHA-containing protein is labeled by SPAAC reaction,and the VdU-containing nucleic acid is labeled by IEDDA reaction)
3 功能化病毒的生物医学应用
生物正交反应功能化的病毒已经被广泛应用于生物医学相关研究,包括病毒示踪、病毒疫苗的开发、病毒感染的检测、基于病毒载体的纳米药物或成像试剂的递送等[54,100-102]。
3.1 病毒示踪
对病毒感染宿主细胞的过程和致病机理等知识的缺乏,严重限制了病毒性疾病诊断技术的发展,以及相关疫苗与治疗药物的研发[103]。随着先进的荧光成像显微镜和单分子荧光成像技术的发展,使得单粒子或单分子水平上研究病毒-细胞相互作用成为了可能。其中利用生物大分子的生物合成和代谢嵌入机制进行病毒不同组分的荧光标记,方法简便、高效,避免了烦琐和破坏性很强的病毒纯化和修饰过程,最大程度保持了病毒活性[78,86,104-107];进而通过动态示踪被标记病毒的运动轨迹,解析其感染宿主细胞过程中的关键分子事件,为阐明病毒的感染机理提供理论依据[93,96,108-109]。例如,Teo等[107]通过示踪单纯疱疹病毒(herpes simplex virus,HSV)蛋白在细胞核内的蓄积过程,揭示了NPDs蛋白在HSV感染早期招募宿主和翻译新生病毒蛋白的重要作用。Hagemeijer 等[93]利用带有乙炔基的尿苷修饰新生冠状病毒的RNA,并通过点击化学反应实现病毒核酸的荧光标记,进而可视化示踪病毒核酸的运
动轨迹,阐述了双链RNA(dsRNA)在病毒RNA合成中的作用。Alandijany 等[108]通过示踪HSV 对宿主细胞的感染过程,发现早幼粒细胞白血病核体(PMLNBs)在病毒基因组进入细胞核时,通过捕获病毒DNA的方式阻止病毒复制。
研究清楚病毒的感染机制,将有助于病毒性疾病的诊断和相关疫苗与治疗药物的研发。例如,丙型肝炎病毒(hepatitis C virus,HCV)的抑制剂BMS-790052,可通过与HCV 编码的锌结合磷酸化蛋白NS5A 作用,抑制病毒感染[110]。为此,研究者设计了含有生物素标签的BMS-790052 结构变体,并成功地从相关的细胞模型中分离出NS5A,从而验证上述结构变体可作为BMS-790052 的替代品用于HCV的抑制[111]。在此基础上,作者将硼二吡咯亚甲基(BODIPY)荧光团取代生物素标签偶联到BMS-790052 结构变体上,发现该结构变体无法与NS5A 共定位,表明BODIPY 荧光团的引入削弱了BMS-790052 结构变体对NS5A 的作用;与BODIPY 标记的探针相比,叠氮基团修饰的BMS-790052 结构变体能更有效地抑制病毒的复制,利用炔基修饰的Alexa Fluor 488 荧光探针原位标记BMS-790052 结构变体,可实现NS5A 蛋白在亚细胞中的精准定位,从而通过可视化方式直观地找到病毒作用于宿主细胞的靶点[110-111]。
3.2 病毒疫苗的开发
两个多世纪以来,接种病毒疫苗是人类预防病毒性疾病(如肝炎、麻疹和流感)的有效措施。病毒疫苗主要是基于病毒结构及其亚结构单元构建而成。目前,研究者已利用生物正交反应开发出多种改造的病毒疫苗[112-116]。主要策略是将病毒抗原和表位装配于载体表面,通过呈现多种抗原和佐剂的方式,提高疫苗效价。例如,Wang等[112]通过点击化学反应将HA和鞭毛蛋白(TLR5受体激动剂)同时偶联在金纳米颗粒(AuNPs)表面,修饰的AuNPs在体外和小鼠体内均能够有效诱导免疫细胞产生较强的免疫应答。Patel等[113]利用噬菌体展示技术构建得到带有叠氮基团的病毒样颗粒,进而通过生物正交反应,直接将炔基修饰的功能分子[包括蛋白质(抗体片段、粒细胞-巨噬细胞集落刺激因子)、核酸和聚乙二醇]结合到病毒样颗粒表面。通过控制功能分子的偶联数量和比例,制备出呈现独特抗原、免疫刺激蛋白和刺激核酸的病毒样颗粒。此外,研究者还利用多种带有生物正交基团的非天然氨基酸制备病毒疫苗,所构建的疫苗对预防病毒感染呈现出良好的效果[114-115]。
此外,利用生物正交反应对病毒进行功能化的应用还可以扩展到病毒疫苗的生产中。将可发生生物正交反应的官能团(例如炔基、叠氮基团)引入病毒的蛋白亚基,进而通过带有互补生物正交反应官能团的探针对修饰的病毒做出反应,实现生产过程中病毒疫苗的监测和鉴定。例如,Carvalho 和他的同事[71]利用杆状病毒表达系统表达流感病毒HA 的过程中,加入AHA,得到了带有叠氮基团标签的HA 蛋白;因此,所构建的流感病毒样颗粒可与环辛炔基修饰的Alexa Fluor 488荧光探针发生SPAAC 反应;进而在病毒疫苗制备过程中,可通过荧光信号将所需的流感病毒样颗粒与其他杂质(如杆状病毒和细胞碎片)区分开来。该技术也是生物制药产业化过程中,优化和监控病毒疫苗生产下游流程的有力工具。
3.3 病毒感染的检测
对病毒的高灵敏检测是预防病毒进一步扩散的有效手段,也是进行病毒性疾病治疗的前提。目前对病毒检测的方法主要分为血清学检测和病毒核酸检测。血清学检测主要是通过抗原-抗体反应对病毒抗原或由病毒感染引起的机体抗体进行检测。通过点击化学反应将抗体或核酸适配体偶联在生物传感器上被广泛用于病毒感染早期的血清学检测。例如,Kato等[116]报道了一种利用四苯基乙烯(TPE)的荧光“开启”传感器,用于流感病毒抗原的检测。主要是利用炔基修饰的TPE 与叠氮化唾液酰乳糖偶联,进而通过唾液酰乳糖与流感病毒NA 的高亲和作用,实现病毒的特异识别;偶联在病毒表面的TPE 具有聚集诱导发光的特性,从而通过荧光信号的变化,实现病毒的高灵敏检测。Pfeilsticker 等[117]报道了一种HIV-1 的体外检测方法。将抗HIV 的抗体通过点击化学反应结合到HIV-1 包膜蛋白gp41 的保守表位,所构建的肽基捕获器,可从HIV 阳性患者收集的血清中检测出HIV-1;该策略与金标准商业化的重组蛋白抗原相比,其灵敏度和特异性均有所提高,而且捕获剂可作为粉末在常温下长期储存。最近,一颗硼掺杂金刚石(boron-doped diamond,BBD)的电极与唾液酸模拟肽通过生物正交反应偶联,进而利用电极表面唾液酸模拟肽与流感病毒表面神经氨酸酶的高亲和作用成功捕获样本中的流感病毒粒子[118]。该装置对流感病毒具有很高的检测灵敏度,可以检测20~500 pfu 的H1N1 型或H3N2型病毒粒子,可用于病毒感染早期的诊断;而且装置用的唾液酸模拟肽具有很好的稳定性,它在功能上可以模拟唾液酸与神经氨酸酶作用,而在性质上又可避免被神经氨酸酶消化[119]。
对病毒核酸进行检测,主要是通过核酸分子杂交、荧光定量PCR 等手段检测病毒的基因组。该策略在实际病毒检测中具有更高灵敏度和重现性,也是最常用的病毒检测方法。基于生物正交反应的病毒核酸检测方法在病毒定性和定量检测中具有很好的应用前景。例如,Yue 等[119]将生物素修饰的捕获DNA 固定在链霉亲和素修饰的顺磁粒子(PMPs)上,当其与目标乙型肝炎病毒DNA杂交后,与DNA-CuS 颗粒形成三明治结构;随后,CuS 粒子被酸化形成Cu(Ⅱ),并被抗坏血酸钠还原成Cu(Ⅰ),继而催化具有微弱荧光信号的3-叠氮-7-羟基香豆素和丙炔醇偶联,形成具有强荧光信号的1,2,3-三唑化合物,而且荧光强度和目标DNA 浓度之间在0.1~100 nmol/L 范围内存在良好的线性关系,使得病毒基因组的检出限可低至0.04 nmol/L。Thomson 等[120-121]报道了一种无需信号放大即可进行HSV 检测的方法,通过将磁性纳米颗粒表面包覆聚乙二醇-甲基丙烯酸酯共聚物,并在表面羟基端修饰叠氮基团,进而通过生物正交反应与炔烃修饰的HSV 特异性DNA 捕获探针结合,该探针兼具磁可操纵性和荧光特性,当其与目标DNA 连接后,可直接通过荧光强度反应目标DNA的浓度。
3.4 基于病毒载体的药物递送系统
病毒高度对称的空间结构、可大规模生产,及其对宿主细胞的高效识别和入侵能力,使其成为非常有应用前景的多功能载体,用于基因、药物、成像试剂递送系统的构建[122]。然而,病毒载体存在一定的不足,例如容易被机体的免疫系统清除、血液循环时间短、肿瘤靶向性差、存在一定的毒副作用等[123-124]。因此,改善病毒载体的传递性能仍然是医学上的一个挑战。通过生物正交反应进行病毒功能化,可增强其对特定细胞的靶向 性、降 低毒 副作 用[84,125-127]。例如,Banerjee等[84]利用腺病毒作为基因递送载体,并通过叠氮基团修饰的糖分子功能化病毒糖蛋白,然后利用生物正交反应将叶酸小分子修饰在病毒表面,使得目标基因对小鼠癌细胞的递送效率显著增加(图8)。Chatterjee 等[126]通过基因工程手段将叠氮化的非天然氨基酸(UAAs)插入腺病毒衣壳上的特定位点;进而通过SPAAC 反应使环状RGD 肽特异性附着于病毒衣壳表面,实现病毒对肿瘤血管中过表达αvβ3 整合素受体细胞的靶向感染。本课题组[127]同时将具有肿瘤细胞靶向识别功能和抗巨噬细胞吞噬功能的两种多肽,通过SPAAC 反应与溶瘤痘苗病毒偶联,构建兼具肿瘤靶向及“隐身”功能的溶瘤痘苗病毒。该方法增强了痘苗病毒的肿瘤靶向性,延长了其在体内的循环时间,可有效抑制肿瘤生长。另外,病毒还可以通过生物正交反应将具有光、电、磁信号的纳米元件装载于病毒内腔或者偶联于病毒表面,构成成像探针,用于疾病的检测[128-129]。例如,Prasuhn 等[57]将炔基修饰的Gd(DOTA)类似物通过CuAAC 反应与正二十面体的豇豆花叶病毒偶联,构建为T1 磁成像系统,与游离的Gd(DOTA)类似物相比,其弛豫性显著增强,是一种非常有应用前景的磁成像造影剂。
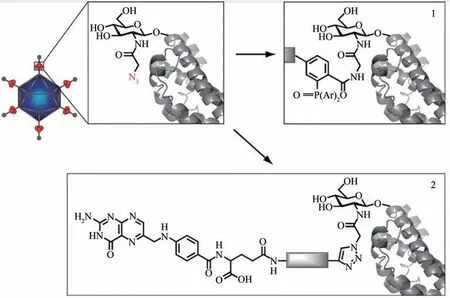
图8 叶酸配体对腺病毒纤维蛋白的功能化示意图[84][O-GlcNAz掺入腺病毒的纤维蛋白(掺入位点用红圈表示),进而通过Click(1)或Staudinger(2)反应将叶酸分子与腺病毒偶联]Fig.8 A cartoon illustration for incorporating the O-GlcNAz residue with the adenoviral fiber protein and subsequent chemical modification with the ligand[84][Potential sites for the O-GlcNAz incorporation are indicated with red circles.Either“Click”(1)or Staudinger ligation(2)chemistry is used to decorate metabolically labeled adenovirus.]
4 总结与展望
综上所述,醛或酮与胺类化合物的缩合反应、无痕施陶丁格反应、叠氮-炔基环加成反应、逆电子效应的狄尔斯-阿尔德反应,具有反应条件温和、反应简单、反应产物结构稳定、易分离纯化、生物相容性好等特性,是进行蛋白质、脂类、糖类、核酸及其代谢物功能化的常用工具,也是实现病毒不同组分修饰的重要方法。目前,化学家仍在不断开发新的生物正交反应,例如:光催化的四氮唑-烯烃环加成反应、钯/钌催化的生物正交反应、基于四嗪-烯烃的生物正交剪切反应等,为病毒不同组分的功能化提供更多的选择。基于生物正交反应的病毒功能化改造技术对病毒在生物医学领域的应用具有重要推动作用,具体应用方向包括:病毒感染机制的研究、病毒性疾病的诊断,以及以病毒为载体的基因、药物、成像试剂递送系统的构建等。研究者需要根据病毒的实际应用情况选择合适的修饰策略与生物正交反应类型,同时也要分析不同类型生物大分子在目标病毒中的结构组成和功能,结合病毒自身的结构特性和功能属性,选择适合的功能化部位和功能化策略。比如对流感病毒进行荧光标记,并用于研究该病毒的感染机制时,需要保证在病毒功能化过程中,其自身的感染力不受影响。因此,可选择能够精确控制目标病毒中生物正交基团的数量和位置的功能化策略,比如基于残基定位法的非天然氨基酸引入技术和基于基因编码的非天然氨基酸定点引入技术,且应尽量避免对病毒表面糖蛋白进行改造,以免因生物正交基团的修饰导致病毒感染力下降,或者感染路径的改变。如果病毒功能化的目的是为了进行病毒相关药物、疫苗的开发或者病毒性疾病的诊断等,这类对病毒自身感染力没有要求的应用时,则对其功能化的方式可有更多的选择性,比如可通过生物偶联或化学修饰的方式将生物正交基团直接引入目标病毒中,作为后续进行病毒功能化的报告基团。若将生物正交基团引入病毒中,是为了进行病毒疫苗的分离纯化或病毒检测等,要求对目标病毒具有高度反应特异性的应用时,可以选择叠氮-炔基、环烯基-四嗪等这些反应基团。它们本身在生物体系中是不存在的,但二者具有高度的反应选择性。因此,将其作为生物正交反应的偶联配体,可以有效避免病毒功能化过程中其他生物成分的干扰。另外,可根据实际情况将基于生物正交反应的病毒功能
化策略与基因工程技术、生物偶联技术、化学修饰技术、生物矿化技术、病毒蛋白的自组装技术等多种病毒功能化改造技术结合,实现病毒结构的精确调控,优化病毒性能并赋予病毒更多的功能,进而拓展病毒的应用方向。
