灵芝多糖对心力衰竭大鼠心肌能量代谢和心肌纤维化的影响
2022-05-14朱娇玉江艳芬
朱娇玉,姚 乐,赵 浩,江艳芬
心力衰竭主要是由于心脏组织结构或功能发生改变,导致心脏的射血能力或心室充盈能力降低而引起的心血管临床综合征[1]。随着我国老龄化越来越严重,心力衰竭已经成为威胁人类生命健康的重要原因。研究显示,心肌能量代谢异常、血流动力学改变能够诱导心肌纤维化的发生,这被认为是心力衰竭发生的关键环节[2]。正常状态下的心肌细胞能量代谢十分旺盛,而在心力衰竭病人体内,常常存在心肌线粒体功能改变,导致能量代谢异常[3]。灵芝属于多孔菌科植物紫芝和赤芝干燥的子实体,有较多生物学活性,对机体免疫系统、氧化系统等均有治疗功效[4]。灵芝多糖作为灵芝的活性成分,具有抗肿瘤、降血压、调节免疫力、保护肝脏等作用[5]。以往研究发现,灵芝多糖对心肌损伤也有治疗作用,其可以保护缺血引起的心肌损伤[6]。灵芝多糖对高血糖引起的心肌纤维化有抑制功效,对心脏有保护作用[7]。研究表明,灵芝多糖发挥生物学作用与信号通路有关[8]。灵芝多糖能够通过降低p38丝裂原活化蛋白激酶(p38MAPK)信号通路的激活水平改善急性肺损伤[9]。p38MAPK是一个多功能信号转导通路,在很多生理和病理过程中发挥关键作用[10]。p38MAPK在心力衰竭中高表达,并且下调p38MAPK信号通路抑制心肌损伤[11]。本研究探讨灵芝多糖对心力衰竭心肌能量代谢和纤维化的影响,以期为灵芝多糖治疗心力衰竭提供依据。
1 材料与方法
1.1 实验材料 灵芝多糖购自西安明泽生物科技有限公司;线粒体分离试剂盒购自北京索莱宝科技有限公司;p38抗体、p-p38抗体购自北京义翘神州科技股份有限公司;转化生长因子-β1(TGF-β1)抗体购自南京欧凯生物科技有限公司;RM6420生理信号采集处理系统购自成都仪器厂;Na+-K+-ATP酶、Ca2+-ATP酶检测试剂盒购自北京百奥莱博科技有限公司。SD大鼠(体重180~220 g)购自上海斯莱克实验动物有限公司。
1.2 模型构建和分组 根据文献[2]构建心力衰竭大鼠模型。腹腔注射氯胺酮(50 mg/kg)及地西泮(5 mg/kg)将大鼠麻醉,然后将大鼠仰卧固定至手术台上,剪去腹部的毛,消毒后,在腹部的正中间位置将皮肤切开,沿着腹部的白线将肌肉层切开,以生理盐水浸泡后的纱布盖住创面,将膈肌下的肾动脉分支分离,以棉线穿到腹主动脉下面区域,取直径为1 mm的软管放在腹主动脉上,然后用棉线把导管和腹主动脉结扎,将血流完全阻断,抽出导管,导管直径就是结扎以后的腹主动脉内径。缝合创面,消毒,肌肉注射青霉素,观察动物清醒以后送回动物房继续饲养。将建模成功的心力衰竭大鼠模型分成模型组、灵芝多糖-1组、灵芝多糖-2组、曲美他嗪组。曲美他嗪组大鼠按5.4 mg/kg曲美他嗪灌胃,灵芝多糖-1组、灵芝多糖-2组大鼠按3.0 g/kg、6.0 g/kg灵芝多糖灌胃,每日1次,连续灌胃8周。设置对照组,对照组不结扎,其余同模型组。对照组、模型组用等剂量生理盐水灌胃。将造模过程中死亡的大鼠剔除,最后各组均剩余9只大鼠。记录对照组、模型组、灵芝多糖-1组、灵芝多糖-2组、曲美他嗪组大鼠心率。取检测心率后的大鼠,测定心脏血流动力学指标,然后取心脏组织,最后将心肌组织分成3部分。
1.3 心脏血流动力学指标检测 用30 mg/kg的2%戊巴比妥钠麻醉大鼠,固定大鼠,分离右侧颈总动脉,以丝线将距离心脏远端结扎,然后用动脉夹把靠近心脏的位置夹住,从右颈总动脉将含有0.05%肝素的生理盐水导管插入左心室。记录大鼠左室压力上升最大速率(-dp/dtmax)、左室压力下降最大速率(-dp/dtmax)、左室收缩压(LVSP)、左室舒张末压(LVEDP)。
1.4 心肌线粒体蛋白浓度和Na+-K+-ATP酶、Ca2+-ATP酶检测 取大鼠心肌组织,分离线粒体,分离步骤完全按照线粒体分离试剂盒进行,检测线粒体蛋白浓度,然后根据试剂盒操作说明分析ATP酶活性(每毫克每1 h组织蛋白内的ATP酶将ATP分解生成1 μmol无机磷定义为一个酶活力单位)。
1.5 右室、左室质量指数检测 取大鼠心脏和左心室、右心室,用电子天平称量重量,然后计算右室质量指数(右心室重量/全心重量)、左室质量指数(左心室重量/全心重量)。
1.6 胶原容积分数检测 将大鼠心肌组织用4%多聚甲醛固定,按常规方法制作病理切片,然后进行Masson染色,以IPP6.0系统检测胶原容积分数。
1.7 TGF-β1、p38、p-p38蛋白检测 蛋白免疫印迹(Western Blot)法检测蛋白表达,收集心肌组织,按照每0.1 g的组织中添加5倍体积的裂解溶液,在4 ℃中过夜。4 ℃,1 000 g离心5 min,吸取上清溶液即为电泳蛋白样品。在蛋白样品中加入等量体积的2×SDS上样缓冲液,放在沸水浴中结合10 min。再将蛋白放在冰水混合物上备用。根据10%分离胶和5%浓缩胶常规配方制备SDS-PAGE凝胶,然后在每个孔内加入40 μg的蛋白样品,首先将电泳仪的电压调整到60 V,观察溴酚蓝已经进入到分离胶以后,将电压调整到120 V继续电泳,等到溴酚蓝染料进入分离胶的底部边缘以后,将凝胶拆下。再将凝胶放在转移缓冲液中平衡。在冰浴条件下以200 mA的电流转膜100 min。取出硝酸纤维素(NC)膜,然后放在5%牛血清白蛋白溶液中,在室温条件结合1 h。NC膜置于1∶1 000稀释之后的一抗溶液(抗体以封闭液稀释)中,放在4 ℃条件下结合过夜。NC膜再置于1∶2 000稀释以后的二抗溶液(用封闭液稀释)中,在室温中结合1 h。滴加ECL显色试剂。Image J分析目的条带TGF-β1、p38、p-p38的灰度值以及内参条带甘油醛-3-磷酸脱氢酶(GAPDH)的灰度值,以目的条带灰度值÷内参条带灰度值的比值表示目的蛋白表达水平。
2 结 果
2.1 各组大鼠心率比较 模型组大鼠心率明显高于对照组,灵芝多糖-1组、灵芝多糖-2组、曲美他嗪组大鼠心率明显低于模型组,且灵芝多糖-2组大鼠心率低于灵芝多糖-1组,差异均有统计学意义(P<0.05)。详见表1。
表1 各组大鼠心率比较(±s) 单位:次/min
2.2 各组大鼠血流动力学指标比较 与对照组比较,模型组大鼠LVSP、LVEDP水平较高,+dp/dtmax、-dp/dtmax水平较低,差异均有统计学意义(P<0.05);与模型组比较,灵芝多糖-1组、灵芝多糖-2组、曲美他嗪组大鼠LVSP、LVEDP水平较低,+dp/dtmax、-dp/dtmax水平较高,差异均有统计学意义(P<0.05)。与灵芝多糖-1组比较,灵芝多糖-2组LVSP、LVEDP水平较低,+dp/dtmax、-dp/dtmax水平较高,差异均有统计学意义(P<0.05)。详见表2。
表2 各组大鼠血流动力学指标比较(±s)
2.3 各组大鼠心肌线粒体蛋白浓度和Na+-K+-ATP酶、Ca2+-ATP酶水平比较 与对照组比较,模型组大鼠心肌线粒体蛋白浓度和Na+-K+-ATP酶、Ca2+-ATP酶水平较低,差异均有统计学意义(P<0.05);与模型组比较,灵芝多糖-1组、灵芝多糖-2组、曲美他嗪组大鼠心肌线粒体蛋白浓度和Na+-K+-ATP酶、Ca2+-ATP酶水平较高,差异均有统计学意义(P<0.05)。与灵芝多糖-1组比较,灵芝多糖-2组心肌线粒体蛋白浓度和Na+-K+-ATP酶、Ca2+-ATP酶水平较高,差异均有统计学意义(P<0.05)。详见表3。
表3 各组大鼠心肌线粒体蛋白浓度和Na+-K+-ATP酶、Ca2+-ATP酶水平比较(±s)
2.4 各组大鼠右室、左室质量指数、胶原容积分数和TGF-β1蛋白水平比较 与对照组比较,模型组大鼠右室质量指数、左室质量指数、胶原容积分数和TGF-β1蛋白水平均较高,差异均有统计学意义(P<0.05);与模型组比较,灵芝多糖-1组、灵芝多糖-2组、曲美他嗪组大鼠右室质量指数、左室质量指数、胶原容积分数和TGF-β1蛋白水平均较低,差异均有统计学意义(P<0.05)。与灵芝多糖-1组比较,灵芝多糖-2组大鼠右室质量指数、左室质量指数、胶原容积分数和TGF-β1蛋白水平均较低,差异均有统计学意义(P<0.05)。详见图1、表4。
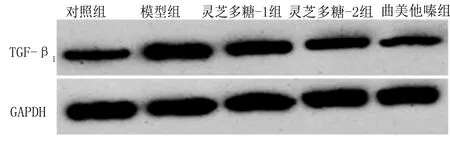
图1 Western Blot检测大鼠心肌组织中TGF-β1蛋白表达条带图
表4 各组大鼠右室质量指数、左室质量指数、胶原容积分数和TGF-β1蛋白水平比较(±s)
2.5 各组大鼠心肌组织中p38MAPK信号激活程度比较 与对照组比较,模型组大鼠p-p38蛋白水平较高,差异均有统计学意义(P<0.05);与模型组比较,灵芝多糖-1组、灵芝多糖-2组、曲美他嗪组大鼠p-p38蛋白水平较低,差异均有统计学意义(P<0.05)。与灵芝多糖-1组比较,灵芝多糖-2组大鼠p-p38蛋白水平较低,差异有统计学意义(P<0.05)。详见图2、表5。
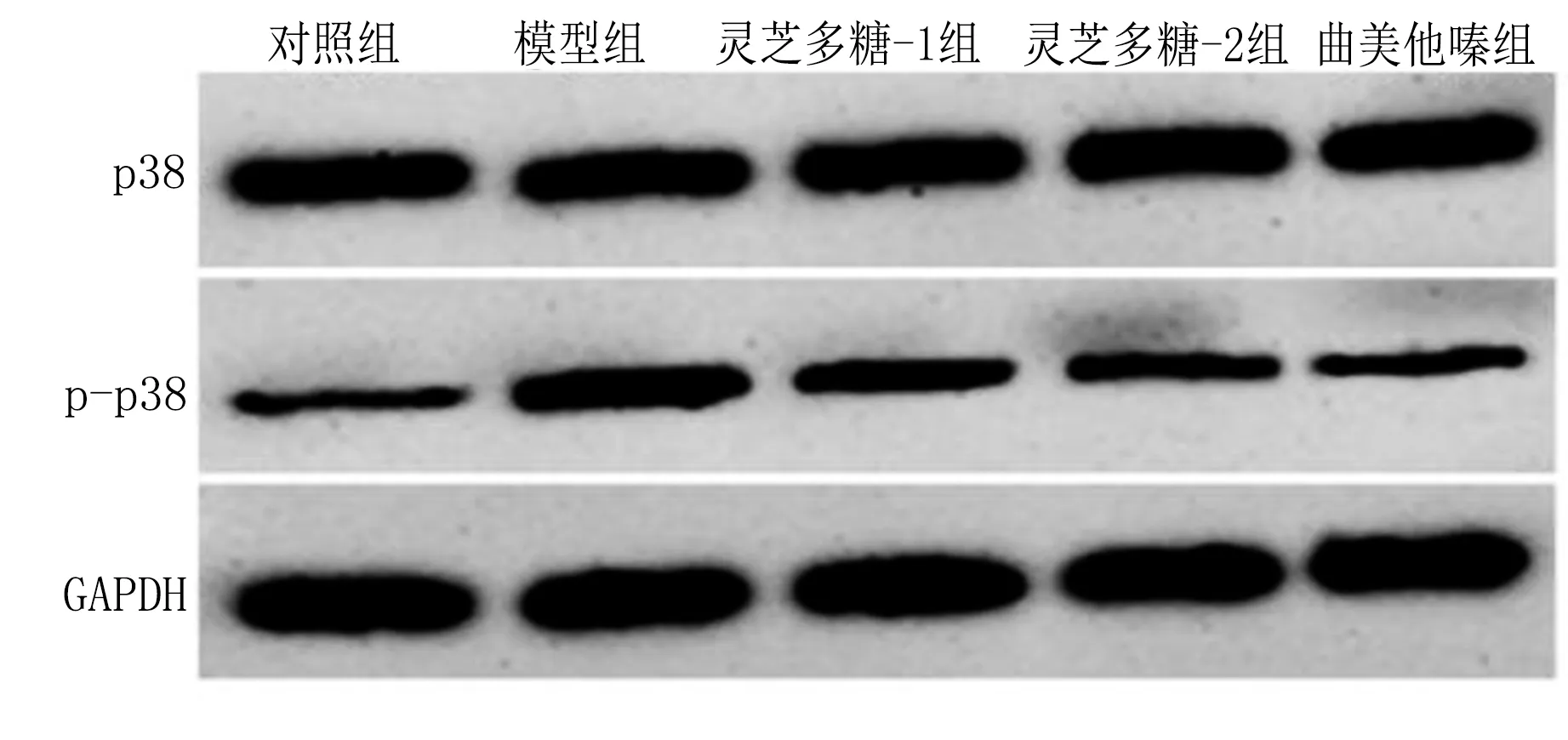
图2 Western Blot检测大鼠心肌组织中p38、p-p38蛋白表达条带图
表5 各组大鼠心肌组织中p38、p-p38蛋白水平比较(±s)
3 讨 论
灵芝内含有多种活性成分,具有降血脂、调节血压、增加免疫力等药理学作用。灵芝多糖是从灵芝内提取的多糖混合物,在很多疾病进展中发挥保护作用,例如:灵芝多糖可以通过抑制肿瘤细胞的生长发挥抗肿瘤作用;通过刺激单核巨噬细胞分泌细胞因子调控机体免疫功能;通过降低肝脏中的脂肪颗粒改善脂肪肝进程[12]。多项实验表明,灵芝多糖对心血管系统疾病也有改善作用,经其治疗后的缺血再灌注大鼠心脏功能得到改善[13]。灵芝多糖还可以抑制心肌纤维化,降低糖尿病心肌病心肌纤维化相关因子的表达[7]。本研究结果显示,灵芝多糖干预后的心力衰竭大鼠心率明显降低,LVSP、LVEDP水平下降,+dp/dtmax、-dp/dtmax水平升高,并且大鼠右室质量指数、左室质量指数均下降,说明灵芝多糖能够改善心力衰竭大鼠心脏功能。
研究显示,心力衰竭病人出现心肌能量代谢异常,进而导致血流动力学改变,诱导心肌纤维化[14]。线粒体是人体内的能量代谢场所,正常状态下的线粒体内的能量代谢极为旺盛,为细胞功能发挥提供动力[15]。Na+-K+-ATP酶、Ca2+-ATP酶能够调控细胞内和细胞外Na+和Ca2+平衡,二者均是重要的蛋白酶[16]。Na+和Ca2+平衡是心房肌、心室肌以及蒲肯耶纤维动作电位的动力,也是调控细胞中钙离子稳定的关键,而心肌细胞中Ca2+水平对于心肌正常功能的维持有十分重要的作用,当Na+-K+-ATP酶的活性降低后,细胞内的Na+水平增加,K+水平降低,Na+和Ca2+交换,导致细胞中的Ca2+水平增加,减弱心肌的收缩功能[17]。Na+-K+-ATP酶、Ca2+-ATP酶活性的变化是细胞能量代谢变化的标志[18]。心肌纤维化是心力衰竭诱导的必然病理结果,心脏胶原含量升高是心肌纤维化的标志[19]。TGF-β1是心肌纤维化的标志因子,其表达升高后标志着纤维化程度升高[20]。本实验结果表明,灵芝多糖处理后的心力衰竭大鼠心肌组织中心肌线粒体蛋白浓度和Na+-K+-ATP酶、Ca2+-ATP酶、心肌胶原含量和TGF-β1蛋白表达水平均降低,提示灵芝多糖能够改善心力衰竭大鼠心肌能量代谢和心肌纤维化进程。
信号通路是存在于人体内的重要枢纽,在细胞分化、胚胎发育、疾病发生等过程中均发挥作用[21]。p38MAPK信号通路是MAPK信号通路的关键分支,而p38是该信号通路中的关键因子,其只有被磷酸化以后才能够发挥作用[22]。p38MAPK信号通路与心力衰竭有关,其被过度激活后诱导心肌损伤,而下调p38MAPK信号通路的激活水平能够改善心功能[23]。研究发现,灵芝多糖能够降低p38磷酸化水平从而改善小鼠急性肺损伤[9]。本研究结果显示,灵芝多糖能够降低心力衰竭大鼠心肌组织中p-p38表达水平,表明灵芝多糖可能通过抑制p38MAPK信号发挥抗心力衰竭作用。
综上所述,灵芝多糖能够改善心力衰竭大鼠心功能、抑制心肌纤维化、改善心肌能量代谢、降低p38MAPK信号激活水平,目前尚未探讨灵芝多糖通过何种靶向机制影响p38MAPK发挥作用,在以后的实验中深入研究。
