北京农村地区阿尔茨海默病影响因素及临床特征的横断面研究
2022-05-14谭展飞刘建勋王志勇李泽惠畅苏瑞刘南阳马丽娜
谭展飞,裴 卉,刘建勋,王志勇,杨 洋,曹 宇,李泽惠,畅苏瑞,刘南阳,马丽娜,李 浩,3
随着人口老龄化,全球每年约有770万例新发痴呆病人,预计到2050年,将有1.31亿例痴呆病人[1]。痴呆已成为全球严重的公共卫生负担,对老年人的身心健康和生活质量产生重大影响[2]。阿尔茨海默病(Alzheimer′s disease,AD)是一种神经退行性疾病,是老年痴呆的主要临床类型,以记忆力减退、认知功能障碍和精神行为异常为主要表现[3]。阿尔茨海默病是由多因素、多病理途径导致的复杂病症,病因和发病机制尚不清楚。目前,尚无特异性的早期诊断方法,尤其在致病性血管因素存在的情况下,阿尔茨海默病表现为混合性痴呆,难以区分原发病因,使早期诊断复杂化并延迟了最佳治疗时机,且目前没有有效的预防性治疗方案和控制措施[4]。探索有效的预防措施来控制阿尔茨海默病的发病并延缓其进展是医学界急需解决的问题[5]。既往对阿尔茨海默病的研究主要集中在城市地区,缺乏针对农村地区的阿尔茨海默病研究资料。本研究旨在探讨北京农村地区阿尔茨海默病的影响因素和认知功能特点,为该病的鉴别诊断、预防和控制提供新的思路。
1 资料与方法
1.1 研究对象 于2018年6月—2018年11月在北京市延庆区井庄镇社区卫生服务中心、沈家营镇社区卫生服务中心、海淀区香山街道及温泉镇社区卫生服务中心开展流行病学调查。受访者要求在调查区域居住超过 30 年;年龄45~85 岁;同意参加并签署知情同意书。共招募3 172人,剔除不符合规范的量表1 116份,收回有效问卷2 056份。其中根据诊断标准共纳入阿尔茨海默病组受试者573人,非认知功能障碍(non cognitive impairment,NCI)组受试者213人。
1.2 诊断标准 痴呆的诊断标准基于第4版精神疾病诊断和统计手册(DSM-Ⅳ)[6]。阿尔茨海默病的诊断标准基于美国国家老龄化研究所和阿尔茨海默病协会诊断指南编写组(NIN-AA)2011 年最新修订的阿尔茨海默病诊断标准[7]。非认知功能障碍者无认知障碍的主诉及客观证据,简易精神状态检查量表(MMSE)测评得分符合正常标准者(文盲>17 分,小学>20 分,初中及以上>24分)[8]。
1.3 研究方法 采用横断面调查设计和便利抽样发放问卷。根据相关文献、德尔菲法和本次调查的目的,结合调查区老年人的实际情况,依据问卷设计原则和要求编制调查问卷。通过预调查对问卷的完整性、合理性和可操作性进行评价。经专家咨询后,最终确定了问卷的修订和改进版本。问卷内容:①一般信息,包括姓名、性别、年龄、职业、婚姻状况、受教育程度、吸烟和饮酒习惯、运动状况、血压、血糖和体质指数(BMI);②病史,包括家族疾病史和个人既往病史;③饮食状况表;④神经心理量表MMSE、中文北京版蒙特利尔认知评估量表(MoCA)[9]。由2名具有副高及以上职称的专家指导,15名老年医学专业硕士、博士生接受统一培训后担任调查员。对完成的问卷进行系统审查,验证可靠性后进行统计分析。
2 结 果
2.1 两组一般资料比较 与非认知功能障碍组比较,阿尔茨海默病组年龄较高,高中及以上学历者占比较低,从事体力工作者较多,未婚、丧偶或离异者占比较高,有午休习惯者占比较低,缺乏中医保健知识者较多,差异均有统计学意义(P<0.05)。详见表1。
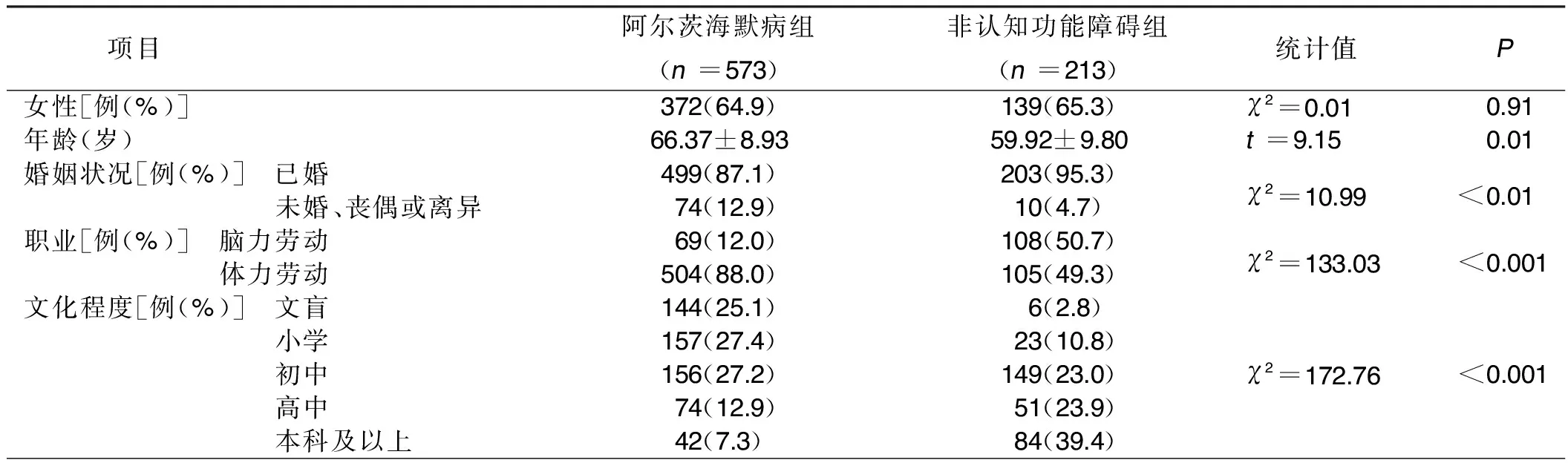
表1 两组一般资料比较
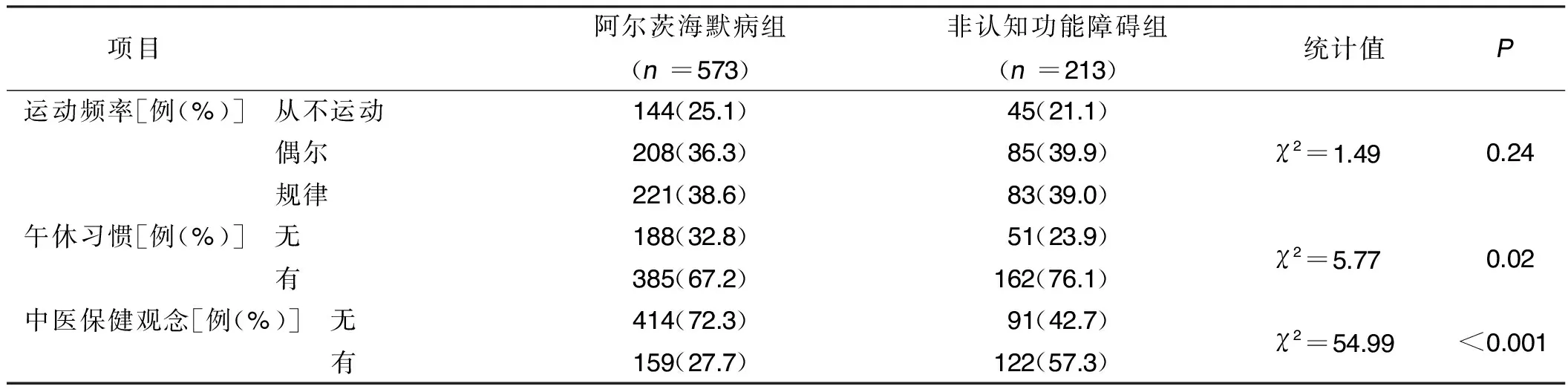
(续表)
2.2 两组病史及心脑血管危险因素比较 与非认知功能障碍组比较,阿尔茨海默病组高血压家族史、高脂血症家族史、糖尿病家族史、癌症家族史者占比较低,差异均有统计学意义(P<0.05);既往高血压史者占比较高、脑血管疾病史者占比较低,差异均有统计学意义(P<0.05)。详见表2。
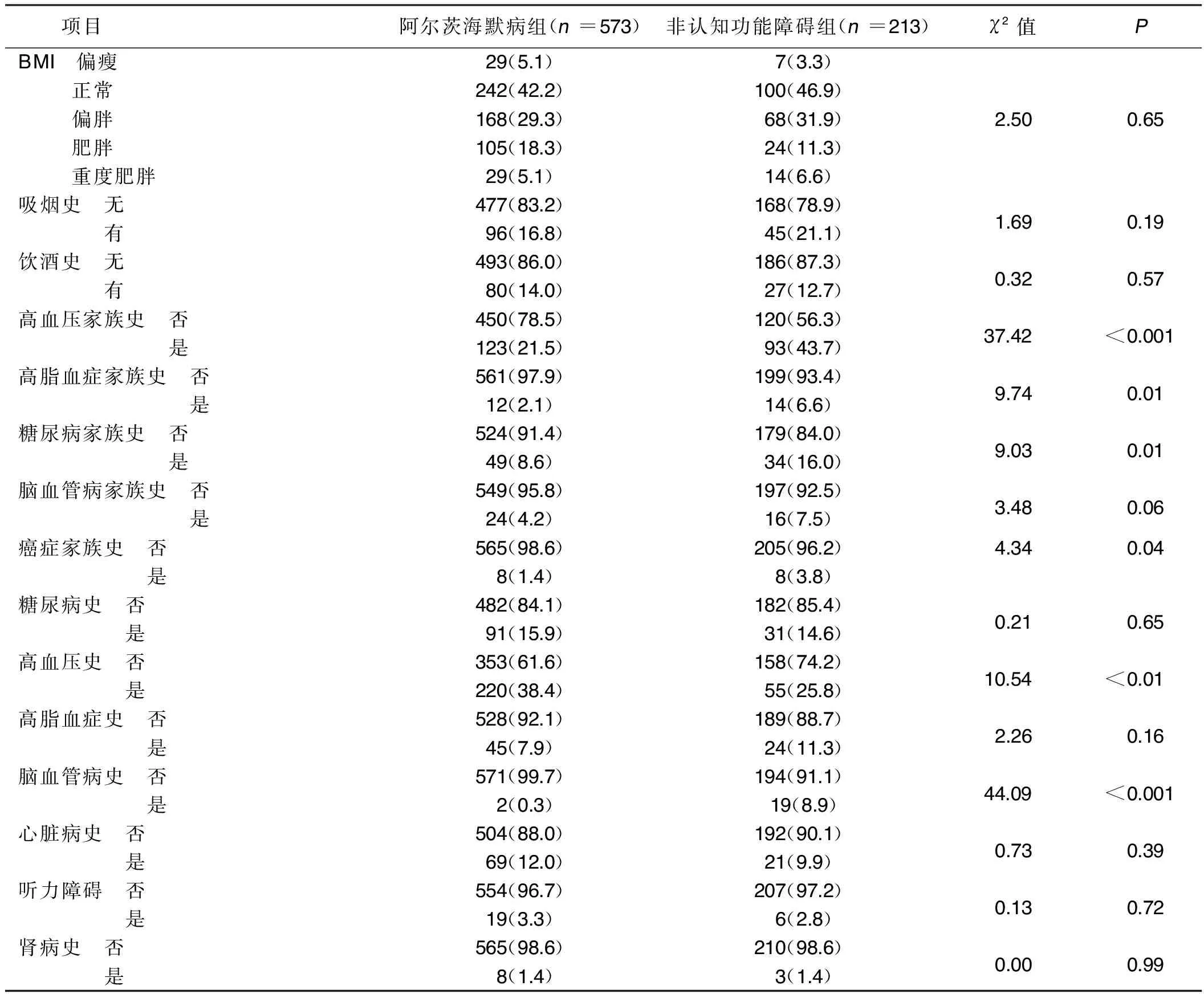
表2 两组病史及心脑血管危险因素比较 单位:例(%)
2.3 两组饮食起居情况比较 与非认知功能障碍组比较,阿尔茨海默病组每天食用水果者、饮食荤素者占比较低,差异均有统计学意义(P<0.05);阿尔茨海默病组食用深海鱼等富含二十二碳六烯酸(DHA)食物、喝咖啡及饮茶者较少,差异均有统计学意义(P<0.05)。详见表3。

表3 阿尔茨海默病、非认知功能障碍组病人饮食起居情况比较 单位:例(%)
2.4 两组认知功能测评结果比较
2.4.1 两组MMSE量表评分比较 阿尔茨海默病组MMSE量表各评分项目得分均低于非认知功能障碍组,差异均有统计学意义(P<0.05)。详见表4。阿尔茨海默病组根据MMSE、MoCA量表总分分为3组:重度痴呆组0~10分(12例)、中度痴呆组11~20分(216例)、轻度痴呆组≥21分(345例)。与重度痴呆组比较,中度痴呆组定向力、记忆力、注意力与计算力、命名能力、阅读能力、语言能力评分较高,差异均有统计学意义(P<0.05)。详见表5。
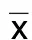
表4 两组MMSE量表评分比较(±s) 单位:分
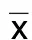
表5 不同认知障碍程度病人MMSE量表评分比较(±s) 单位:分
2.4.2 两组MoCA量表评分比较 阿尔茨海默病MoCA量表各项目评分均低于非认知功能障碍组(P<0.05)。病组轻度痴呆组、中度痴呆组、重度痴呆组MoCA量表评分依次递减,差异均有统计学意义(P<0.05)。详见表6、表7。
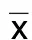
表6 阿尔茨海默病、非认知功能障碍组病人MoCA量表评分比较(±s) 单位:分
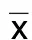
表7 不同认知障碍程度阿尔茨海默病病人MoCA评分比较(±s) 单位:分
2.5 阿尔茨海默病危险因素的单因素Logistic回归分析 将阿尔茨海默病(无阿尔茨海默病=0,有阿尔茨海默病=1)作为因变量,将性别、年龄、BMI、婚姻状况等作为自变量进行单因素Logistic回归分析,结果显示,年龄、职业、文化程度、中医保健观念、高血压家族史、脑血管病史、吃水果频率、饮食习惯、深海鱼等食用频率、喝咖啡频率和饮茶习惯等为阿尔茨海默病的危险因素(P<0.001)。婚姻状况、午休习惯、高脂血症家族史、糖尿病家族史、癌症家族史、高血压病史与阿尔茨海默病也有关(P<0.05)。剔除P>0.05的变量,其余变量进行多因素Logistic回归分析。
2.6 阿尔茨海默病一般资料的多因素Logistic回归分析 基于单因素Logistic回归分析结果,将年龄、婚姻状况、职业、文化程度、午休习惯、中医保健观念等因素作为作为自变量,以是否患有阿尔茨海默病(无阿尔茨海默病=0,有阿尔茨海默病=1)作为因变量,进行多因素Logistic回归分析,结果显示,在控制其他因素的情况下,年龄每增加1岁,发生阿尔茨海默病的概率是上一年的1.075倍。脑力劳动者患阿尔茨海默病的概率仅为体力劳动者的0.336倍。文盲患阿尔茨海默病的概率是大学及以上学历者的14.736倍。小学学历者患阿尔茨海默病的概率是大学及以上学历者的5.429倍。初中学历者患阿尔茨海默病的概率是大学及以上学历者的4.515倍。高中学历者患阿尔茨海默病的概率是大学及以上学历者的2.341倍。有伴侣者患阿尔茨海默病的概率为未婚、离异或丧偶者的0.358倍。有午休习惯者患阿尔茨海默病的可能性是无午休习惯者的0.554倍。详见表8。
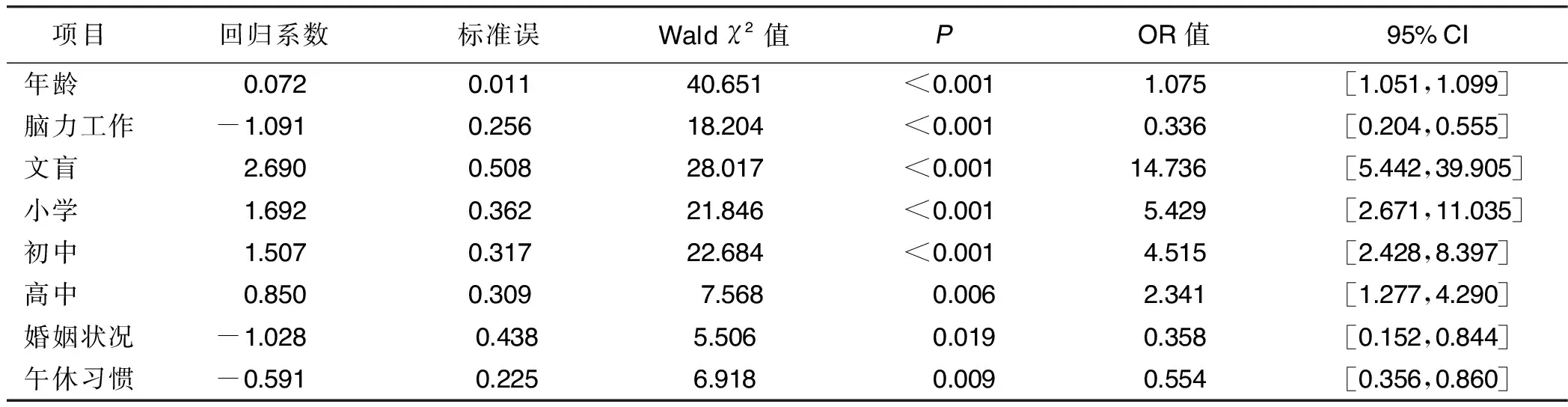
表8 一般资料对阿尔茨海默病影响的多因素 Logistic 回归分析
2.7 阿尔茨海默病心脑血管危险因素的多因素Logistic回归分析 根据单因素Logistic回归分析结果,将高血压家族史、高脂血症家族史、糖尿病家族史、癌症家族史、高血压病史、脑血管病史等因素作为自变量,阿尔茨海默病(无阿尔茨海默病=0,有阿尔茨海默病=1)作为因变量,经逐步回归分析,当控制其他因素时,有高血压家族史者患阿尔茨海默病的概率是无家族史者的0.295倍。有高血压既往史者患阿尔茨海默病的概率是无高血压既往史者的2.499倍。有脑血管病史者患阿尔茨海默病的概率是无脑血管病史者的0.037倍。详见表9。
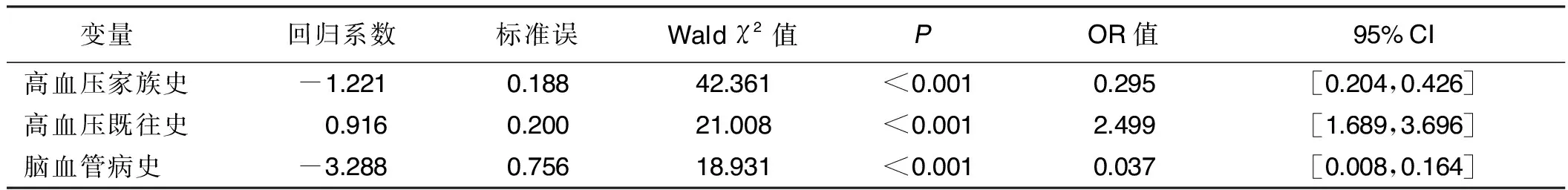
表9 心脑血管病史对阿尔茨海默病影响的多因素Logistic回归分析
2.8 阿尔茨海默病饮食起居因素的多因素Logistic回归分析 基于单因素Logistic回归分析结果,在多因素Logistic回归分析中,把吃水果频率、饮食习惯、深海鱼食用频率、喝咖啡频率、饮茶习惯等因素作为自变量,阿尔茨海默病(无阿尔茨海默病=0,有阿尔茨海默病=1)作为因变量,经逐步回归,分析结果显示,在控制其他因素的情况下,每日吃水果者患阿尔茨海默病的概率是少于每日1次者的0.339倍。荤素均衡者患阿尔茨海默病的概率仅为素食者的0.368倍。深海鱼等食用频率越高,患阿尔茨海默病的概率越低。有喝茶习惯者患阿尔茨海默病的概率是无喝茶习惯者的0.554倍。详见表10。
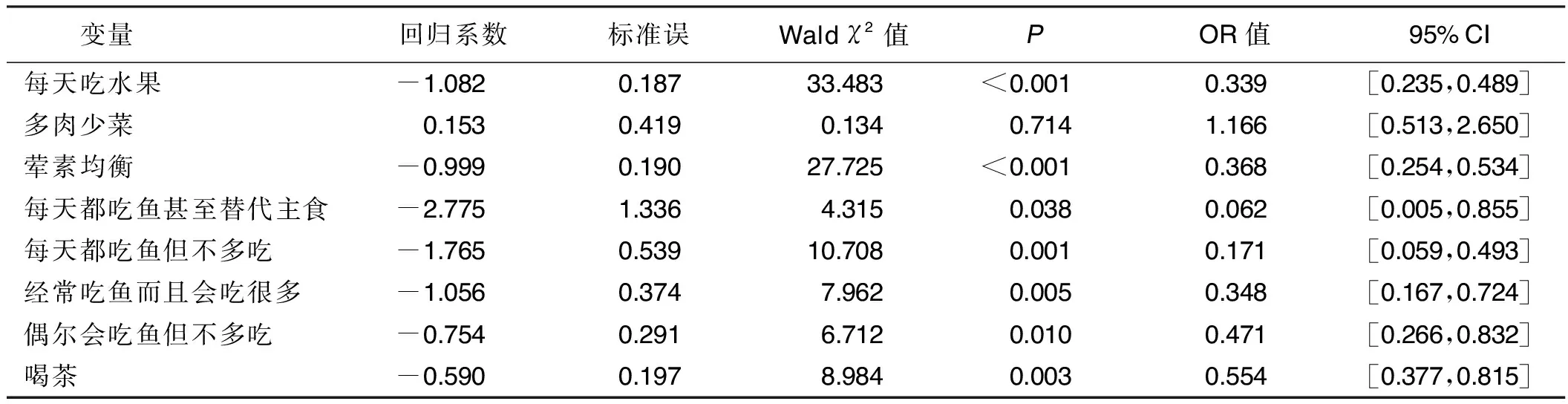
表10 饮食习惯对阿尔茨海默病影响的多因素 Logistic 回归分析
3 讨 论
饮食、运动、认知训练和血管风险监测相结合,可以预防认知能力下降和改善阿尔茨海默病病人晚年生活质量[10-11]。本研究在北京的农村地区进行,与居住在城市的老年人比较,农村老年人更多地参加户外劳作。由于医疗资源短缺和缺乏慢性病预防保健知识,农村居民往往无法良好地控制高血压、糖尿病等慢性病。这些慢性病可引起血管内皮功能障碍、炎症反应、氧化应激、血脑屏障损伤等变化,使得神经血管单元受损或脑血流调节受损,导致认知功能障碍,影响阿尔茨海默病的发生发展[12-13]。这也会造成其他与阿尔茨海默病相关的风险因素如炎性因子α1-抗胰凝乳蛋白酶(α1-ACT)、肿瘤坏死因子-α(TNF-α)和白细胞介素 6(IL-6)等的升高,加重阿尔茨海默病病情[14-15]。血管危险因素对阿尔茨海默病具有不同的潜在影响,可通过脑血管疾病引起海马损伤诱导其发展[16]。
受教育程度被认为与阿尔茨海默病的发病有因果关系[17],高学历可以提高认知功能[18]。教育可以通过不断刺激大脑的高级皮层,加强神经元连接从而增加抽象思维和逻辑推理能力[19-20]。更高水平的教育可以提高人们的健康素养,促进养成健康的生活方式[21-22]。均衡进食肉类和蔬菜,适量食用深海鱼等富含DHA的食物,适量饮用咖啡和茶,这些饮食习惯的改善可以减缓认知功能下降[23-25]。茶多酚可能抑制抗阿尔茨海默病的关键靶酶(如β-分泌酶、γ-分泌酶、糖原合成酶激酶-3β和乙酰胆碱酯酶等),对阿尔茨海默病的预防治疗具有重要意义[26-27]。尽管国际饮食模式各不相同,但公认对认知功能有益的饮食的共同特征包括食用大量水果和蔬菜、不饱和脂肪酸、鱼和粗粮产品[28]。现今农村居民的饮食水平虽然有所提高,但对合理膳食的认识仍然不足,均衡饮食会对农村地区居民的认知功能保护发挥积极作用。
一项针对中国60岁以上人群痴呆患病率的Meta分析显示,非在婚(包括丧偶、独居、离异)人群中,痴呆的患病率是在婚者的2倍,婚姻状况稳定有利于人们的健康状态,寡居被认为是痴呆的社会性危险因素[29]。良好的婚姻状况能够对大脑提供一定的认知刺激,从而保护大脑的认知功能免受进一步损伤。另外,研究表明雌激素通过调节脑源性神经营养因子(BDNF)在淀粉样前体蛋白的加工等过程中发挥重要作用,本研究中超过一半的受访者是绝经后女性,女性患阿尔茨海默病的风险较男性更高[30]。BDNF是神经系统健康的已知因素,其表达减少通常与阿尔茨海默病相关[31]。运动可以增加BDNF水平,为绝经后妇女降低阿尔茨海默病风险提供了一种可行的方法[32]。
研究表明,内侧颞叶和海马与记忆密切相关[33],近期记忆力和学习新事物能力的显著下降是阿尔茨海默病的重要临床表现[34]。延迟回忆是阿尔茨海默病病人认知障碍最早、最敏感的指标,可以有效帮助区分正常衰老、轻度认知障碍(MCI)和阿尔茨海默病[35]。阿尔茨海默病病人大脑中的海马体明显受损,导致记忆障碍,主要是情景记忆丧失[36]。本研究中,根据MMSE量表的评分结果,定向力、记忆力、注意力与计算力、命名能力、阅读能力、语言能力的严重下降是中度阿尔茨海默病病情进展为重度的临床特征。重度阿尔茨海默病病人表现出语义障碍,即在关联语音中的单词检索方面存在明显缺陷[37]。人们常未能认识到最近的记忆丧失或命名困难是阿尔茨海默病的早期症状,因为不熟悉这种疾病,并错误地认为这些症状是正常衰老过程的一部分。因此,阿尔茨海默病病人及其家属可能会延迟寻求医疗支持。针对上述情况,应加强宣传教育,引导病人及其家属养成良好的生活方式,加强慢性病管理,提高早发现、早预防和早治疗的意识[38]。积极调整生活方式,如每日摄入水果,均衡荤素摄入,适量食用深海鱼等富含DHA的食物,适量饮茶,良好地控制高血压等慢性病,可对农村地区阿尔茨海默病病人的预防和治疗起到积极作用。
