miR-494-3p/RRS1轴对结直肠癌影响作用及机制
2022-05-14杨志文阿古达木韩怡茹乌新林
杨志文,阿古达木,韩怡茹,乌新林
内蒙古医科大学附属医院 胃肠外科,内蒙古 呼和浩特 010010
结直肠癌是全球第3大常见恶性肿瘤,也是第4大癌症死亡原因[1]。一旦早期确诊,手术是结直肠癌患者的首选治疗方法[2];复发并发展至晚期时,辅助化疗可以缓解肿瘤进展和转移[3]。然而,上述治疗手段并未取得预期的成功[4]。目前,针对原癌基因或抑癌基因的靶向治疗也得到了发展,但治疗效果十分有限[5]。因此,不断探索与结直肠癌进展有关的新的药物靶点非常重要。MicroRNAs(miRNAs)是内源性非编码小RNA分子,通过与mRNAs结合介导转录后水平的基因表达,参与各种生物过程的调控[6-7]。有研究报道,miR-494-3p在多种癌症的进展中具有显著特征,例如,在卵巢癌中表达下调可抑制细胞增殖并促进细胞凋亡[8],在骨肉瘤中通过抑制胰岛素受体底物-1来阻止骨肉瘤细胞的恶性生物学行为[9]。本研究旨在探讨miR-494-3p/RRS1轴对结直肠癌的影响作用及机制。现报道如下。
1 材料与方法
1.1 实验材料 选取内蒙古医科大学附属医院自2018年1月至2020年1月收治的192例结直肠癌患者为研究对象。纳入标准:经组织学或病理学确诊为结直肠癌;血、肝、肾功能基本正常;同意进行本研究。排除标准:患有精神疾病;合并其他器官功能损伤;采集标本前经过化疗;患有严重感染性疾病;患有其他肿瘤。192例患者中,男性118例,女性74例;平均年龄(52.51±20.09)岁。收集患者的治疗前癌组织及癌旁组织并保存于-80℃冰箱中。所有患者均签署知情同意书。本研究经医院伦理委员会批准。siRNA、miR-494-3p mimics、miR-494-3p inhibitor、RRS1过表达质粒均由南京金斯瑞设计和合成;人结直肠正常细胞株NCM460购自深圳震科生物科技有限公司(货号NCM460);人结直肠癌细胞株RKO、HCT116、SW480、HT-29购自Procell公司(货号CL-0196、CL-0096、CL-0223、CL-0118);Lipofectamine 2000购自北京德航五洲科技有限公司(货号VTY30520-1.5 ml);Trizol试剂购自艾德科技(北京)有限公司(货号5301100);超纯RNA试剂盒购自江苏康为世纪生物科技股份有限公司(货号CW0581M);M-MLV逆转录酶购自北京沃格东方科技有限公司(货号28025013);SYBR试剂盒购自深圳康体生命科技有限公司(货号KTSM602);双荧光素酶报告试剂盒购自百赛生物公司(货号F6075S);3-(4,5-二甲基-2-基)-2,5-二苯基溴化四唑(methyl thiazolyl tetrazolium,MTT)购自深圳市益百顺科技有限公司(货号IM0280-200 mg);CDKN1A、CDC25C、p53[10]、MKI67、CDK1、RRS1抗体购自abcam公司(货号ab102013、ab32444、ab26、ab15580、ab133327、ab188161)。
1.2 实验方法
1.2.1 细胞培养与处理 人结直肠正常细胞株NCM460和人结直肠癌细胞株RKO、HCT116、SW480、HT-29在RPMI-1640培养基、37℃、5% CO2条件下培养。siRNA、miR-494-3p mimics、miR-494-3p inhibitor、RRS1过表达质粒均用Lipofectamine 2000进行转染。
1.2.2 RNA抽取与实时荧光定量聚合酶链反应 根据制造商说明,用Trizol试剂和超纯RNA试剂盒从指定的细胞中分离总RNA。用M-MLV逆转录酶逆转录0.8 μg总RNA。采用SYBR法在实时聚合酶链反应仪TP800上进行实时荧光定量聚合酶链反应。引物序列为:RRS1正向,5′-ccctaccggaccagtaa-3′;RRS1反向,5′-CCGAAAAGGGGTTGAAACTTCC-3′;GAPDH正向,5′-TGACTTCAACAGCGACACCCA-3′;GAPDH反向,5′-CACCCTGTTGCTGTAGCCAAA-3′。RRS1相对表达归一化为GAPDH,采用对比CT法进行数据分析。
1.2.3 细胞周期测定 用碘化丙啶染色的流式细胞仪检测细胞周期进展。将处理过的SW480细胞接种于6孔培养板,培养至80%融合。细胞核碘化丙啶染色分析细胞周期。碘化丙啶吸光度通过流式细胞仪上的荧光激活细胞分选来测定。
1.2.4 细胞增殖低水平测定 SW480细胞以2 000个细胞/孔的密度接种于96孔板,在37℃下分别培养0、1、2 d。PBS洗涤2次后,每孔加入MTT溶液(5 mg/ml)。孵育4 h后,取每孔上清,加入100 μl二甲基亚砜溶解甲氧嘧啶盐。10 min后,用微版阅读器在490 nm波长下测量光密度。
1.2.5 荧光素酶报告实验 构建野生型(wild type,WT)和突变型(mutant type,MT)荧光素酶报告载体,并用 Lipofectamine 2000将miR-494-3p mimics或相应对照转染到SW480细胞中。2 d后,用双荧光素酶报告基因测定系统对荧光素酶活性进行量化。
1.2.6 免疫印迹 用细胞裂解缓冲液从SW480细胞中分离总蛋白,用BCA蛋白测定试剂盒测定总蛋白浓度。总蛋白经12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,转移到聚偏氟乙烯膜上。用5%脱脂牛奶在室温下封膜1 h,4℃下用一抗免疫印迹过夜。PBST洗3次后二抗室温下孵育1 h。PBST洗3次后进行ECL化学发光检测蛋白表达水平。

2 结果
2.1 结直肠癌患者miR-494-3p表达水平及其对结直肠癌患者生存率、细胞增殖影响 miR-494-3p在结直肠癌组织中的表达水平低于癌旁组织(P<0.05)。见图1a。根据miR-494-3p在结直肠癌组织中的平均表达水平,将192例患者分入miR-494-3p低表达组(n=96)和miR-494-3p高表达组(n=96)。miR-494-3p高表达组生存率高于miR-494-3p低表达组(P<0.05)。见图1b。与结直肠正常细胞株NCM460比较,miR-494-3p表达水平在结直肠癌细胞株RKO、HCT116、SW480、HT-29中均处于低表达水平,且SW480细胞株中miR-494-3p表达水平最低(P<0.05)。见图1c。因此,本研究选取SW480细胞株为研究对象进行下游实验。过表达miR-494-3p后,结直肠癌细胞SW480增殖水平下降(P<0.05)。见图1d。敲低miR-494-3p后,结直肠癌细胞SW480增殖水平上升(P<0.05)。见图1e。过表达miR-494-3p后,结直肠癌细胞SW480中S期细胞减少、G2/M期细胞增多(P<0.05)。见图1f。敲低miR-494-3p后,结直肠癌细胞SW480中S期细胞增多、G2/M期细胞减少(P<0.05)。见图1g。即miR-494-3p使结直肠癌细胞在G2/M期细胞周期阻滞。
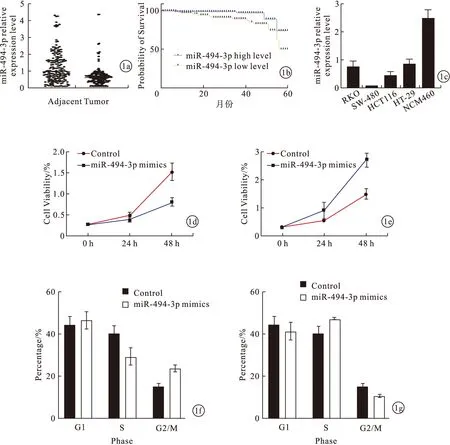
图1 结直肠癌患者miR-494-3p表达水平及其对结直肠癌患者生存率、细胞增殖影响
2.2 RRS1对结直肠癌患者细胞增殖影响及miR-494-3p靶向RRS1对结直肠癌患者细胞增殖调控作用 通过miRDB预测miR-494-3p的潜在底物,选取评分最高的80个候选基因进行siRNA敲低筛选。敲低RRS1后,结直肠癌细胞SW480增殖水平下降(P<0.05)。见图2a、2b。过表达RRS1后,结直肠癌细胞SW480增殖水平上升(P<0.05)。见图2c。敲低RRS1后,结直肠癌细胞SW480中S期细胞减少、G2/M期细胞增多(P<0.05)。见图2d。过表达RRS1后,结直肠癌细胞SW480中S期细胞增多、G2/M期细胞减少(P<0.05)。见图2e。过表达miR-494-3p后,结直肠癌细胞SW480中RRS1 mRNA表达水平下降(P<0.05);敲低miR-494-3p后,结直肠癌细胞SW480中RRS1 mRNA表达水平上升(P<0.05)。见图2f。荧光素酶报告实验发现,miR-494-3p靶向RRS1 mRNA的3’端非翻译区(P<0.05)。见图2g。即miR-494-3p靶向RRS1使结直肠癌细胞在G2/M期细胞周期阻滞。
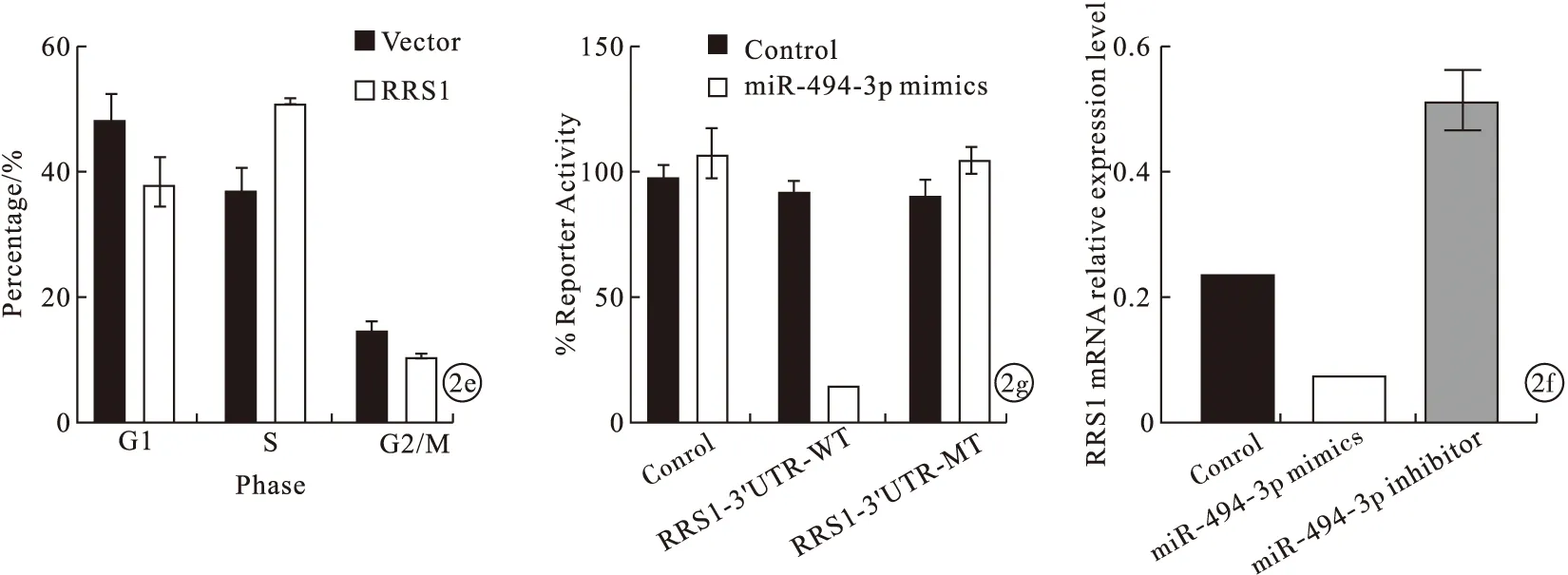
图2 RRS1对结直肠癌患者细胞增殖影响及miR-494-3p靶向RRS1对结直肠癌患者细胞增殖调控作用
2.3 miR-494-3p及RRS1对结直肠癌患者细胞周期相关因子表达水平影响 过表达miR-494-3p后,结直肠癌细胞SW480中细胞周期相关因子CDKN1A、CDC25C、p53表达水平上升,MKI67、CDK1表达水平下降(P<0.05)。见图3a。
敲低miR-494-3p后,结直肠癌细胞SW480中细胞周期相关因子CDKN1A、CDC25C、p53表达水平下降,MKI67、CDK1表达水平上升(P<0.05)。见图3b。敲低RRS1后,结直肠癌细胞SW480中细胞周期相关因子CDKN1A、CDC25C、p53表达水平上升,MKI67、CDK1表达水平下降(P<0.05)。见图3c。过表达RRS1后,结直肠癌细胞SW480中细胞周期相关因子CDKN1A、CDC25C、p53表达水平下降,MKI67、CDK1表达水平上升(P<0.05)。见图3d。
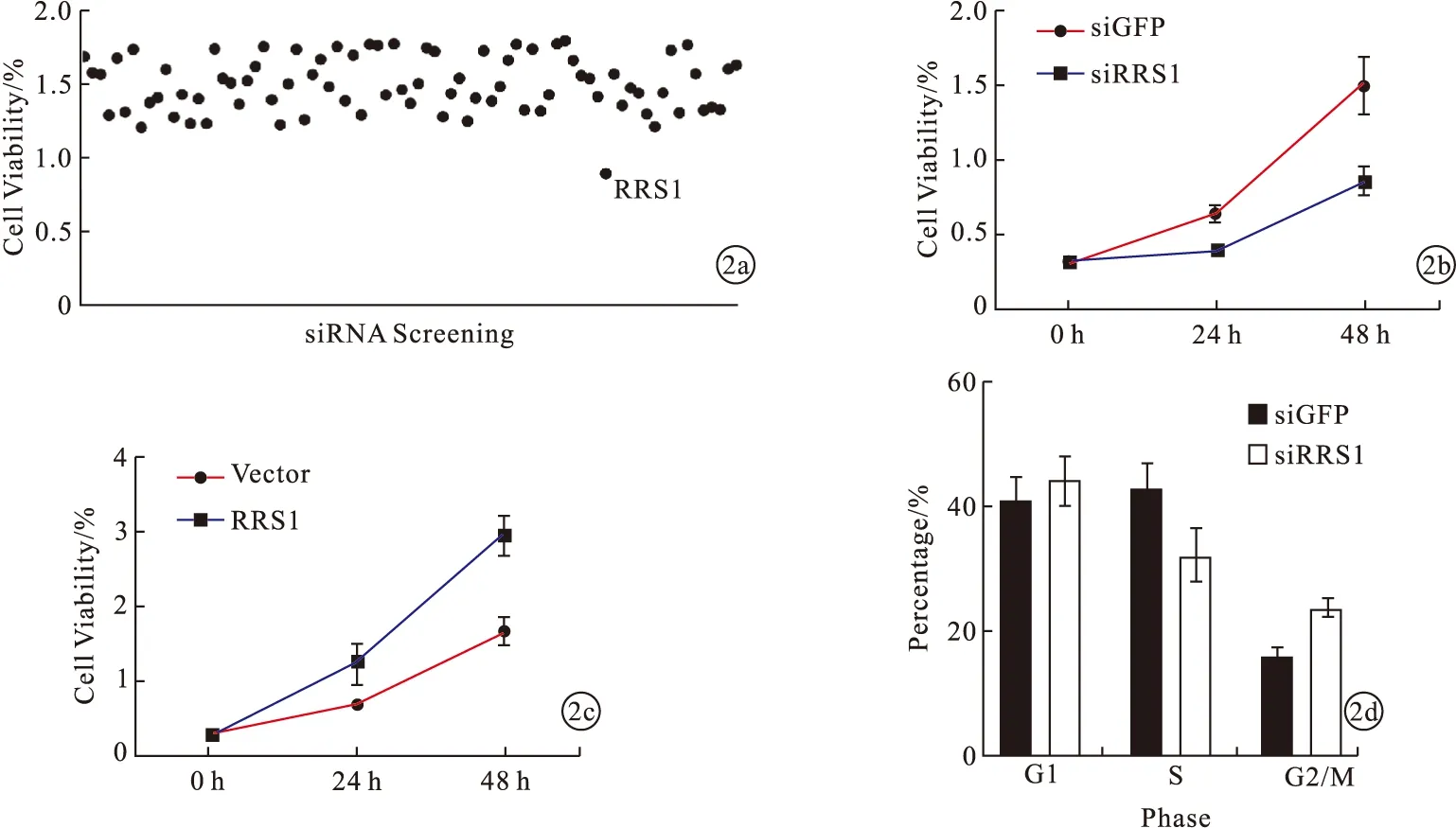
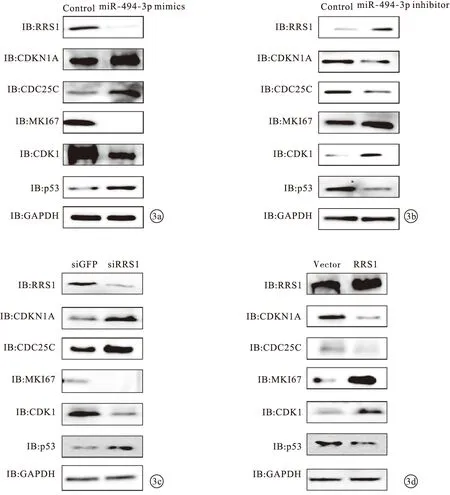
图3 miR-494-3p及RRS1对结直肠癌患者细胞周期相关因子表达水平影响
3 讨论
miRNA是非编码RNA家族的成员,长度为21~23个核苷酸[11]。有证据表明,miRNA作为癌基因或肿瘤抑制因子在多种癌症中发挥调节作用[12]。miR-494-3p可诱导肺癌发生并调节人胶质母细胞瘤细胞的增殖、侵袭、迁移及凋亡[13];但其在某些癌症中充当肿瘤抑制因子,如前列腺癌[14]。本研究结果显示:过表达miR-494-3p后,结直肠癌细胞SW480增殖水平下降(P<0.05),S期细胞减少、G2/M期细胞增多(P<0.05)。即miR-494-3p在结直肠癌中充当肿瘤进展的抑制分子。有研究报道,miRNA可通过直接与目标mRNA的3′非翻译区结合来调节基因表达[15],通过调节靶基因的蛋白质表达水平,miRNA广泛参与各种生物过程和人类疾病。本研究结果发现:过表达miR-494-3p后,结直肠癌细胞SW480中RRS1 mRNA表达水平下降(P<0.05);敲低miR-494-3p后,结直肠癌细胞SW480中RRS1 mRNA表达水平上升(P<0.05);miR-494-3p靶向RRS1 mRNA的3’端非翻译区(P<0.05)。这提示,miR-494-3p通过调节RRS1发挥抑制结直肠癌进展的功能。
RRS1的主要功能是参与核糖体的生物发生,这是蛋白质合成所必需的。癌细胞增殖增强常伴随蛋白质合成增加[16]。有研究证实,一些核糖体蛋白在癌症发展中具有明确作用[17]。有学者称,RRS1突变可延迟G1到S相的转变[18],这提示了RRS1在细胞周期转变中的重要作用。本研究结果显示:敲低RRS1后,结直肠癌细胞SW480中S期细胞减少、G2/M期细胞增多(P<0.05);过表达RRS1后,结直肠癌细胞SW480中S期细胞增多、G2/M期细胞减少(P<0.05)。本研究结果还显示:过表达miR-494-3p后,结直肠癌细胞SW480中细胞周期相关因子CDKN1A、CDC25C、p53表达水平上升,MKI67、CDK1表达水平下降(P<0.05);敲低miR-494-3p后,结直肠癌细胞SW480中细胞周期相关因子CDKN1A、CDC25C、p53表达水平下降,MKI67、CDK1表达水平上升(P<0.05);敲低RRS1后,结直肠癌细胞SW480中细胞周期相关因子CDKN1A、CDC25C、p53表达水平上升,MKI67、CDK1表达水平下降(P<0.05);过表达RRS1后,结直肠癌细胞SW480中细胞周期相关因子CDKN1A、CDC25C、p53表达水平下降,MKI67、CDK1表达水平上升(P<0.05)。上述结果提示,miR-494-3p/RRS1轴在一定程度上通过上调或下调细胞周期相关蛋白来影响细胞周期。
综上所述,miR-494-3p/RRS1轴可影响结直肠癌发展,靶向miR-494-3p/RRS1轴可能是一种有前途的结直肠癌治疗策略。
