共轭亚油酸对脂质代谢和身体成分组成影响的研究进展
2022-05-13李鹏超顾学艳
李鹏超,顾学艳
(1.北京体育大学艺术学院,北京 100084;2.国立群山大学体育学院,韩国 全罗北道 群山 54150)
功能性食品是人体获取营养物质的重要来源之一,其摄取贯穿人体生长、发育与成熟各阶段。共轭亚油酸(conjugated linoleic acid,CLA)是一类天然存在于食品中或通过食品加工技术获得的具有功能性的营养物质,它是一种亚油酸异构体(C18:2,n-6)的脂肪酸,具有抗肥胖作用。CLA可以通过调节脂质代谢达到减脂效果[1],这已在动物和人体内得到证实[2-4]。然而目前人们在减肥过程中对CLA的合理使用剂量及其长期服用所带来的副作用认知还不够全面[5-7]。基于此,本文回顾并综合以往研究,论述CLA减脂的主要分子机制及其对人类和部分啮齿类动物脂质代谢和身体组成成分的影响。
1 共轭亚油酸
CLA是亚油酸所有立体和位置异构体混合物的总称,可以看作是亚油酸的次生衍生物,分子式为C17H31COOH。CLA双键可位于7和9、8和10、9和11、10和12、11和13、12和14位置,其中每个双键又有顺式(cis)和反式(trans)两种构象。CLA目前已鉴定有25种同分异构体[8],其中cis-9,trans-11和trans-10,cis-12是含量最多的两种异构体[9],其结构如图1所示。
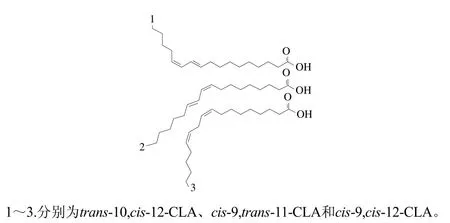
图1 CLA同分异构体[10]Fig. 1 Structures of CLA isomers[10]
CLA天然产生于反刍动物消化道中,其合成主要通过α9-脱氢酶对trans-11硬脂酸脱氢作用实现[11]。cis-9,trans-11-CLA是食品中广泛存在的CLA异构体之一,牛肉中每克脂肪约含2.5~4.5 mg CLA,奶制品中同样有该类CLA的存在[12]。工业上,通过对亚油酸部分氢化和热处理,同样可获得具有生物活性并具有确定化学组成的CLA[13]。CLA具有抗癌、抗动脉粥样硬化、改善血脂、免疫调节、增强骨骼矿化和降低血糖等作用,然而,目前研究最多的还是CLA的减脂功能[14]。
2 共轭亚油酸的减脂分子机制
CLA降低身体脂肪含量首先是通过控制基因表达,进而控制脂肪细胞分化和促进脂质分解。也就是说,CLA通过控制相关基因表达,减少脂肪形成[15-17]。
过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPAR)是一类配体依赖的核转录调节因子,其在脂肪酸(fatty acid,FA)存储和分解代谢中起核心作用。PPAR包含3种亚型:PPAR-α、PPAR-β和PPAR-γ。PPAR-α和PPAR-β参与脂质代谢和葡萄糖代谢,PPAR-γ参与脂肪细胞分化[18-19]。图2展示了PPAR从抑制状态(图2A)到与配体结合被激活,与视黄醇类X受体(retinoid X receptor,RXR)形成异二聚体,所形成的PPAR/RXR异二聚体与靶基因启动子上游PPAR反应元件结合调节靶基因转录过程(图2B)。
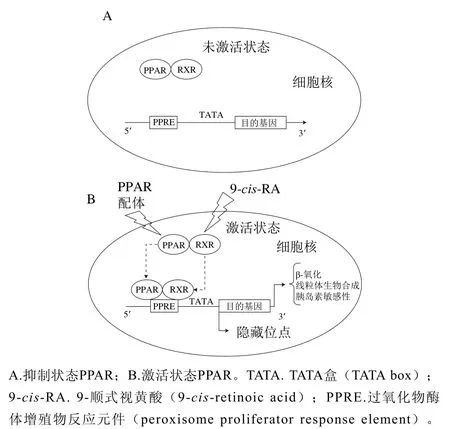
图2 PPAR转录激活分子机制[10]Fig. 2 Mechanism for transcriptional activation by PPAR[10]
CLA对脂质代谢的影响均是通过激活或抑制PPAR信号通路实现的,尤其是PPAR-γ介导的信号通路。脂肪细胞中,PPAR-γ介导的通路控制酰基辅酶A合成酶(acyl CoA-synthetase,Acyl-CoA)、脂蛋白脂肪酶(lipoprteinlipase,LPL)和脂肪酸转运蛋白(fatty acid transport protein,FATP)等脂质代谢相关基因的表达[20]。其中,trans-10,cis-12-CLA可通过抑制PPAR-γ信号通路抑制脂肪细胞分化并改变脂肪合成和脂解相关蛋白活性,从而促进脂质分解[21]。
目前,普遍认为CLA的减脂分子机制是[10,17]:CLA与PPAR-γ共激活因子互作,激活PPAR-γ通路,刺激肉碱-棕榈油转移酶(carnitine-palmoil-transferase,CPT)-1表达,促进脂肪酸β-氧化,减少三酰甘油(triglyceride,TG)合成,最终降低脂肪含量[10,17,22]。具体过程如下:脂肪酸在CPT复合物帮助下转运至线粒体,而CPT复合体涉及3个酶成分(CPT-1、CPT-2和肉碱酰基肉碱转位酶[23-25]),脂肪酸被Acyl-CoA激活形成脂肪酰基辅酶A,其与CPT-1形成复合物,该复合物穿透线粒体膜到达膜间隙,在CPT-2帮助下完成酰基辅酶A的释放,酰基辅酶A一旦到达线粒体基质,长链脂肪酸(long chain fatty acid,LCFA)就会通过β-氧化生成三磷酸腺苷(adenosine triphosphate,ATP),完成脂解作用[25]。但是,这种机制的脂解效率有限。
事实上,CLA还可通过刺激呼吸链解偶联蛋白(uncoupling protein,UCP)的表达,提高其活性,进一步提高脂肪酸β-氧化效率[17,26-28]。UCP是定位在线粒体内膜的蛋白质,负责质子从膜间隙泵入线粒体基质。但是,这种方式下泵入线粒体基质的质子并不以ATP形式进行能量存储,而是以热能形式释放。UCP-1可以加快质子泵入线粒体基质的速率,促进高能底物(包括脂质)氧化所产生的能量以热能散失。在这种情况下,脂质氧化只有不断进行才能产生足量ATP为机体供能。因此,CLA还可通过刺激UCP-1表达加速脂质氧化过程,达到减脂效果[17]。UCP除UCP-1外,还有UCP-2和UCP-3,它们的组织分布和生物学功能各不同。UCP-1仅在棕色脂肪组织中表达,促进棕色脂肪组织脂质氧化;UCP-3在肌肉等组织中表达;UCP-2则在白色脂肪等组织中表达,是表达水平最强的UCP[29]。目前,已在啮齿动物中证实补充CLA混合物或trans-10,cis-12-CLA可以诱导UCP-2转录,但是否促进能量消耗还未知[10,29-30]。
综上,CLA与PPAR-γ的相互作用能够增加CPT-1和UCP-1表达,加速脂解过程的进行[10,17]。
3 共轭亚油酸的减脂生物学效应研究进展
3.1 共轭亚油酸在非运动训练人群中减脂生物学效应研究进展
由于CLA具有抗炎[31]、降低氧化应激[32]、改善胰岛素信号传导[33]、减少体内脂肪含量并改善体能[34]等作用,其作为补剂被广泛添加于人们日常饮食当中,这些机制的协同作用改善了人体的脂质代谢和机体组成成分。Gaullier等[35]曾进行了为期24个月的实验,实验组肥胖人群每日服用4.5 g CLA,结果显示,超重成年人经CLA补充后其饮食耐受性良好且体质量减轻,表明CLA可以减少超重人群体脂。考虑到性别效应,Santos-Zago等[36]进行了一项以健康但营养过剩妇女为研究对象的实验,结果表明,服用CLA的64 d内,超重妇女并未表现出身体成分含量的改变,但是12周之后,体脂含量减少。Gaze等[37]的研究表明,患有代谢综合症的肥胖男性服用CLA 4周后腹围也明显缩小。对于不同CLA异构体来说,它们并没有表现出明显的减肥效果差别,尽管10-trans,12-cis-CLA与9-cis,11-trans-CLA相比增加了健康男性体内甘油三酯和低密度胆固醇的浓度和比例[38]。
另一项为期12周的研究利用生物电阻抗方法探究补充CLA对中国肥胖人群或I级肥胖患者身体组成成分和体质量的影响。其CLA补充方案为受试者每天饮用两餐200 mL无菌牛奶,牛奶中含1.7 g 9-cis,11-trans-CLA和10-trans,12-cis-CLA混合物。研究发现,补充CLA的实验组中肥胖或超重人群比例下降,且受试者没有出现身体不适[39]。Kim等[40]还进行了CLA补充对韩国超重和肥胖人群生理效应的评估,结果表明,为期8周的CLA饮食降低了这些人群的体脂含量,且CLA的补充对这些人群抗氧化系统和白细胞DNA无任何损伤作用。
考虑到饮食结构的复杂性与非单一性,有研究对37名平均身体质量指数(body mass index,BMI)为(25.1±3.4)kg/m2的女性进行了3组不同饮食方案干预:1)对照饮食,不改变其日常饮食习惯;2)高蛋白低热量饮食,辅助蛋白凝胶、胶囊热原、多种维生素和CLA作为补剂;3)高蛋白且与2号组等热量饮食,但无实际生理干扰效应。3周后,与1和3号饮食组相比,2号实验组女性体质量和体脂百分比显著降低。当然,鉴于CLA是与其他营养补品同时食用,很难单独评估CLA对身体肥胖的影响[41]。在另一项研究中,有101名中度肥胖的受试者进行了为期一年的低热量CLA补充饮食,且这些受试者在先前的研究中体质量已下降超过其基准体质量的8%,结果显示,这种状态下补充CLA对体质量及体脂回收率无显著影响。相反,CLA的补充显著增加了受试者白细胞数量[42]。
对于使用二甲双胍的2型糖尿病患者,30名女性和26名男性分别依据性别、年龄和BMI被划分为3组,分别施行为期8周的不同饮食干预方案:1)3 g/d CLA加100 IU/d VE;2)3 g/d CLA加无效VE替代剂;3)无效CLA替代剂(大豆油)加无效VE替代剂。研究结束时,3组患者之间体质量、身体成分组成和血糖水平及炎症状况无显著差异。但是,接受CLA补充的患者丙二醛(malondialdehyde,MDA)水平上升,载脂蛋白apoB100表达水平下降[43]。当以绝经后肥胖2型糖尿病妇女为研究对象时,CLA的补充降低了其BMI和脂肪含量,但并没有改变其肌肉含量[44],值得注意的是,这些绝经后的妇女并没有进行任何减肥饮食或锻炼计划。CLA在非运动训练人群中减脂效应相关研究如表1所示。

表1 CLA在非运动训练人群中的减脂效应Table 1 Effect of CLA supplementation on fat loss in non-exercise population
3.2 共轭亚油酸在运动训练人群中减脂生物学效应研究进展
由于身体成分与运动能力之间存在高度相关性,从1994年开始,在美国等国家已将CLA作为运动食品和营养辅助保健食品向锻炼身体和进行有氧健身运动的人员销售[45-46]。
Lambert等[47]研究了在定期锻炼的个体中,CLA摄入对身体成分组成的影响。64名定期锻炼参与者(包括男性和女性)被随机分配到CLA组(3.9 g 9-cis,11-trans-CLA和10-trans,12-cis-CLA混合物)和对照组(3.9 g高油质葵花籽油),每天服用受试物,为期12周。12周干预后,研究人员发现,CLA的补充与受试对象的体质量及身体成分组成上的改变无显著相关性。除测量身体成分外,该研究在12周干预前后还分别进行了口服葡萄糖耐受性实验。结果发现,与对照组相比,服用CLA的妇女血浆胰岛素浓度在0、30 min和120 min时明显降低。此外,与对照组相比,男性在补充CLA 12周后,平均血清非酯化游离脂肪酸浓度对口服葡萄糖耐受性的响应显著降低。
Diaz等[48]评估了吡啶甲酸铬和CLA联合补充对能量代谢和运动诱导的身体成分变化的影响。实验为期12周,35名超重妇女(平均年龄3 6岁)被要求进行低热量饮食(2 092.93 kJ/d),同时被要求进行每周5 d、每天30 min的慢跑或步行。经过为期12周的营养剂补充和锻炼,吡啶甲酸铬和CLA营养剂补充组人群体质量下降2.6 kg,对照组体质量下降2.5 kg;受试者臀部脂肪在吡啶甲酸铬和CLA补充组中减少2.7 kg,对照组臀部脂肪则减少2.4 kg。该实验数据由于在统计学上缺少显著性差异,因此该作者认为吡啶甲酸铬和CLA的联合补充并没有改变运动诱导的能量代谢和身体组成成分变化,但是某种程度上,结果呈现了一定程度的脂肪含量下降趋势。
Tarnopolsky等[49]进一步探究了一水肌酸和CLA联合补充对老年人耐力训练后肌肉力量改变的影响。75岁老年男性和68岁老年女性参加为期6个月的每周两次的耐力训练计划,这些老年受试者被随机分为营养剂补充组(5 g一水肌酸和6 g 9-cis,11-trans-CLA/10-trans,12-cis-CLA混合物)和对照组。经过6个月耐力训练和营养剂补充后,营养剂补充组人群肌肉质量显著增加2.1 kg,而对照组只增加0.9 kg。此外,与对照组相比,营养剂补充组人群在训练之后脂肪质量减少1.9 kg,而对照组只下降0.4 kg。该作者还做了CLA对肌肉力量和耐力影响的测试,发现营养剂补充组人群肌肉力量没有出现显著提高,但是肌肉耐力明显加强。此外,受试者对营养剂补充的耐受性良好,在营养剂补充组人群中只有一例胃肠道疼痛报告,但并没有影响研究的进行。需要说明的是,由于实验方案的设计,不能确定该研究所观察到的身体成分和肌肉耐力的有益改变有多少比例可归功于一水肌酸的补充,又有多少比例可归功于CLA的摄入。Kreider等[50]同样进行了CLA对肌肉对抗性影响的研究,其让受试者以6 g/d剂量服用CLA 28 d。在28 d的训练中,受试者坚持常规独立训练计划,并维持正常饮食。实验结束后,经检测发现CLA补充对体质量、肌肉含量、体脂百分含量以及肌肉力量均无显著影响。因此,该作者认为,CLA对训练有素的运动员不具有显著的机能增强作用。当然,可能由于实验周期短,28 d不足以引起身体成分和肌肉力量的改变。
最近,有研究探讨了CLA摄入对日本学生运动员耐力表现和抗疲劳能力的影响[46]。该研究对10名男学生运动员进行了双盲交叉研究。受试者分别被给予CLA(0.9 g/d)和无效对照剂补充,为期14 d。在第0天和第14天,使用自行车测力计进行运动耐力测试(稳定负荷),且运动前后均进行血液采集和临界闪烁频率(critical flicker frequency,CFF)测定,并连续测定运动过程中的运动知觉率(rate of perceived exertion,RPE)。结果表明,随CLA的摄入,受试者体质量变化量显著增加,体脂百分比变化量趋于减少,这可能是肌肉质量增加产生的影响。此外,CLA补充组运动员运动时间变化量显著延长,运动后CFF变化量有增加趋势,运动中RPE变化量及运动前后肌酸磷酸激酶变化量有减少趋势。这些结果表明,14 d的CLA摄入可能对学生运动员的耐力表现和抗疲劳能力有积极促进作用。CLA在运动训练人群中减脂效应相关研究如表2所示。
综上,CLA的补充对人体脂质代谢和人体成分组成的影响受人种、性别、年龄、健康状况、身体素质、饮食结构及服用剂量与服用时间等多重因素影响,并不可一概而论。目前,所服用的CLA大都是9-cis,11-trans-CLA和10-trans,12-cis-CLA两种,且剂量在0.5~6.0 g/d不等。
3.3 共轭亚油酸在啮齿类动物减脂中生物学效应研究进展
对于与人类亲缘关系较近的啮齿类动物而言,CLA对小鼠降脂作用最明显[51]。Ma等[52]发现,在饲料中添加0.5% CLA可以降低小鼠网膜脂肪14%、附脂25%~30%;CLA还可减少小鼠附睾和肠系膜脂肪含量,改善脂质分布,同时在瘦素、血糖、肝脏脂肪变性和脂肪细胞体积减小方面也有显著改善作用,CLA对小鼠的体脂肪降脂率最高可达57%~60%[51]。王武等[53]以昆明小鼠为实验对象,设置基础饲料对照组、肥胖模型对照组以及CLA高、中、低剂量组,分别连续灌胃6周,结果显示CLA各剂量组小鼠的Lee’s指数、脂肪系数和血清甘油三酯、总胆固醇、低密度脂蛋白胆固醇水平显著低于肥胖模型对照组,而高密度脂蛋白胆固醇水平极显著高于肥胖模型对照组,这说明CLA除对小鼠具有减脂功能外,还可抑制小鼠肥胖。
对于大鼠而言,有研究报道了CLA和低氧处理对雄性SD大鼠肌肉脂质代谢的影响,发现CLA对大鼠脂质代谢的影响有助于大鼠对低氧的适应,而该过程主要通过调节脂肪酸合成酶和LPL来影响肌肉脂质代谢[54]。对于青春肥胖期的大鼠,按照1.6 g/kgmbCLA剂量对其进行灌胃饲养,5次/周,持续8周,并以低(15~18 m/min)、中(21~25 m/min)、高(28~32 m/min)强度跑台运动进行分组训练,结果显示,青春期肥胖大鼠伴随周龄的增加体质量呈上升趋势,而肌肉吸氧量和总吸氧量、肌肉耗能和总耗能呈下降趋势,不同方法干预8周均能抵抗上述指标的下降,并能抑制体质量增长幅度、降低Lee’s指数,运动结合CLA补充效果优于单独补充CLA,但受运动强度影响较小[55]。该结论在张皓月等[56]的研究中同样得到验证。就减肥效果而言,高强度运动辅助CLA补充减肥效果最明显[57],且运动结合CLA可增加大鼠静息状态下的能量代谢水平[58]。CLA在啮齿类动物中减脂效应相关研究如表3所示。

表2 CLA在运动训练人群中的减脂效应Table 2 Effect of CLA supplementation on fat loss in exercise population
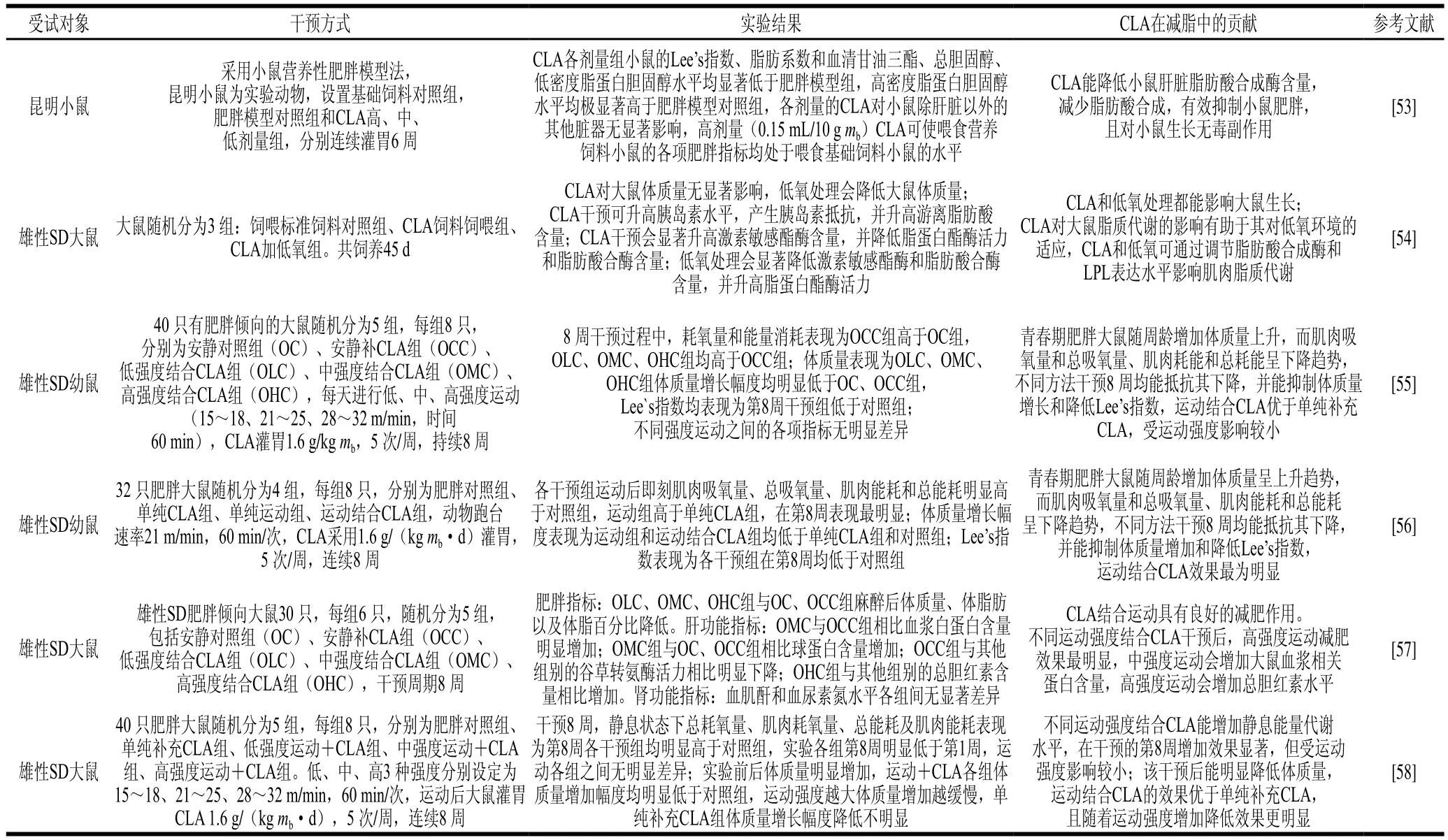
表3 CLA在啮齿类动物中的减脂效应Table 3 Effect of CLA supplementation on fat loss in rodents
由于人类作为实验对象的限制性与特殊性,大多研究以啮齿类动物为模式生物探究CLA的生物学效应,但是由于啮齿类动物和人类进化上的差异性,今后仍然需要关注CLA对人体的生物学效应影响。
4 共轭亚油酸的副作用
虽然补充CLA对某些健康指标具有积极促进作用,但仍有一些关于CLA不良反应的报道,如10-trans,12-cis-CLA对大鼠具有促癌效应[59],其还可诱导生物体瘦素分泌减少、脂质氧化产物含量增加以及导致机体对胰岛素敏感性下降[60]。对于人类,有研究表明CLA补充可增加血液甘油三酯含量、升高低密度脂蛋白胆固醇水平并降低高密度脂蛋白胆固醇含量,引起血脂水平发生负面变化[61]。同时,还有研究表明CLA补充可使肥胖个体葡萄糖代谢出现负面效应,并伴随胰岛素敏感性降低[62]。
5 结 语
综上,尽管诸多研究报道了补充CLA对动物和人类身体成分的改变具有积极促进效应,但是仍有部分研究显示出CLA具有毒副作用。同时,CLA在众多实验模型和人类研究中表现出其具有通过减少脂肪含量来积极改变机体组成成分的能力,但至今仍然缺乏关于CLA单独使用及与运动相结合的方式在人体中生物学效应方面的研究报道。因此,某种意义上讲,通过饮食方式食用天然富含CLA的食物(而不是从补品中摄取)将是控制肥胖的较好选择,它可以降低肥胖及其相关并发症发生的风险,这种补充方式是对人体有益的,且不会增加对健康不利的影响。
