乌头碱对前列腺癌细胞增殖、侵袭与凋亡的影响及其机制
2022-05-13蔡国强昆山市第一人民医院药学部江苏昆山215300
蔡国强 (昆山市第一人民医院药学部,江苏 昆山 215300)
前列腺癌是临床常见恶性肿瘤之一,其具有较高的死亡率,大部分患者确诊时已处于前列腺癌中期或晚期〔1〕。临床常采用手术联合放疗或化疗等综合技术治疗前列腺癌,但化疗药物具有一定毒副作用〔2,3〕。研究表明乌头碱可抑制乳腺癌细胞增殖从而抑制肿瘤恶性进展,同时研究显示乌头碱还具有抗炎作用〔4,5〕。但乌头碱对前列腺癌的影响尚未见报道。研究表明Janus激酶(JAK)2/信号传导与转录激活因子(STAT)3信号通路激活可抑制前列腺癌细胞凋亡及促进细胞增殖从而使前列腺癌恶性进展〔6〕。因此,本研究主要探讨乌头碱对前列腺癌细胞增殖、凋亡及侵袭的影响,初步分析其是否可通过调控JAK2/STAT3信号通路而发挥作用,为临床合理应用乌头碱提供理论依据。
1 材料与方法
1.1材料与试剂 乌头碱购自北纳创联研究院(纯度高于98%),用二甲基亚砜(DMSO)溶解乌头碱,使用前采用细胞培养液稀释乌头碱至实验所需浓度。前列腺癌细胞DU145购自美国ATCC公司;胎牛血清与DMEM培养基购自美国Gibco公司;四甲基偶氮唑蓝(MTT)与二喹啉甲酸(BCA)试剂盒均购自上海碧云天生物技术有限公司;基质胶购自美国BD公司;膜联蛋白(Annexin)V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)双染细胞凋亡检测试剂盒购自上海润成生物科技有限公司;p-JAK2、p-STAT3抗体与辣根过氧化物酶(HRP)标记的二抗均购自美国Santa Cruz公司;B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)抗体均购自上海哈灵生物科技有限公司。
1.2方法
1.2.1实验处理及分组 DU145细胞于DMEM培养液内培养(含有10%胎牛血清),培养条件为37℃、5%CO2,每2 d更换1次培养液。收集对数生长期DU145细胞,用不同浓度的乌头碱处理DU145细胞,实验分组为Control组(未经任何处理的DU145细胞)、乌头碱5 μg/ml组(用终浓度为5 μg/ml乌头碱处理DU145细胞)、乌头碱10 μg/ml组(用终浓度为10 μg/ml乌头碱处理DU145细胞)、乌头碱20 μg/ml组(用终浓度为20 μg/ml的乌头碱处理DU145细胞)〔7〕。每组细胞各处理48 h。
1.2.2MTT比色法检测细胞增殖 收集各组DU145细胞,胰蛋白酶消化,调整细胞密度(5×104个/ml),接种于96孔板(100 μl/孔),每孔加入20 μl MTT溶液,继续培养4 h,弃上清液,每孔加入150 μl DMSO,置于摇床上振荡10 min,应用Bio-Tek808酶标仪检测每孔的OD值(490 nm),根据OD值计算细胞存活率(%)=〔(实验组OD值-空白对照组OD值)/(正常培养组OD值-空白对照OD值)〕×100%
1.2.3Transwell实验检测细胞侵袭 用不含血清的DMEM培养基以1∶8的稀释比稀释基质胶,取100 μl稀释液包被Transwell小室底部的上室面,用0.25%胰蛋白酶消化细胞,调整细胞密度(1×106个/ml),Transwell小室上室内种植细胞悬液(200 μl),Transwell小室下室种植含胎牛血清DMEM培养基(600 μl),继续培养24 h,擦拭未侵袭细胞,多聚甲醛固定15 min,0.2%结晶紫溶液染色10 min,显微镜下观察侵袭细胞。
1.2.4细胞凋亡实验 收集各组前列腺癌细胞,胰蛋白酶消化,每组取1×105个细胞,4℃条件下1 000 r/min离心5 min(离心半径10 cm),弃上清,预冷磷酸盐缓冲液(PBS)洗涤细胞2次,每次10 min,加入100 μl结合缓冲液重悬细胞,加入5 μl Annexin V-FITC,加入5 μl PI,室温孵育15 min,加入400 μl结合缓冲液,充分混匀,置于FACS Calibur流式细胞仪及应用Cellauest软件检测各组细胞凋亡。
1.2.5Western印迹检测Bax、Bcl-2、JAK2/STAT3信号通路相关蛋白 前列腺癌DU145细胞经药物处理后,加入蛋白裂解液裂解细胞,采用BCA法测定蛋白浓度,取30 μg蛋白样品上样进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,电泳反应条件依次为80 V 30 min,120 V 90 min,根据标记位置切胶,将分离的蛋白凝胶于4℃湿转至聚偏氟乙烯(PVDF)膜,室温条件下封闭1 h,TBST洗膜3次,每次10 min,孵育一抗(4℃孵育过夜),TBST洗膜3次,每次10 min,室温条件下孵育二抗(1 h),TBST洗膜,显色,曝光显影,应用凝胶分析系统及Quantity One软件检测条带灰度值,蛋白相对表达量=目的蛋白条带灰度值/内参照条带灰度值。
1.3统计学处理 采用SPSS19.0软件进行t检验、单因素方差分析。
2 结 果
2.1乌头碱对前列腺癌细胞DU145增殖的影响 与Control组DU145细胞存活率〔(100.00±9.25)%〕相比,乌头碱5 μg/ml组〔(91.52±9.68)%〕未见显著变化(P>0.05);而乌头碱10 μg/ml组〔(60.37±5.43)%〕和乌头碱20 μg/ml组〔(48.29±4.37)%〕均显著下降(均P<0.05)。由于乌头碱浓度为20 μg/ml时前列腺癌细胞存活率接近50%,因而选取20 μg/ml的乌头碱进行后续研究。
2.2乌头碱对DU145细胞侵袭的影响 Control组细胞侵袭数目〔(118.24±10.38)个〕显著高于乌头碱20 μg/ml组〔(43.35±5.61)个,t=13.702,P=0.000〕。
2.3乌头碱对DU145细胞凋亡的影响 Control组细胞凋亡率〔(3.39±0.27)%〕显著低于乌头碱20 μg/ml组〔(39.18±3.65)%,t=29.336,P=0.000〕。见图1。

图1 乌头碱对DU145细胞凋亡的影响
2.4乌头碱对DU145细胞凋亡相关蛋白表达的影响 与Control组比较,乌头碱20 μg/ml组Bax水平显著升高(P<0.05),而Bcl-2水平显著降低(P<0.05),见表1、图2。
2.5乌头碱对DU145细胞JAK2/STAT3信号通路相关蛋白表达的影响 与Control组比较,乌头碱20 μg/ml组p-JAK2、p-STAT3蛋白水平显著降低(P<0.05),而JAK2、STAT3蛋白水平差异无统计学意义(P>0.05),见表1、图3。

表1 乌头碱对DU145细胞凋亡及JAK2/STAT3信号通路相关蛋白表达的影响

图2 Western印迹检测乌头碱对DU145细胞凋亡相关蛋白表达的影响
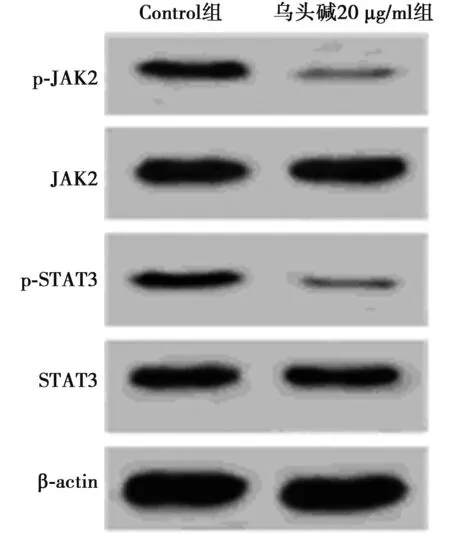
图3 Western印迹检测乌头碱对DU145细胞JAK2/STAT3信号通路相关蛋白表达的影响
3 讨 论
前列腺癌患者接受手术治疗后,由于术后出现转移及复发导致患者预后不良,因而在围术期采取干预措施有助于改善患者预后不良,研究表明黄芩素可通过抑制Ezrin蛋白表达而促进前列腺癌细胞凋亡,抑制细胞增殖及侵袭〔8〕。程翔宇等〔9〕研究表明氯化两面针碱可通过抑制AKT/mTOR磷酸化而抑制前列腺癌细胞增殖及侵袭,并可促进细胞凋亡。研究报道麻醉药物及麻醉技术可影响肿瘤细胞增殖〔10,11〕。
乌头碱具有抗炎、镇痛等作用,但乌头碱具有一定毒性从而限制其应用,研究表明适量的乌头碱可减轻肿瘤患者疼痛,还可抑制消化系统肿瘤发生及发展〔12,13〕。研究报道指出乌头碱可通过抑制核因子(NF)-κB信号通路激活而抑制胰腺癌细胞增殖及促进其凋亡,还可抑制黑色素瘤细胞增殖〔14〕。乌头碱对胰腺癌细胞增殖具有抑制作用,而对细胞凋亡具有促进作用,抑制肿瘤恶性进展〔15〕。本研究结果提示乌头碱可抑制前列腺癌细胞增殖、侵袭及诱导细胞凋亡。研究表明Bax、Bcl-2蛋白可调控细胞凋亡过程,Bcl-2蛋白可抑制细胞凋亡,Bax是细胞凋亡促进因子〔16〕。本研究结果提示乌头碱可通过下调Bcl-2蛋白表达及上调Bax蛋白表达诱导前列腺癌细胞凋亡进而抑制细胞异常增殖。
JAK2/STAT3信号通路可参与细胞增殖、凋亡、分化等过程,研究表明JAK2/STAT3信号通路激活可促进肝癌发生及发展,并可作为评估肝癌恶性程度及患者预后不良的重要指标〔17~19〕。STAT家族属于重要转录因子,STAT3与多种肿瘤发生发展有关,STAT3异常活化可促进肿瘤发生及发展,抑制STAT3表达可减弱肿瘤细胞转移能力,研究表明抑制JAK2与STAT3的磷酸化可抑制前列腺癌细胞迁移及侵袭〔20〕。本研究结果提示乌头碱可通过抑制JAK2/STAT3信号通路激活而抑制癌基因表达进而抑制前列腺癌细胞增殖及侵袭。
综上,乌头碱可抑制前列腺癌细胞增殖并降低其侵袭能力,诱导细胞凋亡,其机制可能与抑制JAK2/STAT3信号通路激活有关。
