miR-493-5p靶向HOPX基因对前列腺癌细胞增殖、凋亡的影响及机制
2022-05-13孙继建潘世杰赵俊峰河南省中医院泌尿外科河南郑州450000
孙继建 潘世杰 赵俊峰 (河南省中医院泌尿外科,河南 郑州 450000)
前列腺癌是泌尿生殖系统恶性肿瘤,目前有根治性手术治疗、放化疗、内分泌治疗等治疗手段〔1〕。由于内分泌治疗、放疗及细胞毒性药物治疗对晚期前列腺癌的疗效有限,因此研究新型治疗药物具有重要的临床意义;随着分子生物学的发展,分子靶向治疗成为新的治疗方法〔2〕。miRNA可以调控多种生物学过程,并调节细胞和基因表达,研究发现miRNA能通过调控多种信号通路调控前列腺癌的发生与发展,了解它们之间的关系,有助于从分子生物学角度认识前列腺癌的发病机制,指导临床治疗及预后〔3〕。miR-493能有效抑制乳腺癌MCF7细胞的增殖、迁移、浸润和肿瘤形成的能力〔4〕。miR-493-5p在前列腺癌中下调表达,过表达miR-493-5p可抑制前列腺癌细胞增殖、迁移侵袭〔5〕。同源域特有蛋白(HOP)X是非HOX基因家族成员,被认为是一种抑癌基因,其在小鼠心肌细胞中下调表达,会引起心脏肥大和心力衰竭〔6〕。HOPX蛋白在非小细胞肺癌组织中低表达,与TNM分期有关〔7〕。HOPX能抑制肺癌细胞系HCC827凋亡、促进细胞分裂增殖〔8〕。但HOPX对前列腺癌细胞的增殖、凋亡的影响尚未清楚,本文研究miR-493-5p是否通过HOPX影响前列腺癌细胞的增殖、凋亡。
1 材料与方法
1.1材料 正常膀胱上皮细胞HUC和前列腺癌细胞T24、5637、SW780均购自中国科学院上海细胞库;RPMI1640培养基购自美国Gibco公司;Trizol试剂、荧光定量试剂盒购自日本TaKaRa公司;双荧光素酶报告基因检测试剂盒购自北京索莱宝科技有限公司;CCK-8试剂盒、凋亡检测试剂盒、放射免疫沉淀试验(RIPA)蛋白裂解液购自上海碧云天生物技术有限公司。
1.2方法
1.2.1细胞培养与分组 正常膀胱上皮细胞HUC和前列腺癌细胞T24、5637、SW780用RPMI1640培养基常规培养;取对数生长期细胞T24,将miR-con、miR-493-5p、si-con、si-HOPX分别转染至T24细胞,记为miR-con组、miR-493-5p组、si-con组、si-HOPX组;将miR-493-5p分别与pcDNA和pcDNA-HOPX共同转染至T24细胞,记为miR-493-5p+pcDNA组、miR-493-5p+pcDNA-HOPX组,正常培养的T24细胞作为NC组。
1.2.2qRT-聚合酶链反应(PCR)检测miR-493-5p和HOPX mRNA表达水平 提取所有细胞总RNA,反转录成cDNA,按照TaKaRa 荧光定量试剂盒说明进行PCR扩增,相对表达量采用2-△△Ct法计算。
1.2.3Western印迹检测蛋白表达 提取各组细胞总蛋白,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜后进行封闭,然后分别加入HOPX、细胞周期蛋白(Cyclin)D1、酶切半胱氨酸天冬氨酸蛋白酶(Caspase)-3、β-actin一抗(1∶800),4℃孵育过夜;加入二抗(1∶1 000)室温孵育2 h,显影,定影,分析蛋白条带吸光度值。
1.2.4四甲基偶氮唑蓝(MTT)比色法检测细胞活性 各组细胞培养24、48、72 h时,分别加入20 μl MTT溶液,孵育4 h;加入150 μl二甲基亚砜,振荡反应10 min,酶标仪检测490 nm处吸光度(OD)值。
1.2.5流式细胞术检测细胞凋亡率 离心收集各组细胞,漂洗后加入Annexin V-FITC和PI避光孵育15 min;上流式细胞仪检测。
1.2.6双荧光素酶报告实验 构建HOPX野生型和突变型荧光素酶表达载体(WT-HOPX和MUT-HOPX),将其分别与miR-con或miR-493-5p转染至T24细胞中,按说明书操作检测细胞荧光素酶活性。将miR-con、miR-493-5p、anti-miR-con、anti-miR-493-5p转染至T24细胞中,Western印迹检测HOPX蛋白表达。
1.3统计学分析 采用SPSS20.0软件进行t检验、单因素方差分析。
2 结 果
2.1前列腺癌细胞株中miR-493-5p 和HOPX的表达 与正常膀胱上皮细胞HUC相比,前列腺癌细胞T24、5637、SW780中miR-493-5p表达水平均降低,差异有统计学意义(P<0.05),HOPX mRNA和蛋白表达水平均升高,差异有统计学意义(P<0.05)。见图1,表1。
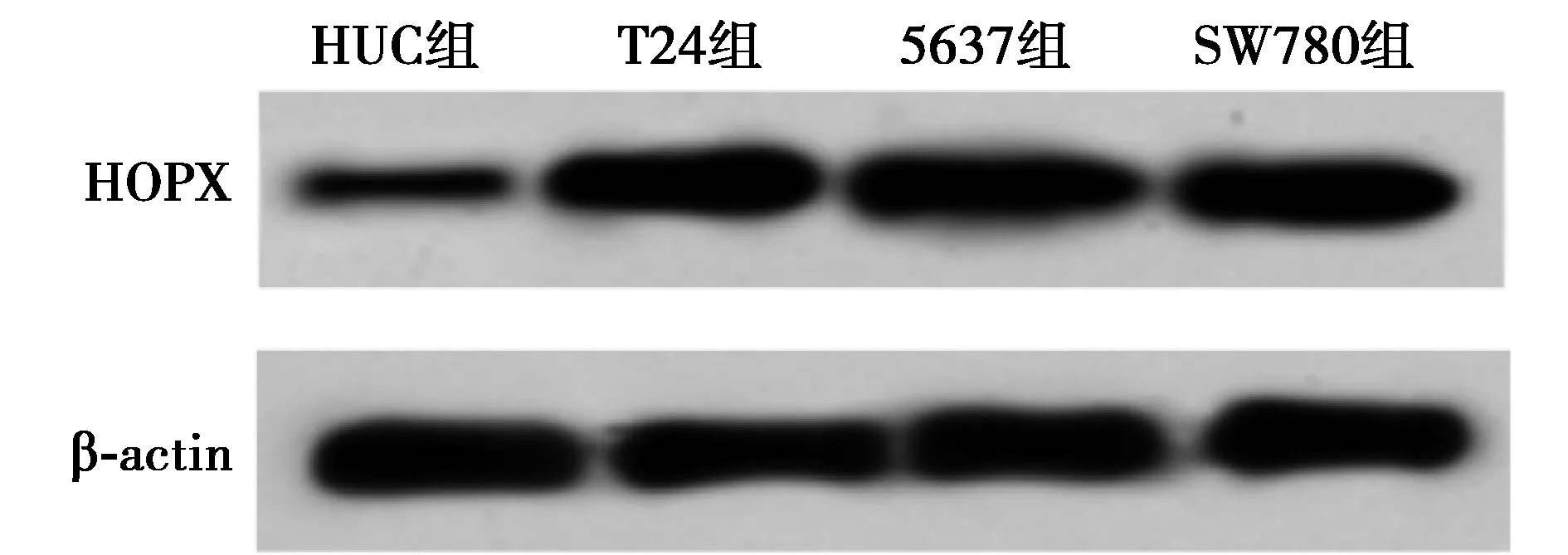
图1 Western印迹检测各细胞HOPX的表达

表1 各细胞中miR-493-5p 和HOPX的表达
2.2miR-493-5p过表达对前列腺癌细胞T24增殖和凋亡的影响 与NC组及miR-con组相比,miR-493-5p组miR-493-5p表达水平显著升高,酶切Caspase-3表达水平显著升高,CyclinD1表达水平显著降低,培养48、72 h的细胞活性显著降低,T24细胞凋亡率显著升高(均P<0.05)。见图2,图3,表2。
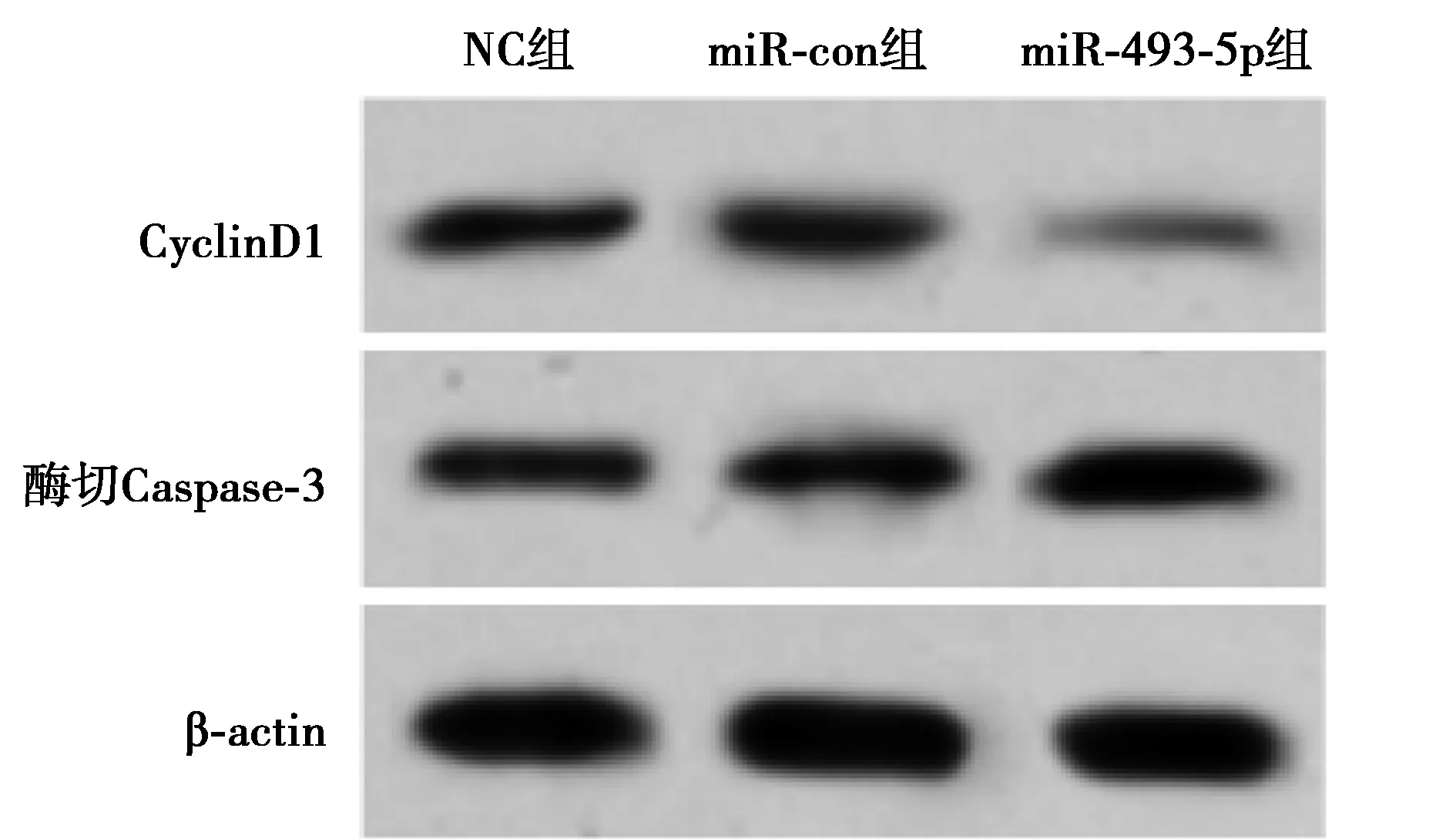
图2 Western印迹检测各组CyclinD1、酶切Caspase-3的表达
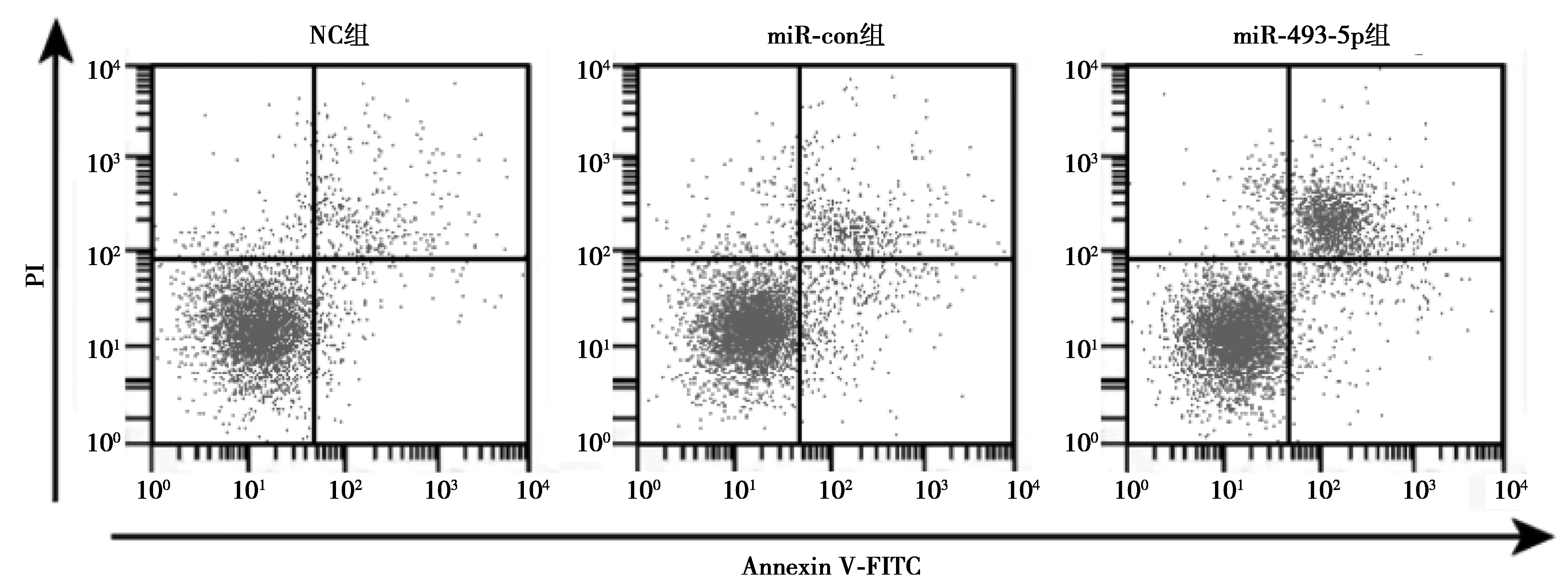
图3 检测前列腺癌细胞T24凋亡率

表2 下调miR-493-5p 表达对前列腺癌细胞T24增殖和凋亡的影响
2.3miR-493-5p靶向调控HOPX的表达的影响 TargetScan预测显示HOPX与miR-493-5p有结合位点,见图4。miR-493-5p与WT-HOPX共转染后T24细胞荧光素酶活性显著降低(P<0.05);miR-493-5p与MUT-HOPX共转染后T24细胞荧光素酶活性差异不显著(P>0.05)。见表3。miR-493-5p组HOPX蛋白表达水平(0.39±0.03)显著低于miR-con组(1.00±0.08,P<0.05);anti-miR-493-5p组HOPX 蛋白表达水平(1.49±0.09)显著高于anti-miR-con组(0.83±0.05,P<0.05)。见图5。

图4 miR-493-5p 与HOPX存在的互补核苷酸序列

表3 双荧光素酶报告实验

1~4:miR-con组、miR-493-5p组、anti-miR-con组、anti-miR-493-5p组图5 Western印迹检测各组HOPX的表达
2.4干扰HOPX对前列腺癌细胞T24的抑制作用 与NC组及si-con组相比,si-HOPX组酶切Caspase-3表达水平显著升高,CyclinD1、HOPX表达水平显著降低,48、72 h时细胞活性显著降低,T24细胞凋亡率显著升高(均P<0.05)。见图6,表4。
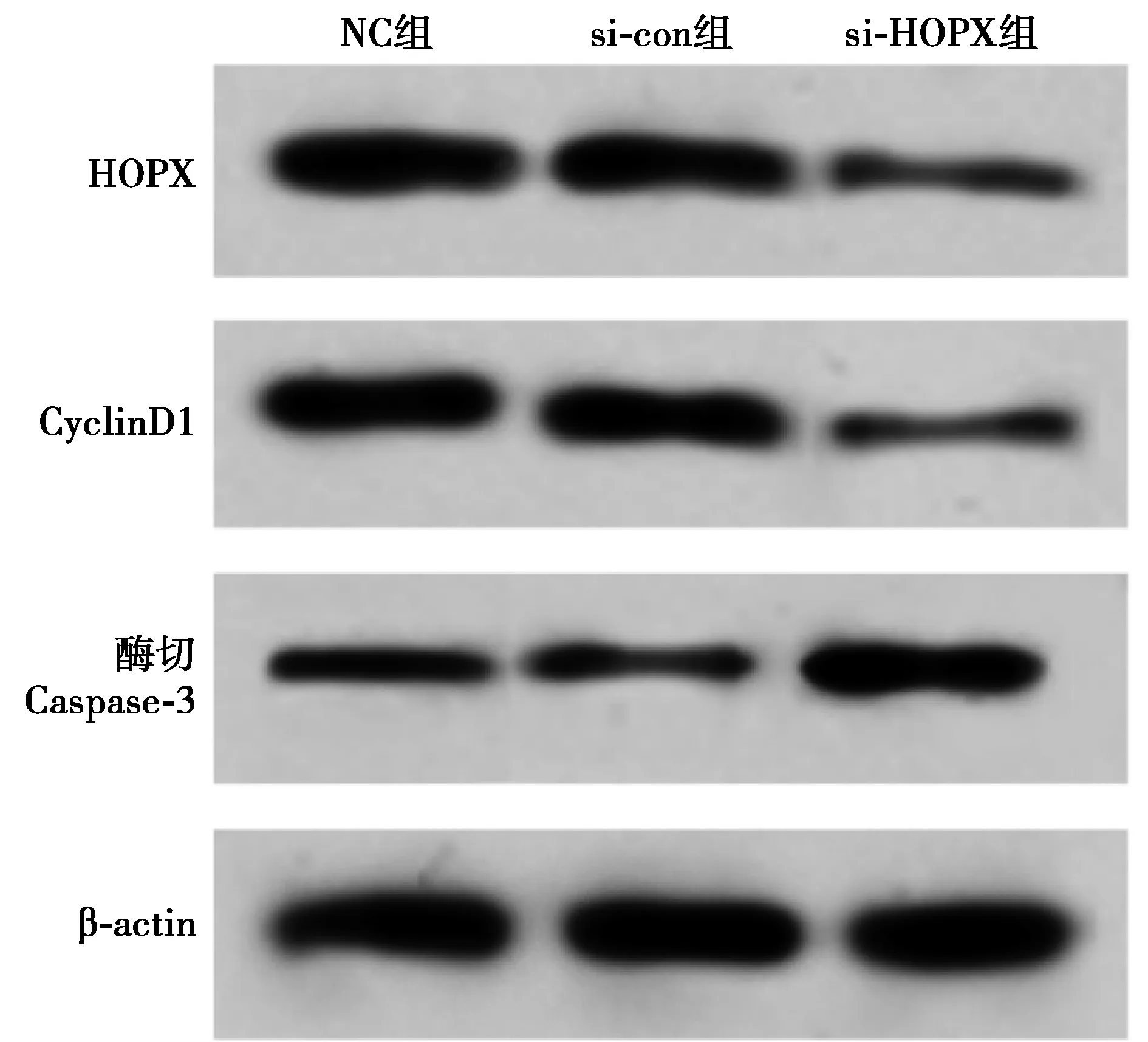
图6 Western印迹检测前列腺癌细胞HOPX、CyclinD1和酶切Caspase-3的表达

表4 干扰HOPX抑制前列腺癌细胞T24 增殖和诱导凋亡的作用
2.5过表达HOPX部分逆转miR-493-5p对前列腺癌细胞T24的抑制作用 与miR-493-5p+pcDNA组相比,miR-493-5p+pcDNA-HOPX组酶切Caspase-3表达水平显著降低,CyclinD1、HOPX表达水平显著升高,48、72 h时细胞活性显著升高,T24细胞凋亡率显著降低(均P<0.05)。见表5,图7。
表5 过表达HOPX部分逆转沉默miR-493-5p抑制前列腺癌细胞T24 增殖和诱导凋亡的作用
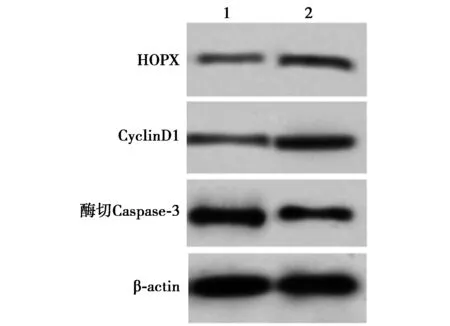
1~2:miR-493-5p+pcDNA组、miR-493-5p+pcDNA-HOPX组图7 Western印迹检测前列腺癌细胞HOPX、CyclinD1和酶切Caspase-3的表达
3 讨 论
前列腺癌发病率逐年上升,有较高的恶性倾向,严重危害男性健康。寻找高特异度、高敏感度的前列腺癌诊断标志物有利于早期诊断与有效治疗〔9〕。miRNA参与调节许多重要的细胞生物学行为,多种miRNA在前列腺癌中异常表达,与前列腺癌的发生、发展密切相关〔10〕。miR-493在前列腺癌中上调表达,miR-493通过靶向PHLPP2并激活Akt信号通路促进前列腺癌细胞的增殖〔11〕;miR-493-5p通过前列腺癌中的AKT/GSK-3β/Snail信号传导抑制上皮间质转化(EMT),在前列腺癌细胞中起肿瘤抑制剂的作用〔12〕。miR-493-5p可减弱人乳腺癌细胞的侵袭性〔13〕;miR-493-5p可抑制肝癌细胞的增殖和侵袭〔14〕。过表达miR-493-5p通过下调KLF5和使PI3K/AKT信号传导途径失活来抑制骨肉瘤细胞的增殖和转移〔15〕。本实验结果表明,在前列腺癌细胞中miR-493-5p显著低表达,过表达miR-493-5p可抑制T24细胞增殖,并促进其凋亡。
HOPX多在人类癌症表观遗传沉默,被认为是肿瘤抑制基因,其启动子甲基化是下调的主要机制;HOPX的表观遗传沉默有加速乳腺癌的侵袭〔16〕,还会促进结肠直肠癌的进展〔17〕。脑胶质瘤患者中HOPX基因甲基化率较高,可能与脑胶质瘤的发生相关〔18〕;较高的HOPX表达与不同的临床和生物学特征相关,并预测新发急性髓细胞白血病的预后不良〔19〕。HOPX在肺癌细胞中通过致癌Ras诱导的细胞衰老发挥肿瘤抑制活性〔20〕。miR-421通过靶向HOPX和调节Wnt/β-连环蛋白信号通路促进非小细胞肺癌的进展〔21〕。本实验结果表明,前列腺癌细胞中HOPX高表达,干扰HOPX可抑制T24细胞增殖,促进细胞凋亡。且miR-493-5p靶向调控HOPX,过表达HOPX能逆转miR-493-5p对T24细胞增殖和凋亡的作用。
