猪伪狂犬病病毒、轮状病毒、传染性胃肠炎病毒和流行性腹泻病毒多重PCR的构建及应用
2022-05-13刘艳成刘艳龙谢家鑫吴玘瑶
赵 娜,刘艳成,刘艳龙,谢家鑫,吴玘瑶,智 宇
(1.兴安盟农牧局综合保障中心,内蒙古 乌兰浩特 137400;2.兴安盟动物疫病预防控制中心,内蒙古 乌兰浩特 137400;3.内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018;4.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031)
相关研究表明,引起猪病毒性腹泻的病原主要有猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒 (Porcine transmissible gastroenteritis virus,TGEV)和 猪 轮 状 病 毒 (Porcine rotavirus,RV)[1]。 自 2013 年以来,伴随猪伪狂犬病病毒新毒株的流行,猪伪狂犬病的发病率呈现明显的上升趋势,特别是在南方省区流行更为严重[2]。猪只感染上述4种病毒后均会出现不同程度的腹泻,仅从流行病学、临床症状和病理变化上很难进行区分[3]。因此,构建一种可同时检测多种目标病毒的诊断方法成为防治该类疾病的重要前提。
本试验根据4种病毒的基因结构,分别设计并合成特异性引物,在单项PCR的基础上不断优化PCR反应体系及反应条件,建立起用于同时检测上述4种疫病的多重PCR方法,意在为临床进行猪腹泻病流行病学调查和快速诊断奠定基础。
1 材料与方法
1.1 病毒来源
猪伪狂犬病毒、猪轮状病毒、猪传染性胃肠炎病毒和猪流行性腹泻病毒均购自中国普通病毒保藏中心;猪呼吸与繁殖障碍综合征弱毒疫苗、猪圆环病毒灭活疫苗、猪瘟活疫苗和猪细小病灭活疫苗,均购自疫苗生产厂家。
1.2 引物设计及合成
根据GenBank收录的PRV的gB基因序列(AF257079.1)、RV的VP6基因序列(JN605419.1)、TGEV的N基因序列(GQ374559.1)和PEDV的M基因序列(JX435317.1)设计特异性引物[4](表1)。 引物由上海生物工程技术有限公司合成。

表1 引物序列及扩增长度
1.3 核酸的提取与反转录
采用病毒核酸(DNA/RNA)提取试剂盒提取病毒DNA和RNA。在冰浴的离心管中加入Random 6 mers(50 μM)1.0 μL,dNTP Mixture(10 μM)1.0 μL,模板RNA 8.0 μL。65℃保温5 min后迅速冰上冷却。简短离心后,加入 4 μL的 5×PrimeScript II Buffer,0.5 μL 的 Rnase Inhibitor(40 U/μL),1.0 μL 的PrimeScript II RTase,轻轻混匀,简短离心收集反应液。30℃温浴10 min,42℃温浴60 min,70℃加热15 min,将所得产物直接进行PCR扩增或-20℃保存。
1.4 优化单项PCR的反应条件
以上述4种病毒的cDNA为模板,利用4对引物进行单项 PCR 扩增,反应体系(25 μL)为:Premix Taq TM 12.5 μL,cDNA 模板 2.5 μL, 上下游引物各 1.0μL,ddH2O补平至25 μL。 扩增程序:94 ℃5 min;94 ℃30 s,51~57 ℃设置梯度退火 30 s,72 ℃延伸 30 s,35个循环;72℃延伸10 min。反应结束后,吸取产物进行电泳检查。
1.4.1 确定单项PCR最佳退火温度。依据4对引物的Tm值,将退火温度设定为51.0℃,51.4℃,52.1 ℃,53.1℃,54.6℃,55.8℃,56.5℃和57.0℃8个梯度。
1.4.2 确定引物最佳浓度和灵敏度。上下游引物各取1.5 μL,1.0 μL,0.5 μL,0.25 μL, 分别采用 104、103、102、101、100稀释度的 cDNA 模板进行滴定,测定 4种病毒的最佳浓度。
1.4.3 特异性鉴定。根据4种病毒的最佳退火温度和引物用量,进行PEDV,TGEV,RV和PRV 4种引物的特异性检查。
1.5 优化多重PCR的反应条件
1.5.1 优化多重PCR退火温度。参考单项PCR的退火温度, 设定51.0℃,51.4℃,52.1℃,53.1 ℃,54.6 ℃,55.8℃,56.5℃和57.0℃ 8个温度梯度。
1.5.2 优化多重PCR引物浓度。根据确定的最佳引物浓度,筛选出多重PCR反应的引物添加量。
1.5.3 多重PCR特异性试验。分别对PRV,RV,PEDV和TGEV混合模板,PPV,PRV,PCV的DNA模板,以及PRRSV,HCV的cDNA模板进行多重PCR特异性检验。
1.5.4 多重PCR敏感性试验。倍比稀释(101~106)4种病毒的核酸模板,测定出最低模板浓度。
1.6 构建多重PCR反应体系
根据所确定的各对引物的最佳浓度、最佳退火温度构建多重PCR反应体系。
1.7 多重PCR与单项PCR的对比
利用建立的多重PCR法和单项PCR法检测60份临床腹泻样品,对两种检测方法进行比较。
2 结果
2.1 确定单项PCR的最佳退火温度
如图1所示,PEDV,TGEV,RV和PRV的退火温度范围均较广,各个温度梯度条带都较为明显,且没有非特异性条带。
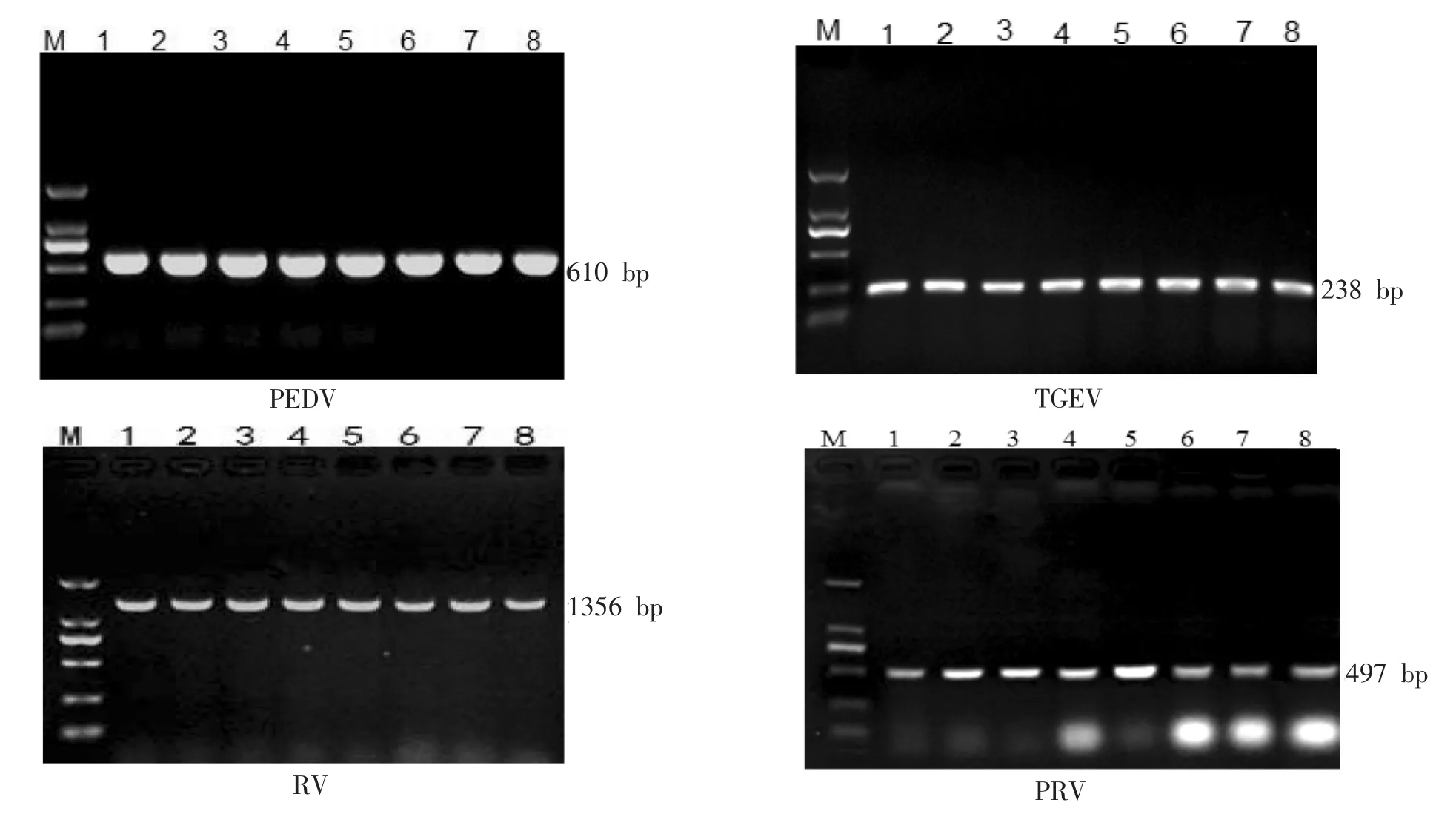
图1 PEDV,TGEV,RV,PRV单项PCR退火温度
2.2 单项PCR的引物浓度及敏感性
由图2可知,PEDV的最佳引物添加量为0.25~1.0 μL(引物终浓度为 0.1~0.4 μM),最低可检测 103稀释倍数的cDNA (32.40 ng/uL);TGEV的最佳引物添加量为 1.0 μL(引物终浓度为 0.4 μM),最低可检测 104稀释倍数的 cDNA(23.31 ng/μL);RV 的最佳引物添加量为 1.0 μL (终浓度为 0.4 μM),最低可检测 103稀释倍数的 cDNA (29.50 ng/μL);PRV的最佳引物添加量为0.25~0.5 μL(终浓度为0.1~0.2 μM), 最低可检测 104稀释倍数的 cDNA(19.87 ng/μL)。
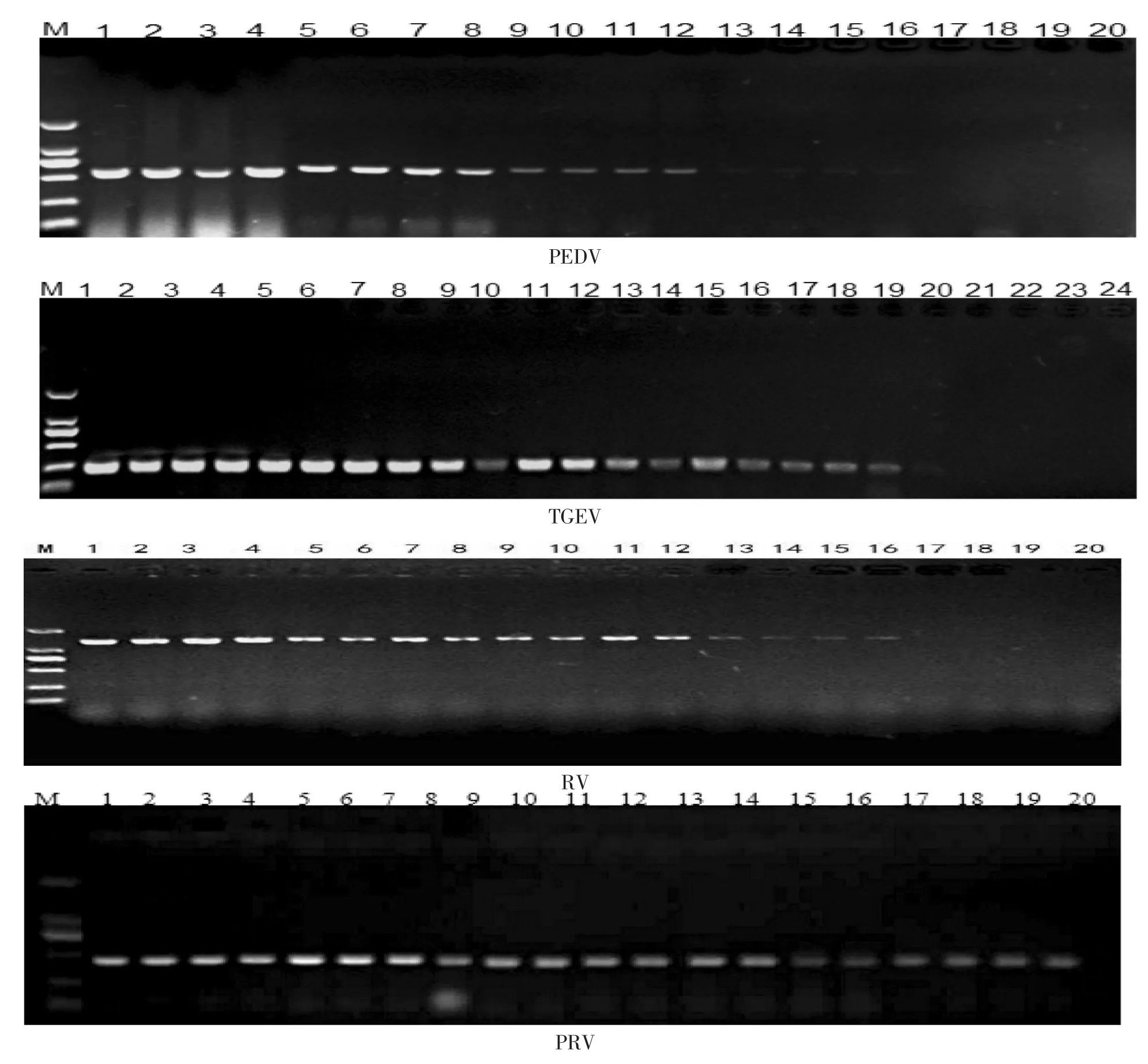
图2 PEDV,TGEV,RV,PRV引物浓度及敏感性的确定
2.3 单项PCR的特异性鉴定结果
PEDV,TGEV,RV和 PRV的 cDNA模板均扩增出与目的片段大小符合的条带,而其他几种病毒均无条带。

图3 单项PCR的特异性
2.4 多重PCR的退火温度
试验结果表明,多重PCR反应的退火温度在51.0~57.0℃的范围内均可扩增出特异性条带,而温度在53.1~57.0℃时扩增效果最好(图4)。
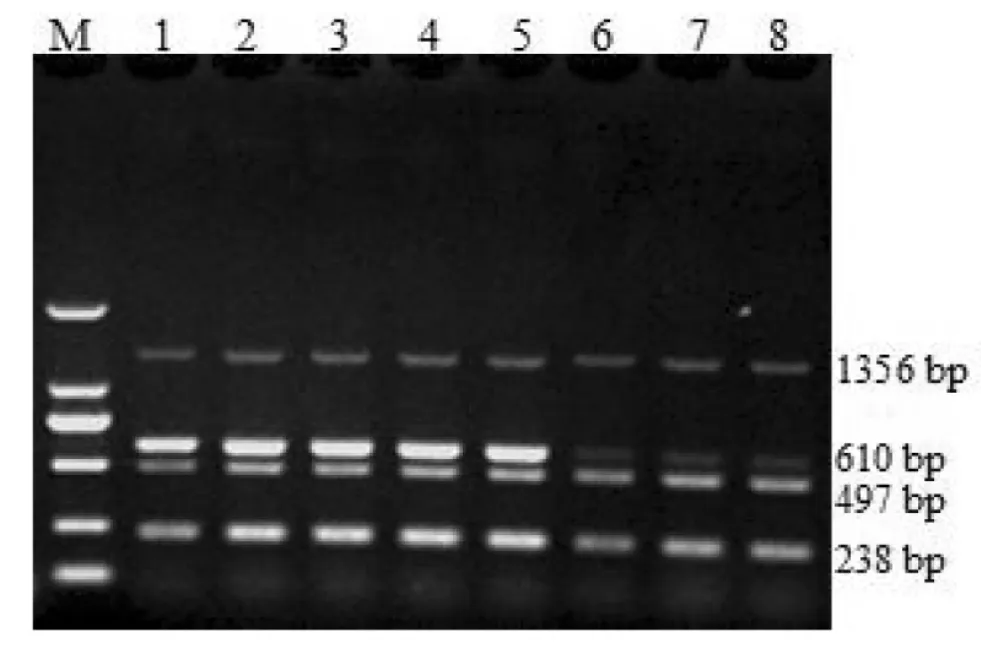
图4 PEDV,TGEV,RV,PRV多重PCR退火温度
2.5 多重PCR的引物浓度
确定引物最佳添加量为:PEDV 0.5 μL(引物最佳浓度为 0.2 μM),TGEV 0.5 μL (引物最佳浓度为0.2 uM),RV 1.0 μL(引物最佳浓度为 0.4 μM),PRV 1.5 μL(引物最佳浓度为 0.6 uM)。
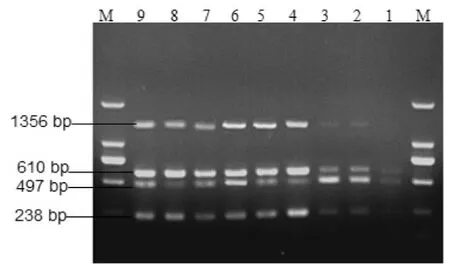
图5 多重PCR的引物浓度优化
2.6 多重PCR的特异性
采用建立的多重PCR方法对4种病毒的混合模板进行扩增,可获得大小分别为610 bp,238 bp,1 356 bp,497 bp的4条清晰的目的条带,但PRRSV,HCV,PPV和PCV均未能扩增出任何条带(图6),证明多重PCR仍具有良好的特异性。
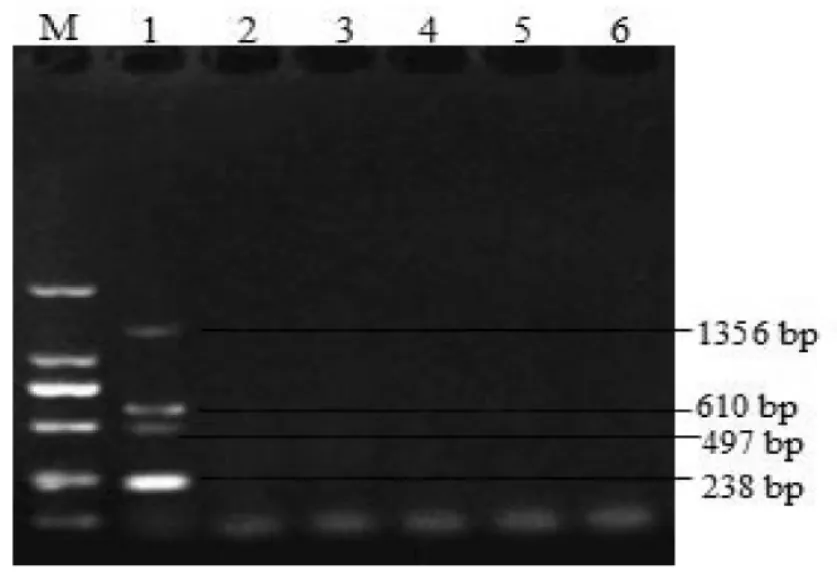
图6 多重PCR的特异性
2.7 多重PCR的敏感性
敏感性试验结果表明,最大稀释倍数为104,酶标仪检测4种病毒的混合cDNA模板及104倍稀释模板的浓度分别为 5.25 μg/μL 和 35.50 ng/μL(见图7)。
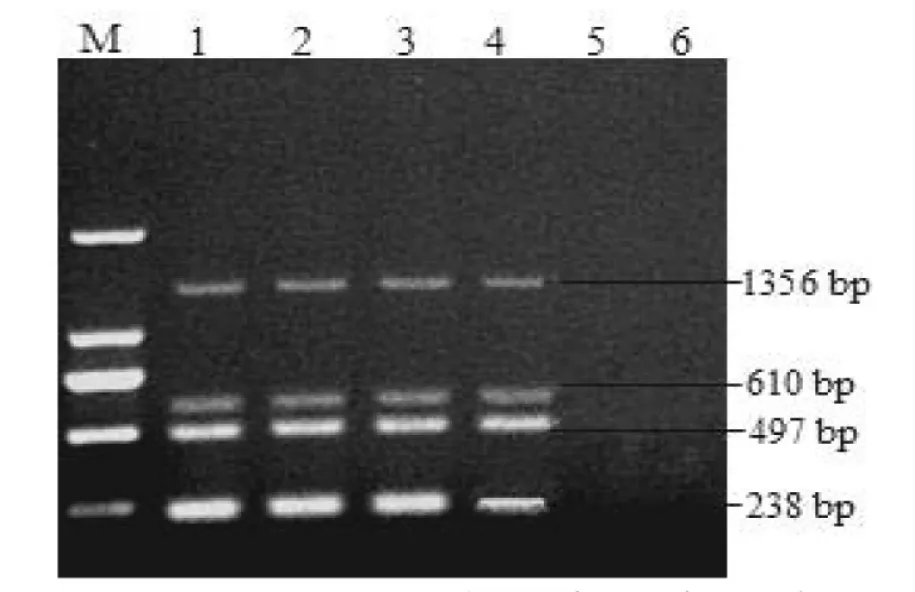
图7 多重PCR的敏感性
2.8 多重PCR的反应体系

表2 多重PCR的反应体系
扩增程序:94 ℃ 5 min;95 ℃ 50 s,57 ℃/53.1 ℃退火 50 s,72 ℃延伸 60 s,38个循环;72℃延伸 10 min,4℃保存。
2.9 多重PCR与单项PCR的临床应用
多重PCR与单项PCR两种检测方法的整体符合率为95%,其中PEDV,TGEV,RV,PRV的符合率分别为96.3%、100%、93.00%和100%,表明建立的多重PCR方法能够用于临床鉴别诊断和流行病学调查。

表3 多重PCR与单项PCR的检测结果比较
3 讨论
随着现代分子生物学检测技术在疫病临床诊断上的广泛应用,多重PCR方法实现了对多种疾病的快速诊断,其显著降低了检测成本和反应时间,为动物疫病的快速控制赢得了宝贵时间。本试验针对引起猪群腹泻的4种主要病毒的保守基因序列,设计了4对特异性引物,扩增产物长度分别为610 bp,238 bp,1 356 bp和497 bp,各目的片段之间的长度差异显著。电泳检测结果表明,4对引物均可扩增出各自的特异片段,且无非特异性扩增。临床应用结果显示,多重PCR检测方法与常规PCR方法的符合率达95.0%,保持了高度一致。特异性试验及灵敏性试验结果均表明,多重PCR检测方法具有敏感性高、特异性强的特点,可应用于临床鉴别诊断。
