ABCA1胞内第三环缺失突变体的抗砷性研究
2022-05-13章云衡狄春红谭晓华
章云衡,狄春红,罗 燕,谭晓华,杨 磊
(1.杭州师范大学 公共卫生学院,浙江 杭州310036;2.杭州师范大学附属医院,浙江 杭州 310015)
ATP结合盒(ATP-binding cassette transporter,ABC)家族介导的多药耐药与生物学体的抗砷功能相关。ABCB1基因,即多药耐药基因(multidrug resistance,MDR1),ABCC1即多药耐药相关蛋白1(multidrug resistance-associated protein, MRP1)可以将砷转运到细胞外,降低胞内的砷的浓度,增加细胞对砷的耐受性。人类ABCA1基因定位于 9q31.1,含50个外显子,ABCA1蛋白质全长2 261个氨基酸,我们之前的研究证实ABCA1是又一重要的细胞抗砷基因,与ABCB1、ABCC1协同发挥作用。ABCA1蛋白共12次跨膜,形成6个胞外环和5个胞内环,其中胞外第一、四、六环和胞内第三环较大,而其他各环包含较少的氨基酸。课题组前期的研究构建了多个ABCA1的突变体,并检测其对ABCA1抗砷性的影响。本研究将构建的ABCA1细胞外第843—1 348位氨基酸密码子缺失的突变体表达载体转染至低表达ABCA1的HeLa细胞中,检测HeLa细胞对砷耐受性及细胞内砷蓄积量。
1 材料与方法
1.1 细胞与质粒 HeLa细胞、pcDNA3.1/V5-His空载体由本实验室保存。大肠杆菌DH5α为分子克隆的受体菌,保存于本实验室中。野生型ABCA1表达质粒pcDNA3.1/V5-His/ABCA1由德国Schimitz Gerd教授惠赠。ABCA1第843—1 348位氨基酸残基缺失突变体(ABCA1△843-1 348)表达载体pcDNA3.1/V5-His/ABCA1△843-1 348由本实验室构建。
1.2 试剂 亚砷酸钠(NaAsO)购自Sigma公司。胎牛血清购自Gibco公司;DMEM高糖培养基购自Hyclone公司。Lipofectamine 2000试剂盒购自Invitrogen公司。ABCA1(AC10)抗体购自Santa cruz biotechnology, inc.。DYLight488标记山羊抗小鼠IgG购自北京中杉金桥生物技术有限公司。CCK-8试剂盒购自碧云天生物技术有限公司。
1.3 激光共聚焦检测蛋白定位 先用75%的酒精浸泡盖玻片过夜,第2天用双蒸水清洗、晾干,置于6孔板内。以5×10细胞/孔接种Hela细胞到6孔板内培养,12 h后采用脂质体法分别转染全长ABCA1、ABCA1△843-1 348突变体和pcDNA3.1/V5-His 空载体至HeLa细胞中。具体过程参考试剂盒说明书操作。培养24 h 后去上清,取出6孔板内细胞爬片,PBS清洗3次,4%多聚甲醛固定15 min,置于载玻片上,加入ABCA1一抗孵育过夜。次日,PBST清洗盖玻片3次,加入DYLight488标记山羊抗小鼠IgG荧光二抗室温避光孵育1 h,封片剂封片。共聚焦显微镜下观察全长ABCA1蛋白和突变体ABCA1蛋白在细胞内的定位。
1.4 CCK-8法检测细胞增殖抑制 pcDNA3.1/V5-His 空载体、ABCA1△843-1 348突变体及全长ABCA1分别转染到HeLa细胞,12 h后收集细胞。收集到的细胞以6×10/孔密度接种Hela细胞到96孔板,培养12 h,然后加入含有不同NaAsO浓度(0、4、8、16、32、64 μM)的培养液,每个浓度5个复孔,继续培养24 h。加入CCK-8试剂10 μL/孔,37℃避光孵育1 h,酶标仪检测OD450值。根据OD450值计算各浓度对应的细胞生存率。生存率计算公式:生存率=(加砷孔OD值-空白培养基OD值)/(对照孔OD值-空白培养基OD值)×100%。根据生存率值计算IC50值。
1.5 细胞内含砷量检测 采用原子荧光吸收光谱法(atomic fluorescence spectrophotometry, AFS)检测细胞内砷蓄积量的变化。HeLa细胞经PBS清洗一遍,收集细胞,计数细胞浓度,然后取离心10细胞。加入浓硝酸消化细胞,用微波消解仪(CEM公司)将所有砷转化为无机砷,加入5%硫脲将砷还原为三价砷,原子荧光分光光度法测定细胞总砷含量。每个时间点做5复孔。

2 结果
2.1 ABCA1△843-1 348突变体蛋白定位 激光共聚焦显微镜下,转染ABCA1△843-1 348突变体与全长ABCA1的HeLa 细胞的细胞膜上均可见目的蛋白(图1)。
2.2 细胞生存率 转染全长ABCA1、ABCA1△843-1 348和空载体的HeLa细胞,在各砷浓度条件下的生存率见表1。根据各砷浓度细胞生存率计算半数抑制浓度IC50值,结果显示:转染空载体细胞IC50值(19.17 μM)低于转染全长ABCA1的细胞(31.64 μM)和转染ABCA1△843-1 348的细胞(29.73 μM),差异有统计学意义(<0.05)。全长ABCA1和突变体ABCA1转染的细胞间的细胞生存率差异无统计学意义(>0.05)。

图 1 激光共聚焦显微镜观察 ABCA1△843-1 348突变体在HeLa细胞中的定位Figure 1 Cellular location of the ABCA1△843-1 348 mutant and full-length ABCA1 detected by confocal microscopy
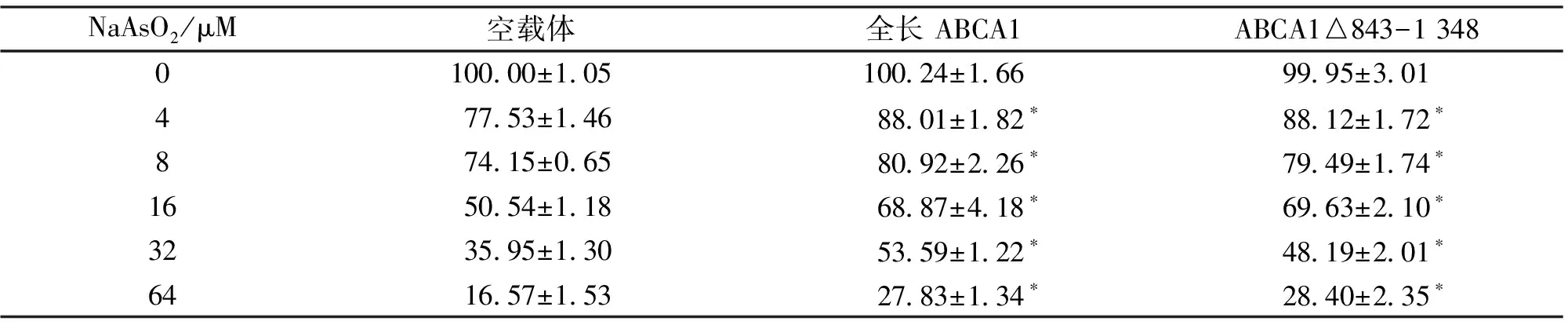
表1 转染全长ABCA1、ABCA1△843-1 348和空载体的HeLa细胞在各砷浓度条件下的生存率(n = 3,%)Table 1 Comparison of survival rates between HeLa cells transfect full-length ABCA1, ABCA1△843-1 348mutant and vector control(n = 3,%)
2.3 各时间点HeLa细胞内的砷含量 10 μM亚砷酸钠处理条件下,转染全长和突变体ABCA1细胞内砷含量在4 h后趋于稳定,而转染空载体的细胞内砷含量仍持续升高。见表2。转染全长ABCA1和ABCA1△843-1 348突变体细胞内各个时间点的砷含量没有差异(>0.05),在砷暴露6、8、10 h的砷含量,均显著低于对应时间点转染空载体组(<0.05)。
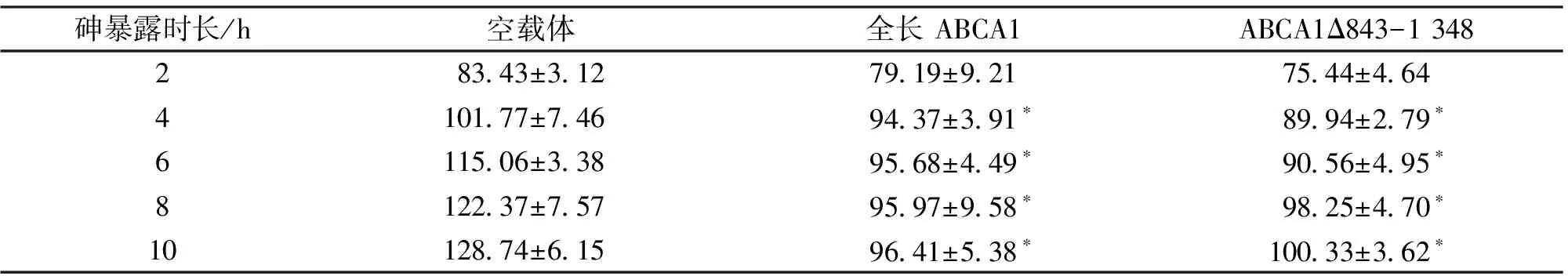
表2 转染ABCA1和空载体的HeLa细胞内各时间点的砷含量 (ng/106个细胞)Table 2 The intracellular arsenic contents in HeLa cells transfected with full-length ABCA1, ABCA1△843-1 348 mutant or vector at each time point (ng/106 cells)
3 讨论
我们前期的研究报道证实ABCA1具有抗砷功能,ABCA1促进砷的排出,增加细胞对砷的耐受。跨膜结构域是ABCA1执行转运功能时关键的结构基础,每个跨膜结构域有6个α螺旋,共12个α螺旋形成了一个允许多种底物通过的孔样跨膜结构。人ABCA1基因定位于 9q31,含有 50个外显子,分子量约为 254 kDa,是一个完全转运蛋白,含2个跨膜结构域,共形成 12个跨膜α螺旋。ABCA1通过α螺旋形成的孔样跨膜结构转运脂质、甾醇、代谢产物以及某些药物等多种底物。相邻α螺旋之间形成 11个大小不同的环状结构。其中胞外第一、四、六环分别含有596、315和61个氨基酸残基,胞内第三环为505氨基酸残基,而其他各个环的长度均较小。为了筛选ABCA1抗砷功能结构域,我们构建了多个ABCA1缺失突变体,其中胞外第一、六环的缺失突变体失去了抗砷功能,而位于胞外第四、五和胞内第四、五环的缺失突变不影响其抗砷功能。本研究构建了ABCA1蛋白第843—1 348缺失突变体,该缺失位于胞内第三环;并检测了该突变体的细胞定位、抗砷功能及细胞内砷含量。
ABCA1是一个跨膜蛋白,正确定位于细胞膜上使其发挥选择性转运底物的基础。本研究在构建缺失突变体时,考虑到缺失可能影响其细胞膜定位,在选择缺失区域时避开了可能影响其细胞膜定位的序列。缺失突变体转染HeLa细胞后,采用激光共聚焦显微镜观察,HeLa细胞本底ABCA1表达水平较低,转染全长和突变的ABCA1均高表达在细胞膜上。另外,CCK-8实验结果显示,转染第843—1 348缺失突变的ABCA1与全长ABCA1组的细胞存活率在各个砷浓度暴露条件下没有差异,均显著高于全空载体转染组。提示第843—1 348位缺失的ABCA1蛋白仍然具有与全长ABCA1相似的抗砷功能,说明该区域不是ABCA1抗砷功能的关键结构域。
课题组早期的研究证实ABCA1通过控制砷的排出提高对砷的耐受性。促进砷的排出也是ABC家族的其他基因(如ABCB1和ABCC1)发挥抗砷功能的重要机制。为研究ABCA1Δ843-1 348突变体对细胞内砷蓄积量的影响,检测了转染不同质粒各组细胞10 μM亚砷酸钠暴露后不同时间点细胞内砷蓄积量,结果显示,各组细胞内的砷含量均随着砷暴露时间的延长而增加。与转染空载体细胞相比,转染全长和突变体ABCA1的细胞内砷蓄积量在4 h后增加缓慢,在6、8、10 h各时间点的砷含量显著低于空载体组。转染全长与突变体ABCA1两组细胞内砷含量在各个时间点均没有差异,表明第843—1 348位氨基酸对ABCA1的排砷的功能影响不大。
综上,ABCA1第843—1 348位氨基酸残基缺失突变对细胞的砷耐受性及细胞内砷含量没有显著影响,提示此段氨基酸残基所在的胞内第三环在ABCA1抗砷功能中的作用有限。
