西红花苷快速抗抑郁作用及其调节mTOR-BDNF信号通路的研究
2022-05-12陈春林胡玲榕童燕灵胡望舒
陈春林,胡玲榕,杨 玲,童燕灵,胡望舒
西红花苷快速抗抑郁作用及其调节mTOR-BDNF信号通路的研究
*陈春林,胡玲榕,杨 玲,童燕灵,胡望舒
(宜春学院化学与生物工程学院,江西,宜春 336000)
探讨不同浓度西红花苷(Crocin)的抗抑郁作用及可能机制。建立皮质酮(CORT)诱导的PC12细胞损伤模型;不同浓度(1、10、30 μmol/L)西红花苷预处理细胞,CCK-8法检测细胞活力,在荧光显微镜下观察细胞突触形态;Western Blot检测细胞BDNF、mTOR蛋白的表达;体外研究中,将40只小鼠分成5组,灌胃生理盐水、CRO10 mg/kg、CRO30 mg/kg、CRO100 mg/kg、氟西汀20 mg/kg后行强迫游泳和悬尾实验,记录其累积不动时间。实验结果表明,西红花苷对皮质酮损伤的PC12细胞有保护作用,且能够改善模型小鼠的抑郁样行为,其机制可能与mTOR-BDNF通路密切相关。
抗抑郁;西红花苷;皮质酮;BDNF;mTOR
抑郁症(Depression)是一种常见的慢性精神疾病,主要表现为心情低落[1]、睡眠障碍、认知功能障碍,严重的患者可能会出现自杀等行为[2]。有研究表明,影响着世界21%人口的抑郁症将成为第三大疾病[3]。单胺氧化酶抑制剂、5-羟色胺再摄取抑制剂、三环类抗抑郁药等为目前临床治疗抑郁症的一线药物。但这些传统的抗抑郁药物作用率低、起效缓慢,不良反应多,不能及时缓解抑郁症患者的痛苦。因此,使用具有抗抑郁作用且安全性较高的中药已经成为治疗抑郁症的新疗法[4]。
临床药物起效缓慢可能与海马神经元再生及可塑性机制有关[5],新蛋白质的合成是形成神经元突触可塑性的关键。哺乳动物雷帕霉素靶蛋白(mTOR)信号通路通过调节下游转录因子表达而促进突触蛋白的合成,从而增加神经突触的可塑性[6]。脑源性神经营养因子(BDNF)是mTOR信号通路的重要调节因子,在促进神经元的生长发育,调节突触的可塑性等方面发挥重要的作用。另有研究表明,西红花苷能显著增加亚急性抑郁模型大鼠海马组织CREB、p-CREB、BDNF和VGF蛋白的表达,提高神经元的兴奋性,从而起到抗抑郁的作用[7]。
西红花苷(Crocin)是从中药材栀子和西红花中提取的主要活性成分之一[8]。大量的临床研究表明西红花苷的药理作用,如抗氧化[9]、抗肿瘤[10]、抗炎[11]、壮阳、保肝利胆及抗糖尿病等。另有研究发现西红花苷在中枢神经系统中具有抗焦虑[12]作用。随机双盲对照实验表明,在治疗轻中度抑郁症方面,西红花苷与丙咪嗪有相当的治疗效果[13]。本实验将探究西红花苷对皮质酮损伤的PC12细胞的保护作用,同时探讨基于mTOR-BDNF信号通路的可能作用机制,其次通过建立小鼠急性抑郁模型,观察其对抑郁样小鼠行为学的影响。
1 材料与方法
1.1 材料
雄性ICR小鼠(湖南斯莱克景达实验动物有限公司);PC12细胞(上海泰然生物科技有限公司);西红花苷(上海源叶生物技术有限公司);皮质酮(阿拉丁生物科技公司);DMEM培养基(1645799)、FBS胎牛血清(GIBCO公司);青霉素、链霉素、胰蛋白酶、牛血清蛋白(BSA)购自索莱宝生物科技公司;盐酸氟西汀;β-actin抗体(Cell Signaling Technology);mTOR抗体(Cell Signaling Technology公司);BDNF抗体(Cell Signaling Technology公司);广谱蛋白Marker(北京索莱宝生物科技有限公司);山羊抗鼠二抗(Jackson ImmunoResearch公司);化学发光底物(Bridgen科技有限公司)。
1.2 细胞培养及分组
1.2.1 细胞培养
PC12细胞培养用含有10%胎牛血清(FBS)、青霉素和链霉素的高糖DMEM培养基,培养箱的培养条件是37℃、5%CO2。处于对数生长期的PC12细胞用于实验。并按照不同组别的要求,对各组细胞进行不同的处理。
1.2.2 CORT损伤模型的建立
取对数生长期的PC12细胞接种于96孔板中,置于CO2培养箱中培养;待细胞贴壁,每孔加入不同浓度皮质酮(50、100、200、300、400、500 μmol/L),继续培养24 h后,用CCK-8法测定细胞存活率,并确定皮质酮损伤PC12细胞的最适浓度以用于后续实验。
实验过程中每组设定6个复孔,平行实验3次。细胞存活率(%)=(OD 实验组- OD 调零组)/(OD 对照组- OD 调零组)×100%。
1.2.3 不同浓度西红花苷对皮质酮损伤的细胞存活率的影响
取对数生长期的PC12细胞按照下列分组接种于96孔板中:①调零组:加入等量培养基。②空白对照组:细胞正常培养,不加任何处理因素。③皮质酮模型组:细胞贴壁后加入适当浓度的皮质酮继续培养24 h。④西红花苷+皮质酮组:细胞贴壁后先加入不同浓度的西红花苷(1、10、30 μmol/L)预处理1 h,再加入适当浓度的皮质酮继续培养24 h。
1.3 CCK-8法检测细胞存活率
取对数生长期的PC12细胞以每孔5000个细胞接种于96孔板中,加入100 μL的细胞悬液,置于CO2培箱中培养;待细胞贴壁后吸弃旧培养基,加入不同浓度药物预处理1 h,再加入适当浓度皮质酮继续培养24 h;每孔加等量的CCK-8试剂,放入细胞培养箱继续培养1-4 h,用酶标仪450 nm波长测定其OD值。实验中设定调零组、空白对照组、皮质酮模型组及药物预处理组,每组设定6个复孔,平行实验重复3次。计算公式为:细胞存活率(%)=(OD 实验组-OD 调零组)/(OD 对照组-OD 调零组)×100%。
1.4 细胞突触形态观察
上述各组细胞接种于6孔板中,按“1.2.3”中的方法对各组细胞进行处理后,于荧光倒置显微镜下观察细胞突触形态并拍照(×20)。神经元计数:每孔随机选取5个视野,定义轴突长度大于细胞体者为阳性,取5个视野的平均数作为该组的实际细胞数。轴突长度的计算:测量每个神经元最长的轴突长度,并随机测量30个神经元,计算轴突的平均长度。实验重复3次。
1.5 Western Blot法检测蛋白的表达
取对数生长期的PC12细胞接种于10 cm2培养皿中,按“1.2.3”中的方法对各组细胞进行处理后,用预冷的PBS缓冲液冲洗3次,加入细胞裂解液后冰上裂解30 min,收集蛋白样品于离心管中,12 000 r/min离心10 min;取上清液,采用Bradford法进行蛋白定量。采用聚丙烯酰胺凝胶电泳(SDS-PAGE),进行抗原抗体反应,用 Alpha Fluor Chem 凝胶成像仪检测化学发光并拍照保存,并用DRAFT-alpha view分析及图像处理软件对保存图像中目的条带进行灰度分析。
目的蛋白相对含量=目的条带灰度值/β-actin 条带灰度值。
1.6 动物分组及给药
强迫游泳实验和悬尾试验各40只小鼠。小鼠适应性培养7 d后,将40只小鼠随机分组:生理盐水组、西红花苷(10、30、100 mg/kg)组、氟西汀组(20 mg/kg),每组8只。各组均灌胃等量的药物。
1.7 行为学实验
1.7.1 小鼠强迫游泳实验
正式实验前一天小鼠预游泳15 min,第二天将小鼠置于实验所在房间适应1 h,给予相应药物30 min后进行6 min的游泳实验,观察小鼠强迫游泳不动时间。使用内径为14 cm,高为20 cm的烧杯,水温(23±2)℃,水深15 cm,以确保小鼠不能通过爪子或尾部触及底部支撑身体。用相机观察6 min,记录后4 min内小鼠的累积不动时间(s)。“不动”是指小鼠在水中不挣扎或仅有微小的肢体运动以保持头部伸出水面。
1.7.2 小鼠悬尾实验
小鼠给予相应药物30 min后,将其尾部2 cm处(距尾根3/4的部位)固定到挂钩上,使小鼠处于倒悬状态,用挡板隔开小鼠的视线,观察6 min,记录后4 min小鼠的累积不动时间(s)。
1.8 统计学处理
以上所有实验数据用均数±标准差(mean±SEM)表示,采用Prism 5统计进行单因素方差分析(one-way ANOVA)。
2 结果
2.1 皮质酮(CORT)损伤PC12细胞模型的建立
实验结果如图1所示,用不同浓度的皮质酮(50、100、200、300、400、500 μmol/L)处理PC12细胞24 h后,细胞存活率随皮质酮浓度的增加而逐渐降低,并呈剂量依赖性。浓度为500 μmol/L的皮质酮对PC12细胞的损伤程度约为50%且比较稳定。根据实验结果采用500 μmol/L的皮质酮作用24 h建立PC12细胞损伤模型。

图1 不同浓度皮质酮对PC12细胞存活率的影响(* P < 0.05, ***P < 0.001与对照组比较)
2.2 西红花苷对皮质酮损伤的PC12细胞存活率的影响
实验结果如图2,与对照组相比,皮质酮模型组的细胞存活率明显降低(< 0.001)。用不同浓度的西红花苷预处理PC12细胞1 h,用500 μmol/L的皮质酮作用24 h,细胞存活率由皮质酮模型组的63.5%(< 0.001)上升为66.8%、79.9%、119.4%(< 0.001)。

图2 西红花苷对皮质酮损伤的PC12细胞存活率影响(###P<0.001,与对照组比较; ***P<0.001,与皮质酮模型组比较)
2.3 西红花苷对皮质酮损伤的PC12细胞神经元突触形态的影响
实验结果如图3所示,各组药物与皮质酮损伤的PC12细胞共培养24 h后,与对照组相比,皮质酮模型组细胞的轴突长度显著降低(<0.001);与皮质酮模型组相比,不同浓度的西红花苷预处理组均能明显增加神经元轴突长度。

2.4 西红花苷对皮质酮损伤的PC12细胞中蛋白表达的影响
2.4.1 西红花苷对皮质酮损伤的PC12细胞中BDNF蛋白表达的影响
与正常组相比,皮质酮处理24 h后,皮质酮模型组BDNF蛋白的表达明显降低(<0.05);与皮质酮模型组相比,不同浓度的西红花苷组能提高损伤细胞中BDNF蛋白的表达,但没有显著性差异。实验结果见图4。
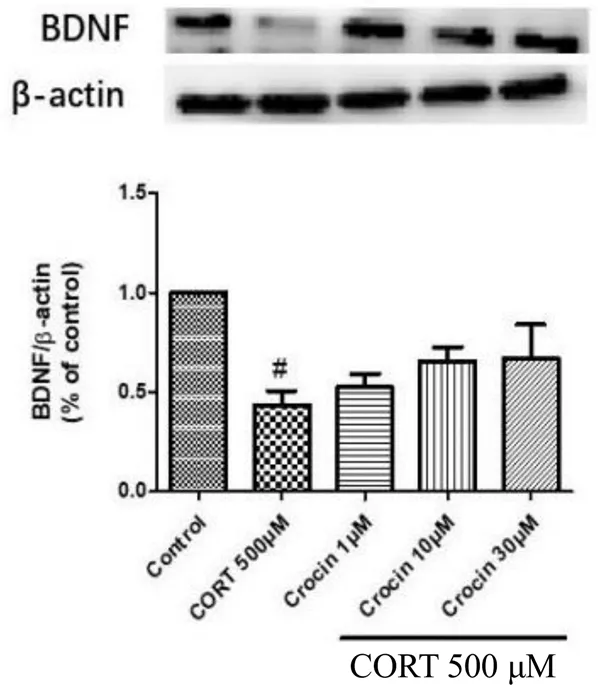
图4 西红花苷对皮质酮损伤的PC12细胞中BDNF蛋白表达的作用(#P< 0.05, 与对照组比较)
2.4.2 西红花苷对皮质酮损伤的PC12细胞p-mTOR蛋白表达的影响
与正常组相比,皮质酮处理24 h后,皮质酮模型组p-mTOR蛋白的表达明显降低(< 0.05),与皮质酮模型组相比,CRO1 μM组、CRO30 μM组能提高损伤细胞中p-mTOR蛋白的表达,但没有显著性差异。实验结果见图5。

图5 西红花苷对皮质酮损伤的PC12细胞中p-mTOR蛋白表达的作用(# P < 0.05, 与对照组比较)
2.5 西红花苷对急性抑郁样小鼠行为学的影响
2.5.1 对强迫游泳累积不动时间的影响
各组给予相应药物30 min后,与生理盐水组相比,西红花苷10 mg/kg组、西红花苷30 mg/kg组、西红花苷100 mg/kg组、氟西汀20 mg/kg组均能明显减少小鼠在强迫游泳中的累积不动时间(< 0.001)。实验结果见图6。
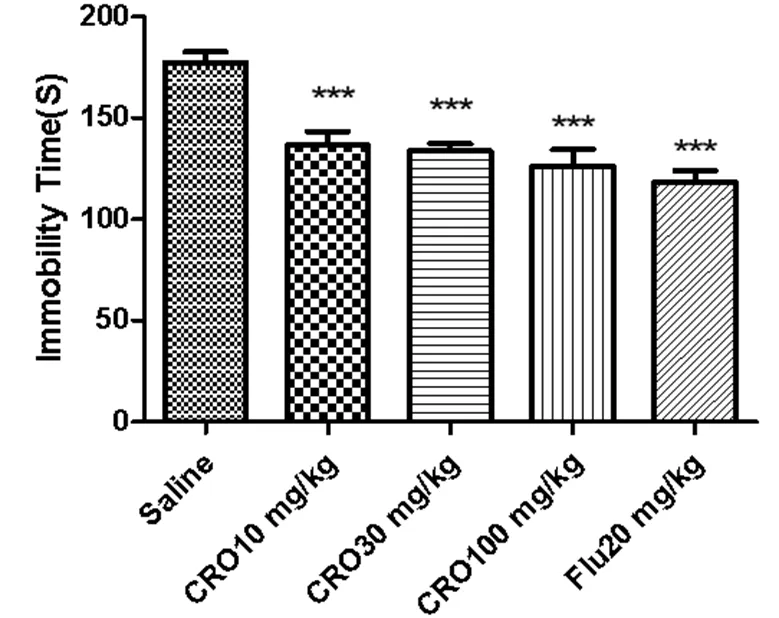
图6 西红花苷对小鼠强迫游泳累积不动时间的影响(***P < 0.001 与生理盐水组比较)
2.5.2 对悬尾累积不动时间的影响
给予相应药物后,与生理盐水组相比,西红花苷10 mg/kg组、西红花苷30 mg/kg组、西红花苷100 mg/kg组、氟西汀20 mg/kg组均能减少小鼠在悬尾中的累积不动时间。实验结果见图7。

图7 西红花苷对小鼠悬尾实验中累积不动时间的影响
3 讨论
抑郁症是一种严重的全球性疾病,全世界的抑郁症病人高达3.5亿。由于传统抗抑郁药物的不良反应多且抑郁症发病机制复杂,学者们开始深入研究中药在抑郁症方面的治疗[14]。研究发现,中药治疗抑郁症的特点体现在其对多个靶点、多个信号通路、多个机制的调节作用[15]。柴胡皂苷能够显著提高抑郁模型大鼠脑内单胺类神经递质的水平,减少神经元的损伤,从而改善抑郁症[16]。另外,五乙酰栀子苷的抗抑郁作用机制可能是调节HPA(Hypothalamic-pituitary-gonadal,HPA)轴的功能,进而改善CUMS大鼠的抑郁样症状[17]。本实验将栀子中的主要效应成分西红花苷作为快速抗抑郁作用的中药分子进行进一步研究。
研究表明西红花苷可以通过上调内源性PACAP的表达来激活ERK和CREB信号通路,进而增强突触可塑性和提高神经元存活率[18]。口服西红花苷能够改善肠道微生物群的结构和屏障功能,减少炎症因子和增加BDNF蛋白表达,以缓解小鼠的抑郁样行为[19]。PC12细胞是一种肾上腺髓质嗜铬瘤细胞,现已广泛用于神经药理学研究。糖皮质激素(Glucocorticoids,GC)持续升高会损伤海马神经元,导致机体神经内分泌系统紊乱,进而造成抑郁症。本实验采用皮质酮建立PC12细胞损伤模型,并发现其对细胞损伤呈浓度依赖性。500 μM皮质酮能显著降低细胞存活率,因此选用此浓度作为后续实验的造模浓度。结果显示西红花苷能显著提高抑郁样PC12细胞的存活率,这表明西红花苷对皮质酮诱导损伤的PC12细胞的保护作用。
强迫游泳实验和悬尾实验是常见的模拟行为绝望实验,用于初步筛选抗抑郁药物[20]。根据实验结果,CRO10 mg/kg,CRO30 mg/kg,CRO100 mg/kg组能明显减少小鼠在强迫游泳实验中的累积不动时间,上述结果表明了西红花苷的抗抑郁作用。
研究表明,抑郁症的发病机制和发病过程与BDNF有关,脑内BDNF含量的降低有可能导致抑郁症的发生[19-20]。BDNF通过与其受体TrkB结合,激活一系列与抑郁症相关的信号通路,进而调节神经元突触的可塑性,进而促进神经元的生长发育。Vahdati等的研究结果显示,西红花苷能以剂量依赖性的方式提高亚急性抑郁模型大鼠脑内的BDNF蛋白水平。研究发现西红花苷能在细胞水平上显著激活PI3K/Akt通路,增加Akt、mTOR和p-p70S6K水平[20]。本实验采用Western Blot法检测PC12细胞中BDNF、mTOR等相关蛋白的表达。实验结果显示,不同浓度的西红花苷均能提高皮质酮损伤的PC12细胞中相关蛋白的表达。
4 小结
本实验结果表明,西红花苷能够减少皮质酮对PC12细胞的损伤,增加细胞中BDNF蛋白以及p-mTOR的表达。此外,灌胃不同浓度的西红花苷,可以显著改善小鼠在急性抑郁模型中强迫游泳的抑郁样行为。但西红花苷的抗抑郁作用具体的信号通路及机制还需要进一步研究。
[1] 李小平,刘文,姚昭,等.井冈山大学医学生抑郁流行病学调查及影响因素分析[J].井冈山大学学报:自然科学版, 2018, 39(1):109-113.
[2] Klerman G L,Weissman M M.The changing epidemiology of depression[J].Clinical Chemistry,1988,34(5):807.
[3] Collins Pamela Y,Patel Vikram,Joestl Sarah S,et al.Grand challenges in global mental health[J]. Nature,2011,475:27-30.
[4] ALZ,ATX,ASW,etal.Curcuminproduces antidepressant effects via activating MAPK/ERK-dependentbrain-derived neurotrophic factor expression in the amygdala of mice[J].Behavioural Brain Research,2012,235(1):67-72.
[5] 孙奕,张志珺.海马神经元再生及可塑性与抑郁症[J].国际精神病学杂志,2007(3):144-147.
[6] 王金梦,杨玉,刘星玥,等.基于信号通路的中药抗抑郁症作用机制研究进展[J].中华中医药学刊,2021,39(1):115-118.
[7] F Vahdati Hassani,Naseri V,Razavi B,et al.Antidepressant effects of crocin and its effects on transcript and protein levels of CREB, BDNF, and VGF in rat hippocampus[J].Daru-journal of faculty of pharmacy,2014,22(1):16.
[8] 李萌,马致洁,章从恩,等.西红花对皮质酮诱导的PC12细胞损伤的保护作用研究[J].世界中医药,2019,14(4):833-838.
[9] Ochiai T,Shimeno H,Mishima K I,et al. Protective effects of carotenoids from saffron on neuronal injury in vitro and in vivo[J].Biochim Biophys Acta,2007,1770(4):578-584.
[10] Abdullaev F I,Espinosa-Aguirre J J.Biomedical properties of saffron and its potential use in cancer therapy and chemoprevention trials[J].Cancer Detection & Prevention,2004,28(6):426-432.
[11] Amin B,Nakhsaz A,Hosseinzadeh H.Evaluation of the antidepressant-like effects of acute and sub-acute administration of crocin and crocetin in mice[J].Avicenna Journal of Phytomedicine,2015,5(5):458-468.
[12] Dorri S A,Hosseinzadeh H,Abnous K,et al.Involvement of brain-derived neurotrophic factor(BDNF) on malathion induced depressive-like behavior in subacute exposure and protective effects of crocin[J].Iranian Journal of Basic Medical Sciences,2015,18(10):958-966.
[13] Akhondzadeh S,Fallah-Pour H,Afkham K,et al.Comparison of Crocus sativus L.and imipramine in the treatment of mild to moderate depression:A pilot double-blind randomized trial [ISRCTN45683816][J]. Complementary and Alternative Medicine,2004,4:12.
[14] 许鹏,章程鹏,周童.中医药改善抑郁症发病机制的研究进展[J].中国实验方剂学杂志,2021,27(9):244-250.
[15] Gill V, Laugharne J,Janca A. Complementary and alternative medicine in the treatment of anxiety and depression[J].Current Opinion in Psychiatry, 2008, 21(1):37-42.
[16] 戈宏焱,陈博,许丹,等.柴胡皂苷A对抑郁模型大鼠脑中单胺类神经递质及其代谢产物含量的影响[J].高等学校化学学报,2008(8):1535-1538.
[17] Ge J F,Peng L,Cheng J Q,et al. Antidepressant-like effect of resveratrol:Involvement of antioxidant effect and peripheral regulation on HPA axis[J].Pharmacology Biochemistry&Behavior,2013, 114-115(Complete):64-69.
[18] Lu L,Wu D,Wang K,et al.Beneficial effects of crocin against depression via pituitary adenylate cyclase-activating polypeptide[J]. BioMed Research International, 2020, 2020(53):1-10.
[19] Qx A,Rs A,Cw A,et al.Crocin-I alleviates the depression-like behaviors probably via modulating "microbiota-gut-brain"axis in mice exposed to chronic restraint stress[J].Journal of Affective Disorders,2020,276:476-486.
[20] 崔广智.芍药苷抗抑郁作用的实验研究[J].现代药物与临床, 2009, 24(4):231-233..
RAPID ANTIDEPRESSANT EFFECT OF CROCIN BASED ON mTOR-BDNF SIGNALING PATHWAY
*CHEN Chun-lin, HU Ling-rong, YANG Ling, TONG Yan-ling, HU Wang-shu
(College of Chemical and Biological Engineering, Yichun University, Yichun, Jiangxi 336000, China)
The objective was to investigate the antidepressant effect and the possible mechanism of crocin at different concentrations. The PC12 cell injury model was induced by corticosterone. The cells were pretreated with crocin at different concentrations (1, 10, 30 μmol/L), and the cell viability was detected by CCK-8 assay. The synaptic morphology of cells was observed under fluorescence microscope. The expression of BDNF and mTOR protein was detected by Western Blot. In thestudy, 40 mice were divided into 5 groups and given normal saline, Cro10 mg/kg, Cro30 mg/kg, Cro100 mg/kg, and fluoxetine 20 mg/kg, and performed with the forced swimming and tail suspension experiments, and the cumulative immobility time was recorded. The results showed that crocin had a protective effect on corticosterone-damaged PC12 cells and improved the depression-like behavior of model mice, the mechanism of which may be closely related to mTOR-BDNF pathway.
antidepressant; crocin; corticosterone; BDNF; mTOR
1674-8085(2022)03-0041-06
R285.5
A
10.3669/j.issn.1674-8085.2022.03.007
2021-05-10;
2022-01-16
国家自然科学基金项目(81560584);江西省2020年大学生创新创业训练计划项目(202010407011)
*陈春林(1984-),男,江西赣州人,副教授,博士,硕士生导师,主要从事神经药理学研究(E-mail:chenchunlinycxy@163.com).
