磁性β-环糊精硅胶基吸附剂制备及吸附性能
2022-05-12王秋玉夏潇枫徐剑桥刘玥乔刘汉林宋燕西1b
王秋玉,夏潇枫,徐剑桥,刘玥乔,刘汉林,宋燕西,1b,2
(1.东华大学 a.环境科学与工程学院,b.国家环境保护纺织污染防治工程技术中心,上海 201620;2.复旦大学 聚合物分子工程国家重点实验室,上海 200433)
染料废水是水体主要的污染源之一,纺织、服装、造纸、印刷等行业常产生大量染料废水[1-2]。很多染料可致癌、致突变,损害人体机能。部分染料进入环境后通常难以光降解和生物降解,此外降解后还可能转变为毒性更大的二次污染物[3-5]。亚甲基蓝(MB)是一种阳离子染料,广泛用于棉、麻和丝等的染色。染料废水中存在的MB会阻碍阳光透过,抑制水生生物光合作用,影响水生生态系统,长时间接触会引起人体健康问题[6]。
吸附法具有高效、易操作和经济实用等优势,是最绿色环保的污染物处理方法[7]。吸附剂是吸附法的关键,不同吸附剂的吸附能力往往存在差异。Nagpal等[8]合成了十二烷基苯磺酸钠改性微球(Hr-SMV)用于吸附去除MB,最大吸附容量为68.8 mg/g;Alinezhad等[9]合成了聚合物磁性勃姆石纳米复合材料(boehmite@Fe3O4@PLA@SiO2),其对MB的最大吸附容量为70.03 mg/g;Arabpour等[10]制备的氧化石墨烯对MB的吸附容量高达1 635 mg/g。
SiO2具有较高的比表面积、良好的化学稳定性和力学稳定性,同时,还具有无毒、低成本、表面改性灵活等优点,因此,SiO2及其改性材料常被用作吸附剂,富集分离水中污染物[11-12]。β-环糊精(cyclodextrin,CD)是由7个D-吡喃葡萄糖单元组成的环状低聚糖,其空腔具有外部亲水、内部疏水的特殊结构,能与不同的化合物形成包合物,常被用作无机材料表面改性剂,还具有来源广、成本低、安全无毒、可生物降解、对环境无二次污染的特点[13]。传统吸附分离往往利用离心或过滤技术使吸附剂与吸附质母液分离,操作较为繁琐。而基于磁性吸附剂的磁分离技术则操作简便,且磁性吸附剂易回收[14-15],因此,越来越受到研究者的关注。在各种磁性材料中,磁性Fe2O3具有制备简单、成本低廉、化学稳定性好等优势。
本研究设计合成基于Fe2O3的磁性β-环糊精硅胶基(m-Fe2O3/β-CD/SiO2)吸附材料,利用溶剂热法获得β-环糊精改性磁性Fe2O3,将其进行简单的溶液共混处理形成磁性β-环糊精硅胶基吸附材料。对磁性β-环糊精硅胶基吸附材料的理化性能进行表征,考察该吸附材料对水中MB的吸附去除性能,研究吸附过程的吸附动力学、热力学及等温方程,为磁性β-环糊精硅胶基吸附剂的制备及其吸附去除水中MB的应用提供参考。
1 试验部分
1.1 仪器与试剂
试验材料:β-环糊精(β-CD)、FeCl3·6H2O、无水乙醇、无水乙酸钠、NH4Cl、十六烷基三甲基溴化铵(CTAB)、Na2SiO3、MB。所有试剂均购自国药集团化学试剂有限公司,且均为分析纯。
试验仪器:X射线衍射仪(Rigaku Ultimate IV型,日本);傅里叶变换红外光谱仪(Tensor27型,德国);比表面积测定仪(ASAP-2460型,美国);扫描电子显微镜(Phenom ProX型,美国);Zeta电位仪(NanoBrook型,美国);紫外可见分光光度计(752 S型;中国上海);调速多用振荡器(HY-4A型,中国常州);控温磁力搅拌器(HJ-3型,中国金坛)。
1.2 m-Fe2O3/β-CD/SiO2的制备
溶剂热法制备β-环糊精改性磁性Fe2O3颗粒(m-Fe2O3/β-CD):在1.35 g的FeCl3·6H2O和3.6 g的无水乙酸钠中加入40 mL的无水乙醇,超声得到橙红色混悬液。将0.2 g的β-CD加入混悬液,搅拌1 h后,转移到聚四氟乙烯内衬的反应釜中,于190 ℃下反应12 h,冷却至室温。利用磁铁收集红褐色颗粒,并用蒸馏水和无水乙醇洗涤,室温干燥,得到红褐色产物m-Fe2O3/β-CD。
溶液共混法制备m-Fe2O3/β-CD/SiO2吸附剂:将0.1 g的CTAB和7.1 g的Na2SiO3溶于含60 mL蒸馏水和15 mL无水乙醇的溶液中,加热搅拌。在40 ℃下,将50 mL浓度为1 mol/L的NH4Cl溶液缓慢滴加入混合溶液,反应获得硅溶胶,再将含0.4 g m-Fe2O3/β-CD的乙醇水溶液(体积比为1∶1)加入该硅溶胶中,搅拌反应一段时间后收集获得的颗粒物,并用蒸馏水和无水乙醇洗涤,置于90 ℃下干燥,得到浅灰褐色的m-Fe2O3/β-CD/SiO2。
1.3 材料结构与性能测试
采用傅里叶变换红外光谱仪分析材料,研究m-Fe2O3/β-CD和m-Fe2O3/β-CD/SiO2的化学组成与结构变化,扫描范围为4 000~400 cm-1;用X射线衍射仪对m-Fe2O3/β-CD和m-Fe2O3/β-CD/SiO2进行物相分析,使用Cu Kα,扫描范围为5°~90°,扫描速率10(°)/min;采用SEM在20 000倍率下观察材料的表观形貌;材料的比表面积及孔径采用BET法进行测定,N2吸附-脱附测试温度为77 K;采用Zeta电位仪在pH值为4.0~10.0时测定m-Fe2O3/β-CD/SiO2表面电荷。
1.4 MB吸附试验
将适量吸附剂m-Fe2O3/β-CD/SiO2加入50 mL一定质量浓度的MB溶液中,一定温度下振荡吸附一定时间,吸附完成后用磁铁将吸附剂与MB溶液分离,利用可见分光光度法在665 nm波长处测定吸附完成后溶液中MB的质量浓度,根据文献[11]分别计算吸附剂对MB的吸附容量(Qt)和去除率(Rt),如式(1)和(2)所示。
(1)
(2)
式中:Qt为t时刻吸附剂对MB的吸附容量,mg/g;ρ0为吸附前溶液中MB的质量浓度,mg/L;ρt为t时刻溶液中MB的质量浓度,mg/L;V为溶液体积,L;m为吸附剂的质量,g;Rt为t时刻染料的去除率,%。
1.4.1 吸附时间对吸附性能的影响
室温下,将10 mg吸附剂m-Fe2O3/β-CD/SiO2加入10 mg/L的MB溶液中,测定不同吸附时间(5~200 min)时吸附剂对MB的吸附容量。
1.4.2 溶液pH值对吸附性能的影响
室温下,用0.1 mol/L的NaOH溶液或0.1 mol/L的HCl溶液调节MB溶液pH值为4.0~10.0,将10 mg吸附剂m-Fe2O3/β-CD/SiO2加入质量浓度为10 mg/L的MB溶液中,吸附120 min,测试溶液pH值对吸附性能的影响。
1.4.3 温度和MB质量浓度对吸附性能的影响
在不同温度(30、40、50 ℃)下,将10 mg吸附剂m-Fe2O3/β-CD/SiO2分别加入不同质量浓度(5~50 mg/L)的MB溶液中,分析温度和MB质量浓度对吸附性能的影响。
1.4.4 共存离子对吸附性能的影响
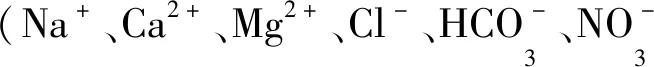
1.4.5 m-Fe2O3/β-CD/SiO2的循环利用及实际应用
循环利用:吸附试验完成后的吸附剂m-Fe2O3/β-CD/SiO2,用蒸馏水和无水乙醇解吸附,得到再生吸附剂,取10 mg再生吸附剂加入质量浓度为10 mg/L的MB溶液中,吸附120 min,完成MB的吸附-解吸-再吸附试验,循环5次。
实际应用:取某湖(121°E,31°N)湖水样品,经0.45 μm滤膜过滤,测定滤液中MB的质量浓度,然后用过滤后的湖水配制已知质量浓度的MB湖水溶液,加入吸附剂m-Fe2O3/β-CD/SiO2,吸附120 min,计算湖水中MB去除率。
2 结果与讨论
2.1 材料的表征
m-Fe2O3/β-CD和m-Fe2O3/β-CD/SiO2的X射线衍射分析结果如图1所示。
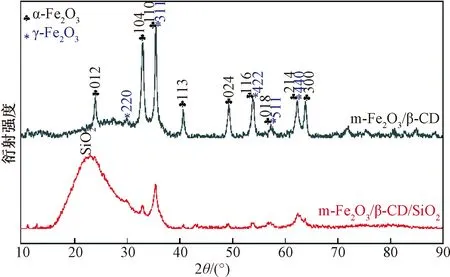
图1 m-Fe2O3/β-CD和m-Fe2O3/β-CD/SiO2的XRD图Fig.1 XRD patterns of m-Fe2O3/β-CD and m-Fe2O3/β-CD/SiO2
由图1可知:衍射峰2θ=24.1°,33.1°,35.6°,40.8°,49.4°,53.9°,57.4°,62.8°和63.9°分别对应α-Fe2O3(PDF#33-0664)的(012),(104),(110),(113),(024),(116),(018),(214)和(300)平面;在2θ=30.2°,35.6°,53.9°,57.4°和62.8°处的特征衍射峰分别对应于γ-Fe2O3(PDF#39-1346)[16]的(220),(311),(422),(511)和(440)平面。因此,两种材料中都含有α-Fe2O3和γ-Fe2O3。同时,制备的m-Fe2O3/β-CD和m-Fe2O3/β-CD/SiO2呈现褐色并具有磁性,说明生成了磁性Fe2O3。图1中m-Fe2O3/β-CD/SiO2的XRD图显示,2θ=10°~25°处有明显的非晶SiO2凸起[17],表明样品中存在非晶SiO2。XRD图谱分析表明,合成的吸附剂m-Fe2O3/β-CD/SiO2含有磁性Fe2O3和SiO2。
β-CD、m-Fe2O3/β-CD和m-Fe2O3/β-CD/SiO2的傅里叶变换红外光谱如图2所示。图2显示:m-Fe2O3/β-CD/SiO2的红外图谱中3 390 cm-1处的宽吸收峰由β-CD的O—H对称伸缩和表面吸附的水分子的O—H引起;2 925和2 850 cm-1处的峰为β-CD中的C—H不对称和对称伸缩振动峰[18];1 647、1 421 cm-1处的峰分别为H—O—H的弯曲变形吸收峰[19]和-CH2的面内弯曲振动吸收峰;1 028和1 180 cm-1处的峰为β-CD分子C—O—C伸缩振动和C—O伸缩振动吸收峰[18]。结果表明β-CD被成功引入m-Fe2O3/β-CD/SiO2中。m-Fe2O3/β-CD和m-Fe2O3/β-CD/SiO2图谱中582 cm-1处的吸收峰归因于Fe2O3的Fe—O伸缩振动[19];m-Fe2O3/β-CD/SiO2图谱中的1 095和802 cm-1处分别对应SiO2中Si—O—Si反对称振动吸收峰和对称振动吸收峰;960和455 cm-1处分别为Si—OH和Si—O的振动吸收峰[17,20]。结果表明,成功合成吸附剂m-Fe2O3/β-CD/SiO2。
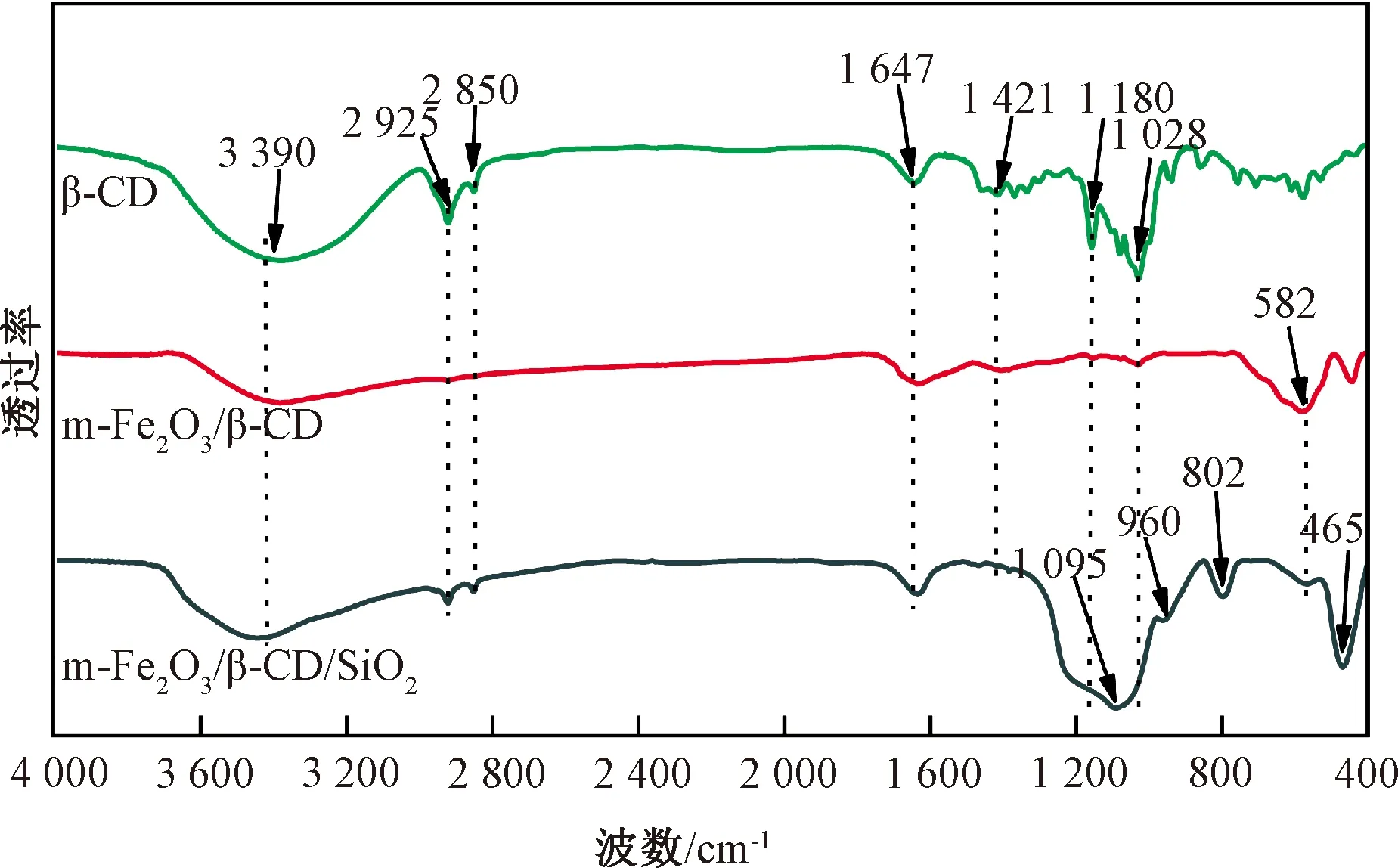
图2 β-CD、m-Fe2O3/β-CD和m-Fe2O3/β-CD/SiO2的傅里叶变换红外光谱Fig.2 FT-IR spectra of β-CD,m-Fe2O3/β-CD and m-Fe2O3/β-CD/SiO2
利用BET法测得m-Fe2O3/β-CD和m-Fe2O3/β-CD/SiO2的比表面积分别为84.8和100.5 m2/g,结果显示,引入SiO2后,m-Fe2O3/β-CD/SiO2相比m-Fe2O3/β-CD的比表面积增加了15.7 m2/g,比表面积增加更有利于吸附作用的增强。
m-Fe2O3/β-CD/SiO2的SEM表征结果如图3所示。由图3可知,m-Fe2O3/β-CD/SiO2的颗粒呈不规则的球形,颗粒层叠,表面有褶皱,主要粒径为150~200 nm。由于吸附材料具有小的粒径和丰富的表面褶皱,有利于获得大的比表面积,因而有利于提高吸附性能。

图3 m-Fe2O3/β-CD/SiO2的扫描电子显微镜图Fig.3 SEM image of m-Fe2O3/β-CD/SiO2
2.2 吸附动力学分析
图4显示了不同吸附时间对m-Fe2O3/β-CD/SiO2吸附性能的影响。由图4可知,在吸附过程的前60 min,吸附剂对MB的吸附容量增加较快,之后吸附容量增加变缓,在120 min后,其吸附容量几乎没有变化,说明120 min时达到吸附平衡。这是因为在吸附初始阶段,吸附剂表面有大量未被占据的活性位点,可与染料分子发生作用,同时,溶液中MB质量浓度比吸附剂表面的MB质量浓度大,质量浓度梯度较大,有利于MB向吸附剂表面扩散,所以吸附初始阶段吸附速率较大;而随着MB不断向吸附剂表面聚集,吸附剂表面的活性位点不断被占据,质量浓度梯度减小,使得吸附速率降低;最终,当MB在吸附剂表面的吸附和解吸附速率相等时,吸附达到平衡。
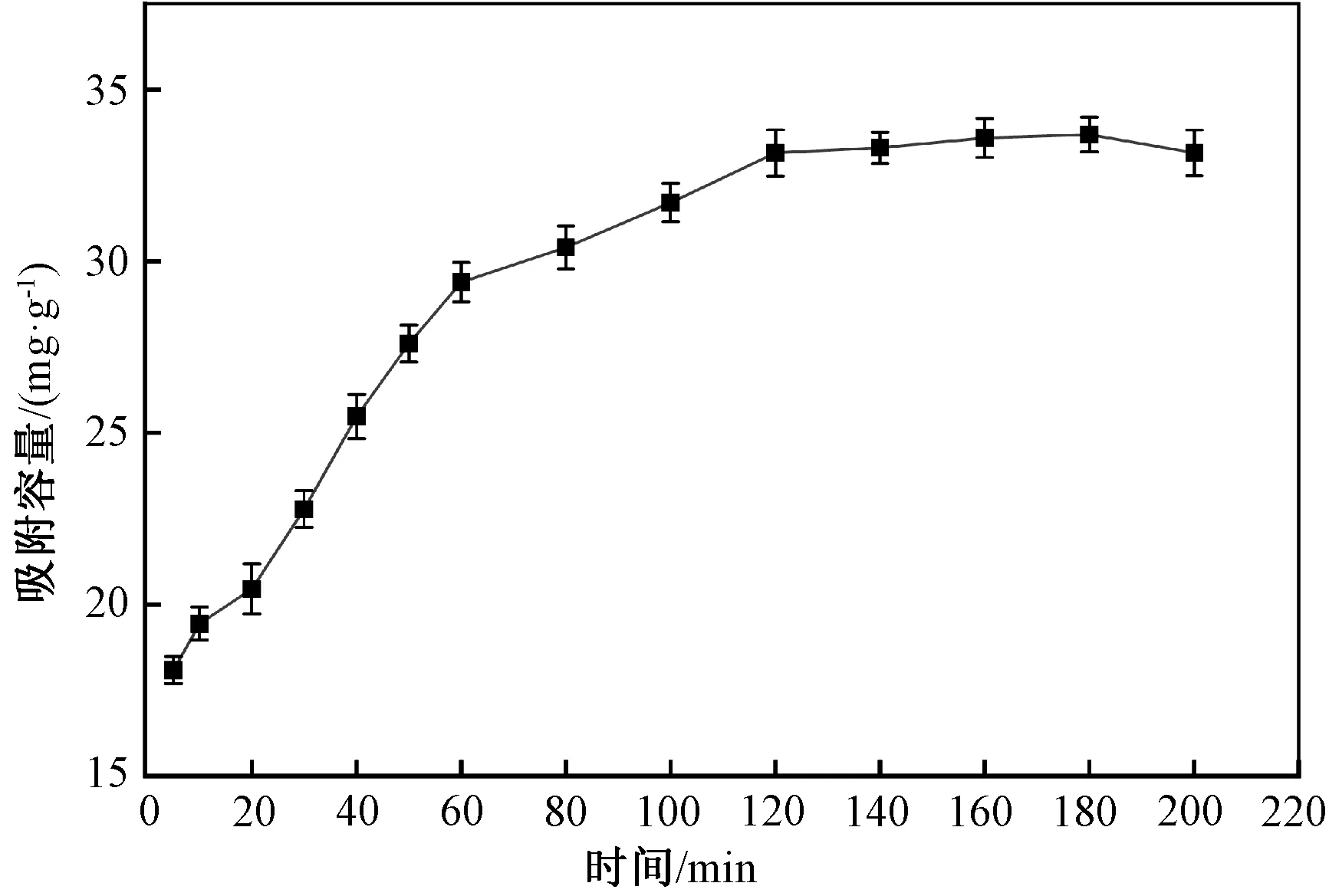
图4 不同吸附时间的吸附效果Fig.4 Effect of adsorption time on adsorption effect
根据文献[11,21],利用准一级动力学方程式(3)和准二级动力学方程式(4)对数据进行线性拟合,进行吸附动力学分析。
ln(Qe-Qt)=-K1t+lnQe
(3)
(4)
式中:Qe为吸附剂达到吸附平衡时的吸附容量,mg/g;Qt为任意t时刻的吸附容量,mg/g;t为吸附时间,min;K1为准一级动力学方程的吸附速率常数,min-1;K2为准二级动力学方程的吸附速率常数,g/(mg·min)。
表1为吸附剂m-Fe2O3/β-CD/SiO2试验数据的准一级和准二级动力学拟合结果。由表1可知,利用准二级动力学方程拟合的相关系数平方r2=0.996 7,大于准一级动力学方程的拟合结果。由此说明,m-Fe2O3/β-CD/SiO2对MB的吸附过程更符合准二级吸附动力学,吸附过程以化学吸附为主,MB与吸附剂之间的相互作用包括:包合作用、氢键作用、疏水相互作用和静电相互作用。

表1 吸附过程准一级和准二级吸附动力学拟合参数Table 1 Pseudo-first and pseudo-second adsorption kinetics fitting parameters
2.3 pH值对吸附性能的影响
测定了不同pH值溶液中吸附剂m-Fe2O3/β-CD/SiO2的Zeta电位,结果如图5所示。
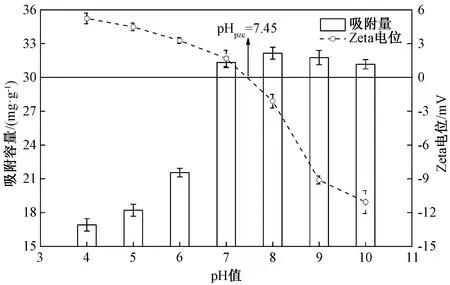
图5 溶液pH值对m-Fe2O3/β-CD/SiO2表面Zeta电位 和吸附性能的影响Fig.5 The effect of pH on adsorption capacity and Zeta potential of m-Fe2O3/β-CD/SiO2
由图5可知,随着溶液pH值由4.0增加到10.0,Zeta电位不断降低,吸附剂表面所带电荷由正变负,当pH为7.45时,吸附剂表面不带电荷,吸附剂的零电荷点(pHpzc)为7.45。此外,溶液pH值对MB吸附容量也有一定影响:pH值从4.0增加到8.0时,MB的吸附容量逐渐增加;pH值为8.0时吸附容量达到最大;当pH值从8.0增加到10.0时,MB的吸附容量变化很小,略有降低。由于阳离子染料MB的pKa为2.6和11.2,在pH值为4.0~10.0的溶液中,MB主要以阳离子形态存在。当pH值低于pHpzc时,吸附剂表面带正电荷,与溶液中大量存在的带正电荷的阳离子染料MB之间存在静电排斥力,导致染料的吸附容量低。当pH值在pHpzc=7.45附近时,吸附剂不带电荷,此时,吸附剂与吸附质MB之间的包合作用、氢键及疏水相互作用增强,吸附容量达到最大,吸附剂的吸附性能最好。当溶液pH值大于pHpzc时,吸附剂表面带负电荷,由于静电吸引作用,MB在m-Fe2O3/β-CD/SiO2上的吸附作用相对酸性条件下有所增强。
2.4 吸附热力学分析
分析MB平衡质量浓度及试验温度对m-Fe2O3/β-CD/SiO2吸附性能的影响,结果如图6所示。由图6可知:随着MB平衡质量浓度的增加,吸附容量不断增加,但当MB平衡质量浓度达到一定值时,吸附容量不再变化,吸附达到饱和;随着温度由30 ℃升高到50 ℃,吸附剂对MB的吸附容量降低。这可能是因为,随着温度的升高,MB的溶解度增加,MB与吸附剂之间的包合作用、氢键及疏水作用减弱,结果使吸附容量随温度的升高而降低。
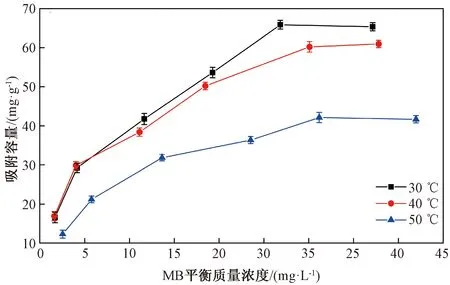
图6 MB平衡质量浓度及试验温度对 m-Fe2O3/β-CD/SiO2吸附性能的影响Fig.6 Effect of equilibrium concentration of MB and temperature on adsorption property of m-Fe2O3/β-CD/SiO2
根据文献[21],分别利用Langmuir吸附等温模型方程式(5)和Freundlich吸附等温模型方程式(6)对吸附数据进行拟合,拟合结果见表2。
(5)
(6)

由表2可知,在试验温度下Langmuir模型拟合的r2值均高于Freundlich吸附等温模型的r2值,说明Langmuir模型可以更好地描述MB分子的吸附,MB在吸附剂表面的吸附为单分子层吸附过程。m-Fe2O3/β-CD/SiO2在30、40和50 ℃时对MB的最大吸附容量分别为80.00、72.46和48.54 mg/g。利用Freundlich模型拟合的r2值均大于0.95,也能较好地描述MB的吸附过程,并且n>1,表明m-Fe2O3/β-CD/SiO2对MB是优惠吸附,可见m-Fe2O3/β-CD/SiO2和MB之间有强的亲和力[22]。

表2 Langmuir和Freundlich吸附等温模型的拟合参数Table 2 Adsorption isotherm parameters for MB on m-Fe2O3/β-CD/SiO2
根据方程式(7)和(8)[21]计算得到吸附剂m-Fe2O3/β-CD/SiO2吸附MB的热力学参数。
ΔG=-RTlnKc
(7)
(8)
式中:ΔG为标准吉布斯自由能变,kJ/mol;ΔH为标准摩尔焓变,kJ/mol;ΔS为标准摩尔熵变,J/(mol·K);R为摩尔气体常数,数值为8.314 J/(mol·K);T为吸附温度,K;Kc为热力学平衡常数。
m-Fe2O3/β-CD/SiO2吸附MB的热力学参数计算结果如表3所示。由表3可知:mFe2O3/β-CD/SiO2吸附MB过程的ΔG值均为负数,表明吸附过程是自发进行的;ΔH<0表明m-Fe2O3/β-CD/SiO2吸附MB的过程是放热的,升高温度不利于吸附;ΔS<0表明溶液/固体界面的吸附随机性减小。
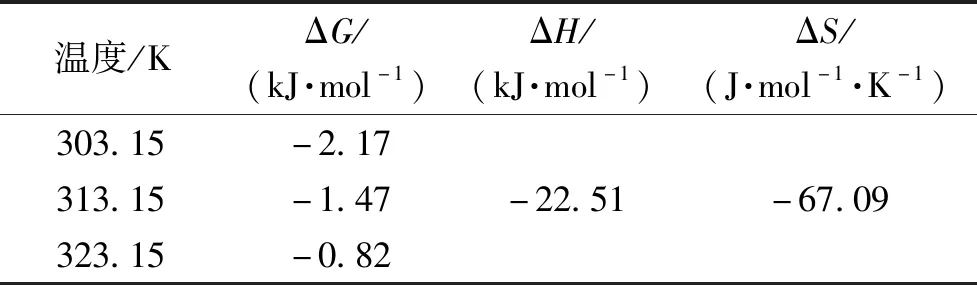
表3 m-Fe2O3/β-CD/SiO2吸附MB的热力学参数Table 3 Thermodynamic parameters of MB adsorption on m-Fe2O3/β-CD/SiO2
2.5 共存离子对m-Fe2O3/β-CD/SiO2吸附MB的影响
共存离子对m-Fe2O3/β-CD/SiO2吸附MB的影响如图7所示。由图7(a)可知,当溶液中阳离子Na+、Mg2+和Ca2+的浓度从0增加到0.20 mol/L时,吸附剂对MB的吸附容量分别降低了8.5、13.0和15.6 mg/g。当离子浓度相同时,二价阳离子Ca2+和Mg2+对m-Fe2O3/β-CD/SiO2吸附容量的影响大于一价阳离子Na+。这是因为金属离子可与β-CD形成配合物,二价阳离子Ca2+和Mg2+与MB的竞争吸附比一价Na+强。同时,阳离子也可能会引起材料发生团聚,使吸附位点减少。Van Olphen[23]研究发现阳离子分散作用大小顺序为Na+>Mg2+>Ca2+,由此可知,Ca2+对吸附材料的团聚作用更明显。Ca2+对吸附容量的影响大于Mg2+,这可能是由于Ca2+的离子半径大于Mg2+,吸附剂表面的Ca2+产生的空间位阻较大,不利于染料被吸附。结果表明,阳离子的离子半径和所带电荷数差异可能是影响MB吸附的主要因素。由图7(b)可知,随着阴离子浓度的增加,m-Fe2O3/β-CD/SiO2对MB的吸附容量降低,影响的程度依次为CO32->NO3->HCO3->Cl-。

图7 不同阳离子和不同阴离子对m-Fe2O3/β-CD/SiO2 吸附性能的影响Fig.7 Effect of different cations and anions on adsorption performance of m-Fe2O3/β-CD/SiO2
2.6 m-Fe2O3/β-CD/SiO2的循环利用
m-Fe2O3/β-CD/SiO2循环利用对吸附容量的影响如图8所示。由图8可知,经过5次吸附-解吸附循环使用,m-Fe2O3/β-CD/SiO2的吸附容量略有下降,循环使用5次后,吸附容量为初次使用吸附容量的71.42%,表明该吸附剂有较好的循环利用性能。
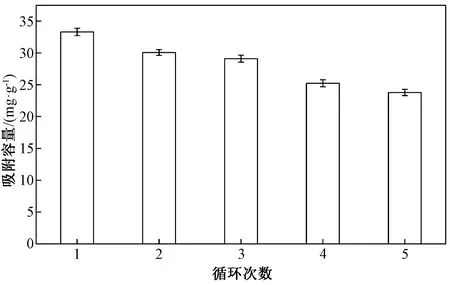
图8 m-Fe2O3/β-CD/SiO2循环利用对吸附容量的影响Fig.8 The recyclability of m-Fe2O3/β-CD/SiO2 on the adsorption capacity
2.7 m-Fe2O3/β-CD/SiO2的实际吸附效果
将吸附剂m-Fe2O3/β-CD/SiO2用于湖水样品中MB的吸附去除,当MB质量浓度为20 mg/L时,m-Fe2O3/β-CD/SiO2对湖水样品中MB的去除率是蒸馏水中MB去除率的84.10%,表明m-Fe2O3/β-CD/SiO2具有较好的实际应用性能。
另外,将本文制备的吸附剂m-Fe2O3/β-CD/SiO2与现有文献中的吸附剂对MB的吸附容量情况进行对比,具体结果如表4所示。由表4可知,本文制备的吸附剂m-Fe2O3/β-CD/SiO2吸附容量优于表中大多数文献值。
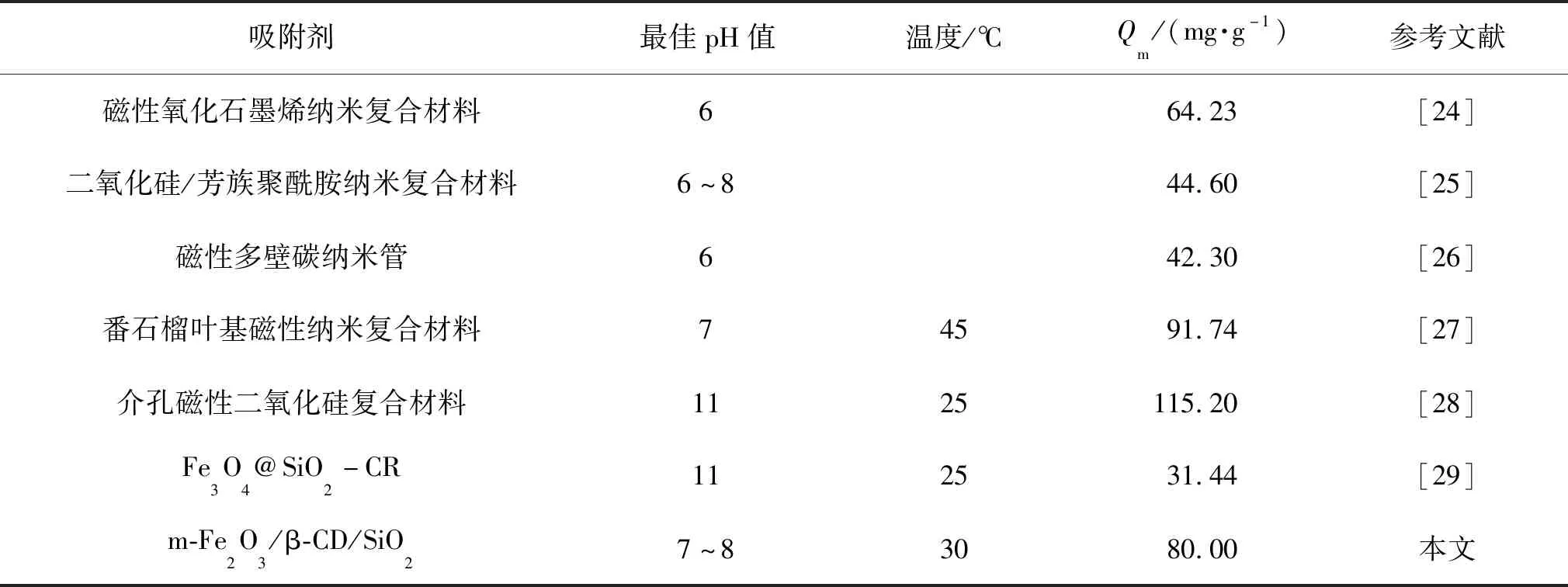
表4 本文吸附剂与现有文献吸附剂对MB的吸附容量Table 4 The adsorption capacity of MB on the adsorbents in literatures and in this paper
3 结 论
(1)采用简单的溶剂热法结合溶液共混法,制备得到可有效吸附去除水中MB的新型纳米磁性β-环糊精硅胶基吸附剂m-Fe2O3/β-CD/SiO2。
(2)m-Fe2O3/β-CD/SiO2对MB的最大吸附容量为80.00 mg/g,吸附过程符合准二级动力学和Langmuir吸附等温模型。
(3)m-Fe2O3/β-CD/SiO2对MB的吸附-解吸附试验表明,循环使用5次后,其对MB的吸附容量仍能达到初次使用的71.42%,有良好的可重复利用性能。
(4)m-Fe2O3/β-CD/SiO2吸附剂能较好地去除湖水中的MB,显示该吸附材料在吸附去除水中MB以及样品富集分离前处理等方面有良好的应用前景。
