根性状的共变性和可塑性驱动不同水稻基因型对氮环境的适应性
2022-05-11高剑飞张家铱李洪波刘碧桃
高剑飞,韩 飞,张家铱,夏 蕾,吉 卉,李洪波,刘碧桃*
(1 山西农业大学林学院,山西太谷 030801;2 中国农业科学院农业环境与可持续发展研究所,北京 100081)
氮素是作物需求量最大的矿质元素,也是作物生产重要的限制因子。肥料在保障我国粮食安全中起着不可替代的支撑作用,同时化肥养分利用率低又会对环境产生不良影响[1],如水体富营养化[2],农田土壤酸化[3]等。目前,世界氮肥的平均利用率为40%~60%,而我国仅为30%左右[4]。全国每年通过淋溶和气态损失的化肥氮量约为900万t,价值50亿美元。农田生态系统仍有一半左右的氮肥发生了损失,作物氮肥利用率没有得到显著提高[4]。因此,降低氮肥施用、提高氮肥利用率是我国农业面临的重大问题,而选育合理的作物品种(如耐低氮品种)是实现肥料减施增效、农业绿色发展的重要手段和基础。
根系是作物获取土壤资源的器官,其变化特征是决定作物养分吸收效率的基础。在低养分环境中,作物往往通过调节根系形态及生长性状,以增加对养分的吸收面积来提高养分获取效率。例如,在逆境环境中,作物可以提高根系的碳投入量(如提高根冠比或总根长)、减小根系直径和根组织密度来降低根系的构建成本,以扩大根吸收面积来适应环境[5-7]。而不同植物种类或同一植物种类的不同基因型在适应低养分环境时往往采取改变不同的根系性状组合,体现出差异较大的根系可塑性[8],进而造成地上部养分吸收效率的巨大差异。
具有较强资源获取能力的植物(资源获取策略)可能具有较长的总根长和比根长,以及较低的根组织密度;相反,资源获取能力较弱的植物(资源保守策略)可能具有更高的根构建成本和更长的根寿命。因此,不同植物种类[9]或基因型[8]之间特定根性状的高度变异是不同养分觅取策略的重点。例如,根较细的作物往往更依赖于它们根形态的变化(如大的比根长),这种形态通过增加土壤勘探面积来增加养分(包括氮)的获取,表明是一种资源获取策略;相反,根较粗的作物可能更依赖其共生的丛植菌根真菌以弥补根吸收面积较低的不足[9]。当前,大多数研究都集中在个体根性状的可塑性上[10-12]或物种间根可塑性的种间变异[9,13-14]。而对于同一作物的不同基因型,各根系功能性状如何变化以提高植物的耐低氮环境仍然缺乏系统的研究。
根系形态特征与其功能相匹配所表现出的状态即为根系表型。最近,Milla等[15]发现,与育种改进后的现代品种相比,其野生型的植株不同功能性状之间具有更紧密的联系。由于驯化后的植物逐渐从资源保守策略转向资源获取策略[16],这可能意味着具有资源获取策略的基因型其性状的共同变异能力降低[17]。因此,资源保守策略的基因型,其根系不同性状间的相关性应该比资源获取策略的基因型更紧密。此外,功能性状之间的共同变异通常随着环境胁迫程度的降低而降低[18-19],因此,与获取策略的基因型相比,氮添加可能会导致保守策略的基因型其根性状的共变强度降低。到目前为止,大多数研究都集中在植物地上性状的共变上,很少研究氮供应的强弱影响不同基因型其根系性状的变化及其关联,以及性状间的这种相关性如何影响植物地上部的适宜性。
水稻是世界三大粮食作物之一,为了应对缺氮胁迫,水稻植株通过改变根系性状来增加对氮的吸收[20]。然而,很少有研究系统地考虑植株形态和生长性状之间的相互作用,以及水稻根系性状的可塑性和性状共变性对不同氮环境的响应。为了解决这些问题,本研究对12个氮敏感度不同的水稻基因型进行了系统地研究。目的是为了验证:1)不同氮敏感度的水稻基因型,其根系的养分获取策略是否存在差异;2)高氮敏感的基因型是否比低氮敏感的基因型具有更高的根系性状可塑性;3)氮供应环境是否会调节不同水稻基因型其根系性状的共变性。
1 材料和方法
1.1 试验布置
本试验样地设置在宁夏引黄灌区青铜峡市叶盛镇宁夏正鑫源农业发展集团水稻种植基地(106°11′57″E,38°07′32″N),该地区属于典型的温带大陆性干旱气候,年均温为8.9℃,年均降水量为180 mm,平均海拔约为1100 m。供试土壤类型为灌淤土,耕层(0—20 cm)土壤有机质含量为12.1 g/kg、全氮含量1.1 g/kg、全磷含量0.9 g/kg、速效氮含量41.2 mg/kg、速效磷含量16.8 mg/kg、速效钾含量101.7 mg/kg、pH 8.58,测定方法及详细步骤参照《土壤农化分析》[21]。试验于2019年水稻生长季(5月至10月),选取12个不同基因型的水稻,设置两个氮处理:不施氮处理(N0)和施氮处理(180 kg/hm2,N180),每个处理3次重复,试验对水稻基因型和氮水平采取完全随机区组设计。试验所用的氮肥为尿素(含氮46%)分3个阶段撒施:水稻于5月10日播种育秧,6月8日施基肥(P2O5和K2O各90 kg/hm2)和50%氮肥,在分蘖期(6月10日)施用30%氮肥,剩余20%氮肥在拔节期(6月29日)施用。施基肥至插秧期间(6月20日),一直处于泡田状态,9月初开始晒田,9月底田间无明水,10月18日水稻收获。水稻插秧株距10 cm,行距40 cm,每穴插秧3~5株。
1.2 水稻基因型的选择
本试验根据选择的12个水稻基因型在N0和N180处理下的地上部生物量(AB_N0和AB_N180),计算氮敏感度(AB_N0 / AB_N180),为了保证低、高氮敏感基因型数量一致,将氮敏感度低于0.5设置为高敏感,敏感度高于0.7设置为低敏感[22](表1)。
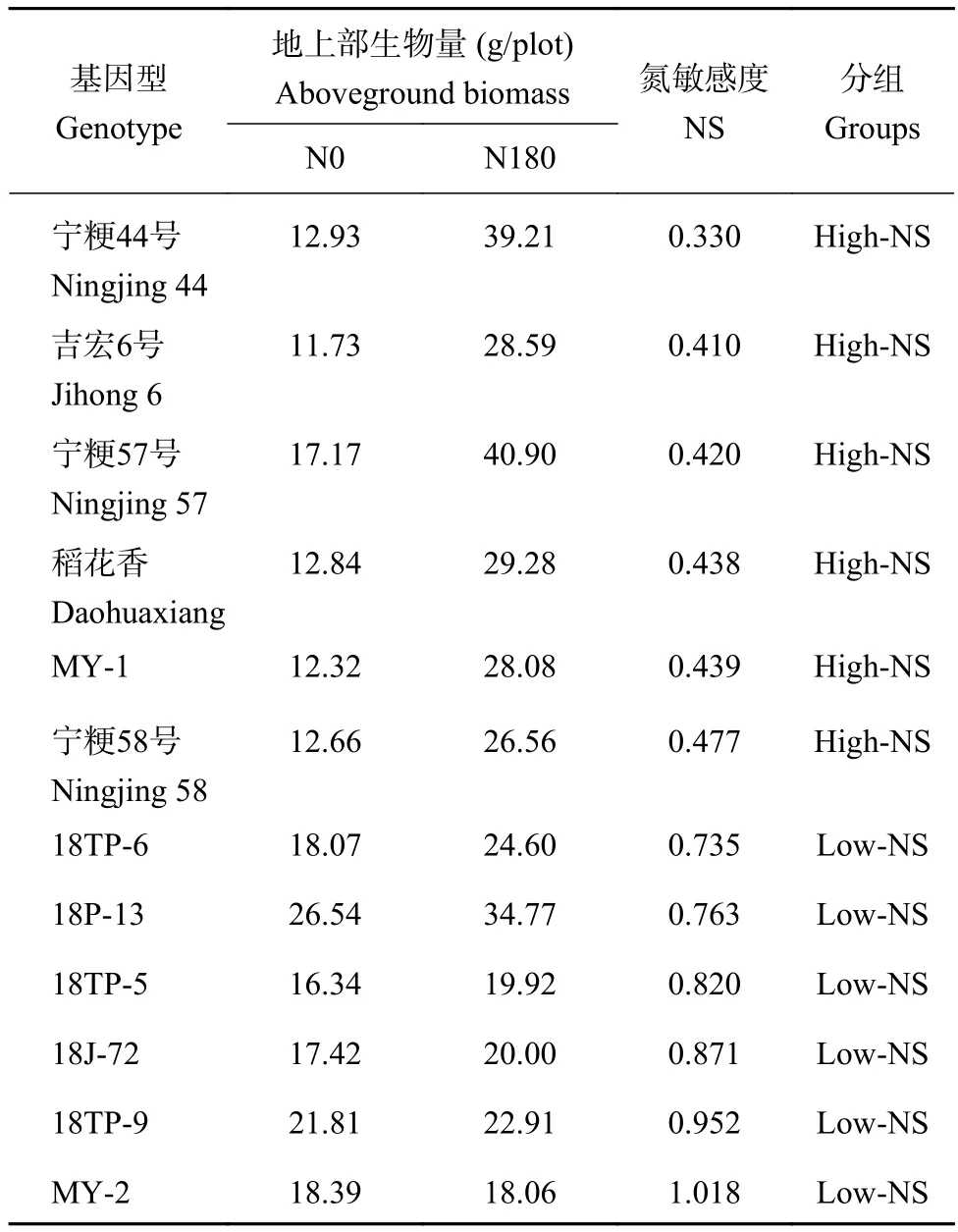
表1 水稻基因型的选择Table 1 The selection of rice genotypes
1.3 样品收获及指标测定
水稻处于开花期(此时根系生长量达到最大)时,每个处理随机选取20 cm×20 cm 4块样地,挖深0—40 cm尽可能获得完整的根系。地上部与地下部分开后,分别测定地上部生物量、地上部氮累积量;根生物量、根冠比、根长度和根体积;根直径、比根长和根组织密度[23]。
地上部生长情况的测定:将采集的水稻植株地上部装入信封置于烘箱75℃烘干至恒重,称干重获得地上部生物量。地上部氮累积量采用硫酸氧化—紫外分光光度法测定[21]。
根属性的测定:将水稻根系用自来水仔细清洗掉附着在根上的土壤,将根系尽可能少地重叠放置于塑料盘,用爱普生扫描仪(ExpressionV800; Epson,Suwa, Japan)在分辨率400 dpi下进行扫描,扫描后的图像用WinRHIZO软件(Regent Instruments Inc.,Quebec City, QC, Canada)分析,获得平均根直径、根体积和总根长。扫描后的根置于烘箱75℃烘至恒重,得到根系生物量,计算获得比根长(根长/根生物量)、根组织密度(根生物量/根体积)和根冠比(根生物量/地上部生物量)。
1.4 数据分析
用SPSS软件(版本25.0)的双因素方差分析,检验两个氮水平和两个基因型组对8个植物性状的影响及其交互作用。对单个性状,采用独立样本t检验,比较其在同一氮水平下不同氮敏感基因型组之间的差异,以及同一基因型在不同氮水平处理之间的差异。用R软件(版本 4.0.5)的“igraph”和“Hmisc”包构建高、低氮敏感基因型组在两个氮水平下不同性状的关联网络图;用“vegan”包对两个氮水平处理的不同性状进行主成分分析(PCA)。为了比较高、低氮敏感基因型组其不同性状对氮水平的可塑性响应,对所有9个性状分别进行响应比(response ratio,RR,在低氮和高氮条件下植物性状的响应程度)的计算[8],计算公式如下:
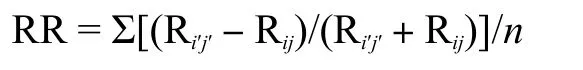
式中,Ri′j′和 Rij分别是 N0 和 N180 下的根性状;对于给定的基因型,i′和i分别表示N0和N180处理,j′和j分别是N0和N180下同一基因型3个重复中随机选择的两个个体;n是 Ri′j′-Rij值的数量。
采用独立样本t检验比较同一性状不同氮敏感基因型间氮响应比的差异。
2 结果与分析
2.1 氮添加对不同水稻基因型的地上部生长及根性状的影响
表2显示,水稻基因型对所有性状均有显著影响(P< 0.05),氮处理只对生长性状有显著影响(根冠比除外),而基因型与施氮量对除根组织密度外的所有性状均有显著的交互作用。在N0处理下,作物的地上部生物量和氮累积量(图1),以及根生物量、根长和根体积(图2)均表现出高氮敏感基因型显著低于低氮敏感基因型(P<0.05),而在N180处理下,水稻的地上部生长则是高氮敏感基因型显著高于低氮敏感基因型(图1),而根生长性状在两个基因型组间无显著差异(图2)。低氮敏感基因型除地上部氮累积量外(N180显著高于N0 1.6倍),所有生长属性在两个氮水平间均无显著差异,但高氮敏感基因型的地上部生长和根生长属性(根冠比除外)均表现出N180显著高于N0,其中地上部氮累积量增加了3.8倍,地上部生物量和根体积均增加了2.5倍,根生物量和根长均增加了2.4倍(图1和图2)。同一氮处理的不同氮敏感基因型组之间,以及同一组氮敏感基因型的不同氮处理之间的根形态性状(根直径、比根长和根组织密度)均无显著差异(图2)。不同基因型水稻的地上部生物量和根生物量在N0和N180处理下表现出不同程度的变化趋势,但总的来看基本都是高氮敏感基因型表现为N180显著高于N0 (吉宏6号的根生物量除外),而低氮敏感基因型在两个氮水平之间无显著差异(图3)。
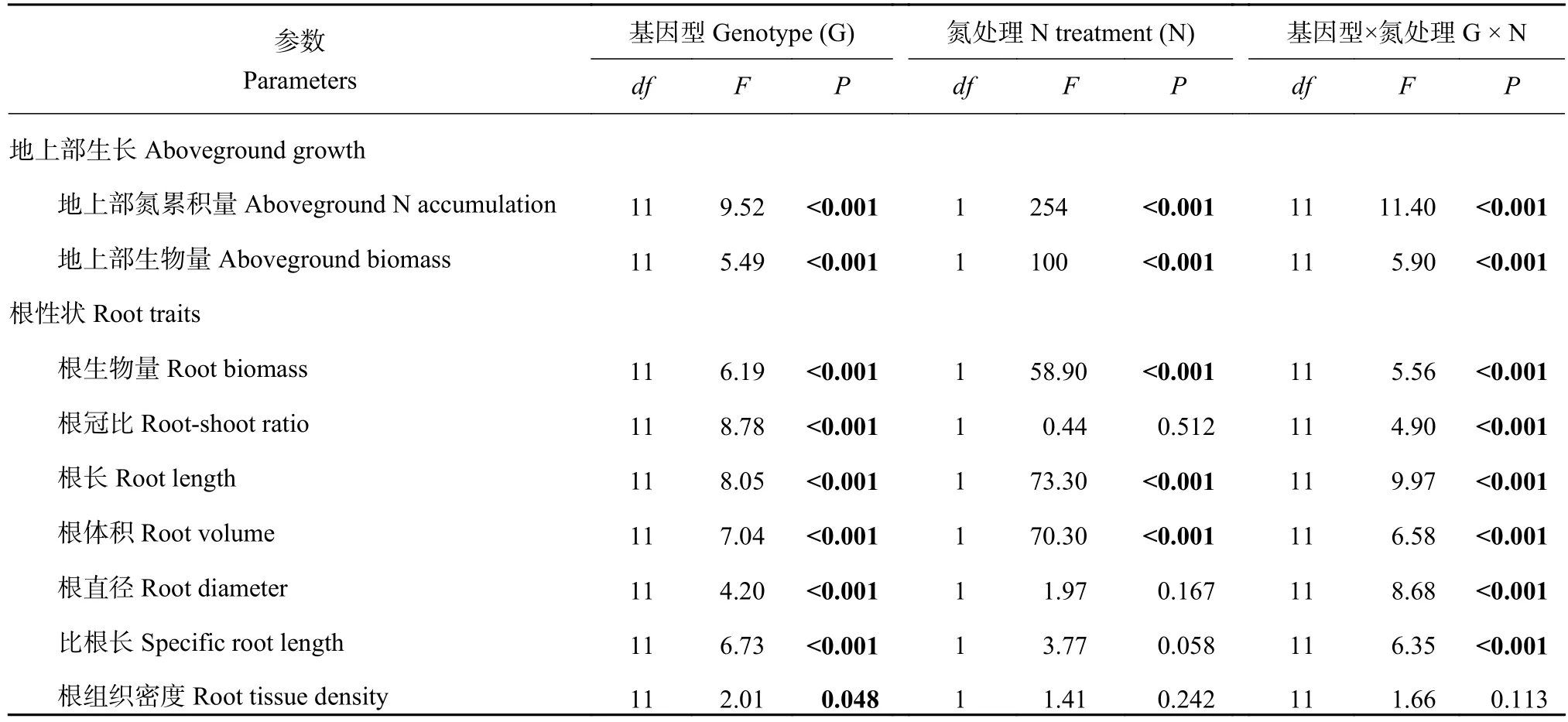
表2 基因型与氮处理的双因素方差分析Table 2 Two-way ANOVA of genotype and nitrogen treatments effect on the aboveground growth and root traits of rice
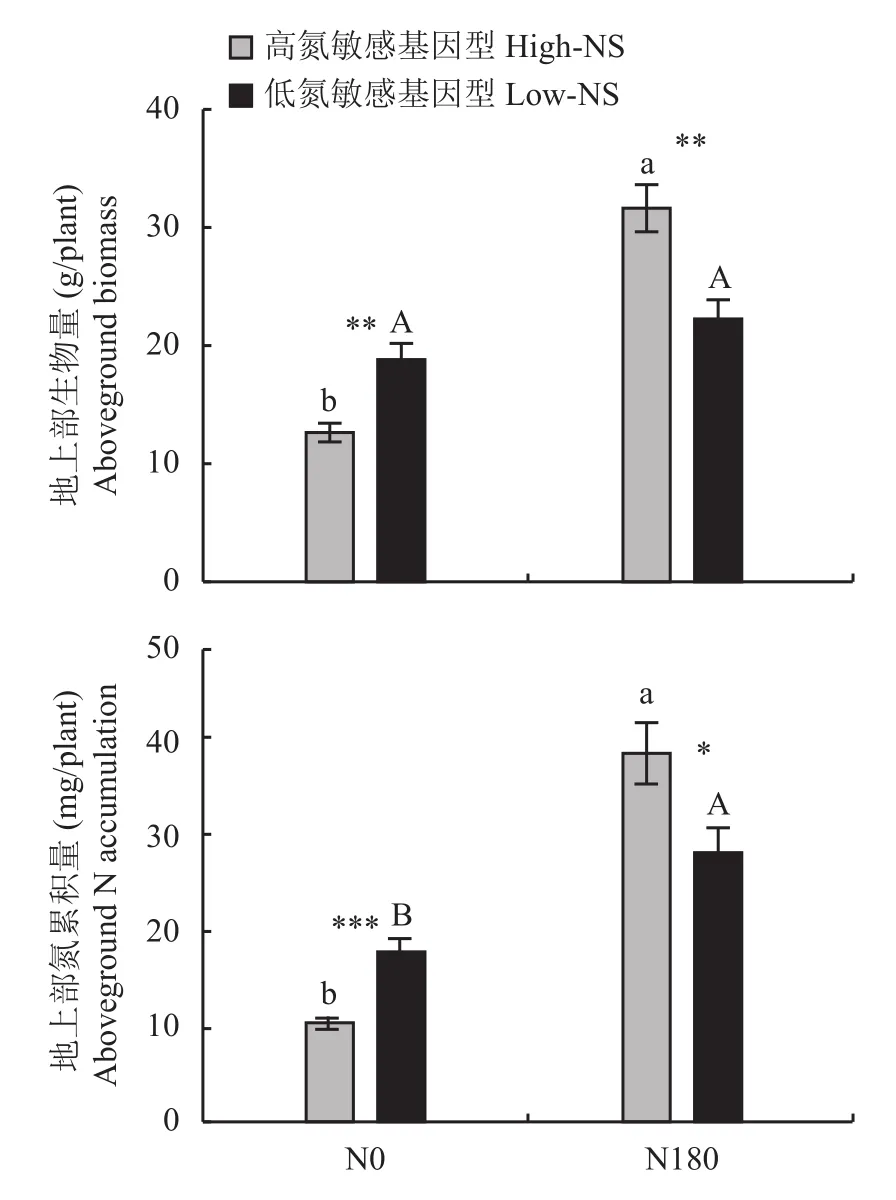
图1 N0和N180处理下高氮和低氮敏感基因型的地上部生物量和氮素累积量Fig. 1 The aboveground biomass and aboveground N accumulation of rice genotypes with high and low nitrogen sensitivity under N0 and N180 treatments

图2 N0和N180处理下高氮和低氮敏感基因型的根系生长和形态性状Fig. 2 Root growth and morphological traits of rice genotypes with high and low nitrogen sensitivity (NS)under N0 and N180 treatments
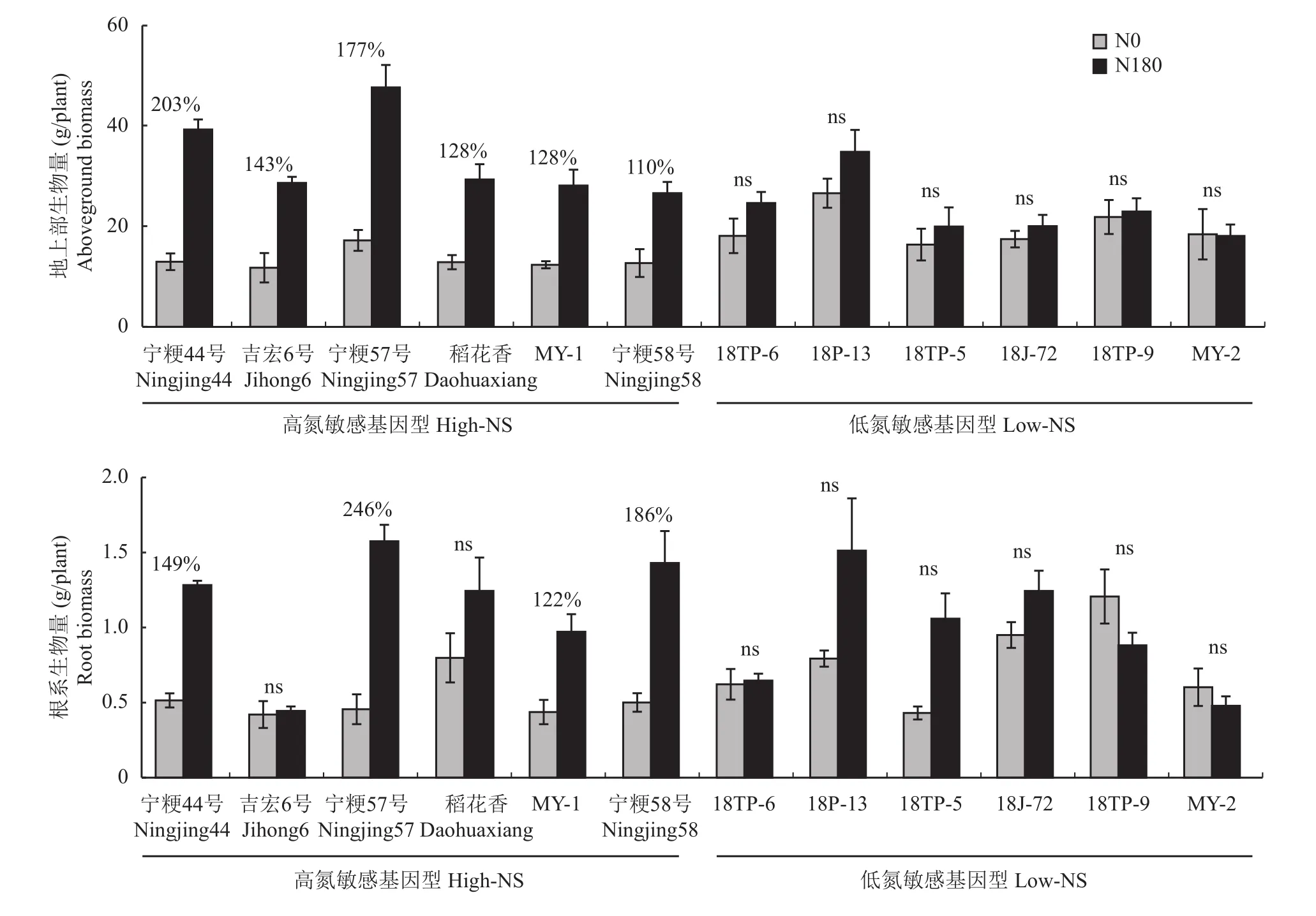
图3 12个基因型在N0和N180处理下的地上部和根系生物量Fig. 3 Biomass of aboveground and root of 12 genotypes under N0 and N180 treatments
2.2 水稻地上部生长与根性状对氮的可塑性响应
水稻的地上部生长和根性状随氮添加的变化体现在氮响应比上,且不同性状氮响应比的大小和方向是不同的(图4)。不同氮敏感基因型的地上部氮累积量、地上部生物量、根生物量、根体积和根长度的响应比均对缺氮表现出负响应,表明缺氮会限制水稻地上和地下的生长。其中,地上部氮累积量、地上部生物量和根体积的负响应比表现出高氮敏感基因型显著低于低氮敏感基因型,表明缺氮对高氮敏感基因型的影响更大。相反,高氮敏感基因型的根冠比在缺氮时表现出正响应,表明缺氮对地上的限制高于地下。对根形态性状来说,根直径和比根长的响应比接近0,表明其对缺氮环境表现出低的可塑性。根组织密度则表现出高敏感基因型对缺氮是正响应,而低氮敏感基因型对缺氮是负响应。
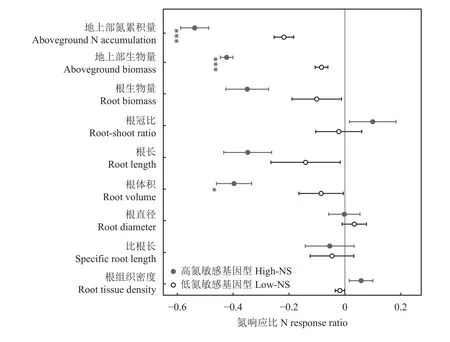
图4 高氮和低氮敏感基因型的地上部和根性状对氮的可塑性响应Fig. 4 The nitrogen plasticity response of the aboveground and root traits of high and low nitrogen sensitive (NS) genotypes
2.3 两种氮供应下水稻植株性状的相关性
主成分分析结果(图5)表明,N180处理下,主成分第一轴解释率为43.50%,能被绝大多数植物性状所解释;而第二轴的解释率为26.58%,主要是由根直径和比根长来解释。相反,N0处理下,主成分的第一轴和第二轴解释率分别为42.41%和29.62%,但是植物性状的分布更为分散。此外,关联网络图结果(图6)表明,在N0处理下,高氮敏感基因型的植物性状表现出8个显著相关,而低氮敏感基因型则表现出13个显著相关。在N180处理下,高氮敏感基因型存在12个显著相关,低氮敏感基因型存在13个显著相关。然而不管是低氮敏感基因型还是高氮敏感基因型,其在两个氮水平下,地上部生物量均与根体积显著正相关(图6)。另外,在N180下,高或低氮敏感基因型的地上部生物量还与根生物量显著正相关,而这种相关性在N0下只存在于低氮敏感基因型。综上所述,不管是N0还是N180处理,与高氮敏感基因型相比较,低氮敏感基因型的植物性状间的相关性更加紧密。而对同一氮敏感基因型来说,缺氮使得植物性状间的相关性减弱。
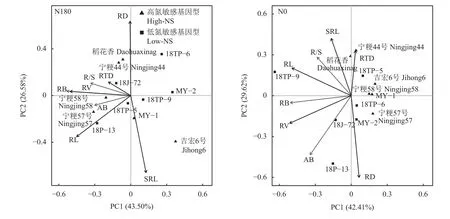
图5 N180与N0处理下不同氮敏感基因型水稻地上部生物量和根性状的主成分分析Fig. 5 Principal component analysis (PCA) of aboveground biomass and root traits of two nitrogen-sensitive (NS)genotypes under N180 and N0 treatments
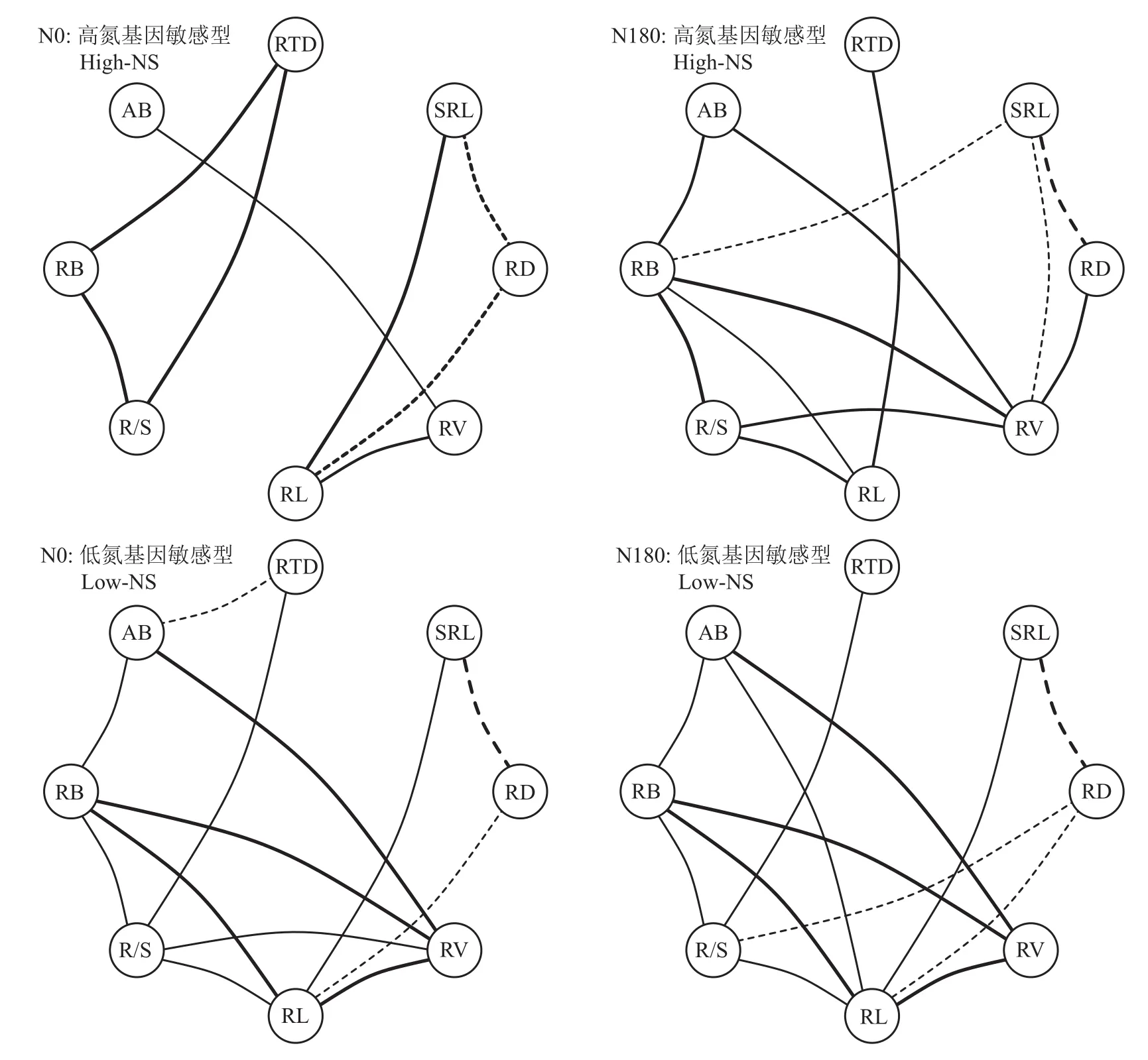
图6 N0与N180处理下不同氮敏感基因型水稻地上部生物量与根性状的相关性Fig. 6 The correlation of aboveground biomass and root traits of rice genotypes under N0 and N180 treatments
3 讨论
3.1 氮胁迫下水稻基因型性状的差异
本研究结果表明,在N180处理条件下,高氮敏感基因型的地上部生物量显著高于低氮敏感基因型,而在N0处理下则相反(图1)。另外,高氮敏感基因型的地上部生物量呈现出N180显著高于N0,而低氮敏感基因型的地上部生物量在N0和N180处理间没有显著差异(图1)。这说明,氮敏感性高的基因型在高氮养分环境中具有更高的生产力,而敏感性低的基因型则在低养分环境中依然保持较高的生产力。前人的研究也发现了类似的结果,即作物的野生祖先(敏感度低)在水分胁迫下表现出比驯化植物(敏感度高)更高的表型稳定性[24],这种差异可能是由于根系生长的变化造成的。本研究结果也表明,在N0处理下,低氮敏感基因型的根生物量、根长度和根体积均显著高于高氮敏感基因型(图2)。很多研究表明,生物量分配的改变是植物适应养分环境变化最重要的策略[6,25-26]。研究结果表明,育种策略可以改善低氮土壤中作物的生长及其对氮的吸收(但代价是降低高氮土壤中的产量潜力),也可以提高高氮土壤中的生长潜力(但牺牲了处理极端氮亏缺的能力)[27]。本研究结果也发现,在N0处理下,高氮敏感基因型的地上和地下生长均显著低于低氮敏感基因型,但在N180处理下差异消失甚至相反(图1和图2),表明高氮敏感基因型的植物生长可塑性高于低氮敏感基因型。在N0处理下,氮敏感性低的基因型表现出一种资源获取策略—较高的根系生物量、根长和根体积(图2);而且在不同氮环境中,根系生长变化幅度远低于高氮敏感基因型(图4),因而,低氮敏感基因型的这种策略表明提高养分吸收面积和体积是水稻在逆境中获得养分的主要手段。相反,在低氮环境下,高氮敏感基因型则拥有较低的根长和根系生物量(图2),这也体现了高氮敏感基因型的水稻对根系的低投入是其在低氮环境中的生长策略。
本研究结果表明,不同基因型水稻的根形态性状(根直径、比根长和根组织密度)具有显著差异(表2),但是根形态性状在不同氮水平(N0和N180)之间和不同氮敏感基因型(高氮敏感基因型和低氮敏感基因型)之间均无显著差异(表2和图2)。有关研究表明,在养分逆境中,植物往往会对根系形态性状做出调整,如降低根直径和根组织密度,增加比根长[28-30],这能够降低植物根系的构建成本,使同等生物量的根系具有更大的吸收面积。然而这种现象也往往具有物种依赖性,例如Wen等[9]对16种作物的研究发现,其中有6种作物的比根长在低磷环境中有显著增加,而3种作物的比根长反而降低,其他作物的比根长则没有显著的变化。最新的研究也发现,在不同养分环境中,玉米的根系形态性状几乎没有显著的变化,而是显著增加根长度来获取资源[25]。这也从侧面证明,相比于改变根系形态性状,水稻可能更加依靠增加根系的生长来获取养分资源。
3.2 不同氮环境对水稻根性状关系的影响
性状共变模式代表了植物在不同环境条件下的适应性策略[31-32]。本研究结果表明,水稻高氮敏感基因型的植物性状的共变强度在N0处理下远低于N180处理(图6);而对低氮敏感基因型来说,植物性状间的相关性在两个氮水平下均比较高(图6)。另外,高氮敏感基因型表现出地上和地下生长均是N180显著高于N0,而低氮敏感基因型在两个氮水平之间则无显著差异(图1和图2)。可见,水稻生产力的提升依赖于植物性状的共变强度。
过去的研究表明,逆境往往能够强化植物性状间的共变性以提高其对逆境的抵御能力[18],这与本研究氮敏感度高的基因型植物性状在不同氮环境的变化模式不一致,可能是因为相比较低氮敏感基因型,高氮敏感基因型的生长性状(地上部生物量、根生物量、根长和根体积)可塑性更高(图4),从而能更快地适应环境的变化(如快速地从富养环境中获取资源)。根系生长是决定植物地上生产力的基础,所以植物通过提高其生长性状的可塑性来实现高产也是其适应环境的一种策略。研究表明,现代农业由于化肥的大量投入,人们更倾向于选择和培育资源获取型作物[33],因为这类植物往往具有更细的根直径和更高的性状可塑性[9],通过降低性状间的共变,来更快地获取土壤资源。Milla等[33]发现未驯化的作物野生基因型的植物性状间的共变性更强,从而更好地适应养分胁迫较大的自然环境。而人类驯化过程,由于高养分的投入,可能会使一些基因型失去适应养分逆境的植物性状[34],从而降低植物性状间的共变强度。综上所述,氮敏感性低的基因型主要通过增强植物性状间的共变强度,来保证水稻地上生产力的稳定性。而氮敏感性高的基因型则通过提高植物性状的可塑性,降低其共变性,来更充分地利用富集土壤资源。
目前,农业在减少施肥量但作物产量不降低方面面临巨大的挑战[35-36]。本研究结果的思路为选择根性状整合性强的基因型,在可持续农业生态系统中具有重要意义。
4 结论
水稻主要是调节根生长性状,而非形态性状来适应不同氮环境。低氮敏感基因型水稻在低氮和正常氮环境下均表现出强的根性状共变性,而高氮敏感基因型仅在正常氮环境下表现出较高的性状关联,且根生长性状的可塑性显著高于低氮敏感基因型。由此可知,低氮敏感基因型主要通过整合根性状的共变来适应环境,而高氮敏感基因型则通过提高根性状的可塑性来适应环境。
