SCAMP2 与Rab8a 在小鼠原代巨噬细胞源性泡沫细胞胆固醇转运中的作用
2022-05-11林俍良潘海强马卫列张志珍广东医科大学生物化学与分子生物学教研室广东东莞523808
林俍良,潘海强,丁 航,马卫列,张志珍 (广东医科大学生物化学与分子生物学教研室,广东东莞 523808)
动脉粥样硬化是心血管疾病的病理基础,其早期特征以巨噬细胞脂质代谢功能障碍导致的泡沫细胞形成为主要标志,是引发心血管疾病发生和患者死亡的主要原因[1]。载脂蛋白A-1(apoA-1)是高密度脂蛋白的重要结构蛋白组分,在机体脂质代谢过程中具有介导泡沫细胞胆固醇外流、维持机体胆固醇稳态、抗动脉粥样硬化的作用[2]。研究表明,apoA-1 能介导泡沫细胞内累积的胆固醇以囊泡形式胞吐至细胞外,有多种蛋白质参与该胆固醇囊泡转运过程[3]。分泌载体膜蛋白2(SCAMP2)是一种进化上保守的含有4 个跨膜区的膜整合蛋白,主要在胞内分泌囊泡及质膜上表达,以复合物形式参与胞吐/胞吐过程,在调节囊泡转运及细胞分泌过程中发挥关键作用[4]。Ras 相关蛋白(Ras-related protein)Rab8a 是参与细胞膜转运和囊泡运输的调控因子[5]。在巨噬细胞中,Rab8a 参与控制细胞表面蛋白的转运和循环,如基质金属蛋白酶、腺苷三磷酸结合盒转运体A1 等[6]。然而,SCAMP2 和Rab8a 是否参与apoA-1 介导的泡沫细胞内胆固醇囊泡转运以及它们是否具有相互作用,目前尚不清楚。我们前期从Jackson实验室引进SCAMP2基因敲除的杂合子小鼠,并成功繁殖获得同一品系的野生型C57BL/6NJ小鼠[7]。本实验将提取野生型小鼠腹腔巨噬细胞,建立泡沫细胞模型,分析SCAMP2 和Rab8a的表达情况及二者之间的相互作用。
1 材料和方法
1.1 仪器与材料
1.1.1 仪器 荧光定量PCR 仪(德国Roche公司);电泳及电转移装置(美国Bio-Rad 公司);5417R 高速台式离心机(德国Eppendorf 公司);C400 成像系统(美国Azure Biosystems 公司);SYNERGY H1 酶标仪(美国Biotek 公司);TCS SP8 共聚焦荧光显微镜(德国Zeiss公司)。
1.1.2 实验动物与材料 野生雄性C57BL/6NJ 小鼠(种鼠C57BL 品系的C57BL/6NJ-Scamp2em1J小鼠购自美国Jackson 实验室,库存号:028970)按照SPF 级动物饲养标准于广东医科大学实验动物中心进行饲养繁殖。RPMI 1640 培养基购自Invitrogen 公司;胎牛血清购自Gibco 公司;乙酰化低密度脂蛋白(acLDL)购自安徽经科生物技术有限公司;apoA-1 和Protein A/G 磁珠购自Sigma 公司;细胞总RNA 抽提试剂Trizol 购自Thermo Fisher 公司;逆转录和定量PCR 试剂盒购自Takala 公司;羊抗兔SCAMP2 多克隆抗体、羊抗鼠Rab8a 单克隆抗体和β-tubulin 抗体购自Proteintech 公司;二抗及荧光二抗购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 小鼠腹腔巨噬细胞的分离与培养 雄性8 周龄SPF级C57BL/6NJ小鼠禁食过夜后,颈椎脱臼法处死,腹腔注射5 mL 预冷的RPMI 1640 培养基,按摩腹壁5 min 后收集腹腔内富集的巨噬细胞。1 500 r/min离心8 min,弃上清,用含10%胎牛血清和1%青霉素/链霉素的RPMI 1640 培养基重悬细胞,接种于6 孔板(1.2×106个细胞/孔),在37 ℃、5% CO2培养箱中培养6 h,用RPMI 1640 空白培养基轻轻冲洗2~3 次,去除未贴壁细胞,培养板上的贴壁细胞即为实验所用的原代巨噬细胞。
1.2.2 建立泡沫细胞模型 提取的腹腔巨噬细胞用含10%胎牛血清的RPMI 1640培养基培养12 h后,用空白培养基洗2 次,加入含有50 mg/L 乙酰化低密度脂蛋白(acLDL)0.2% BSA 的RPMI 1640 培养基孵育48 h,诱导巨噬细胞转变为泡沫细胞。
1.2.3 apoA-1 处理与实验分组 巨噬细胞源性泡沫细胞用空白培养基洗2 次,用含0.2% BSA 的RPMI 1640 培养基平衡12 h,加入10 mg/L 的apoA-1 作用12 h。实验中未做任何处理的原代巨噬细胞作为对照组;加入acLDL 诱导48 h 转变的泡沫细胞即为acLDL 组;加入apoA-1 处理12 h 的泡沫细胞即为apoA-1组。
1.2.4 qRT-PCR 实验 上述不同处理组细胞分别用核酸提取试剂Trizol 提取细胞总RNA,6 孔板每孔加入1 mL Trizol进行裂解。使用Takala逆转录试剂盒,将提取的RNA 逆转录为cDNA,随后用Takala试剂盒进 行qPCR 分 析。PCR 扩增程序为:95 ℃、30 s;95 ℃、5 s,60 ℃、30 s,循环40 次;95 ℃、10 s、65 ℃、60 s、97℃、1 s。以GAPDH 为内参,计算SCAMP2 和Rab8a mRNA 相对表达量。SCAMP2、Rab8a、GAPDH 引物由上海生工生物工程有限公司设计并合成,序列见表1。

表1 qRT-PCR引物序列
1.2.5 Western blot 实验 提取的腹腔巨噬细胞铺入6 孔板(1.2×106个细胞/孔),用50 mg/L acLDL 处理48 h,再用10 mg/L apoA-1作用12 h,对照组不做任何处理。提取不同处理组细胞总蛋白,BCA 法测定蛋白含量。用10%SDS-PAGE 凝胶将等量的蛋白稀释样品进行电泳分离;电泳结束后,将凝胶中的蛋白质在4 ℃、110 V 恒压下转移90 min 至PVDF 膜;5%脱脂奶粉室温封闭1 h,分别加入SCAMP2、Rab8a、β-tubulin 一抗(1:1 000 稀释),4 ℃孵育过夜;用1×TBST洗膜3 次,每次10 min,加入相应的二抗(1:2 000 稀释),室温孵育1 h;用1×TBST 洗膜3 次,每次10 min;采用Azure Biosystems C400成像系统进行曝光显影。
1.2.6 免疫共沉淀(Co-IP)实验 提取腹腔巨噬细胞铺入10 cm培养皿(7×106个细胞),经acLDL和apoA-1处理后,加入500 μL 预冷的含PMSF 的RIPA(弱)蛋白裂解缓冲液,冰上裂解细胞30 min;收集细胞,12 000 r/min、4 ℃离心5 min,收集上清液。每组细胞的裂解产物取50 μL 作为阳性对照(input组),剩余裂解产物平均分成2 份,分别加入2 μg 的免疫球蛋白作为阴性对照(IgG组)和相应SCAMP2、Rab8a、β-tubulin抗体(IP 组),置于4 ℃冰箱交联。交联过夜后加入30 μL protein A/G 磁珠,常温交联2 h,再次拉下免疫复合物,用裂解缓冲液洗涤。每个样品加入30 μL 的2×SDS缓冲液,蛋白变性后进行Western blot分析。
1.2.7 免疫荧光(IF)实验 提取的腹腔巨噬细胞铺24孔板进行细胞爬片(1.5×105个细胞/孔)。不同处理组的细胞用4%多聚甲醛室温固定20 min;1×PBS 漂洗3 次,每次5 min,加入含5%BSA 的PBS 缓冲液进行封闭,摇床1 h;加入SCAMP2 抗体、Rab8a 抗体(1:200 稀释),4 ℃孵育过夜;1×PBS 漂洗3 次,每次时间5 min,加入荧光二抗(1∶1 000 稀释)室温孵育1 h;加DAPI 染液200 μL,室温避光1 min,洗板3 次后封片,使用TCS SP8 共聚焦荧光显微镜观察SCAMP2 和Rab8a的定位和表达情况。
1.3 统计学处理
采用GraphPad Prism 6.02 软件进行统计学分析,数据以均数±标准差表示,采用单因素方差分析及LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SCAMP2和Rab8基因表达分析
与对照组相比,acLDL 诱导的泡沫细胞内SCAMP2 mRNA 表达增强(P<0.01);与acLDL 组相比,apoA-1处理的泡沫细胞内SCAMP2 mRNA表达进一步升高(P<0.01),见图1A。用apoA-1 处理泡沫细胞后Rab8a mRNA 表达水平升高,与对照组和acLDL组相比,差异均有统计学意义(P<0.01),见图1B。

图1 qRT-PCR检测巨噬细胞内SCAMP2和Rab8a mRNA的表达水平
2.2 SCAMP2和Rab8a的蛋白表达分析
Western blot 分析显示,apoA-1 处理的泡沫细胞组SCAMP2 和Rab8a 的蛋白表达,与对照组和acLDL组相比均明显增强,结果见图2A。与acLDL 组相比,apoA-1处理组SCAMP2蛋白表达升高了38.5%,差异有统计学意义(P<0.05),见图2B;与acLDL 组相比,apoA-1 处理组Rab8a 蛋白表达升高了30.8%,差异有统计学意义(P<0.05),见图2C。
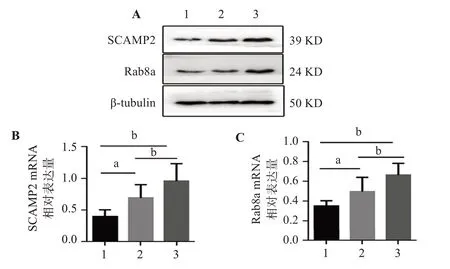
图2 巨噬细胞内SCAMP2和Rab8a的蛋白表达分析
2.3 SCAMP2与Rab8a在巨噬细胞内的相互作用
免疫共沉淀结果表明,内参β-tubulin在两种抗体处理的不同组细胞中表达量基本一致(图3A)。与对照组相比,acLDL诱导的泡沫细胞内SCAMP2蛋白与Rab8a蛋白形成复合物,而加入apoA-1介导泡沫细胞胆固醇外流过程中,SCAMP2 蛋白与Rab8a 蛋白的相互作用增强,见图3B的IP组。

图3 SCAMP2与Rab8a在巨噬细胞内的相互作用分析
2.4 SCAMP2与Rab8a在巨噬细胞内的共定位
对不同处理组的巨噬细胞进行免疫荧光染色,结果见图4。相比于对照巨噬细胞,泡沫细胞内SCAMP2(绿色荧光)和Rab8a(红色荧光)表达均增强。当用apoA-1 处理泡沫细胞介导胆固醇外流时,SCAMP2 和Rab8a 的荧光强度进一步增加,而且两种蛋白在细胞膜上聚集,二者在细胞质膜处的共定位(黄色荧光)表达增强。

图4 SCAMP2和Rab8a在巨噬细胞内的定位观察
3 讨论
分泌载体膜蛋白(SCAMPs)是高尔基体及后高尔基体循环转运中的一类载体蛋白,调控细胞内运输和信号转导。SCAMPs 家族有5 个成员,即SCAMP1~5,参与细胞内囊泡的运输及细胞内物质到细胞膜表面的转运,能加速细胞膜重构,影响胞吞和胞吐融合孔的形成、稳定及扩张[8]。SCAMP2 作为分泌囊泡的标记物,早期研究发现在哺乳动物细胞中能够与磷脂酸肌醇4,5-二磷酸(PIP2)相互作用,调节囊泡的胞吐过程[9]。最近研究发现,SCAMP2 通过其疏水性肽段CWYRPIYKAFR 与PIP2之间发生静电相互作用,可抑制胞外分泌[10]。但SCAMP2 是否参与apoA-1 介导的泡沫细胞内胆固醇囊泡转运目前报道较少。为此,我们首先提取小鼠腹腔巨噬细胞,贴壁培养后加入acLDL,诱导形成巨噬细胞源性泡沫细胞。在此基础上,用apoA-1 进行处理介导泡沫细胞胆固醇外流,分析SCAMP2 在细胞内的表达改变。研究发现,acLDL诱导形成的泡沫细胞内SCAMP2的mRNA 和蛋白水平均升高,提示SCAMP2 参与了apoA-1介导的泡沫细胞胆固醇转运过程。
Ras 相关蛋白(Rab)是属于GTP 酶超家族的一类单分子蛋白质,大约有70 种,在细胞内囊泡运输过程中发挥重要作用[11]。Rab GTP 酶充当分子开关,由鸟嘌呤核苷酸交换因子激活后,与GDP 结合的无活性Rab 转变为有活性的GTP-Rab 结合形式,并募集特异的效应蛋白,进而调控囊泡的形成、融合及与质膜锚定[12]。小GTP 酶Rab8 在膜转运中起着重要作用,在分泌途径中,Rab8 调节细胞囊泡从反面高尔基体到质膜的运输,调节囊泡与质膜的融合,控制胞吐活性[13]。Rab8 包 括Rab8a 和Rab8b 两种亚型[6],能调控细胞膜转运和囊泡运输过程。有研究发现Rab8a 介导的胞内脂滴增大可能在帕金森发病机制中起重要作用[14],并且Rab8a的72位磷酸化在脂滴融合和增大中发挥作用[15]。然而,Rab8a 在巨噬泡沫细胞内胆固醇囊泡运输中的作用目前研究较少。我们的实验发现,Rab8a mRNA 和蛋白水平在acLDL 诱导形成的泡沫细胞内升高,当用apoA-1 处理后,泡沫细胞内Rab8a mRNA 和蛋白水平进一步升高,提示Rab8a 参与了apoA-1介导的泡沫细胞胆固醇囊泡转运过程。
为了分析SCAMP2 蛋白与Rab8a 蛋白在巨噬细胞内是否具有相互作用,我们分别用Rab8a 抗体和SCAMP2 抗体在巨噬细胞、泡沫细胞和apoA-1 处理的泡沫细胞的蛋白裂解液中富集蛋白复合物,分析显示acLDL 诱导的泡沫细胞内SCAMP2 蛋白与Rab8a蛋白形成复合物,提示二者存在相互作用。当用apoA-1处理泡沫细胞后,SCAMP2与Rab8a的相互作用增强,说明两种蛋白以复合物形式参与了胆固醇的转运过程。为了进一步验证这一结果,我们采用免疫荧光实验分析SCAMP2 蛋白和Rab8a 蛋白在细胞内的表达及定位情况。与免疫共沉淀结果一致,通过激光共聚焦显微镜观察到acLDL 诱导的泡沫细胞内SCAMP2 的绿色荧光和Rab8a 的红色荧光增强,而且二者相互作用形成复合物,出现叠加的黄色荧光。apoA-1 处理泡沫细胞后,绿色荧光和红色荧光进一步增强,并且在细胞质膜处出现了更强的黄色荧光,说明两种蛋白在细胞膜上的共定位。本实验结果证实了SCAMP2 与Rab8a 在巨噬细胞源性泡沫细胞中具有相互作用,二者以复合物形式参与apoA-1 介导的泡沫细胞内胆固醇囊泡转运,但两种蛋白之间是否具有直接相互作用及其作用的机制需进一步研究。
