沙棘黄酮对大鼠动脉粥样硬化斑块的影响及作用机制
2022-05-11焦艳谢世静李喆
焦艳 谢世静 李喆
(沧州医学高等专科学校药学系,河北 沧州 061000)
动脉粥样硬化(AS)是冠心病、脑血管疾病和血栓栓塞性疾病等缺血性心脑血管疾病的主要病理基础,但目前AS的发病机制尚未完全清楚〔1〕。他汀类药物是AS治疗的基石,但存在药物不良反应。沙棘黄酮(TFH)是从中药沙棘中提取出的主要有效成分,具有增强免疫、抗氧化、保护心血管系统等作用。研究发现,TFH可通过降低烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶蛋白表达及升高去乙酰化酶(SIRT1)蛋白表达,提高机体防御氧化应激能力〔2〕。由于目前关于TFH对AS大鼠斑块影响的相关研究较少,因此本文就TFH对大鼠AS斑块的影响及机制进行探讨。
1 材料与方法
1.1材料 实验动物 SPF级雄性SD大鼠,8月龄,体重200~220 g,购于第四军医大学动物实验中心,动物合格证号为SCXK(军)2015-0014。主要试剂:TFH(青海康普德生物制品有限公司,纯度≥95%);阿托伐他汀钙片(北京嘉林药业股份有限公司,批号:110808,规格:10 mg/片);维生素D3滴剂(上海通用药业股份有限公司,批号:121125,规格:30万IU:1 ml);CD4+、CD8+单克隆抗体(美国Biolegend公司);Smad3抗体(英国Abcam公司);免疫组化试剂盒(德国Thermo Fisher Scientific公司)等。主要仪器:RM2125型Leica石蜡切片机(德国Leica公司);1-15K型高速冷冻离心机(美国Sigma公司);BH-2光学显微镜(日本Olympus公司);XL20全自动生化分析仪(德国Thermo Fisher Scientific公司);FACS Calibur型流式细胞仪(美国Becton-Dickinson公司)等。
1.2方法
1.2.1实验动物模型建立〔3〕、分组及处理 实验分为对照组、模型组、阳性对照组及实验组5组,每组25只。模型组、阳性对照组及实验组大鼠均按60万IU/kg的总剂量腹腔注射维生素D3,注射3 d,同时给予高脂饲料喂养8 w,建立大鼠AS模型。造模第8周末,随机抽取各组5只大鼠,取主动脉组织做病理切片,出现主动脉内膜增厚,血管内有斑块形成,并伴有脂质沉积的现象,说明造模成功。各组均剩余造模成功大鼠各20只,阳性对照组给予阿托伐他汀钙10 mg/(kg·d)灌胃,实验组给予TFH 200 mg/(kg·d)灌胃,对照组与模型组则使用等量生理盐水灌胃,各组均连续给药4 w。
1.2.2全自动生化分析仪〔4〕检测各组血脂水平 末次干预结束后,大鼠均禁食24 h,给予戊巴比妥钠30 mg/kg行腹腔麻醉,自心脏心室处插管,用红色生化管采集动脉血10 ml,3 000 r/min离心15 min,取上层血清,装于离心管,用于血脂检测。应用XL20全自动生化分析仪检测以下血脂指标水平,即血清中总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平。
1.2.3流式细胞仪法〔5〕测定各组血清T淋巴细胞亚群水平 末次干预结束后,血液采集同1.2.2,采集好的血液标本,加入EDTA-K2抗凝,加荧光素标记的抗CD4+、CD8+单克隆抗体80 μl,室温孵育15 min,制备待测样本,流式细胞仪用前向角测向角设二维点图,用Gatel将淋巴细胞圈住,检测Gatel内细胞10 000个,使用CELL QUEST软件获取荧光信号并分析CD4+、CD8+T细胞百分比。
1.2.4苏木素-伊红(HE)染色〔6〕观察大鼠主动脉病理学形态 末次干预结束后,将各组大鼠放置于操作台上,给予麻醉后将小鼠断头处死,75%酒精消毒,解剖取出颈部主动脉,200 ml甲醛溶液固定后,不同浓度乙醇脱水,采用石蜡包埋制作常规石蜡病理切片,使用 HE染色,于光学显微镜下观察主动脉病理学变化情况。
1.2.5免疫组织化学法〔7〕检测Smad3表达情况 末次干预结束后,主动脉组织采集同1.2.4。采用免疫组化法,严格按试剂盒说明书进行。按1∶100将Smad3抗体稀释,4℃冰箱过夜。室温下放置60 min,滴加二抗〔辣根过氧化物酶(HRP)标记山羊抗兔IgG抗体-HRP多聚体〕50 μl,37℃孵育30 min;二氨基联苯胺(DAB)显色,苏木素复染,脱水、透明、封片。在光学显微镜下观察棕黄色颗粒为阳性表达,每张切片在光镜下随机选6个不同视野,采用BI-2000图像分析系统计算Smad3蛋白阳性表达细胞数,与总细胞数之比即为阳性细胞百分比。
1.3统计学方法 采用SPSS21.0软件进行t检验。
2 结 果
2.1各组血脂水平比较 与对照组相比,其余3组血清TC、TG、LDL-C水平显著升高,而HDL-C水平显著降低(P<0.05);与模型组相比,阳性对照组及实验组TC、TG、LDL-C水平显著降低,HDL-C水平显著升高(P<0.05);与阳性对照组比较,实验组TC、TG、LDL-C水平显著升高,HDL-C水平显著降低(P<0.05)。见表1。
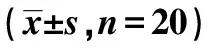
表1 各组血清血脂、T淋巴细胞亚群水平比较
2.2各组血清T淋巴细胞亚群水平比较 与对照组相比,其余3组血清CD4+、CD4+/CD8+显著降低,CD8+显著升高;与模型组相比,阳性对照组及实验组CD4+与CD4+/CD8+显著升高,CD8+显著降低(P<0.05);与阳性对照组比较,实验组CD4+、CD4+/CD8+显著降低,CD8+显著升高(P<0.05)。见表1。
2.3各组主动脉病理学形态 对照组主动脉血管壁结构清晰,内膜完整,无脂质沉积,无斑块形成,且表面无炎性细胞浸润;模型组主动脉内膜结构破坏,动脉内膜增厚、可见血管内斑块形成,并伴有炎性细胞浸润及脂质沉积;阳性对照组及实验组主动脉内膜结构稍有破坏,内膜纤维帽增厚,斑块病变程度及病变面积、范围均较模型组减轻、减小,且斑块稳定性增加。见图1。
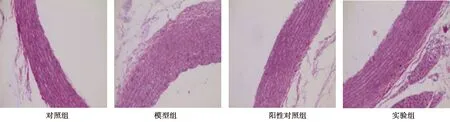
图1 光学显微镜下观察主动脉的病理学形态(HE,×200)
2.4各组大鼠主动脉中Smad3表达情况 对照组、模型组、阳性对照组及实验组主动脉斑块Smad3蛋白阳性细胞百分比分别为(16.12±4.63)%、(87.26±3.91)%、(39.73±4.82)%、(51.02±5.38)%。与对照组相比,其余3组Smad3蛋白阳性细胞百分比显著升高,与模型组相比,阳性对照组及实验组Smad3蛋白表达显著降低,且阳性对照组显著低于实验组(P<0.05)。见图2。
图2 主动脉斑块中Smad3蛋白表达(免疫组化,×400)
3 讨 论
脂代谢异常和血清中生长因子水平异常是AS的重要危险因素,同时,T淋巴细胞作为免疫因素在AS发生、发展过程中的作用越来越受到重视〔8〕。TFH有活血化瘀、调节血脂蛋白、抗肿瘤等药理功效。研究发现,TFH可以显著调节实验性高脂血症大鼠血脂水平〔9〕。TFH可显著降低高脂饲料喂养大鼠的血脂水平,调节脂质代谢紊乱,减少肝细胞中脂肪变性〔10〕。本研究结果提示TFH可降低AS大鼠血脂水平,降低脂肪变性。研究发现,正常人的动脉管壁罕见T淋巴细胞浸润,而AS斑块可见T淋巴细胞活化,CD4+T淋巴细胞增多,在不稳定斑块中,CD8+T淋巴细胞增多〔11〕。本研究结果提示TFH可调节T淋巴细胞亚群分布,提高细胞免疫功能。Smad3是参与AS炎症信号的重要通路之一,研究表明白细胞介素(IL)-37和Smad3在AS斑块中表达增高,并推测IL-37/Smad3可能参与AS的调节过程〔12〕。本研究结果提示TFH可降低Smad3表达,进而改善AS。
