2-羟基-3-甲基蒽醌诱导大肠癌细胞凋亡
2022-05-11李玉花林金蕊丘金浪何则沂
李玉花 林金蕊 丘金浪 何则沂
(福州市中医院检验科,福建 福州 350001)
大肠癌是常见的消化道恶性肿瘤,具有发病率和死亡率高、5年生存率低等特点〔1,2〕。大肠癌常见的临床表现有便血、便秘、腹胀、腹痛、食欲减退等。中医药采用整体观念、辨证论治等诊疗思维,在大肠癌的治疗中取得了良好的效果。中医学将大肠癌归为“肠痈”“癥瘕”等范畴,中医认为大肠癌以脾肾亏虚为本虚,以热毒、瘀血、湿热为标实〔3,4〕。临床上常以清热解毒、活血化瘀、消肿散结等中药用于治疗大肠癌〔5〕。研究证实白花蛇舌草、半枝莲等清热解毒类中药可抑制大肠癌细胞生长,诱导细胞凋亡〔6~8〕,但对白花蛇舌草的内在成分分析和作用机理研究较少。2-羟基-3-甲基蒽醌(HMA)是白花蛇舌草中提取出的一种蒽醌类化合物,研究表明HMA明显抑制白血病、肝癌、卵巢癌、乳腺癌、肺癌等多种肿瘤细胞增殖〔9~13〕。本研究旨在探讨HMA对大肠癌细胞株增殖和凋亡的影响并分析其可能机制。
1 材料与方法
1.1材料
1.1.1实验细胞 人大肠癌细胞株HCT116和HT-29(中国科学院上海细胞库),分别培养在含10%胎牛血清(FBS)的McCoy 5A 培养基中,37℃、5%CO2培养箱中培养,细胞贴壁生长至融合80%~90%时,胰酶消化传代。选取处于对数生长期的细胞用于实验。
1.1.2实验试剂 HMA(相对分子质量:238.24,纯度>98%,货号:B50996,用DMSO释稀配制成200 mmol/L母液,-20℃保存备用,上海源叶生物科技有限公司);FBS(美国Thermo Fisher Scientific公司);McCoy′s 5A培养基(江苏凯基生物有限公司);青链霉素混合液和磷酸盐缓冲液(美国Hyclone公司);含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-9、caspase-3、B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)一抗和羊抗兔二抗(美国CST 公司);CCK-8试剂盒和凋亡试剂盒(武汉Abbkine公司);放射免疫沉淀试验(RIPA)裂解液、苯甲基磺酰氟(PMSF)、封闭液、电化学发光(ECL)显影剂(北京索莱宝有限公司)。
1.1.3主要仪器 CO2培养箱、超净工作台(美国Thermo Fisher Scientific公司);酶标仪(美国BioTek公司);Countstar全自动细胞计数仪(美国Countstar公司);流式细胞分析仪(美国BD公司);离心机(美国Eppendorf公司);电泳系统、凝胶成像系统(美国Bio-Rad公司)。
1.2方法
1.2.1CCK-8检测细胞活力 人大肠癌细胞在培养瓶中培养至对数生长期,以3×104个/ml接种于96孔板,过夜培养后,加入不同浓度(0、25、50、100 μmol/L)HMA,干预48 h后每孔10 μl CCK-8溶液混匀,培养箱避光孵育2 h,于450 nm波长测定吸光度值。计算HMA对大肠癌细胞的活力,细胞存活率(%)=(实验组吸光度均值/对照组吸光度均值)×100%。
1.2.2台盼蓝染色细胞计数检测细胞生长能力 取对数生长期细胞,以1×105/ml细胞接种于12孔板,过夜培养后分别加入不同浓度(0、25、50、100 μmol/L)的HMA药物干预,培养48 h后消化收集细胞,重悬混匀细胞后与0.2%台盼蓝等体积混合,加入计数板中,Countstar全自动细胞计数仪分析细胞总数。
1.2.3集落形成检测细胞存活能力 取对数生长期细胞,以2×105/ml细胞接种于6孔板,过夜培养后分别加入不同浓度(0、25、50、100 μmol/L)HMA药物干预,培养48 h后消化细胞,以500个/孔接种于12孔板中,连续培养8~12 d,每隔3天换1次液,待肉眼看到集落时终止实验。弃去12孔板中培养基,磷酸盐缓冲液(PBS)清洗3遍,弃去PBS,加入4%多聚甲醛室温固定20 min,PBS清洗3遍,弃去PBS,加入0.1%结晶紫染液避光室温染色20 min,PBS清洗3遍,干燥后相机拍照,计算各组集落数。结晶紫染色观察细胞集落形成情况,集落形成率(%)=(实验组集落数均值/对照组集落数吸光度均值)×100%。
1.2.4Annexin V单色染色检测细胞凋亡 取对数生长期细胞,过夜培养后加入不同浓度(0、25、50、100 μmol/L)HMA药物干预,48 h后收集细胞,PBS洗涤细胞2次,离心后取1×106个/ml细胞数,加入100 μl 1×结合缓冲液混匀,分别加入5 μl Annexin V(647 nm波长)混匀,室温避光反应30 min,待细胞充分结合Annexin V染液,于1 h内流式细胞仪上机检测,每个样本至少计数10 000个细胞。
1.2.5Western印迹 按照上述方式HMA干预后收集细胞,PBS洗涤后加入含PMSF裂解液,低温高速离心后吸取上清液即为所需蛋白。二喹啉甲酸(BCA)测定蛋白浓度后加入50 μg蛋白量上样电泳跑胶,将胶上蛋白转入聚偏氟乙烯(PVDF)膜后室温封闭1 h,加入不同抗体(1∶1 000)4℃过夜孵育。经TBST清洗后加入对应二抗(1∶5 000)室温孵育1 h,经TBST洗膜后化学发光显影拍照。
1.3统计学方法 采用SPSS23.0软件进行t检验及方差分析。
2 结 果
2.1HMA对大肠癌细胞生长的影响 与0 μmol/L HMA组相比,25、50、100 μmol/L HMA组细胞存活率及细胞计数均显著降低(P<0.05)。见表1。
2.2HMA对大肠癌细胞存活能力的影响 与0 μmol/L HMA组相比,25、50、100 μmol/L HMA组集落形成率均显著降低(P<0.05)。见表1、图1。
2.3HMA对大肠癌细胞凋亡的影响 与0 μmol/L HMA组相比,25、50、100 μmol/L HMA组细胞凋亡率均显著升高(P<0.05)。见表1,图2。
2.4HMA对大肠癌细胞凋亡相关蛋白的影响 与0 μmol/L HMA组相比,25 μmol/L HMA组HCT116 Bax水平显著升高,Bcl-2水平显著降低(P<0.05);50、100 μmol/L HMA组HCT116和HT-29细胞酶切caspase-9、酶切caspase-3、Bax水平均显著升高,Bcl-2水平均显著降低(均P<0.05)。见图3,表2。

表1 HMA对HCT116和HT-29细胞存活率及细胞计数的影响
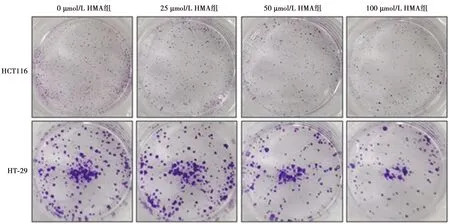
图1 HMA对HCT116和HT-29细胞集落形成的影响(结晶紫染色)
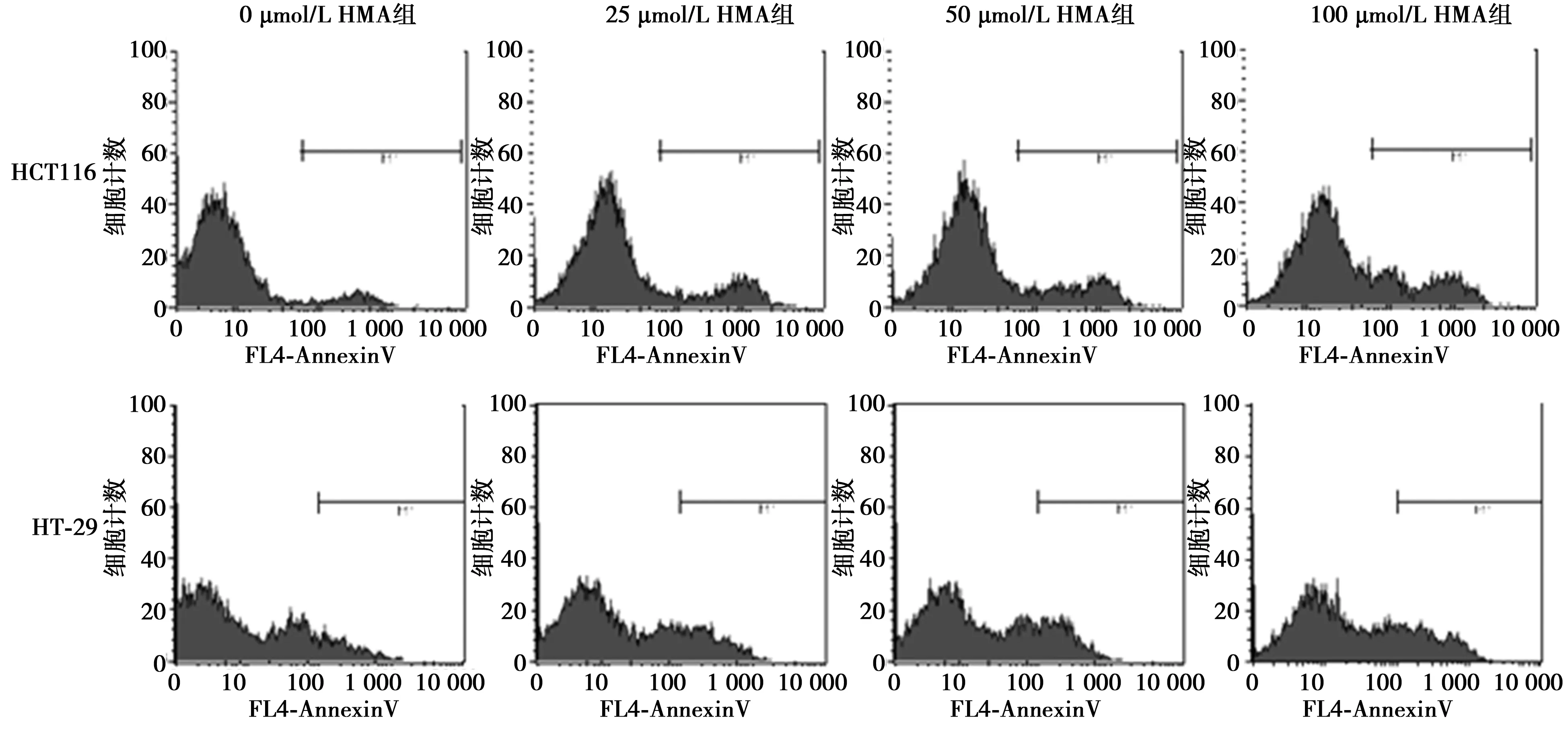
图2 HMA对HCT116和HT-29细胞凋亡的影响
表2 HMA对HCT116和HT-29细胞凋亡相关蛋白的影响
3 讨 论
大肠癌有恶性程度高、预后差、病死率高等特点〔1,2〕。尽管手术治疗仍为大肠癌的首选方案,但大多数就诊时已到中晚期,不能手术治疗,常以放化疗或临床药物控制,目前临床常用药物存在靶点单一、途径单一且存在毒副作用,影响患者的生存质量。而传统中医药注重整体调节,在改善患者临床症状、提高机体免疫力,预防肿瘤的复发和转移等方面发挥重要作用〔3〕。研究报道白花蛇舌草、半枝莲等清热解毒类中药临床常用于肿瘤、热症等疾病治疗〔14〕,在体内外实验均证实对大肠癌生长、转移等具有明显的抑制作用〔15,16〕。
细胞凋亡是机体常见的正常生理过程,是生物体细胞在特定信号诱导下、凋亡相关基因调控下发生的一种程序性死亡,作用机制极复杂〔17,18〕。抗凋亡蛋白Bcl-2和促凋亡蛋白Bax是细胞增殖和凋亡的重要调控蛋白,抗凋亡蛋白Bcl-2和促凋亡蛋白Bax可形成一个调节系统,Bcl-2 通过与Bax 竞争结合形成异源二聚体从而抑制或促进细胞凋亡〔19〕。caspase家族是介导细胞凋亡的蛋白酶系统,在细胞凋亡机制中起到重要调控作用〔20〕,其中caspase-3、caspase-9是caspase家族中参与细胞凋亡的关键分子。一般认为caspase-9是参与细胞凋亡的上游分子,而caspase-3是细胞凋亡过程中最主要的下游终末剪切酶。当caspase-9由于多种因素剪切小片段剪接体部分活化后,引起下游级联酶活反应,如caspase-3的激活。被激活的caspase-3裂解相应胞质胞核底物,最终导致细胞凋亡〔21〕。Bcl-2、Bax及caspase-9、caspase-3是与细胞凋亡进程密切相关的基因,其中caspase-9、caspase-3和Bax激活促进细胞凋亡,而Bcl-2表现出抑制凋亡作用〔19〕。
