miR-215-5p靶向FOXN1调控肝癌细胞生物学特性
2022-05-11王红山杨大勇余江涛孙德利
王红山 杨大勇 余江涛 孙德利
(郑州人民医院普外科,河南 郑州 450000)
原发性肝癌(HCC)是一种发病率较高的恶性肿瘤,其初期症状不明显,导致早期诊断率较低,且HCC具有转移率及复发率较高的特征,导致HCC每年新增死亡人数位于全身肿瘤的前列〔1〕。微小RNA(miRNA)是一类含有18~25 bp的小片段RNA,其主要通过特异性结合于相应靶基因3′非编码区域(UTR)区域部分或全部碱基,从而抑制靶基因mRNA翻译或阻碍降解,参与机体生长、发育以及相关疾病的诱导产生过程,并对细胞的增殖、凋亡、侵袭等过程具有重要意义〔2〕。研究发现,miRNA在多种肿瘤组织中异常表达,且在肿瘤发生发展过程中稳定表达,不易被RNA酶降解〔3,4〕。因此,近年来将miRNA作为肿瘤生物学诊断的理想分子标志物,对肿瘤的早期诊断、治疗、靶向药物的研发具有重要意义。研究发现miR-215-5p具有癌基因或者抑癌基因的作用。但miR-215-5p在肝癌高转移的细胞较不转移的Hep3B显著上调〔5〕,表明miR-215-5p在肝组织发生、转移过程中具有重要作用,但其具体的作用机制不十分明确。因此本文通过敲低miR-215-5p观察细胞的增殖、凋亡、侵袭等生物学特性,并进一步研究其作用机制,为肝癌的治疗提供实验依据。
1 材料与方法
1.1材料 肝癌细胞系(MHCC97-H)购自北纳生物,DMEM培养基、胎牛血清购自吉诺生物公司,Lipofectamine 2000购自美国Thermo公司;Trizol试剂购自美国Sigma公司,凋亡检测试剂盒、噻唑蓝(MTT)购自美国Bio Basic Inc公司;反转录试剂盒、实时定量PCR(qPCR)试剂盒购自日本TOYOBO公司,叉头状基因家族蛋白(FOX)N1野生型(FOXN1-wt)及FOXN1突变型(FOXN1-mut)双荧光素酶报告基因、pcDNA-FOXN1、miR-215-5p mimics、anti-miR-215-5p及阴性对照购自上海吉玛公司,鼠抗FOXN1抗体购自美国Sigma公司。酶标仪、流式细胞仪、PCR仪购自美国Thermo公司。
1.2方法
1.2.1细胞系的培养 MHCC97-H细胞系至于含10%胎牛血清DMEM培养基中培养,细胞培养箱参数设置为5%CO2、37℃,加入胰酶消化、传代。
1.2.2细胞的转染 选取生长状态良好的MHCC97-H细胞进行培养,随机分为miR-215-5p-NC组(转染过表达miR-215-5p的阴性对照)、miR-215-5p组(转染miR-215-5p mimics从而过表达miR-215-5p)、anti-miR-215-5p-NC组(转染敲低miR-215-5p的阴性对照)、anti-miR-215-5p组(转染anti-miR-215-5p从而敲低miR-215-5p)、NC组(转染过表达FOXN1的阴性对照)、FOXN1组(转染pcDNA-FOXN1从而过表达FOXN1)、FOXN1+miR-215-5p-NC组(共转染miR-215-5p mimics阴性对照和pcDNA-FOXN1)、FOXN1+miR-215-5p组(共转染pcDNA-FOXN1和miR-215-5p mimics),对照组为正常培养的MHCC97-H细胞。在Lipofectamine 2000说明书指示下进行转染。
1.2.3qPCR 各组细胞中加入Trizol试剂提取总RNA,反转录合成cDNA。以β-actin为内参,根据2-ΔΔCt法计算miR-215-5p的相对表达水平。其中,miR-215-5p扩增引物由上海生工合成,miR-215-5p:上游引物:5′-CTCGAGATGTCATCCTCA-3′,下游引物:5′-GAATTCGTGAGTTCTTCTG-3′;β-actin:上游引物:5′-AAGATGACCCAGATC ATGTTTGAG-3′,下游引物:5′-GCAGCTCGTAGCTCTTCTCCAG-3′。扩增条件为95℃ 5 min,95℃ 20 s,60℃ 1 min,72℃ 1 min,40个循环。实验重复3次。
1.2.4MTT实验 收集各组5×103个MHCC97-H细胞接种96孔板,培养24 h、48 h、72 h,分别加入20 μl/孔MTT,37℃孵育4 h,加入150 μl/孔 二甲基亚砜(DMSO),振荡10 min,多功能酶标仪检测细胞在490 nm的吸光值(A值)。
1.2.5流式细胞术实验 收集5×105个MHCC97-H细胞,磷酸盐缓冲液(PBS)冲洗3次,加入500 μl缓冲液、5 μl膜联蛋白(Annexin V)V-FITC、5 μl碘化丙啶(PI)混匀,避光孵育15~20 min,流式细胞仪检测MHCC97-H凋亡率。
1.2.6Transwell实验 实验前,提前将基质胶融化、稀释,覆盖Transwell上室膜。收集各组MHCC97-H细胞,吸5×104个MHCC97-H细胞悬液加入Transwell上室,下室加入600 μl含15%胎牛血清的培养基,培养24 h;清洗上室,弃去残留液体、细胞和基质胶,多聚甲醛固定30 min,结晶紫染色30 min,显微镜下取5个区域拍照、计数,取平均值。
1.2.7双荧光素酶报告基因实验 通过Target Scan Targetscan(http://www.targetscan.org/vert_71/)数据库预测miR-215-5p与FOXN1的3′-UTR存在结合位点。野生型(FOXN1-wt)和突变型(FOXN1-mut)FOXN1 3′-UTR荧光素酶载体分别与miR-215-5p mimics和阴性对照共转染,37℃培养48 h,测定双荧光素酶的相对活性。
1.2.8Western印迹 取各组稳定转染的MHCC97-H细胞,在RIAP裂解液作用下提取蛋白,以10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)作为介质进行电泳,将FOXN1蛋白条带转移至聚偏氟乙烯(PVDF)膜。5%封闭液孵育2 h,TBST清洗3次,加入FOXN1(1∶200)、GAPDH一抗(1∶10 000),孵育过夜,加入二抗(1∶1 000)孵育1 h,加入ECL发光液,Image J软件检测FOXN1蛋白灰度值。
1.3统计学方法 采用SPSS20.0软件进行t检验、单因素方差分析、SNK-q检验。
2 结 果
2.1miR-215-5p在MHCC97-H细胞系中的表达量 与人正常肝细胞(LO2)miR-215-5p相对表达量(1.000±0.059)相比,MHCC97-H细胞系表达量(3.285±0.296)显著增加(P<0.05)。
2.2敲低miR-215-5p的表达量对MHCC97-H细胞增殖的影响 与对照组相比,anti-miR-215-5p-NC组miR-215-5p表达量无明显变化,但在anti-miR-215-5p组表达量显著降低(P<0.05)。anti-miR-215-5p组48及72 h OD值显著低于对照组(P<0.05)。见表1。
2.3敲低miR-215-5p的表达量对MHCC97-H细胞凋亡、侵袭的影响 与对照组相比,anti-miR-215-5p-NC组细胞的凋亡率、侵袭细胞数无明显变化,但anti-miR-215-5p组细胞凋亡率显著增加,侵袭细胞数显著降低(均P<0.05)。见表1、图1、图2。

表1 敲低miR-215-5p表达量对MHCC97-H细胞增殖及侵袭的影响
2.4miR-215-5p靶基因的预测和验证 Targetscan在线数据库预测miR-215-5p的下游靶基因,发现FOXN1 3′UTR区域含有部分碱基可与miR-215-5p特异性结合;见图3。进一步通过双荧光素酶报告基因检测,miR-215-5p过表达和FOXN1-wt联合转染入MHCC97-H细胞可显著降低双荧光素酶相对活性(P<0.05);但miR-215-5p过表达与FOXN1-mut联合转染对双荧光素酶的活性无明显变化(P>0.05)。见表2。

图1 敲低miR-215-5p的表达量对MHCC97-H细胞凋亡的影响

图2 敲低miR-215-5p的表达量对MHCC97-H细胞侵袭的影响(结晶紫染色,×200)

图3 Targetscan在线数据库预测miR-215-5p潜在靶基因

表2 过表达miR-215-5p对双荧光素酶活性的影响
2.5上调/下调miR-215-5p对靶基因表达量的影响 与miR-215-5p-NC组FOXN1蛋白相对表达量(1.000±0.073)相比,miR-215-5p组(0.469±0.054)显著降低(P<0.05);与anti-miR-215-5p-NC组FOXN1蛋白相对表达量(1.025±0.085)相比,anti-miR-215-5p组(2.852±0.236)显著增加。见图4。
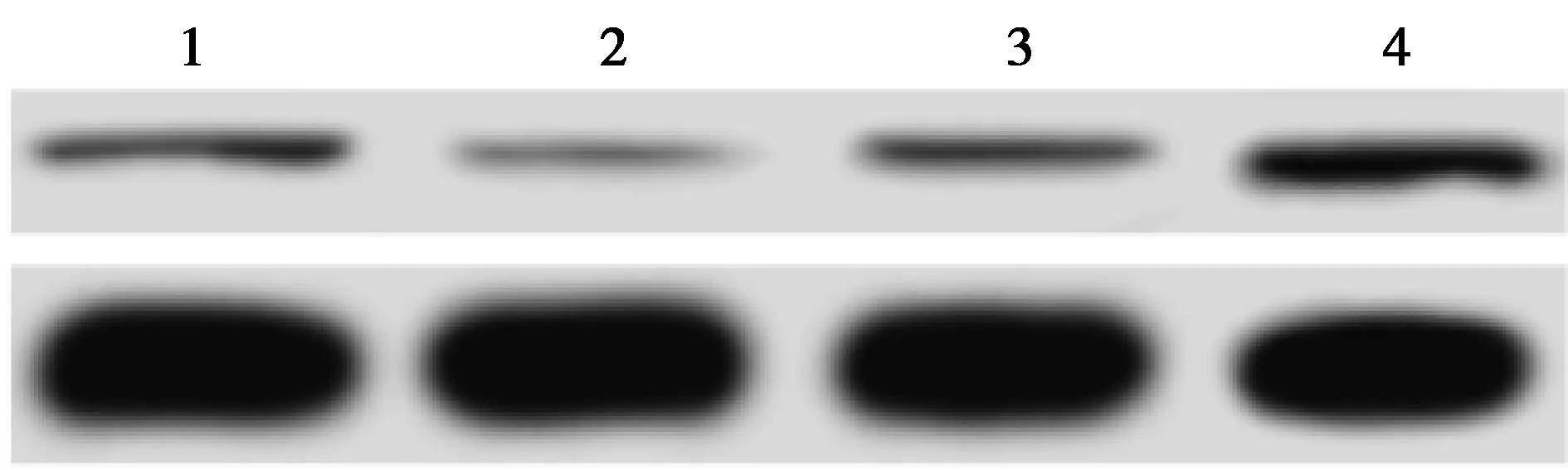
1~4:miR-215-5p-NC组、miR-215-5p组、anti-miR-215-5p-NC组、anti-miR-215-5p组图4 上调/下调miR-215-5p对FOXN1蛋白相对表达量的影响
2.6过表达FOXN1和miR-215-5p对MHCC97-H细胞生物学特性的影响 与NC组FOXN1蛋白相对表达量(1.000±0.059)相比,FOXN1组(3.658±0.327)显著增加,抑制MHCC97-H细胞增殖、侵袭,促进凋亡(见P<0.05),与FOXN1组比较,FOXN1+miR-215-5p-NC组FOXN1蛋白相对表达量(3.743±0.353)、增殖、凋亡、侵袭无明显变化(P>0.05);与FOXN1+miR-215-5p-NC组相比,FOXN1+miR-215-5p组MHCC97-H细胞中FOXN1蛋白相对表达量(1.522±0.145)显著降低,促进细胞增殖、侵袭,抑制凋亡(均P<0.05)。见表3,图5。

表3 过表达FOXN1和miR-215-5p对MHCC97-H细胞增殖、侵袭及凋亡的影响

1~4:NC组、FOXN1组、mRr-215-5p-NC组、FOXN1+miR-215-5p组图5 过表达FOXN1和miR-215-5p对FOXN1蛋白的影响
3 讨 论
研究证实多种miRNA在肝癌病理过程中发挥癌基因或致癌基因的作用,调控肝癌细胞增殖、侵袭等〔6,7〕。在结直肠癌中,miR-215-5p表达量较正常对照组织表达量下调,其表达量与结肠癌患者的淋巴结转移、肿瘤分期和总生存期有关,在结直肠癌演进过程中发挥抑制作用,其作用机制主要是通过靶向调控HOXB9的表达量〔8〕。在肺癌病理过程中,miR-215表达量降低,并通过抑制ZEB2、TYMS、DTL表达参与肺癌细胞增殖、凋亡过程〔9,10〕。在胃癌发生发展过程中,miR-215表达量显著增加,且与患者的肿瘤分化程度、临床分期等有关,并通过靶向调控RUNX1、FOXO1影响胃癌细胞的增殖、侵袭等过程〔11~13〕。
Liu等〔14〕研究结果发现,乙型肝炎病毒X蛋白突变体Δ127X蛋白(HBxΔ127)通过上调miR-215的表达水平,从而促进肝癌细胞增殖。miR-215在阿霉素诱导的肝癌细胞中表达量上调,从而降低细胞的化疗敏感性,进一步促进肝癌的恶化,影响患者的预后〔15〕。本研究结果表明miR-215-5p对肝癌组织转移过程中发挥重要的作用,下调miR-215-5p的表达量可阻碍MHCC97-H细胞增殖、转移,从而影响肝癌组织的进一步恶化。
FOXN1属于FOX家族成员,是一种新的胃肠肿瘤抑癌基因〔16〕。本研究结果表明FOXN1是miR-215-5p的下游靶基因之一;miR-215-5p负反馈调节FOXN1表达量;miR-215-5p可通过抑制FOXN1调控MHCC97-H细胞增殖、侵袭、凋亡。
综上,miR-215-5p在高转移肝癌细胞MHCC97-H中表达量增加;敲低miR-215-5p可通过抑制FOXN1表达量阻碍MHCC97-H细胞增殖、侵袭,促进其凋亡,从而参与肝癌发生发展过程。但本实验只从细胞水平探究了miR-215-5p的作用及分子机制,未来会在多株细胞系及动物模型中进一步探究miR-215-5p的相关作用,为肝癌患者预后的提高提供理论依据。
